修回日期: 2013-05-28
接受日期: 2013-09-09
在线出版日期: 2013-10-08
目的: 观察肝癌缺氧诱导因子-1α(hypoxia inducible factor-1alpha, HIF-1α)表达及靶向其基因转录对肝癌细胞增殖的影响.
方法: 以自身配对法收集术后肝癌及癌周组织, 免疫组织化学染色法分析HIF-1α胞内表达及分布; 按照HIF-1α基因序列合成miRNA, 筛选干扰效率最佳者转染肝癌(HepG2)细胞, 以荧光定量-PCR和Western blot分别检测HIF-1α转录和蛋白表达; 并以miRNA转染联合阿霉素后, 流式细胞仪检测沉默细胞中HIF-1α对HepG2细胞增殖的影响.
结果: 肝癌及癌周组织HIF-1α表达呈棕黄色颗粒状, 位于胞浆和部分胞核, 呈均匀表达, 中央静脉周围明显; 其阳性率癌组织为80%, 低于癌旁100%表达(χ2 = 22.35, P<0.001); 与瘤体大小和分化程度相关; HepG2细胞经miRNA干扰后, HIF-1α在RNA和蛋白水平分别下降87%和56%, 发生细胞凋亡(22.46%±0.61%)和G1期阻滞(61.49%±1.12%, P<0.01); 加入阿霉素后细胞凋亡率和G1期细胞分别增至36.99%±0.88%和65.68%± 0.91%.
结论: HIF-1α过表达与肝癌密切相关, 以特异性miRNA靶向HIF-1α, 可调控细胞周期, 通过加速凋亡的机制抑制癌细胞增殖.
核心提示: 肝细胞性肝癌(hepatocellular carcinoma)血供丰富, 传统疗法易耐受, 预后极差. 肝癌细胞增殖失控导致局部缺氧, 激活缺氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α), 进而增强血管新生、促进癌细胞增殖及转移, 抑制细胞凋亡和分化. 本研究分析了肝癌及癌周组织HIF-1α表达, 并以miRNA或联合阿霉素在体外干扰细胞中HIF-1α表达, 观察肝癌细胞凋亡和增殖周期的变化, 发现肝癌组织内HIF-1α表达水平异常升高, 其表达增强与癌周围组织的增生活跃密切相关. 沉默HIF-1α可逆转缺氧引起的HIF-1α升高, 控制癌细胞增殖, 可作为一种辅助策略应用于肝癌的治疗.
引文著录: 王理, 姚敏, 顾星, 时运, 邱历伟, 陆少林, 姚登福. 下调缺氧诱导因子-1α表达对肝癌细胞增殖和凋亡的影响. 世界华人消化杂志 2013; 21(28): 2937-2944
Revised: May 28, 2013
Accepted: September 9, 2013
Published online: October 8, 2013
AIM: To detect the expression of hypoxia inducible factor-1alpha (HIF-1α) in human hepatocellular carcinoma and to observe the effect of silencing HIF-1α gene on the proliferation and apoptosis of hepatocellular carcinoma HepG2 cells.
METHODS: Hepatocellular carcinoma tissue samples and matched tumor-adjacent tissue samples were collected to detect the expression and cellular distribution of HIF-1α by immunohistochemistry. HIF-1α-specific miRNAs were synthesized and screened. After HepG2 cells were transfected with a miRNA, the expression of HIF-1α mRNA and protein was determined by real time-PCR and Western blot, respectively. Cell cycle progression and apoptosis were quantitatively analyzed by flow cytometry and annexin V-FITC/PI double dyeing assay.
RESULTS: HIF-1α was distributed mainly in the cytoplasm and less in the nucleus, which was especially prominent around the central vein. The positive rate of HIF-1α expression was significantly lower in hepatocellular carcinoma than in tumor-adjacent tissue (80% vs 100%, χ2 = 22.35, P < 0.001). HIF-1α expression was correlated with tumor size and differentiation degree. After HepG2 cells were transfected with a miRNA, HIF-1α expression was down-regulated in a time-dependent manner, the apoptosis rate increased significantly (P < 0.01), and HepG2 cells were significantly arrested at G1 phase (proportion of cells in G1 phase: 61.49% ± 1.12%, P < 0.01). In the presence of doxorubicin, the apoptosis rate and the proportion of cells in G1 phase were increased to 36.99% ± 0.88% and 65.68% ± 0.91%, respectively.
CONCLUSION: Abnormal HIF-1α expression is associated with the development of hepatocellular carcinoma. Silencing HIF-1α gene efficiently inhibits the proliferation of hepatocellular carcinoma cells possibly by regulating cell cycle progression and apoptosis.
- Citation: Wang L, Yao M, Gu X, Shi Y, Qiu LW, Lu SL, Yao DF. Down-regulation of hypoxia-inducible factor-1alpha expression inhibits cell proliferation and induces apoptosis in human hepatocellular carcinoma cell line HepG2. Shijie Huaren Xiaohua Zazhi 2013; 21(28): 2937-2944
- URL: https://www.wjgnet.com/1009-3079/full/v21/i28/2937.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i28.2937
肝细胞性肝癌(hepatocellular carcinoma, HCC)是一多基因、多阶段发生、血供丰富、传统疗法易耐受、预后极差、高度恶性的实体瘤[1,2]. 肝癌细胞增殖失控导致无效或畸形血供增加, 在慢性肝损伤、肝硬化、肝癌演变过程中, 正常脉管系统破坏, 共同导致局部缺氧[3]. 肝组织缺氧微环境, 激活缺氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α), 促使其进入细胞核内与HIF-b异二聚体化, 结合于百余种下游靶基因, 发挥一系列细胞适应性调节, 从而增强血管新生、癌细胞增殖及转移、对放化疗耐受、抑制细胞凋亡和分化[4,5]. HIF-1α是介导生理性和病理性低氧反应的关键转录因子, 在缺氧环境中表达相对显著, 在转录水平调控细胞增殖, 调控血管新生"开关基因", 激活许多缺氧反应性基因表达, 与肿瘤的生长、转移和预后等密切相关[6,7]. 本文分析了肝癌及癌周组织HIF-1α表达, 并以miRNA在体外干扰肝癌细胞HIF-1α表达, 或联合阿霉素观察对肝癌细胞凋亡和增殖周期的变化, 以探讨干扰HIF-1α活化对肝癌细胞的增殖抑制作用与机制.
35例肝癌组织取自南通大学附属医院2012-03/2012-12肝癌手术标本, 标本切下后经40 g/L甲醛溶液固定、取材、石蜡包埋保存, 均经病理学检查证实为肝细胞癌, 其中高分化8例、中分化22例、低分化5例; 男30例, 女5例; 年龄35-69岁, 平均51岁±9.19岁. 癌灶直径为1.0-12.0 cm, 中位数4.65 cm±2.96 cm. 肿瘤单发者28例, ≥2个者7例. 所有病例均有完整随访资料, 按全国肝癌防治协作组制定的标准核实诊断. 鼠抗人 HIF-1α单克隆抗体(Abcam, 英国); 双荧光素酶报告基因、pGL3及pRL-TK(Promega, 美国); Annexin-V FITC凋亡检测试剂盒、FuGENE HD转染试剂(Roche, 德国); Premix Taq酶、DNA Marker、T4连接酶、Xho-Ⅰ、Hind-Ⅲ及SYBR Premix Ex Taq(TaKaRa, 日本); RevertAidTM第一链cDNA合成试剂盒(Fermentas, 立陶宛); pcDNA™6.2-GW/ EmGFPmiR载体、载体构建盒BLOCK-iT™含EmGFP的Pol Ⅱ miR RNAi表达载体(Invitrogen, 美国); DYEnamic ET Dye测序(Amersham Biosciences, 美国); Top10感受态细胞(百奥生物); 鼠抗人β-actin一抗、HRP-羊抗鼠二抗、SDS-PAGE、彩色预染蛋白标准、PVDF膜、BCA蛋白、质粒抽提盒(碧云天生物技术有限公司).
1.2.1 肝总RNA制备与浓度分析: 称取肝组织50 mg, 置于无RNase的匀浆器中, 加入RNA快速制备试剂(TRIzol)1.0 mL匀浆2 min, 在匀浆液中加氯仿混匀冻存, 高速离心, 上清液中加入等量异丙醇混匀, 再离心并经预冷乙醇洗涤, 弃上清至室温5 min, 加入TE缓冲液置60 ℃水浴10 min, 取出置于-85 ℃冰箱保存备用. 取RNA提取液置微量比色皿中, 于岛津UV-2201型紫外分光光度计上检测RNA吸光度A260, 并换算总RNA浓度(μg/mg组织).
1.2.2 免疫组织化学分析: 采用二步法免疫组织化学检测法, 按照操作说明进行. 组织切片常规脱蜡及水化后, 以EDTA缓冲液冲洗后微波修复10 min. 加入HIF-1α一抗, 室温孵育1 h, 磷酸盐缓冲液(PBS)洗涤3次后加入聚合体增强剂, 室温孵育20 min, PBS清洗切片3次后再加入二抗, 室温孵育30 min, PBS洗涤3次后经0.1%DAB显色5 min, 自来水充分冲洗、复染、脱水、透明、封片. 实验以PBS代替一抗作阴性对照. 阳性标准以已知表达HIF-1α的乳腺癌组织作阳性对照, 以组织中显示棕黄色颗粒为HIF-1α染色阳性. 阳性细胞计数: 每份标本切片选取5个高倍镜视野(×400)作阳性细胞计数, 按阳性细胞(清晰棕黄色染色)所占比例数分为: HIF-1α染色阴性(-), 阳性细胞数<10%; HIF-1α染色弱阳性(+), 10%-25%; HIF-1α染色中等阳性(++), 阳性细胞数在26%-50%; HIF-1α染色呈强阳性(+++), 阳性细胞数>50%.
1.2.3 细胞培养: 肝癌细胞株(HepG2, 南京凯基)常规复苏后, 以RPMI 1640完全培养液(含1%非必需氨基酸), 37 ℃, 50 mL/L CO2及100%湿度的条件下培养, 传代, 取对数生长期细胞分析.设空白、阴性和干扰组, 检测细胞凋亡及周期时, 另加两组分别为阿霉素组(0.5 μmol/L)和干扰联合阿霉素组(0.5 μmol/L), 每组均设 3个复孔. 空白组常规培养; 阴性组添加阴性质粒和转染试剂培养; 干扰组加靶向HIF-1α载体和转染培养. 于转染后 24、48和72 h收集细胞.
1.2.3 miRNA设计: 人HIF-1α mRNA序列(NM_001530), 用Invitrogen miRNA设计系统软件设计4对miRNA寡聚单链DNA. 将4对oligo各自退火成双链. 然后用载体构建试剂盒BLOCK-iT™ Pol Ⅱ miR RNAi Expression Vector Kit with EmGFP(Invitrogen公司)进行重组克隆, 将双链的miRNA oligo各自插入到miRNA表达载体pcDNA™6.2-GW/EmGFPmiR中, 构建miRNA质粒, 筛选干扰效率最佳一对序列为5'-TGCTGTAAAGCATCAGGTTCCTTCTTGTT TTGGCC ACTGACTGACAAGAAGGACTGATGCTTTA-3'和5'-CCTGTAAAGCA TCAGTC CTCT TGTCAGTCAGTGGCCAAAACAAGAAGGAACCTGATGCTTT AC-3', 其中加下划线部分为靶区序列, 其上下游为茎环结构.
1.2.4 细胞转染: FuGENE HD转染试剂转染 HepG2细胞. 转染前24 h每孔接种2 mL细胞悬液, 浓度为1×105/mL, 使转染时细胞密度达80%-90%. 每孔加转染试剂和干扰载体, RPMI 1640完全培养补至100 μL, 室温静置15 min, 以形成干扰载体与转染试剂稳定复合物. 吸弃培养液, PBS洗两遍, 加入干扰载体与转染试剂稳定复合物, 加完全培养补至2 mL, 晃匀, 培养, 于转染后24、48和72 h取细胞备用.
1.2.5 干扰效率检测: 以QuickGene RNA culture cell试剂盒于核酸自动提取仪(Fujifilm, 日本)提取总RNA. 利用第一链cDNA合成试剂盒(ReverAidTM First Strand cDNA Synthesis Kit)经RT-PCR生成相应的cDNA.以各组cDNA作为模板, 利用染料法进行Real-time PCR, 目标片段扩增引物HIF-1α-F和HIF-1α-R的序列分别为5'-CCACTGCCACCACTGATGAA-3'(nt 2254-2273)和5'-TTGGTGA GGCTGTCCGACTT-3'(nt 2412-2431), 产物大小178 bp, 退火温度为60 ℃, 延伸循环数为40. 根据相对定量法计算目标片段的扩增比例, mRNA的相对变化量公式为: Ratio = 2-△△Ct. 以GAPDH作为内参, 各样本重复3次.
1.2.6 Western blot分析: 制作10%分离胶, 蛋白40 μg, 加上样缓冲液, 沸水浴后上样, 恒压80 V×35 min, 后100 V×60 min. 结束后转膜, 封闭. 取膜用TBS-T漂洗, 加鼠抗人HIF-1α(1:500), 4 ℃过夜, 漂洗, 加入HRP标记羊抗鼠 IgG(1:1000)二抗, 孵育2 h, 漂洗、DAB显色并摄相.
1.2.7 Annexin V-FITC/PI法分析: 常规消化, 接种, 培养, 根据设计加入相应试剂. 转染加阿霉素, 分别于48、72 h后, 收集细胞, 离心, 洗涤. 加入Annexin V-FLUOS/PI混合液, 重悬细胞, 避光, 流式细胞仪进行检测.
1.2.8 细胞周期: 常规消化细胞, 接种, 培养后弃培养基, 根据设计加入相应试剂, 转染后加阿霉素, 收集细胞, 固定, 洗涤, 加碘化丙啶混合液, 避光, 过300目筛网, 以488 nm波长为激发光检测, Macguit软件分析细胞周期.
统计学处理 数据以mean±SD表示, 样本均数间的比较采用方差分析, 两两比较采用q检验. 用SPSS13.0统计软件包处理、分析数据. 以P<0.05表示差异有统计学意义.
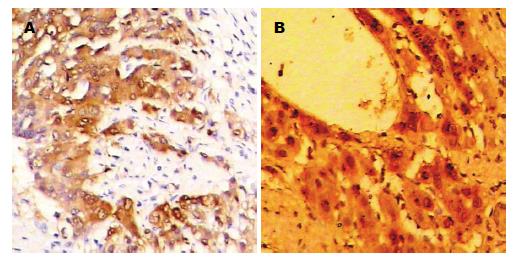
免疫组织化学显示肝癌及癌周组织HIF-1α阳性表达呈棕黄色, 颗粒状, 主要定位于胞浆中, 部分位于胞核. 癌组织HIF-1α表达均匀, 坏死区周围及浸润边缘HIF-lα表达增多(图1A). 癌旁近肿瘤边缘被压扁的组织条索中及中央静脉周围HIF-1α表达明显(图1B). 肝癌HIF-1α呈阳性表达28例占总数80%(+)-(++), 20%(7/35)未见表达; 癌周组织HIF-1α全数表达, 中等以上强度(++)-(+++)占71.4%(25/35), 癌周表达明显高于癌组织(χ2 = 22.35, P<0.001, 表1). HIF-1α表达强度与分化程度负相关, 高分化<中分化<低分化(P<0.05), 与肿瘤数目、HBsAg感染间均未见明显相关.
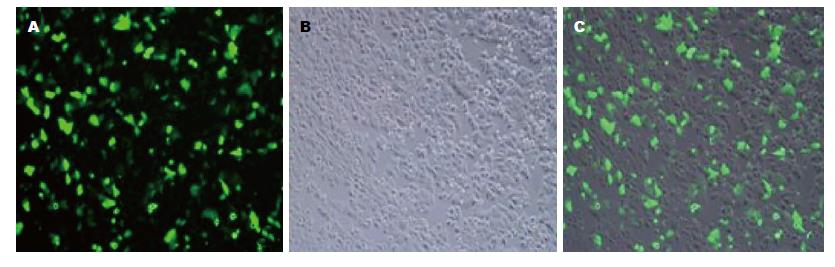
HIF-1α miRNA干扰质粒转染HepG2细胞, 于转染后24 h镜下观察, 成功转染的HepG2细胞发绿色荧光, 转染效率达45%(图2).
miRNA干扰HepG2细胞在转录水平上对HIF-1α表达抑制如表2. 与空白组相比, 转染HIF-1α miRNA后24、48和72 h, HepG2细胞中HIF-1α mRNA表达量(2-△△Ct)分别减少为0.69, 0.39和0.13, 抑制率分别为31%, 61%和87%(P值分别为0.007, 0.000和0.000); 且干扰效率依次递增(P<0.001). miRNA干扰后HIF-1α基因相对定量与效率如表3. 阴性组抑制率未见明显统计学差异. 阴性组抑制率分别为9%、7%和17%, 与空白组相比未见统计学明显差异(P值分别为0.297, 0.356和0.060).
| 分组 | 24 h | 48 h | 72 h | ||||||
| CtHIF-1α | CtGAPDH | △Ct | CtHIF-1α | CtGAPDH | △Ct | CtHIF-1α | CtGAPDH | △Ct | |
| 空白 | 19.20 | 14.70 | 4.50 | 16.30 | 13.20 | 3.10 | 16.80 | 13.60 | 3.20 |
| 19.30 | 14.80 | 4.50 | 16.00 | 12.90 | 3.10 | 16.80 | 13.20 | 3.60 | |
| 19.50 | 14.80 | 4.70 | 16.20 | 12.70 | 3.50 | 17.00 | 13.40 | 3.60 | |
| 阴性 | 17.90 | 13.50 | 4.40 | 16.60 | 13.50 | 3.10 | 18.80 | 15.20 | 3.60 |
| 18.30 | 13.30 | 5.00 | 16.70 | 13.00 | 3.70 | 18.80 | 15.00 | 3.80 | |
| 18.10 | 13.40 | 4.70 | 16.50 | 13.30 | 3.20 | 19.20 | 15.40 | 3.80 | |
| 干扰 | 18.90 | 13.60 | 5.30 | 18.50 | 13.80 | 4.70 | 23.10 | 16.80 | 6.30 |
| 18.90 | 13.80 | 5.10 | 18.30 | 13.60 | 4.70 | 23.50 | 16.70 | 6.80 | |
| 18.90 | 14.00 | 4.90 | 18.00 | 13.60 | 4.40 | 23.20 | 17.10 | 6.10 | |
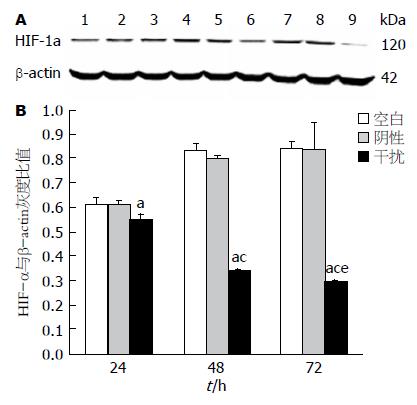
miRNA对HepG2细胞HIF-1α蛋白表达的抑制作用如图3. 与空白组比, 转染HIF-1α miRNA干扰载体 48、72 h后HepG2细胞中HIF-1α蛋白表达明显减少(图3A), HIF-1α与b-actin灰度扫描比值显示HIF-1α表达量分别减少为空白组的0.85、0.41、0.35, 抑制率为15%、59%、65%(P值分别为0.024、0.000和0.000); 且蛋白表达率依次递减(P<0.05). 阴性组与空白组间未见明显统计学差异(图3B).
2.5.1细胞周期改变: miRNA转染HepG2细胞48和72 h后, HepG2细胞周期时相均发生改变(表4). 干扰组G0/G1期比例明显高于空白组和阴性组(P<0.000), S期比例低于空白组和阴性组(P<0.000). 转染后48 h, 联合阿霉素组较阿霉素组G0/G1期比例增高(q = 0.10, P = 0.045), S期比例减低(q = 2.24, P = 0.049); 转染后72 h, 联合阿霉素组较阿霉素组G0/G1期比例同样增高(q = 4.50, P = 0.001), S期比例减低(q = 2.48, P = 0.033); 阴性组与空白组间未见统计学明显差异. 而G2/M期比例, 各组间均未见统计学明显差异.
| 分组 | 空白 | 阴性 | miRNA | 阿霉素 | 阿霉素+miRNA | |
| 48 h | G0/G1 | 37.91±2.05 | 40.12±1.64a | 54.78±1.64a | 57.48±0.71a | 60.32±1.20ade |
| S | 46.48±2.44 | 43.75±2.10a | 28.43±0.76a | 27.31±1.32a | 24.24±1.88ace | |
| G2/M | 15.61±0.72 | 16.13±0.68 | 16.79±1.93 | 15.21±0.77 | 15.44±1.13 | |
| 72 h | G0/G1 | 56.75±1.13 | 57.43±1.27a | 61.49±1.12a | 61.95±0.42a | 65.68±0.91adf |
| S | 26.14±0.78 | 25.56±1.21a | 22.40±0.58a | 21.62±1.19a | 19.47±1.34ace | |
| G2/M | 17.11±0.36 | 17.01±0.26 | 16.11±1.41 | 16.43±1.61 | 14.85±2.07 |
2.5.2 促进肝癌细胞凋亡: miRNA转染HepG2细胞48和72 h后, HepG2细胞凋亡率均明显增加(表5); 转染后48 h干扰组凋亡率为15.49%±0.99%, 阿霉素组凋亡率为15.91%±0.37%, 两者未见显著统计学差异, 而两者联合组凋亡率达27.33%±0.94%, 显著高于单用阿霉素组(q = 22.90, P<0.001); 72 h联合组凋亡率呈现同样改变(q = 13.74, P<0.001); 阴性组与空白组间未见显著统计学差异.
肝癌组织内HIF-1α表达水平异常升高, 肝癌组织及其周围组织中HIF-1α阳性表达呈棕黄色, 颗粒状, 主要定位于胞浆中, 部分位于胞核. 肝癌发生发展的早期阶段, HIF-1α在转录和蛋白水平上过表达, 癌前和癌变阶段在基因和蛋白表达上呈动态梯度增高[8]. 在人HCC癌灶组织中, 肿瘤坏死区周围及肿瘤浸润边缘HIF-lα表达增多; 癌旁组织中靠近肿瘤边缘被压扁的肝组织条索中及中央静脉周围HIF-1α表达明显, 癌周组织表达明显强于癌灶组织[9], 提示HIF-1α表达增强与癌周围组织的增生活跃密切相关.
HIF-1α调控VEGF和Ang-2[10,11]. 干扰HIF-1α后下调VEGF、Ang等, 显著抑制血管新生, 阻断肿瘤进展[12]. 干扰HIF-1α后, 随时间延长, HepG2细胞凋亡率逐渐增加, 且G1期细胞明显增多, S期细胞显著减少, 阻断细胞有丝分裂, 从而抑制细胞增殖. 斯钙素(STC-2)启动子序列含有2个HIF-1α的结合位点, HIF-1α介导STC-2过表达可上调cyclin D的表达, 推动细胞G1/S期转变, HIF-1α下调后STC-2表达也随之下调[13]. HIF-1α诱导髓样细胞因子、磷酸腺苷反应元件结合蛋白过表达, 降低Bax/Bcl-2比值, 抵抗凋亡; 干扰HIF-1α、bcl-2、bcl-xl下调, 抗凋亡能力减弱[14].
HIF-1α可诱导癌细胞周围间质成纤维细胞发生自噬, 实体瘤内巨噬细胞大量浸润及局部缺氧, 缺氧促使巨噬细胞介导的T细胞功能抑制效应增强, 靶向干扰巨噬细胞中HIF-1α, 明显抑制了移植瘤的生长[15]. 丝氨酸/苏氨酸激酶-15(STK-15)是细胞周期的重要调节因子、HIF-1α下游靶基因, 可编码一种中心体复制相关激酶, 并具高水平的酪氨酸激酶活性, 参与调节、G2/M期转换等, 干扰HIF-1α后, STK-15明显减少[16]. 阻断HIF-1α活化, 可显著增强化疗敏感性, 抑制肿瘤生长. HIF-1α可上调多重耐药基因mdr1, 下调Bax、caspase3表达, 抑制P53活性, 参与耐药形成; 干扰后可增强化疗药物诱导的凋亡, 逆转其化疗耐药[17,18]. HIF-1下调后, 提高化疗敏感性, 抑制肿瘤形成[19]. 阿霉素联合干扰, 凋亡率明显比单组高, 表明沉默HIF-1α可显著提高化疗敏感性.
TAE或TACE是晚期不可手术肝癌患者的疗法, 可阻断肿瘤血供引起坏死、萎缩, 但因造成缺氧, 诱导HIF-1α、VEGF等过表达, 导致侧支循环建立, 癌细胞逃逸, 残余癌迅速膨胀, 终使治疗失败[20]. 联合HIF-1α沉默, 可逆转TAE致缺氧引起的HIF-1α、VEGF和增殖核抗原升高, 控制血管新生和癌细胞增殖, 抑制残余癌生长, 加强TAE疗效. 且HIF -1α沉默, 可逆转放化疗耐受, 可作为一种辅助策略应用于肝癌的治疗, 具有应用前景[21].
缺氧诱导因子-1α(hypoxia inducible factor-1alpha, HIF-1α)是介导生理性和病理性低氧反应的关键转录因子, 在缺氧环境中表达相对显著, 在转录水平调控细胞增殖, 调控血管新生"开关基因", 与肿瘤的生长、转移和预后等密切相关. 肝癌演变过程中, 正常脉管系统破坏, 共同导致局部缺氧, 激活HIF-1α, 从而增强血管新生, 促进癌细胞增殖及转移.
姜春萌, 教授, 大连医科大学附属第二医院消化科; 庄林, 主任医师, 昆明市第三人民医院肝病科
近年来对肿瘤血管新生的研究表明, 血管新生在肝癌的恶变、生长、转移等方面是至关重要的. VEGF是肿瘤诱导产生新生血管的最主要的细胞因子之一, 而HIF-1α则在基因水平上直接调控VEGF表达, 是恶性肿瘤诱导新生血管形成的一个主要调控因子. 目前对HIF-1α调控肝癌新生血管机制的分析是研究热点, 但如何利用这种机制来治疗肝癌尚缺乏深入研究.
已有的研究表明, HIF-1α可调控VEGF和Ang-2, 影响血管生成; 而干扰HIF-1α后下调VEGF、Ang等, 显著抑制血管新生, 阻断肿瘤进展. 新近研究显示斯钙素(STC-2)启动子序列含有2个HIF-1α的结合位点, HIF-1α介导STC-2过表达可上调cyclin D的表达, 推动细胞G1/S期转变, HIF-1α下调后STC-2表达也随之下调.
本研究发现在人肝细胞性肝癌组织中, HIF-1α癌周组织表达明显强于癌灶组织, 提示HIF-1α表达增强与癌周围组织的增生活跃密切相关. 而通过miRNA或联合阿霉素沉默HIF-1α, 可逆转缺氧引起的HIF-1α升高, 控制癌细胞增殖.
TAE或TACE是晚期不可手术肝癌患者的疗法, 可阻断肿瘤血供引起坏死、萎缩, 但因造成缺氧, 诱导HIF-1α、VEGF等过表达, 导致侧支循环建立, 癌细胞逃逸, 残余癌迅速膨胀, 终使治疗失败. 联合HIF-1α沉默, 可逆转TAE致缺氧引起的HIF-1α、VEGF和增殖核抗原升高, 控制血管新生和癌细胞增殖, 抑制残余癌生长, 加强TAE疗效. 且HIF-1α沉默, 可逆转放化疗耐受, 可作为一种辅助策略应用于肝癌的治疗, 有应用前景.
本文结果可靠, 科学结论较明确, 实验证据较充足, 具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Yao DF, Jiang H, Yao M, Li YM, Gu WJ, Shen YC, Qiu LW, Wu W, Wu XH, Sai WL. Quantitative analysis of hepatic hypoxia-inducible factor-1alpha and its abnormal gene expression during the formation of hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2009;8:407-413. [PubMed] |
| 2. | Raza SA, Clifford GM, Franceschi S. Worldwide variation in the relative importance of hepatitis B and hepatitis C viruses in hepatocellular carcinoma: a systematic review. Br J Cancer. 2007;96:1127-1134. [PubMed] [DOI] |
| 3. | van Malenstein H, Verslype C, Windmolders P, van Eijsden R, Nevens F, van Pelt J. Characterization of a cell culture model for clinically aggressive hepatocellular carcinoma induced by chronic hypoxia. Cancer Lett. 2012;315:178-188. [PubMed] [DOI] |
| 4. | Xiang ZL, Zeng ZC, Fan J, Tang ZY, He J, Zeng HY, Chang JY. The expression of HIF-1α in primary hepatocellular carcinoma and its correlation with radiotherapy response and clinical outcome. Mol Biol Rep. 2012;39:2021-2029. [PubMed] [DOI] |
| 5. | Jiao M, Nan KJ. Activation of PI3 kinase/Akt/HIF-1α pathway contributes to hypoxia-induced epithelial-mesenchymal transition and chemoresistance in hepatocellular carcinoma. Int J Oncol. 2012;40:461-468. [PubMed] |
| 6. | Semenza GL. Oxygen sensing, homeostasis, and disease. N Engl J Med. 2011;365:537-547. [PubMed] [DOI] |
| 8. | Li S, Yao D, Wang L, Wu W, Qiu L, Yao M, Yao N, Zhang H, Yu D, Ni Q. Expression characteristics of hypoxia-inducible factor-1α and its clinical values in diagnosis and prognosis of hepatocellular carcinoma. Hepat Mon. 2011;11:821-828. [PubMed] |
| 9. | Huang C, Ding G, Gu C, Zhou J, Kuang M, Ji Y, He Y, Kondo T, Fan J. Decreased selenium-binding protein 1 enhances glutathione peroxidase 1 activity and downregulates HIF-1α to promote hepatocellular carcinoma invasiveness. Clin Cancer Res. 2012;18:3042-3053. [PubMed] [DOI] |
| 10. | Sebastià J, Kieran D, Breen B, King MA, Netteland DF, Joyce D, Fitzpatrick SF, Taylor CT, Prehn JH. Angiogenin protects motoneurons against hypoxic injury. Cell Death Differ. 2009;16:1238-1247. [PubMed] [DOI] |
| 11. | Simon MP, Tournaire R, Pouyssegur J. The angiopoietin-2 gene of endothelial cells is up-regulated in hypoxia by a HIF binding site located in its first intron and by the central factors GATA-2 and Ets-1. J Cell Physiol. 2008;217:809-818. [PubMed] [DOI] |
| 12. | Kim TH, Hur EG, Kang SJ, Kim JA, Thapa D, Lee YM, Ku SK, Jung Y, Kwak MK. NRF2 blockade suppresses colon tumor angiogenesis by inhibiting hypoxia-induced activation of HIF-1α. Cancer Res. 2011;71:2260-2275. [PubMed] [DOI] |
| 13. | Chiche J, Rouleau M, Gounon P, Brahimi-Horn MC, Pouysségur J, Mazure NM. Hypoxic enlarged mitochondria protect cancer cells from apoptotic stimuli. J Cell Physiol. 2010;222:648-657. [PubMed] |
| 14. | Torii S, Goto Y, Ishizawa T, Hoshi H, Goryo K, Yasumoto K, Fukumura H, Sogawa K. Pro-apoptotic activity of inhibitory PAS domain protein (IPAS), a negative regulator of HIF-1, through binding to pro-survival Bcl-2 family proteins. Cell Death Differ. 2011;18:1711-1725. [PubMed] [DOI] |
| 15. | Thomas S, Harding MA, Smith SC, Overdevest JB, Nitz MD, Frierson HF, Tomlins SA, Kristiansen G, Theodorescu D. CD24 is an effector of HIF-1-driven primary tumor growth and metastasis. Cancer Res. 2012;72:5600-5612. [PubMed] [DOI] |
| 16. | Klein A, Flügel D, Kietzmann T. Transcriptional regulation of serine/threonine kinase-15 (STK15) expression by hypoxia and HIF-1. Mol Biol Cell. 2008;19:3667-3675. [PubMed] [DOI] |
| 17. | Lau CK, Yang ZF, Ho DW, Ng MN, Yeoh GC, Poon RT, Fan ST. An Akt/hypoxia-inducible factor-1alpha/platelet-derived growth factor-BB autocrine loop mediates hypoxia-induced chemoresistance in liver cancer cells and tumorigenic hepatic progenitor cells. Clin Cancer Res. 2009;15:3462-3471. [PubMed] [DOI] |
| 18. | Brökers N, Le-Huu S, Vogel S, Hagos Y, Katschinski DM, Kleinschmidt M. Increased chemoresistance induced by inhibition of HIF-prolyl-hydroxylase domain enzymes. Cancer Sci. 2010;101:129-136. [PubMed] [DOI] |
| 19. | Kasuya K, Tsuchida A, Nagakawa Y, Suzuki M, Abe Y, Itoi T, Serizawa H, Nagao T, Shimazu M, Aoki T. Hypoxia-inducible factor-1α expression and gemcitabine chemotherapy for pancreatic cancer. Oncol Rep. 2011;26:1399-1406. [PubMed] |
| 20. | Chen C, Wang J, Liu R, Qian S. RNA interference of hypoxia-inducible factor-1 alpha improves the effects of transcatheter arterial embolization in rat liver tumors. Tumour Biol. 2012;33:1095-1103. [PubMed] [DOI] |
| 21. | Sun X, Jiang H, Jiang X, Tan H, Meng Q, Sun B, Xu R, Krissansen GW. Antisense hypoxia-inducible factor-1alpha augments transcatheter arterial embolization in the treatment of hepatocellular carcinomas in rats. Hum Gene Ther. 2009;20:314-324. [PubMed] [DOI] |