修回日期: 2013-07-10
接受日期: 2013-09-09
在线出版日期: 2013-10-08
目的: 探讨全反式维甲酸(all-trans retinoic acid, ATRA)对葡聚糖硫酸钠(dextran sulfate sodium, DSS)结肠炎治疗作用的机制.
方法: 将小鼠随机分成4组: 正常对照组、DSS组、DSS+ATRA组和DSS+LE135组. 建立小鼠DSS结肠炎的急性模型, 从小鼠饮用DSS第3天开始, DSS+ATRA组、DSS+LE135组分别给予ATRA 0.5 mg/d、LE135 0.1 mg/d腹腔注射至实验结束. 每天观察各组小鼠疾病活动指数(disease activity index, DAI), 第8天颈椎脱臼处死小鼠取肠组织匀浆检测各组 小 鼠炎症肠段中髓过氧化物酶(myeloperoxidase, MPO)的含量, ELISA检测肿瘤坏死因子-a(tumor necrosis factor-a, TNF-a)的含量, 免疫组织化学测定小鼠结肠CD68和核因子kB(nuclear factor kB, NF-kB) P65的表达.
结果: (1)DAI评分: DSS+ATRA组小鼠的DAI评分为4.63±2.20, 与DSS组、DSS+LE135组相比评分明显较低(P<0.05); 对照组小鼠的DAI评分均为0; (2)组织学评分: DSS+ATRA组小鼠的组织学评分为7.63±1.19, 与DSS组(10.13±1.36)、DSS+LE135组(10.38±1.30)相比得分明显降低(P<0.05), 但明显高于正常对照组(0.25±0.463); (3)MPO活性: DSS+ATRA组小鼠的MPO活性为7.88±0.68, 与空白对照(3.52±0.58)、DSS组(11.36±0.96)、DSS+LE135组(12.65±0.77)相比均有明显差异(P<0.05); (4)组织匀浆TNF含量: DSS+ATRA组(178.63±39.37), 明显低于DSS组(316.67±43.68)、DSS+LE135组(362.45±62.75)这2组; (5)结肠组织CD68的表达: DSS+ATRA组肠黏膜固有层CD68阳性细胞数明显低于DSS组、DSS+LE135组(P<0.05), 与对照组小鼠的CD68表达量相比明显增高(P<0.05); (6)结肠组织NF-kB的表达: DSS+ATRA组肠黏膜固有层NF-kB阳性细胞数明显低于DSS组、DSS+LE135组(P<0.05), 与对照组NF-kB的表达量相比增高(P<0.05).
结论: ATRA对DSS诱导的小鼠结肠炎具有治疗作用, 机制为抑制结肠炎作用肠道免疫反应及外周巨噬细胞向肠黏膜浸润.
核心提示: 全反式维甲酸(all-trans retinoic acid)对葡聚糖硫酸钠(dextran sulfate sodium)诱导的小鼠结肠炎具有治疗作用, 机制为抑制结肠炎作用肠道免疫反应, 及外周巨噬细胞向肠黏膜浸润.
引文著录: 洪凯, 张翼, 郭媛, 白爱平. 全反式维甲酸治疗葡聚糖硫酸钠诱导的小鼠结肠炎. 世界华人消化杂志 2013; 21(28): 2902-2907
Revised: July 10, 2013
Accepted: September 9, 2013
Published online: October 8, 2013
AIM: To investigate the effect of all-trans retinoic acid (ATRA) on dextran sulfate sodium (DSS)-induced colitis in mice.
METHODS: Mice were randomly divided into four groups: a normal control group, a DSS group, an ATRA group, and a LE135 group. Except the normal control group, the other groups were fed 3%DSS (w/v) solution from days 1 to 8 to induce colitis. The DSS group and ATRA group were intraperitoneally injected with ATRA 0.5 mg/d and LE135 0.1 mg/d from day 3, respectively. Disease activity index (DAI) was recorded daily. The expression of CD68, NF-κB p65, MPO activity, and TNF level in the colon of mice of each group were measured.
RESULTS: DAI was significantly lower in the ATRA group than in the DSS and LE135 groups (both P < 0.05). The histological score and MPO activity in colonic tissue in the ATRA group were significantly lower than those in the DSS and LE135 groups (histological score: 7.63 ± 1.19 vs 10.13 ± 1.36, 10.38 ± 1.30, both P < 0.05; MPO activity: 7.88 ± 0.68 vs 11.36 ± 0.96, 12.65 ± 0.77, both P < 0.05), but were higher than those in the control group (7.63 ± 1.19 vs 0.25 ± 0.463, P < 0.05; 7.88 ± 0.68 vs 3.52 ± 0.58, P < 0.05). The levels of TNF in colonic tissue were significantly lower in the ATRA group than in the DSS and LE135 groups (178.63 ± 39.37 vs 316.67 ± 43.68, 362.45 ± 62.75, both P < 0.05). The numbers of CD68 positive cells and NF-kB positive cells in lamina propria in the ATRA group were significantly lower than those in the DSS and LE135 groups (all P < 0.05), but higher than those in the control group (all P < 0.05).
CONCLUSION: ATRA protects against DSS-induced colitis in mice possibly by inhibiting immune cell activation in the lamina propria and infiltration of macrophage into colon tissue.
- Citation: Hong K, Zhang Y, Guo Y, Bai AP. All-trans retinoic acid protects against dextran sulfate sodium-induced colitis in mice. Shijie Huaren Xiaohua Zazhi 2013; 21(28): 2902-2907
- URL: https://www.wjgnet.com/1009-3079/full/v21/i28/2902.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i28.2902
炎症性肠病(inflammatory bowel disease, IBD)主要包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD), 是一组慢性肠道炎症性疾病, 目前其具体机制尚不完全明确[1], 有研究表明IBD患者肠道上皮细胞受损, 肠腔内细菌分泌的LPS等向肠黏膜固有层移位, LPS激活固有层免疫细胞, 这些免疫细胞释放炎症因子和趋化因子, 如肿瘤坏死因子-a(tumor necrosis factor-a, TNF-a)、白介素1β(interleukin-1β, IL-1β)、IL-12、核因子kB(nuclear factor kB, NF-kB)等, 诱导血液及其他部位的免疫细胞尤其是巨噬细胞向损伤肠黏膜趋化、浸润, 导致肠道巨噬细胞增多[2]; 维甲酸(retinoic acid, RA)又名视黄酸是维生素A的活性衍生物[3], 是脂溶性、小分子量信号分子, 通过与其细胞内的受体a(retinoic acid receptor a, RARa)结合发挥生物学功能[4]. 在体内的生理活性代谢产物主要包括全反式维甲酸(all-trans retinoic acid, ATRA)、9-顺式维甲酸和13-顺式维甲酸, 在调节生物各种进程如细胞分化、凋亡[5]、胚胎发育、再生和视力发育[6]中发挥重要作用. 近年来有研究表明, 全反式维甲酸能明显减轻小鼠实验性结肠炎的炎症反应[7], 但具体机制尚不完全明确. 有研究表明视黄酸能通过抑制巨噬细胞的功能而对恶性肿瘤、慢性炎症等疾病起作用, 但维甲酸是否能通过抑制巨噬细胞向肠黏膜浸润而对炎症性肠病起治疗作用目前鲜有人研究.
葡聚糖硫酸钠(dextran sulfate sodium, DSS)购自美国MP公司, 兔抗小鼠NF-kB p65购自北京中杉金桥生物有限公司; anti mouse-CD68 antibody for IHC-P购自美国Abcam公司; 全反式维甲酸购自美国Sigma公司; LE135购自美国Santa cruz公司; 二步法免疫组织化学检测试剂盒(PV-9001)购自北京中山生物有限公司; DAB显色增强剂购自北京中山生物有限公司; 髓过氧化物酶(myeloperoxidase, MPO)检测试剂盒购自南京建成生物工程有限公司; 小鼠TNF ELISA试剂盒购自上海森雄生物工程有限公司; DMSO购自Amresco公司.
1.2.1 急性DSS结肠炎的诱导: 6-8周龄的♀Balb/c小鼠, 体质量18-22 g, 分为正常对照组、DSS组、DSS+ATRA组、DSS+LE135组, 每组8只, 按Cooper等[8]的方法建立小鼠急性DSS结肠炎模型. 自实验开始第1-7天DSS组、DSS+ATRA组、DSS+LE135组小鼠喂含3%DSS的蒸馏水; 实验第3天开始给予DSS+ATRA组和DSS+LE135组分别向腹腔注射配好的ATRA 0.5 mL(浓度为1 mg/mL, 溶于DMSO中加生理盐水稀释)和LE135 0.5 mL(浓度为0.2 mg/mL, 溶于DMSO中加生理盐水稀释)直至第8天处死小鼠; 对照组小鼠喂蒸馏水, 实验第8天处死小鼠.
1.2.2 结肠炎疾病活动指数(disease activity index, DAI)的评估: 每天观察并纪录小鼠的体质量变化、大便性状和大便出血(隐血或血便)等情况, 按Murano等[9]的评分方法, 将体质量下降、大便性状、大便出血等情况的评分相加, 计算每只小鼠的疾病活动指数, 根据评估结肠炎症的严重程度.
1.2.3 组织学评分: 取距肛门5-6 cm处结肠行HE染色, 按Dielelman等[10]的评分方法, 用炎症的严重程度、病变侵及的深度、隐窝的破坏与病变范围等评分相加, 评估结肠炎的严重程度.
1.2.4 结肠组织MPO活性测定: 按南京建成生物工程有限公司试剂盒说明进行操作.
1.2.5 结肠组织细胞因子TNF-a的检测: 在距肛门3 cm处取0.1-0.2 cm的结肠组织块, 称质量后匀浆, 取上清, 按试剂盒说明进行操作, 检测结肠组织中TNF-α的含量.
1.2.6 免疫组织化学法检测结肠黏膜NF-kB p65及CD68的表达: 在距肛门约2 cm处取0.5 cm×0.5 cm大小的结肠组织块, 4%甲醛溶液固定、石蜡包埋、切片. 山羊血清封闭后, 加抗NF-kB p65抗体或抗CD68抗体4 ℃孵育过夜, 加二抗, DAB显色, 显微镜下观察. 细胞质、细胞核都出现棕褐色颗粒的细胞为NF-κB p65阳性细胞, 细胞质出现棕褐色颗粒的细胞为CD68阳性细胞, 在40倍高倍镜下计数100个细胞, 其中阳性细胞数作为NF-κB p65及CD68计数值.
统计学处理 所有的数据均以mean±SD形式表示. 计数、计量资料的统计分析均经SPSS18.0处理, 符合正态分布计量资料的比较采用方差分析; 不符合的采用秩和检验, 以P<0.05为差异有统计学意义.
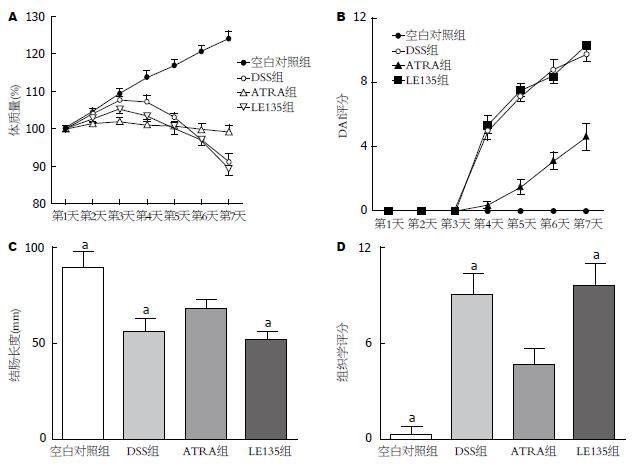
如图1A所示, DSS组和DSS+LE135组小鼠在饮用DSS水的第3天出现毛发缺少光泽、身体蜷缩、懒动、进食减少等的情况, 第4天开始体质量出现不同程度的下降. DSS+ATRA下降幅度较DSS组和DSS+LE135组要小并有统计学意义(P<0.05). 对照组小鼠的体质量呈持续性的增长.
DSS+ATRA组出现腹泻、便血等结肠炎症状DSS和DSS+LE135组轻, 症状出现时间也较晚. 自实验第4天开始, DSS+ATRA的DAI评分明显低于DSS和DSS+LE135组(P<0.05). 对照组小鼠每天DAI评分均为0(图1B).
所有饮用DSS溶液的小鼠均出现大肠不同程度的缩短, DSS组和DSS+LE135组缩短程度最大, DSS+ATRA组介于DSS组和正常对照组之间, 结肠长度明显比DSS组要长(P<0.05)(图1C).
各组小鼠组织学评分如图1D所示, 3个实验组的组织学评分明显高于空白对照组, DSS+ATRA组的组织学评分明显低于DSS组和DSS+LE135组(P<0.05).
MPO主要还是存在于炎症细胞中, 以中性粒细胞的细胞质中最为多见, 他的活性反映了结肠组织中炎症细胞的浸润程度. DSS组和DSS+LE135组小鼠结肠组织的MPO活性较正常对照组小鼠明显增高(P<0.05), 给予ATRA干预后MPO活性明显比DSS组和DSS+LE135组要低(P<0.05)(表1).
饮用了7 d DSS后, DSS组和DSS+LE135组TNF-α表达较正常组明显增高(P<0.05), 给予ATRA干预后TNF-α表达明显比DSS组和DSS+LE135组要低, 具有统计学意义(P<0.05)(表2).
正常对照组小鼠黏膜层中、少数隐窝底部上皮细胞和少量的固有层单核细胞为P65阳性细胞, 且胞核着色较浅. DSS组的黏膜层中, 残存的腺体细胞均为P65阳性细胞, 黏膜层和黏膜下层有大量的炎症细胞胞核P65染色阳性. DSS+LE135组P65表达情况和DSS相似, DSS+ATRA组P65表达较DSS组相比明显下降, 具有统计学意义(P<0.05)(表3).
正常对照组小鼠少量的固有层单核细胞为CD68阳性细胞, 胞浆着色较浅. DSS组固有层有大量CD68染色阳性细胞, 较正常对照组明显增加(P<0.05). DSS+LE135组CD68的表达情况比DSS组要高(P<0.05), DSS+ATRA组CD68表达较DSS组相比明显下降, 具有明显的统计学意义(P<0.05)(表4).
肠黏膜巨噬细胞与其他部位的巨噬细胞一样起源于骨髓的造血干细胞, 大部分在正常肠黏膜定居的巨噬细胞主要位于上皮下的黏膜固有层和集合淋巴小结[11]. 巨噬细胞表面有许多特异性的单克隆抗体识别标志物: CD68[12,13]、CD14[14]、巨噬细胞清除受体[15]、巨噬细胞甘露醇受体[16]、天然耐受相关巨噬细胞蛋白[17,18]、F4/80[19]、M-CSF受体[20]、巨噬细胞基因-1[21]、单核细胞特异性酯酶[22]等. 巨噬细胞在机体固有免疫、适应性免疫、炎症反应、组织修复中起关键作用, 巨噬细胞可产生和分泌多种生物活性物质, 如IL-1、IL-3、TNF-α等[23], 大量研究表明在炎症性肠病中巨噬细胞处于一种高表达状态[24,25], 其产生的炎症因子TNF-α也明显增多, CD68作为巨噬细胞表面特异性标记物在炎症性肠病中也呈高表达状态. 本实验中我们利用免疫组织化学法检测小鼠结肠组织中CD68的表达情况, 在正常对照组小鼠结肠组织黏膜固有层仅有少量的CD68表达, DSS结肠炎肠黏膜有大量的CD68表达, DSS+ATRA组CD68的表达明显减少, 而DSS+LE135组CD68的表达较DSS都有明显的增高.
TNF是一种由巨噬细胞产生的有广泛生物学活性的细胞因子[26], TNF-α是一种重要的炎症递质, 在启动和维持肠组织炎症中起着非常重要的作用[27]. 本实验中, 我们利用ELISA学法检测小鼠结肠组织TNF-α的表达情况, 在正常对照组小鼠结肠组织TNF-α含量较少, 而DSS小鼠结肠组织中TNF-α含量明显增高. 在小鼠腹腔注射ATRA后, 结肠损伤程度明显减轻, TNF-α含量较DSS组明显减少.
IBD患者肠黏膜组织中NF-κB的表达量明显上调[28,29], NF-κB在肠道主要定位于黏膜固有层单核细胞及巨噬细胞内, 黏膜下表皮细胞及内皮细胞中亦可见NF-κB的表达. NF-κB通过对细胞因子、黏附分子、趋化因子及其他炎性递质的调控在IBD炎症反应中起关键作用, 目前发现这些与炎症性肠病密切相关的细胞基因启动子或增强子部位均有κB的位点, NF-κB在核内与κB结合促进多种炎性细胞因子如IL-1b、IL-2、IL-6、IL-8等的基因转录[30], 已有大量的研究表明IBD中NF-κB表达上调的同时还伴有IL-1、TNF-α等表达的上调, 如前所述IL-1和TNF-α可促进NF-κB表达进一步增加, 产生级联反应, 使炎症进一步加重[30]. 本实验中, 我们利用免疫组织化学法检测小鼠结肠组织NF-κB的活化情况, 在正常对照组小鼠结肠组织黏膜中仅有少量的肠上皮细胞和固有层单核细胞(LPMC)核表达NF-κB p65, DSS诱导小鼠结肠炎受损结肠组织中残存的腺体上皮细胞可见大量p65阳性细胞, LPMC高表达激活的NF-κB. 在小鼠腹腔注射ATRA后, 结肠损伤程度明显减轻, 黏膜层炎性细胞中p65阳性细胞数较DSS组的表达明显减少.
目前对维甲酸的研究相当的广泛, 过去的研究发现他对恶性肿瘤、肾病、肝脏疾病、肺气肿、动脉粥样硬化、炎症性肠病等疾病均有治疗的作用, 但其具体的机制尚不完全明确, 有研究表明他能通过抑制巨噬细胞的功能而对恶性肿瘤、慢性炎症等疾病起作用, 本实验通过检测巨噬细胞的表面特异性标记物CD68观察到维甲酸能抑制巨噬细胞向肠道浸润, 从而抑制炎症性肠病的进展.
炎症性肠病(inflammatory bowel disease, IBD)目前具体机制尚不完全明确, 有研究表明可能与血液及其他部位的免疫细胞尤其是巨噬细胞向损伤肠黏膜趋化、浸润, 导致肠道巨噬细胞增多有关; 维甲酸又名视黄酸是维生素A的活性衍生, 近年来发现全反式维甲酸(all-trans retinoic acid, ATRA)能明显减轻小鼠实验性结肠炎的炎症反应, 但具体机制尚不完全明确. 有研究表明视黄酸能通过抑制巨噬细胞的功能而对恶性肿瘤、慢性炎症等疾病起作用, 但维甲酸是否能通过抑制巨噬细胞向肠黏膜浸润而对IBD起治疗作用目前鲜有人进行研究.
任粉玉, 教授, 延边大学附属医院消化内科
已有大量的研究表明Th17/Treg、Th1/Th2转化平衡是维持肠道免疫稳态的重要因素, 这可能是导致人类IBD的原因之一. 近年来研究表明全反式维甲酸可能是调控二者平衡关系的重要因素, 通过调节Th17/Treg、Th1/Th2转化平衡继而影响IBD的进程, 达到治疗的目的.
白爱平等的研究发现全反式维甲酸能通过调节Th17/Treg、Th1/Th2转化平衡继而影响IBD的进程, 达到治疗的目的.
维甲酸是否能通过抑制巨噬细胞向肠黏膜浸润而对炎症性肠病起治疗作用目前鲜有人研究.
本研究发现ATRA能通过抑制结肠炎作用肠道免疫反应, 及外周巨噬细胞向肠黏膜浸润而对葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的小鼠结肠炎起治疗作用, 有待进一步证实是否也能通过这样一个机制对人体炎症性肠病起治疗作用, 是否还有其他能抑制巨噬细胞向肠黏膜浸润的药物也能通过这个途径对炎症性肠病起治疗作用.
本文探讨ATRA对DSS诱导的小鼠结肠炎的治疗作用机制, 设计合理, 具有可读性和科学性, 研究结果具有一定的学术意义和参考价值.
编辑: 田滢 电编:鲁亚静
| 1. | Thia KT, Loftus EV, Sandborn WJ, Yang SK. An update on the epidemiology of inflammatory bowel disease in Asia. Am J Gastroenterol. 2008;103:3167-3182. [PubMed] [DOI] |
| 2. | Munitz A, Cole ET, Beichler A, Groschwitz K, Ahrens R, Steinbrecher K, Willson T, Han X, Denson L, Rothenberg ME. Paired immunoglobulin-like receptor B (PIR-B) negatively regulates macrophage activation in experimental colitis. Gastroenterology. 2010;139:530-541. [PubMed] [DOI] |
| 3. | D'Ambrosio DN, Clugston RD, Blaner WS. Vitamin A metabolism: an update. Nutrients. 2011;3:63-103. [PubMed] [DOI] |
| 4. | Kasimanickam VR, Kasimanickam RK. Retinoic acid signaling biomarkers after treatment with retinoic acid and retinoic acid receptor alpha antagonist (Ro 41-5253) in canine testis: an in vitro organ culture study. Theriogenology. 2013;79:10-16. [PubMed] [DOI] |
| 5. | Spano A, Barni S, Sciola L. PMA withdrawal in PMA-treated monocytic THP-1 cells and subsequent retinoic acid stimulation, modulate induction of apoptosis and appearance of dendritic cells. Cell Prolif. 2013;46:328-347. [PubMed] [DOI] |
| 6. | Luo T, Sakai Y, Wagner E, Dräger UC. Retinoids, eye development, and maturation of visual function. J Neurobiol. 2006;66:677-686. [PubMed] [DOI] |
| 7. | Bai A, Lu N, Zeng H, Li Z, Zhou X, Chen J, Liu P, Peng Z, Guo Y. All-trans retinoic acid ameliorates trinitrobenzene sulfonic acid-induced colitis by shifting Th1 to Th2 profile. J Interferon Cytokine Res. 2010;30:399-406. [PubMed] [DOI] |
| 8. | Cooper HS, Murthy SN, Shah RS, Sedergran DJ. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab Invest. 1993;69:238-249. [PubMed] |
| 9. | Murano M, Maemura K, Hirata I, Toshina K, Nishikawa T, Hamamoto N, Sasaki S, Saitoh O, Katsu K. Therapeutic effect of intracolonically administered nuclear factor kappa B (p65) antisense oligonucleotide on mouse dextran sulphate sodium (DSS)-induced colitis. Clin Exp Immunol. 2000;120:51-58. [PubMed] |
| 10. | Dieleman LA, Ridwan BU, Tennyson GS, Beagley KW, Bucy RP, Elson CO. Dextran sulfate sodium-induced colitis occurs in severe combined immunodeficient mice. Gastroenterology. 1994;107:1643-1652. [PubMed] |
| 11. | Fonseca J, Martins dos Santos J, Oliveira P, Laranjeira N, Castelo Branco NA. Noise-induced duodenal lesions: a light and electron microscopy study of the lesions of the rat duodenal mucosa exposed to low frequency noise. Clin Res Hepatol Gastroenterol. 2012;36:72-77. [PubMed] [DOI] |
| 12. | Holness CL, Simmons DL. Molecular cloning of CD68, a human macrophage marker related to lysosomal glycoproteins. Blood. 1993;81:1607-1613. [PubMed] |
| 13. | Holness CL, da Silva RP, Fawcett J, Gordon S, Simmons DL. Macrosialin, a mouse macrophage-restricted glycoprotein, is a member of the lamp/lgp family. J Biol Chem. 1993;268:9661-9666. [PubMed] |
| 14. | Wright SD, Ramos RA, Tobias PS, Ulevitch RJ, Mathison JC. CD14, a receptor for complexes of lipopolysaccharide (LPS) and LPS binding protein. Science. 1990;249:1431-1433. [PubMed] [DOI] |
| 15. | Krieger M, Herz J. Structures and functions of multiligand lipoprotein receptors: macrophage scavenger receptors and LDL receptor-related protein (LRP). Annu Rev Biochem. 1994;63:601-637. [PubMed] [DOI] |
| 16. | Mokoena T, Gordon S. Human macrophage activation. Modulation of mannosyl, fucosyl receptor activity in vitro by lymphokines, gamma and alpha interferons, and dexamethasone. J Clin Invest. 1985;75:624-631. [PubMed] [DOI] |
| 17. | Chen SL, Xu MY, Ji XS, Yu GC. Cloning and characterisation of natural resistance associated macrophage protein (Nramp) cDNA from red sea bream (Pagrus major). Fish Shellfish Immunol. 2004;17:305-313. [PubMed] [DOI] |
| 18. | Vidal SM, Malo D, Vogan K, Skamene E, Gros P. Natural resistance to infection with intracellular parasites: isolation of a candidate for Bcg. Cell. 1993;73:469-485. [PubMed] [DOI] |
| 19. | Lin HH, Stacey M, Stein-Streilein J, Gordon S. F4/80: the macrophage-specific adhesion-GPCR and its role in immunoregulation. Adv Exp Med Biol. 2010;706:149-156. [PubMed] [DOI] |
| 20. | Zhang DE, Hetherington CJ, Chen HM, Tenen DG. The macrophage transcription factor PU.1 directs tissue-specific expression of the macrophage colony-stimulating factor receptor. Mol Cell Biol. 1994;14:373-381. [PubMed] [DOI] |
| 21. | Spilsbury K, O'Mara MA, Wu WM, Rowe PB, Symonds G, Takayama Y. Isolation of a novel macrophage-specific gene by differential cDNA analysis. Blood. 1995;85:1620-1629. [PubMed] |
| 22. | Zschunke F, Salmassi A, Kreipe H, Buck F, Parwaresch MR, Radzun HJ. cDNA cloning and characterization of human monocyte/macrophage serine esterase-1. Blood. 1991;78:506-512. [PubMed] |
| 23. | Hamilton JA. Colony stimulating factors, cytokines and monocyte-macrophages--some controversies. Immunol Today. 1993;14:18-24. [PubMed] [DOI] |
| 24. | Allison MC, Cornwall S, Poulter LW, Dhillon AP, Pounder RE. Macrophage heterogeneity in normal colonic mucosa and in inflammatory bowel disease. Gut. 1988;29:1531-1538. [PubMed] [DOI] |
| 25. | Mahida YR, Patel S, Gionchetti P, Vaux D, Jewell DP. Macrophage subpopulations in lamina propria of normal and inflamed colon and terminal ileum. Gut. 1989;30:826-834. [PubMed] [DOI] |
| 26. | Kapadia S, Lee J, Torre-Amione G, Birdsall HH, Ma TS, Mann DL. Tumor necrosis factor-alpha gene and protein expression in adult feline myocardium after endotoxin administration. J Clin Invest. 1995;96:1042-1052. [PubMed] [DOI] |
| 27. | Blam ME, Stein RB, Lichtenstein GR. Integrating anti-tumor necrosis factor therapy in inflammatory bowel disease: current and future perspectives. Am J Gastroenterol. 2001;96:1977-1997. [PubMed] [DOI] |
| 28. | Atreya I, Atreya R, Neurath MF. NF-kappaB in inflammatory bowel disease. J Intern Med. 2008;263:591-596. [PubMed] [DOI] |
| 29. | Thiele K, Bierhaus A, Autschbach F, Hofmann M, Stremmel W, Thiele H, Ziegler R, Nawroth PP. Cell specific effects of glucocorticoid treatment on the NF-kappaBp65/IkappaBalpha system in patients with Crohn's disease. Gut. 1999;45:693-704. [PubMed] [DOI] |
| 30. | Tak PP, Firestein GS. NF-kappaB: a key role in inflammatory diseases. J Clin Invest. 2001;107:7-11. [PubMed] [DOI] |