修回日期: 2013-08-20
接受日期: 2013-09-06
在线出版日期: 2013-09-18
目的: 提高对胆囊切除后引起胆汁反流对胃黏膜细胞影响因素的认识.
方法: 对40例经B超、CT检查确诊为胆囊结石行胆囊切除的患者, 应用胃镜对每一例患者胆囊切除前及切除后3 mo进行检查, 观察幽门口胆汁反流程度及十二指肠球部胆汁存留程度, 同时使用活检钳在胃窦部钳取胃黏膜做细胞组织学检查; 此后, 每年进行1次复查, 连续3年, 观察胆汁反流程度及胃黏膜细胞组织病理学变化.
结果: (1)胆囊切除前、后胃幽门口无胆汁反流患者的比例由65%降低至7.5%, 减少57.5%; 有少量反流的患者由术前的27.5%降低至15%, 减少12.5%; 有中量反流的患者由术前的7.5%增加至55%, 增加47.5%; 在术前无大量胆汁反流现象的患者, 术后出现了占比例22.5%的大量胆汁反流现象的患者, 增加率为100%; (2)十二指肠球部胆汁存留程度在胆囊切除前后比例发生显著变化: 有少量胆汁存留的患者由术前的80%降低至10%, 减少70%; 有中量存留的患者由术前的20%增加至67.5%, 增加57.5%; 术前无胆汁大量存留的患者, 出现了22.5%比例的胆汁存留现象的患者, 增加率为100%; (3)胃窦黏膜细胞在胆囊切除前、后组织病理学发生明显变化: 胃窦黏膜细胞发生肠化生的患者由胆囊切除前的7.5%增加至胆囊切除后的62.5%, 增加率45%; 不典型增生由胆囊切除前的5%增加至45%, 增加率40%.
结论: 胆囊切除后, 胆汁反流明显增加, 引起胆汁反流性胃炎, 逐渐导致胃黏膜细胞发生肠上皮化生、不典型增生改变等胃黏膜多阶段病变发生及发展.
核心提示: 本文对经B超、CT检查确诊为胆囊结石行胆囊切除的患者, 应用胃镜对每一例患者胆囊切除前及切除后进行检查, 观察幽门口胆汁反流程度及十二指肠球部胆汁存留程度, 同时使用活检钳在胃窦部钳取胃黏膜做细胞组织学检查, 观察胆汁反流程度及胃黏膜细胞组织病理学变化. 提高对胆囊切除后引起胆汁反流对胃黏膜细胞影响因素的认识.
引文著录: 黎永军, 胡咏泉, 陈卫刚, 李睿, 陈云昭, 田德安. 胆囊切除后胆汁反流对胃窦黏膜上皮细胞病理学影响. 世界华人消化杂志 2013; 21(26): 2702-2707
Revised: August 20, 2013
Accepted: September 6, 2013
Published online: September 18, 2013
AIM: To investigate the effect of bile reflux after cholecystectomy on the histology of gastric antral mucosal cells.
METHODS: Forty patients with gallstones diagnosed by type-B ultrasound and CT underwent endoscopy before and three months after the excision of the gallbladder to observe the degree of bile reflux in the pyloric opening and the extent of duodenal bile retention. Biopsy forceps were used to take antral gastric mucosal tissues for histological examination. The patients then underwent re-examinations annually for three years to observe the degree of bile reflux and histological changes of gastric mucosal cells.
RESULTS: The percentage of patients without bile reflux in the pyloric opening was reduced from 65% before cholecystectomy to 7.5% after cholecystectomy, and the corresponding percentages were 27.5% to 15% for patients with a small amount of bile reflux, 7.5% to 55% for those with a medium amount of bile reflux, and 0% to 22.5% for those with a large amount of bile reflux. The percentage of patients with a small amount of bile retention was reduced from 80% before cholecystectomy to 10% after cholecystectomy, and the corresponding percentages were 20% to 67.5% for patients with a medium amount of bile retention, and 0% to 22.5% for those with a large amount of bile retention. Gastric mucosal cells showed significant histological changes after cholecystectomy. The percentage of patients with intestinal metaplasia increased from preoperative 7.5% to postoperative 62.5%, and the percentage of patients with atypia-hyperplasia increased from preoperative 5% to 45%.
CONCLUSION: Bile reflux increases significantly after cholecystectomy, which can cause bile reflux gastritis and gradually lead to intestinal metaplasia and atypia-hyperplasia.
- Citation: Li YJ, Hu YQ, Chen WG, Li R, Chen YZ, Tian DA. Bile reflux after cholecystectomy affects histology of gastric antral epithelial cells. Shijie Huaren Xiaohua Zazhi 2013; 21(26): 2702-2707
- URL: https://www.wjgnet.com/1009-3079/full/v21/i26/2702.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i26.2702
胆囊结石是临床上常见疾病, 其发生率约占我国总人口的7%, 并有逐步增高趋势[1]. 胆囊结石的治疗目前仍以手术切除胆囊为主, 但胆囊切除术后多数患者出现上腹胀满不适、烧心、口苦、恶心、呕吐等为特征的临床症候群, 又称胆汁反流性胃炎综合征[2]. 并不是胃镜观察下胃底黏液池内存留有胆汁就可以诊断胆汁反流性胃炎(bile reflux gastritis, BRG), 胆汁反流是BRG的先决条件, 必须伴有胃黏膜损害及病理诊断[3]. BRG的胃镜诊断标准为: 胃镜见黏液池呈黄色或黄绿色胆汁样, 胃黏膜上可见胆汁瘀斑、黏膜充血、水肿、质脆或糜烂, 呈牛肉红色. BRG主要病理学改变为: 黏膜下层水肿, 黏膜层血管扩张充血, 炎性细胞浸润[4]. 为探讨胆囊摘除术后胆汁反流程度及其对于胃窦部黏膜病理学的影响, 本研究对40例经B超、CT检查确诊为胆囊结石的患者, 在胆囊切除术前后行胃镜检查, 观察患者幽门及十二指肠球部胆汁反流量的变化及胆汁反流对胃窦部黏膜组织病理学的改变进行分析, 为进一步探索胆汁反流是否会增加胃黏膜病变提供理论依据.
纳入标准: 收集2003-03/2009-09在我院就诊, 并经B超、CT检查确诊为胆囊结石并行胆囊切除手术患者40例, 年龄32-65岁, 平均年龄43.3岁. 40例患者均具有完整病历资料, 其中结石单发者11例, 直径0.7-3.0 cm; 多发者16例, 胆囊内有结石2-5枚不等, 直径0.4-2.0 cm; 泥沙充满型13例. 排除标准: 40例患者胆囊切除术前胃镜下钳取胃窦黏膜病理学检查均无肠化生/不典型增生且行幽门螺旋杆菌(Helicobacter pylori, H. pylori)检测阴性.
1.2.1 组织检查: 患者经B超、CT检查确诊为胆囊结石, 采用胃镜检查, 插入胃内后静置1 min, 观察胃内情况符合BRG的胃镜诊断标准的, 记录幽门口胆汁反流情况, 十二指肠球部胆汁存留程度, 同时用活检钳钳取胃窦部(距幽门5 cm范围)黏膜做细胞组织学检查[5]. 术后3 mo, 由同一胃镜操作医师进行胃镜检查, 同时钳取胃窦部黏膜做组织细胞学检查, 检查结果与前1次结果作对比; 之后连续3年, 每年进行1次胃镜检查及黏膜细胞组织学检查, 做好记录, 进行对比观察.
1.2.2 观察指标: (1)观察胆囊切除前、后不同时段幽门口胆汁反流量; (2)观察胆囊切除前、后不同时段十二指肠球部胆汁存留量; (3)观察胃窦部黏膜在胆囊切除前、后不同时段肠化生及不典型增生发生率.
1.2.3 判定指标: 幽门口胆汁反流量: 少量-胆汁在每次幽门关闭时反流在幽门口附近; 中量-胆汁反流至胃窦部; 大量-胆汁反流至胃体部. 十二指肠球部胆汁存留量: 少量-球部存在黄色胆汁泡沫; 中量-球部见较多的胆汁泡沫, 并有少量液体状胆汁; 大量-有较多的黄色液体状胆汁存留在球部[6]. 胃窦黏膜细胞组织学改变按病理学诊断标准判定, 将肠化生分为不完全性和完全性; 不典型增生分为轻度、中度及重度三种进行分析研究[7]. 胆汁反流少量、中量、大量符合有关文献根据黏液湖黄染程度及有无胆汁反流、黏膜糜烂程度将胆汁反流性胃炎划分的三级标准[8].
统计学处理 应用SPSSl2.0统计软件包对资料进行处理, 组间比较采用χ2检验. P<0.05为差异有统计学意义.
在40例胆结石患者中, 胆囊切除前、后, 幽门口的胆汁反流结果: 胆囊切除3 mo后幽门口胆汁中-大量反流增多, 胆囊切除后1、2、3年胆汁中量反流比率较术前明显增多, 有统计学意义(P<0.05). 胆囊切除后2、3年胆汁大量反流比率较术前明显增多, 有统计学意义(P<0.05)(表1).
| 无胆汁反流 | 少量胆汁反流 | 中量胆汁反流 | 大量胆汁反流 | |
| 胆囊切除前 | 26(65) | 11(27.5) | 3(7.5) | - |
| 切除后3 mo | 8(20) | 17(42.5) | 12(30) | 3(7.5) |
| 切除后1年 | 4(10) | 10(25) | 19(47.5) | 7(17.5) |
| 切除后2年 | 3(7.5) | 8(20) | 20(50) | 9(22.5) |
| 切除后3年 | 3(7.5) | 6(15) | 22(55) | 9(22.5) |
| 变化率(%) | -57.5 | -12.5 | +47.5 | +100 |
在40例胆结石患者中, 胆囊切除前、后, 十二指肠球部的胆汁存留结果: 胆囊切除3 mo后十二指肠球部胆汁中-大量存留增多, 胆囊切除后1、2、3年胆汁中量存留比率较术前明显增多, 有统计学意义(P<0.05). 胆囊切除后2、3年胆汁大量存留比率较术前明显增多, 有统计学意义(P<0.05)(表2).
| 少量胆汁存留 | 中量胆汁存留 | 大量胆汁存留 | |
| 胆囊切除前 | 32(80) | 8(20) | - |
| 胆囊切除后3 mo | 15(37.5) | 20(50) | 5(12.5) |
| 胆囊切除后1年 | 7(17.5) | 25(62.5) | 8(20) |
| 胆囊切除后2年 | 5(12.5) | 2(65) | 9(22.5) |
| 胆囊切除后3年 | 4(10) | 27(67.5) | 9(22.5) |
| 变化率(%) | -70 | +47.5 | +100 |
在40例胆结石患者中, 胆囊切除前、后, 肠化生和不典型增生的结果: 胆囊切除后1、2、3年肠化生及不典型增生比率较术前明显增多, 有统计学意义(P<0.05, 表3).
| 肠化生 | 不典型增生 | ||||
| 完全性 | 不完全性 | 轻度 | 中度 | 重度 | |
| 胆囊切除前 | 3(7.5) | - | 2(5) | - | - |
| 切除后3 mo | 4(10) | - | 3(7.5) | - | - |
| 切除后1年 | 11(27.5) | 1(2.5) | 6(15) | 2(5) | - |
| 切除后2年 | 16(40) | 2(5) | 10(25) | 3(7.5) | 1(2.5) |
| 切除后3年 | 20(50) | 5(12.5) | 11(27.5) | 5(12.5) | 2(5) |
| 变化率(%) | +42.5 | +100 | +22.5 | +100 | +100 |
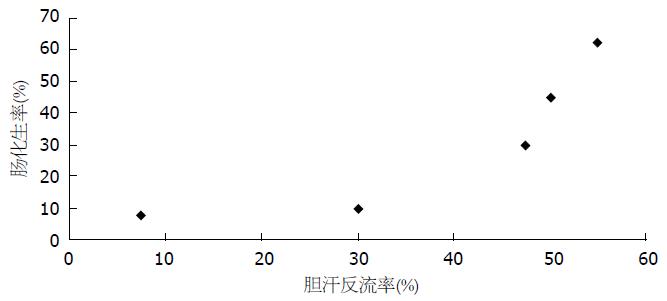
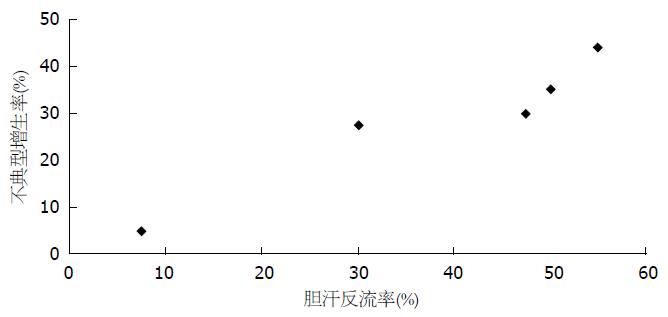
幽门口胆汁反流与胃窦黏膜肠化生、不典型增生呈正相关(图1, 2)
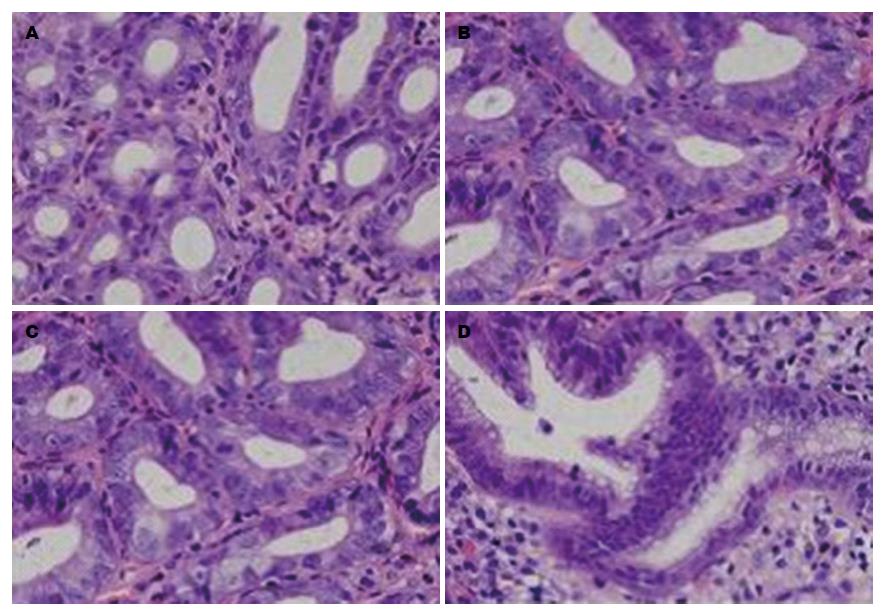
胃窦部黏膜肠化生及不典型增生病理学变化如图3所示.
已有研究表明, 胆囊具有贮存、浓缩、排放胆汁, 调节胆道压力等作用[9]. 当人体进食时, 胆囊开始收缩并排出胆汁进入十二指肠帮助消化食物中脂质成分. 节律性的胆囊收缩使十二指肠球部内胆汁的排入量较为恒定, 球部的压力亦适中[10]. 而当胆囊切除后, 胆囊的调节功能丧失, 肝脏合成胆汁排入十二指肠由间歇性和进餐相关的方式变成持续排出, 为胆汁反流提供了条件[11]; 胆囊切除术后血清胃泌素、胆囊收缩素、YY肽等胃肠道激素水平升高, 可直接影响胃-幽门-十二指肠协同运动, 十二指肠球腔内压力增高, 十二指肠液经幽门反流入胃成为可能[12]. 本研究表明: 胆囊切除前、后胃幽门口中量反流的患者由术前的7.5%增加至术后55%(P<0.05), 术后大量胆汁反流患者比例由术前无增加至22.5%(P<0.05). 十二指肠球部有中量胆汁存留的患者由术前的20%增加至67.5%(P<0.05), 术前无胆汁大量存留的患者, 术后出现22.5%比例(P<0.05). 说明幽门口胆汁反流程度与十二指肠球部胆汁存留状况密切相关, 这与以往研究相符合[13]. 造成十二指肠球部胆汁存留量增多的机制可能是胆囊切除手术过程中会造成胆总管不同程度的黏连, 相邻的十二指肠发生结构及形态的改变, 出现十二指肠扭曲和部分梗阻, 致使十二指肠球部胆汁存留逐渐增加, 十二指肠球内的压力也不断增加[14]. 与此同时, 十二指肠分泌的胰泌素、胆囊收缩素和胃窦分泌的胃泌素之间平衡失调导致幽门括约肌肌力下降, 而造成幽门松弛, 幽门括约肌的闸门作用消失, 为胆汁反流打开了渠道, 形成十二指肠液(主要成分为胆汁)反流进入胃幽门口.
本研究显示: 胆囊切除术后幽门口胆汁反流量与胃窦黏膜肠化生及不典型增生均呈正相关, 且随时间的延长胃窦黏膜肠化生及不典型增生率逐渐增加. 其原因可能为胆汁中含有大量胆酸、肠液、胰液使胃黏液屏障受损, 胆汁酸渗透、氢离子弥散、胰酶消化等因素影响到胃黏膜上皮细胞的能量代谢, 在长期有害物质作用下产生细胞坏死、腺体萎缩、肠化生等一系列改变. 胃黏膜有很强的再生能力, 坏死的胃黏膜细胞在被再生细胞替代过程中由于胆汁影响细胞的能量代谢, 再生细胞出现细胞核异常分裂, 细胞排列结构紊乱, 最终导致胃黏膜的不典型增生. 重度不典型增生为癌前病变, 可能导致胃癌的发生. 胆汁反流所导致的胃黏膜的肠化生及不典型增生应引起医务工作者的高度重视.
总之, 本研究通过对胆囊结石患者胆囊切除术前、后胆汁反流程度及胃窦黏膜病理学变化的观察对比提示: 胆囊切除术后幽门口胆汁反流率、胃窦黏膜肠上皮化生率、不典型增生率均明显升高. 胆汁反流与肠上皮化生及不典型增生的发生密切相关, 为临床工作中针对胆汁反流性胃炎的治疗, 以及胃癌前病变的预防提供了一定的理论依据. 针对胆汁反流所导致的胃黏膜的损害, 治疗上应该选用胆酸络合剂、促胃动力剂、胃黏膜保护剂、抑酸剂治疗, 可起到缓解临床症状, 降低癌前病变发生发展的作用.
胆囊结石在我国属常见疾病, 其治疗目前仍以手术切除胆囊为主. 胆囊切除术后患者常出现胆汁反流性胃炎的临床表现, 而胆汁反流对于胃黏膜的病理学影响目前报道很少. 本研究对胆囊结石患者胆囊切除术前后胆汁反流程度及胃窦黏膜病理学变化的观察提示: 胆汁反流与肠上皮化生及不典型增生的发生密切相关, 为临床工作中针对胆汁反流性胃炎的治疗, 以及胃癌前病变的预防及诊断提供了一定的理论依据.
卢宁, 副主任医师, 中国人民解放军兰州军区乌鲁木齐总医院肿瘤科; 潘阳林, 副教授, 副主任医师, 中国人民解放军第四军医大学西京医院消化病医院消化六科
胃黏膜上皮细胞肠化生及不典型增生属胃癌前病变, 胃癌是我国高发的恶性肿瘤. 胃癌根治的关键在于早期诊断, 而目前我国胃癌的早期诊断率明显低于发达国家. 胃黏膜上皮细胞重度不典型增生已成为早期胃癌最主要的存在形式, 如何发现及诊断重度不典型增生已逐渐成为早期胃癌诊断的热点及难点.
胆囊切除术后多数患者出现以上腹胀满不适、烧心、口苦、恶心、呕吐等为特征的胆汁反流性胃炎综合征, 以及幽门口胆汁反流与十二指肠球部胆汁存留状况密切相关, 均有相关报道. 而胆汁反流对于胃黏膜的病理学影响目前报道很少.
本研究对胆囊结石患者胆囊切除术前后胆汁反流量及十二指肠胆汁存留量进行胃镜下观察记录, 结合组织活检观察胃窦黏膜病理学变化, 定量分析胆汁反流与胃黏膜病理学改变的关系鲜见类似报道.
本文通过对胆囊结石患者胆囊切除术前、后胆汁反流程度及胃窦黏膜病理学变化的观察对比提示: 胆汁反流与肠上皮化生及不典型增生的发生密切相关, 为临床工作中针对胆汁反流性胃炎的治疗, 以及胃癌前病变的预防提供了一定的理论依据.
本文研究目的明确, 具有一定指导意义.
编辑: 田滢 电编: 闫晋利
| 4. | 邱 玉瑾, 彭 淑英, 毛 福帧, 单 晓宇. 水负荷试验联合B超在评价胆汁反流性胃炎中的价值. 胃肠病学和肝病学杂志. 2008;17:727-728. |
| 7. | 田 峰. 胆汁反流与胃黏膜肠化生以及CDX2表达的关系. 山东医学高等专科学校报. 2009;31:411-413. |
| 9. | Dixon MF, Mapstone NP, Neville PM, Moayyedi P, Axon AT. Bile reflux gastritis and intestinal metaplasia at the cardia. Gut. 2002;51:351-355. [PubMed] [DOI] |
| 10. | Dowall JE, Willis P, Prescott R, Lamonby S, Lynch DA. Cell proliferation in type C gastritis affecting the intact stomach. J Clin Pathol. 2000;53:784-787. [PubMed] [DOI] |
| 11. | Azuma H, Ehata S, Miyazaki H, Watabe T, Maruyama O, Imamura T, Sakamoto T, Kiyama S, Kiyama Y, Ubai T. Effect of Smad7 expression on metastasis of mouse mammary carcinoma JygMC(A) cells. J Natl Cancer Inst. 2005;97:1734-1746. [PubMed] [DOI] |
| 12. | Frank M, Byers and Paul H, Jordan R. Effect of bile upon Gastric mucosa. Experimental Biology and Medicine. 2010;110:864-866. |
| 13. | Erbil Y, Türkoglu U, Barbaros U, Balik E, Olgac V, Kaya H, Cimşit B. Oxidative damage in an experimentally induced gastric and gastroduodenal reflux model. Surg Innov. 2005;12:219-225. [PubMed] [DOI] |
| 14. | Lauwers GY. Gastritis: beyond Helicobacter pylori. Int J Surg Pathol. 2010;18:28S-32S. [PubMed] [DOI] |