修回日期: 2013-07-20
接受日期: 2013-08-13
在线出版日期: 2013-09-18
目的: 了解胃肠道常见的B细胞淋巴瘤中含caspase募集结构域的膜相关鸟苷酸激酶蛋白1(caspase recruitment domain-containing membrane-associated guanylate kinase protein 1, CARMA1)表达与核因子κB(nuclear factor κB, NF-κB)表达的关系及其对淋巴瘤的影响.
方法: 筛选54例胃肠B细胞淋巴瘤, 其中弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma, DLBCL)34例、黏膜相关淋巴组织结外边缘区B细胞淋巴瘤(extranodal marginal zone B cell lymphoma of mucosa-associated lymphoid tissue, MALT淋巴瘤)20例及21例胃肠淋巴组织反应性增生病例. Real-time PCR检测CARMA1 mRNA, 免疫组织化学染色检测肿瘤细胞的CARMA1、NF-κB/p65和NF-κB/p50蛋白表达.
结果: CARMA1、NF-κB/p65和NF-κB/p50蛋白表达率在淋巴瘤组较淋巴组织反应性增生组病例明显增高(淋巴瘤: 淋巴组织反应性增生CARMA1为75.9%:47.6%, NF-κB/p65为48.2%:14.3%, NF-κB/p50为38.9%:9.5%, P = 0.042, 0.007, 0.013). 与MALT淋巴瘤比较, DLBCL病例中CARMA1 mRNA和蛋白高表达(DLBCL:MALT淋巴瘤CARMA1 mRNA 2-△△Ct为3.073:1, CARMA1蛋白为88.2%:55.0%), P值为0.019和0.020. CARMA1蛋白表达与NF-κB/p65和NF-κB/p50蛋白核表达有正相关关系(NF-κB/p65阴性组:阳性组为67.9%:84.6%, NF-κB/p50阴性组:阳性组为78.8%:71.4%), P值分别为0.030和0.031. CARMA1 mRNA在晚分期(Ⅲ和Ⅳ期)病例中表达水平高于早分期(Ⅰ和Ⅱ期)病例(晚分期:早分期CARMA1 mRNA 2-△△Ct = 4.416:1), P = 0.011, 在消化管壁内浸润病例中CARMA1蛋白表达低于浸润至管壁外的病例(管壁内:管壁外66.7%:91.7%), P = 0.003. 肿瘤细胞高增殖活性病例中CARMA1 mRNA和蛋白表达都显著升高(高增殖活性:低增殖活性 CARMA1 mRNA 2-△△Ct = 2.885:1 CARMA1蛋白为88.6%:52.6%), P值分别为0.035, 0.006. NF-κB/p65、NF-κB/p50蛋白在晚分期病例、肿瘤细胞高增殖活性病例中表达水平明显高于相应的比较组病例(晚分期:早分期NF-κB/p65为68.2%:34.4%, NF-κB/p50为54.5%:28.1%, 高增殖活性: 低增殖活性NF-κB/p65为60.0%:26.3%, NF-κB/p50为51.4%:15.8%), P值分别为0.015和0.05, 0.018和0.001. 生存分析: 淋巴瘤类型、临床分期、CARMA1蛋白及NF-κB/p65蛋白表达都是淋巴瘤独立的预后影响因子, 4种因素的相对风险度接近. CARMA1蛋白强阳性表达的所有淋巴瘤和DLBCL病例的生存状况较阴性和一般阳性表达(<50%)的相应病例差(P值为0.020, 0.045).
结论: 胃肠MALT淋巴瘤和DLBCL中NF-κB持续活化可能与CARMA1蛋白高表达相关, 推测CARMA1高表达通过活化NF-κB参与相关淋巴瘤的发生发展过程.
核心提示: 本研究发现胃肠道黏膜相关淋巴组织结外边缘区B细胞淋巴瘤(extranodal marginal zone B cell lymphoma of mucosa-associated lymphoid tissue)淋巴瘤和弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma)中核因子κB(nuclear factor κB, NF-κB)蛋白表达与CARMA1 mRNA表达无明显相关, 但随着CARMA1蛋白表达增加而增强. 且发现CARMA1和NF-κB/p65、NF-κB/p50的表达对上述淋巴瘤的临床病理特征有一定的影响.
引文著录: 裴媛媛, 杨文秀, 孟青, 陈琴, 李品浩. 胃肠道常见的B细胞淋巴瘤中CARMA1与NF-κB表达的关系. 世界华人消化杂志 2013; 21(26): 2641-2648
Revised: July 20, 2013
Accepted: August 13, 2013
Published online: September 18, 2013
AIM: To investigate the relationship between the expression of CARMA1 and nuclear factor κB (NF-κB) proteins in common subtypes of gastrointestinal B cell lymphoma.
METHODS: Fifty-four specimens of lymphomas, including 34 cases of diffuse large B-cell lymphoma (DLBCL) and 20 cases of mucosa-associated lymphoid tissue (MALT) lymphoma, and 21 specimens of gastrointestinal reactive lymphoid hyperplasia (GRLH) were selected for H&E staining and immunohistochemical staining. The mRNA and protein expression of CARMA1 was detected by Real-time PCR and immunohistochemistry, respectively. Expression of NF-κB proteins was assayed by immunohistochemistry.
RESULTS: The positive rates of CARMA1, NF-κB/p65 and NF-κB/p50 proteins were significantly higher in lymphomas than in GRLH (75.9% vs 47.6%, 48.2% vs 14.3%, 38.9% vs 9.5%; P = 0.042, 0.007, 0.013). The expression levels of CARMA1 mRNA and protein were significantly higher in DLBCL than in MALT lymphoma (P = 0.019, 0.020). There were significant differences in CARMA1 protein expression between lymphomas which were positive and negative for NF-κB/p65 or NF-κB/p50 (84.6% vs 67.9%, 71.4% vs 78.8%, P = 0.030, 0.031). CARMA1 mRNA expression was significantly higher in advanced cases than in early disease (P = 0.011). Expression of CARMA1 protein was significantly higher in cases which infiltrated through the wall than in those which did not (91.7% vs 66.7%, P = 0.003). The levels of CARMA1 mRNA and protein were significantly higher in cases with a high proliferation rate (P = 0.035, 0.006). Expression of NF-κB/p65 and NF-κB/p50 proteins was obviously increased in cases with a later TNM stage or a high proliferation rate (P = 0.015, 0.05, 0.018, 0.001). The type of lymphoma, stage, CARMA1 and NF-κB/p65 protein expression were independent factors affecting the prognosis of lymphomas. Survival was poor in cases with strong expression of CARMA1 protein than in those without (P = 0.02).
CONCLUSION: Expression of CARMA1 was correlated with that of NF-κB in gastrointestinal MALT lymphoma and DLBCL. CARMA1 expression may induce activation of NF-κB and thereby participate in the pathogenesis and progression of gastrointestinal MALT lymphoma and DLBCL.
- Citation: Pei YY, Yang WX, Meng Q, Chen Q, Li PH. Correlation between expression of CARMA1 and NF-κB proteins in common subtypes of gastrointestinal B cell lymphoma. Shijie Huaren Xiaohua Zazhi 2013; 21(26): 2641-2648
- URL: https://www.wjgnet.com/1009-3079/full/v21/i26/2641.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i26.2641
目前研究认为肿瘤细胞生存的关键取决于核因子κB(nuclear factor κB, NF-κB)的持续活化. 研究报道淋巴瘤中也存在NF-κB的持续活化[1,2]. 黏膜相关淋巴组织结外边缘区B细胞淋巴瘤(extranodal marginal zone B cell lymphoma of mucosa-associated lymphoid tissue, MALT淋巴瘤)和弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma, DLBCL)是常见的胃肠道B细胞淋巴瘤类型. 含caspase募集结构域的膜相关鸟苷酸激酶蛋白1(caspase recruitment domain-containing membrane-associated guanylate kinase protein 1, CARMA1)是淋巴细胞特异性的膜相关鸟苷酸激酶家族成员. 研究报道[3-10]CARMA1作为衔接蛋白, 与B细胞淋巴瘤10(B cell lymphoma 10, BCL10)及黏膜相关淋巴瘤易位基因1(mucosa-associated lymphoma translocation gene 1, MALT1)形成CARMA1/BCL10/MALT1复合物(CBM complex), 可活化NF-κB. 本研究就CARMA1表达与NF-κB蛋白的关系进行分析, 进一步研究MALT淋巴瘤和DLBCL的发生发展的机制.
收集贵阳医学院附属医院病理科1999-01/2011-03诊断的胃肠道B细胞非霍奇金淋巴瘤. 通过HE切片复习及肿瘤细胞免疫表型检查, 按照2008年WHO淋巴造血组织肿瘤分类[11]筛选出54例具有完整病理和临床资料的病例(包括34例DLBCL和20例MALT淋巴瘤), 其中Ⅰ期17例, Ⅱ期15例, Ⅲ期6例, Ⅳ期16例. 同时收集21例胃肠淋巴组织反应性增生病例做对照研究. 淋巴瘤的分期参照修改的Ann arbor分期. 多克隆一抗CARMA1购自美国BETHYL; NF-κB/p65、NF-κB/p50购自Santa Cruz; 免疫组织化学检测试剂盒购自中杉金桥公司; 二乙基焦磷酰胺(DEPC)、蛋白酶K购自Sigma公司; TRIzol、 dNTP、RNA酶抑制剂购自TIANGEN公司; AMV逆转录酶、SYBR Premix Ex Taq购自Takara; 三羟甲基氨基甲烷(Tris碱)、十二烷基硫酸钠(SDS)及乙二胺四乙酸二钠(EDTA)购自上海申博化工有限公司.
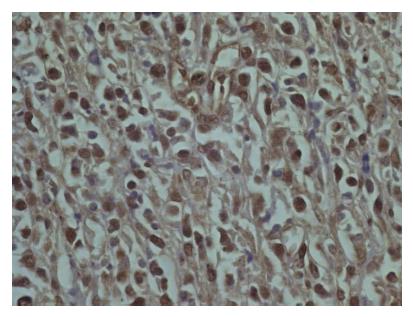
1.2.1 免疫组织化学染色: 采用SP三步法, 据抗体要求进行枸橼酸盐或高pH的EDTA缓冲液进行抗原热修复. 一抗包括: NF-κB/p65(1:100)、多克隆抗体CARMA1(1:400)、NF-κB/p50 (1:100). 以pH7.4的PBS代替一抗作空白对照, 并以胃肠淋巴组织反应性增生病例做CARMA1、NF-κB/p65及NF-κB/p65标记的实验对照. 结果判断: CARMA1、NF-κB/p65及NF-κB/p50阳性信号定位于细胞浆和/或细胞核. CARMA1蛋白每张切片观察10个400倍视野, 计数棕黄色细胞数占细胞总数的均值, 低于20%记为阴性, 20%-49%的肿瘤细胞阳性记为阳性, 50%及以上的肿瘤细胞阳性计为强阳性. NF-κB蛋白阳性信号定位于细胞核是其活化状态的标志, 因此以出现细胞核内表达统计分析NF-κB的表达情况.
1.2.2 CARMA1 mRNA的检测: (1)石蜡组织中RNA提取: 据参考文献[12]并改进, 实验用品均经DEPC水或180 ℃高温烘烤灭活RNA酶. 切5 μm厚石蜡切片, 据组织大小选取石蜡组织切片10-15片, 二甲苯脱蜡、无水乙醇清洗并干燥; 加入裂解缓冲液及蛋白酶K(终浓度为400-500 μg/mL), 震荡并在55 ℃过夜消化组织; 加入TRIzol, 室温孵育后加入氯仿分离RNA; 吸取水相在-20 ℃以异丙醇沉淀RNA, 乙醇洗涤后以0.1%DEPC消毒水溶解RNA, 测定浓度后-85 ℃冻存备用; (2)Real-time PCR检测: RT-PCR: 取总RNA 2 μg用AMV逆转录酶转录合成cDNA, 逆转录体系及条件按说明书进行. Real-time PCR扩增体系: 照SYBR Premix Ex Taq试剂盒进行. 根据CARMA1 mRNA基因序列设计引物, 引物序列如下: 上游引物为5'-CCATCACCAACTCCTTCAC-3'; 下游引物5'-TCCTCCTTGTAGCGTCTG-3', 产物长短112 bp. 以GAPDH为内对照, 引物序列如下: 上游引物为5'-TGAAGGTCGGAGTCAACGG-3', 下游引物为5'-CCTGGAAGATGGTGATGGGA-3', 产物长短225 bp. 扩增条件: 50 ℃ 2 min, 95 ℃ 10 min预变性, 95 ℃ 15 s变性, 60 ℃ 1 min, 循环40次. Stepone实时荧光定量PCR仪采集待测CARMA1基因及内参照GAPDH扩增荧光信号. 分析其△Ct、△△Ct值、相对定量(relative quantity, RQ)值, RQ值 = 2-△△Ct.
1.2.3 随访: 采用电话随访和信访, 以患者初次住院为随访开始时间, 以2011-11为随访结束时间.
统计学处理 采用SPSSl7.0统计软件进行分析. 等级资料采用秩和检验, 计量资料采用独立样本t检验, 生存分析采用Kaplan-Meier方法绘制生存曲线, 生存曲线的比较采用对数秩检验(Log-rank test), 影响生存的多种因子分析采用Cox回归分析, P<0.05为差异有统计学意义.
42例胃肠淋巴瘤全部检测出GAPDH mRNA表达, 提示提取的RNA可以满足检测CARMA1 mRNA的需要. CARMA1 mRNA与蛋白表达一致(2-△△Ct = 2.739, P = 0.046), 且在DLBCL中CARMA1 mRNA表达显著高于MALT淋巴瘤(P = 0.019), CARMA1蛋白表达(图1): 淋巴瘤组75.9%(强阳性12/54, 阳性29/54), 胃肠淋巴组织反应性增生组47.6%(强阳性3/21, 阳性7/21), 两组病例之间CARMA1蛋白表达具有统计学差异(P = 0.042); NF-κB/p65和NF-κB/p50蛋白胞核或核浆阳性率依次为: 淋巴瘤组48.2%(26/54)、38.9%(21/54), 胃肠淋巴组织反应性增生组14.3%(3/21)、9.5%(2/21). 两种蛋白表达在两组病例之间均有统计学差异(P值分别为0.007, 0.013, 表1).
| n | NF-κB/P65蛋白 | P值 | NF-κB/P50 | P值 | |||
| 阴性 | 阳性 | 阴性 | 阳性 | ||||
| CARMA1蛋白 | 54 | 0.030 | 0.031 | ||||
| 阴性 | 9 | 4 | 7 | 6 | |||
| 阳性 | 16 | 13 | 25 | 4 | |||
| 强阳性 | 3 | 9 | 1 | 11 | |||
| CARMA1 mRNA | 42 | 0.694 | 0.862 | ||||
| △Ct mean±SD | 3.574±1.850 | 3.09±1.724 | 3.519±1.956 | 3.206±1.620 | |||
| 2-△△Ct | 1 | 1.393 | 1 | 1.243 | |||
CARMA1和NF-κB表达对淋巴瘤临床病理特征的影响如表2所示.
| 参数 | CARMA1蛋白n = 54 | P值 | CARMA1mRNAn = 42 | P值 | NF-κB/P65n = 54 | P值 | NF-κB/P50n = 54 | P值 | |||||
| 阴性 | 阳性 | 强阳性 | △Ct(mean±SD) | 2-△△Ct | 核阴 | 核阳 | 核阴 | 核阳 | |||||
| 淋巴瘤类型 | 0.020 | 0.019 | 0.138 | 0.635 | |||||||||
| MALToma | 9 | 8 | 3 | 4.105±1.745 | 1 | 13 | 7 | 13 | 7 | ||||
| DLBCL | 4 | 21 | 9 | 2.485±1.333 | 3.073 | 15 | 19 | 20 | 14 | ||||
| 临床分期 | 0.341 | 0.011 | 0.015 | 0.050 | |||||||||
| I和Ⅱ | 7 | 21 | 4 | 4.400±1.650 | 1 | 21 | 11 | 23 | 9 | ||||
| Ⅲ和Ⅳ | 6 | 8 | 8 | 2.291±1.118 | 4.416 | 7 | 15 | 10 | 12 | ||||
| Ki-67 | 0.006 | 0.035 | 0.018 | 0.001 | |||||||||
| ≤40% | 9 | 8 | 2 | 4.096±1.766 | 1 | 14 | 5 | 16 | 3 | ||||
| >40% | 4 | 21 | 10 | 2.568±1.385 | 2.885 | 14 | 21 | 17 | 18 | ||||
| 淋巴结累及(n = 42) | 0.542 | 0.355 | 0.126 | 0.028 | |||||||||
| 无 | 3 | 7 | 4 | 3.049±1.763 | 1 | 9 | 5 | 11 | 3 | ||||
| 有 | 8 | 14 | 6 | 3.566±1.715 | 0.700 | 11 | 17 | 12 | 16 | ||||
| 浸润深度(n = 42) | 0.003 | 0.668 | 0.063 | 0.078 | |||||||||
| 管壁内 | 10 | 17 | 3 | 3.338±1.703 | 1 | 17 | 13 | 19 | 11 | ||||
| 管壁外 | 1 | 4 | 7 | 3.405±1.906 | 0.955 | 3 | 9 | 4 | 8 | ||||
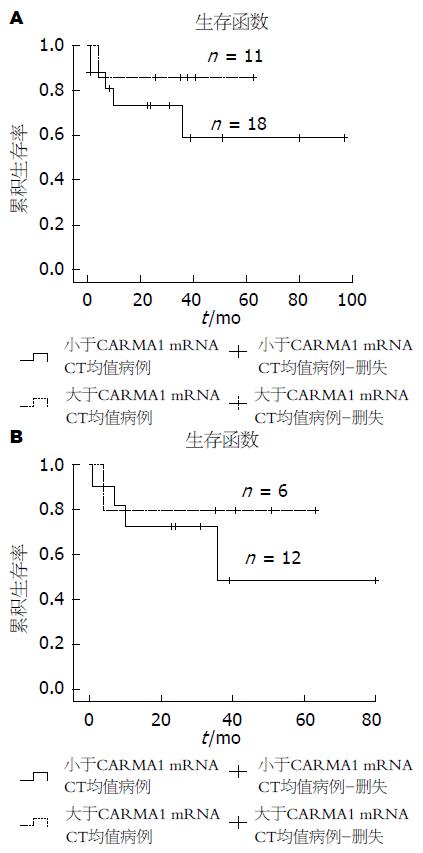
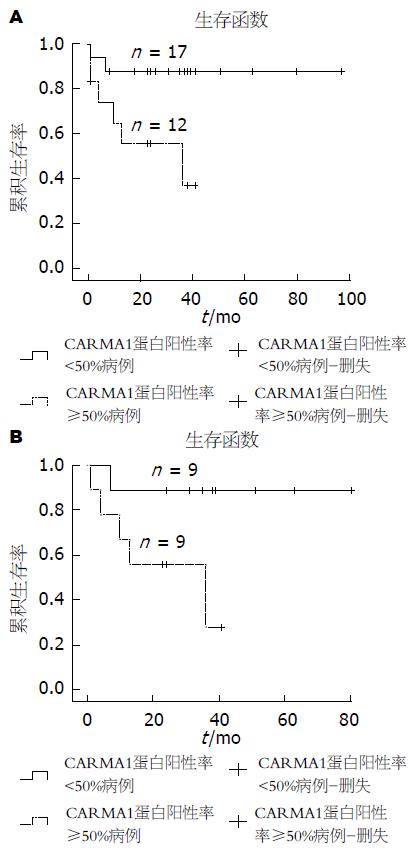
54例淋巴瘤病例中29例获得随访(包括11例MALT淋巴瘤和18例DLBCL), 获访率53.7%. 治疗方案上6例单纯手术切除, 2例用CHOP方案化疗, 17例手术后辅以其他治疗(12例行CHOP方案, 4例行R-CHOP方案, 1例行其他治疗), 2例用其他治疗方案, 2例放弃治疗. Cox多因素回归分析结果如表3所示, 根据淋巴瘤中CARMA1表达情况绘制生存率曲线如图2、3所示.
| 淋巴瘤类型 | 分期 | CARMA1 mRNA | CARMA1蛋白 | NF-κB/p65 | NF-κB/p50 | 淋巴结累及 | Ki-67 | |
| RR | 7.801 | 5.601 | 0.648 | 6.135 | 5.889 | 0.515 | 0.127 | 0.550 |
| P值 | 0.017 | 0.043 | 0.208 | 0.035 | 0.034 | 0.424 | 2.324 | 0.358 |
NF-κB是一类能与多种基因启动子或增强子的κB位点发生特异性结合并促进其转录的信号分子. 迄今已发现有5种NF-κB家族成员[13-15], 他们以同源二聚体或异源二聚体的蛋白质结构存在于大多数细胞中. 最常见的NF-κB二聚体由p65和p50组成. 在静息状态下, NF-κB二聚体与NF-κB的抑制蛋白(inhibitory κB, IκB)结合, 以无活性的三聚体形式存在于细胞浆中. 当机体面临生存危机时, 在各种因素的作用下, NF-κB进入核内开始转录, 从而调控多种细胞因子、黏附分子、转录因子等编码基因的转录, 不仅能促进细胞增殖, 他还可以上调抗凋亡基因BCL2及凋亡蛋白抑制因子家族成员survivin的表达, 使肿瘤细胞逃避凋亡, 成为肿瘤细胞生存的关键因素[16-20]. Davis等[21]发现, 活化的B细胞来源样DLBCL细胞株中存在NF-κB的异常持续活化, IκB激酶(IκB kinase, IκK)活性增强, IκB降解加速, 而在GCB样DLBCL中未能见到这种情况. 并有研究报道NF-κB蛋白在ABC型DLBCL、伴有EBV感染DLBCL病例高表达, 体外抑制NF-κB, 其靶基因BCL2、survivin表达下降而使细胞凋亡[22,23]. 2008年新的WHO分类也提到NF-κB在ABC样DLBCL中有异常活化, 而GCB亚型中未发现该异常[11].
CARMA1能有效地整合来自细胞膜的信号系统, 对于多种刺激引起的NF-κB活化有调节作用[24-26]. 有研究报道: CARMA1在B细胞受体和T细胞受体刺激下引发IκK复合物信号, 使NF-κB信号通路活化, 从而调控淋巴细胞的增生并维持淋巴细胞生存[27,28]. 当邻近抗原受体信号使CARMA1募集于细胞膜时, 导致其蛋白激酶C调节区域的磷酸化, 使其能够与BCL10和MALT1结合, 并自身寡聚化形成CARMA1/ BCL10/MALT1复合物(CBM complex), 降解IκB从而调节NF-κB的活化[29]. 对T细胞分化的研究表明, CARMA1位于BCL10的上游, 在T细胞受体介导的NF-κB活化过程中是必须的. CARMA1仅限于淋巴组织, 抑制CARMA1信号通路, 理论上产生效应仅限于淋巴系统, 因此对于ABC-DLBCL, CARMA1成为有吸引力的治疗靶标[30-32].
本研究通过Real-time PCR检测淋巴瘤组织中CARMA1 mRNA的表达水平, 用免疫组织化学染色检测CARMA1蛋白和NF-κB蛋白中的两个主要亚型NF-κB/p65、NF-κB/p50. 结果发现在淋巴瘤组和淋巴组织反应性增生组病例之间, CARMA1、NF-κB/p65、NF-κB/p50蛋白表达水平均有明显的差异, 淋巴瘤组均明显高于淋巴组织反应性增生组病例. NF-κB分子的定位与NF-κB在细胞内的状态有关, 即在细胞浆内的无活性状态和细胞核内的活化状态, 故我们将NF-κB的细胞核表达作为NF-κB活化状态的标志. 我们发现在淋巴瘤病例中虽然CARMA1 mRNA表达水平与NF-κB/p65、NF-κB/p50表达无明显相关, 但CARMA1蛋白表达却与这两种NF-κB亚型均有明显的正相关关系. 静息状态下, NF-κB主要定位于细胞浆, 活化后NF-κB从细胞浆迅速转运至细胞核, 并在短暂活化后被降解. MALT淋巴瘤和DLBCL中CARMA1的表达致使肿瘤细胞中NF-κB的异常持续活化, 加上其负调节因子A20的失活等因素, 引起NF-κB表达水平的增加. 这可能是CARMA1参与胃肠MALT淋巴瘤和DLBCL发生和演进的重要机制. 同时肿瘤中CARMA1基因可能存在转录后的表达调控. 与MALT淋巴瘤比较, DLBCL病例中CARMA1 mRNA和蛋白高表达, 差异具有统计学意义. 提示上述蛋白分子在淋巴瘤中的表达可能与其发生和发展过程有关. 然而, 两种淋巴瘤中NF-κB/p65、NF-κB/p50蛋白表达未见统计学差异, 这提示CARMA1可能还通过其他的机制参与了MALT淋巴瘤向DLBCL转化的过程, 有待于进一步的研究.
本组病例的临床病理资料和随访资料分析发现: CARMA1 mRNA和蛋白表达水平在DLBCL组和高增殖活性组明显升高, 与相应比较组之间有统计学差异. CARMA1 mRNA在晚分期(Ⅲ和Ⅳ期)病例中表达水平高于早分期(Ⅰ和Ⅱ期)病例, 在消化管壁内浸润病例中CARMA1蛋白表达低于浸润至管壁外的病例(均P<0.05). NF-κB/p65、NF-κB/p50蛋白在晚分期病例, 肿瘤细胞高增殖活性组病例中表达水平明显高于相应的比较组病例, 差异均有统计学意义. Cox回归分析发现: 淋巴瘤类型、临床分期、CARMA1蛋白及NF-κB/p65蛋白表达都是胃肠MALT淋巴瘤和DLBCL独立的预后影响因子, 4种因素的相对风险度接近. 生存曲线比较, CARMA1蛋白强阳性表达的所有淋巴瘤病例及DLBCL病例的生存状况明显较阴性和一般阳性表达(<50%)的相应病例差(P值分别为0.020和0.045). 分析结果表明CARMA1和NF-κB/p65、NF-κB/p50蛋白分子表达对胃肠MALT和DLBCL的临床病理特征和预后可能有一定影响.
总之, CARMA1表达可能参与了胃肠MALT淋巴瘤和DLBCL的发生和发展过程, 使NF-κB的异常持续活化可能是其作用的重要机制. CARMA1和NF-κB/p65、NF-κB/p50蛋白的表达与两种淋巴瘤的临床病理特征和预后有关, 可能是其预后估计的相关因子.
弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma, DLBCL)和黏膜相关淋巴组织结外边缘区B细胞淋巴瘤(extranodal marginal zone B cell lymphoma of mucosa-associated lymphoid tissue, MALT淋巴瘤)是常见的B细胞淋巴瘤类型. 惰性发展的MALT淋巴瘤有一部分可以转化为侵袭性的DLBCL. MALT淋巴瘤的发生和向大细胞淋巴瘤转化的过程及其机制目前还不太清楚, 有研究表明NF-κB信号通路的激活和MALT淋巴瘤的发生和发展机制密切相关.
陈云昭, 副教授, 新疆维吾尔自治区石河子市北四路, 新疆石河子大学医学院/一附院病理科
含caspase募集结构域的膜相关鸟苷酸激酶蛋白1(CARMA1)是淋巴细胞特异性的膜相关鸟苷酸激酶家族成员. 研究报道CARMA1蛋白阳性表达率在不伴有低恶性MALT淋巴瘤成分的DLBCL病例中表达较高, 推测CARMA1与淋巴瘤的发生和高恶性转化有关. CARMA1表达是否通过激活NF-κB通路参与MALT淋巴瘤和DLBCL的发生发展, 有待进一步研究.
NF-κB异常持续活化是DLBCL, 尤其是ABC型DLBCL的重要特征之一, 这一特点越来越受到广泛的关注. 有研究发现: DLBCL中存在CARMA1基因的突变和表达异常. 当邻近抗原受体信号使CARMA1募集于细胞膜, 并导致其蛋白激酶C调节区域的磷酸化, 使其能够与BCL10结合, 并自身寡聚化, 形成CARMA1/BCL10/MALT1复合物(CBM complex), 信号最终汇集于IκK复合物, 降解IκB从而调节NF-κB. CARMA1是淋巴细胞特异性的膜相关鸟苷酸激酶家族成员, 抑制CARMA1可能抑制肿瘤中NF-κB通路的异常活化. 因此对于ABC-DLBCL, CARMA1成为有吸引力的治疗靶标.
本研究发现胃肠道MALT淋巴瘤和DLBCL中CARMA1, NF-κB/p65和NF-κB/p50蛋白表达率显著高于淋巴组织反应性增生组病例. CARMA1 mRNA和蛋白表达与淋巴瘤类型、临床分期、浸润深度、肿瘤细胞增殖活性相关. NF-κB/p65、NF-κB/p50蛋白在晚分期病例、肿瘤细胞高增殖活性病例中表达水平明显高于相应的比较组病例. NF-κB蛋白表达与CARMA1 mRNA表达无明显相关, 但随着CARMA1蛋白表达增加而增强. 生存分析发现淋巴瘤类型、临床分期、CARMA1蛋白及NF-κB/p65蛋白表达都是淋巴瘤独立的预后影响因子. CARMA1蛋白强阳性表达的所有淋巴瘤和DLBCL病例的生存状况较阴性和一般阳性表达的相应病例差.
CARMA1表达可能参与了胃肠MALT淋巴瘤和DLBCL的发生和发展过程, 使NF-κB的异常持续活化可能是其作用的重要机制. CARMA1和NF-κB/p65、NF-κB/p50蛋白的表达与两种淋巴瘤的临床病理特征和预后有关, 可能是其预后估计的相关因子, 可能成为相关淋巴瘤治疗的新靶点.
本文整体方法得当, 结果可靠, 很好的达到了预期的研究目的.
编辑: 田滢 电编: 闫晋利
| 1. | Mathas S, Jöhrens K, Joos S, Lietz A, Hummel F, Janz M, Jundt F, Anagnostopoulos I, Bommert K, Lichter P. Elevated NF-kappaB p50 complex formation and Bcl-3 expression in classical Hodgkin, anaplastic large-cell, and other peripheral T-cell lymphomas. Blood. 2005;106:4287-4293. [PubMed] [DOI] |
| 2. | Lam LT, Davis RE, Pierce J, Hepperle M, Xu Y, Hottelet M, Nong Y, Wen D, Adams J, Dang L. Small molecule inhibitors of IkappaB kinase are selectively toxic for subgroups of diffuse large B-cell lymphoma defined by gene expression profiling. Clin Cancer Res. 2005;11:28-40. [PubMed] |
| 3. | Gaide O, Martinon F, Micheau O, Bonnet D, Thome M, Tschopp J. Carma1, a CARD-containing binding partner of Bcl10, induces Bcl10 phosphorylation and NF-kappaB activation. FEBS Lett. 2001;496:121-127. [PubMed] [DOI] |
| 4. | Thome M, Charton JE, Pelzer C, Hailfinger S. Antigen receptor signaling to NF-kappaB via CARMA1, BCL10, and MALT1. Cold Spring Harb Perspect Biol. 2010;2:a003004. [PubMed] [DOI] |
| 5. | Blonska M, Lin X. CARMA1-mediated NF-kappaB and JNK activation in lymphocytes. Immunol Rev. 2009;228:199-211. [PubMed] [DOI] |
| 6. | Egawa T, Albrecht B, Favier B, Sunshine MJ, Mirchandani K, O'Brien W, Thome M, Littman DR. Requirement for CARMA1 in antigen receptor-induced NF-kappa B activation and lymphocyte proliferation. Curr Biol. 2003;13:1252-1258. [PubMed] [DOI] |
| 7. | Lucas PC, McAllister-Lucas LM, Nunez G. NF-kappaB signaling in lymphocytes: a new cast of characters. J Cell Sci. 2004;117:31-39. [PubMed] [DOI] |
| 8. | Compagno M, Lim WK, Grunn A, Nandula SV, Brahmachary M, Shen Q, Bertoni F, Ponzoni M, Scandurra M, Califano A. Mutations of multiple genes cause deregulation of NF-kappaB in diffuse large B-cell lymphoma. Nature. 2009;459:717-721. [PubMed] [DOI] |
| 9. | Lamason RL, McCully RR, Lew SM, Pomerantz JL. Oncogenic CARD11 mutations induce hyperactive signaling by disrupting autoinhibition by the PKC-responsive inhibitory domain. Biochemistry. 2010;49:8240-8250. [PubMed] [DOI] |
| 10. | Bu R, Bavi P, Abubaker J, Jehan Z, Al-Haqawi W, Ajarim D, Al-Dayel F, Uddin S, Al-Kuraya KS. Role of nuclear factor-κB regulators TNFAIP3 and CARD11 in Middle Eastern diffuse large B-cell lymphoma. Leuk Lymphoma. 2012;53:1971-1977. [PubMed] [DOI] |
| 11. | Swerdlow SH, Campo E, Harris NL, Jaffe ES, Pileri S, Hea S. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4th Edition. Lyon: IARC Press; 2008; 214-217. |
| 13. | Hayden MS, Ghosh S. Shared principles in NF-kappaB signaling. Cell. 2008;132:344-362. [PubMed] [DOI] |
| 14. | Ghosh S, May MJ, Kopp EB. NF-kappa B and Rel proteins: evolutionarily conserved mediators of immune responses. Annu Rev Immunol. 1998;16:225-260. [PubMed] [DOI] |
| 15. | Ruland J, Mak TW. Transducing signals from antigen receptors to nuclear factor kappaB. Immunol Rev. 2003;193:93-100. [PubMed] [DOI] |
| 16. | Karin M, Cao Y, Greten FR, Li ZW. NF-kappaB in cancer: from innocent bystander to major culprit. Nat Rev Cancer. 2002;2:301-310. [PubMed] [DOI] |
| 17. | Karin M. Nuclear factor-kappaB in cancer development and progression. Nature. 2006;441:431-436. [PubMed] [DOI] |
| 18. | Inoue J, Gohda J, Akiyama T, Semba K. NF-kappaB activation in development and progression of cancer. Cancer Sci. 2007;98:268-274. [PubMed] [DOI] |
| 19. | Rayet B, Gélinas C. Aberrant rel/nfkb genes and activity in human cancer. Oncogene. 1999;18:6938-6947. [PubMed] |
| 20. | Chiao PJ, Na R, Niu J, Sclabas GM, Dong Q, Curley SA. Role of Rel/NF-kappaB transcription factors in apoptosis of human hepatocellular carcinoma cells. Cancer. 2002;95:1696-1705. [PubMed] [DOI] |
| 21. | Davis RE, Brown KD, Siebenlist U, Staudt LM. Constitutive nuclear factor kappaB activity is required for survival of activated B cell-like diffuse large B cell lymphoma cells. J Exp Med. 2001;194:1861-1874. [PubMed] [DOI] |
| 22. | Bavi P, Uddin S, Bu R, Ahmed M, Abubaker J, Balde V, Qadri Z, Ajarim D, Al-Dayel F, Hussain AR. The biological and clinical impact of inhibition of NF-κB-initiated apoptosis in diffuse large B cell lymphoma (DLBCL). J Pathol. 2011;224:355-366. [PubMed] [DOI] |
| 24. | Ruefli-Brasse AA, French DM, Dixit VM. Regulation of NF-kappaB-dependent lymphocyte activation and development by paracaspase. Science. 2003;302:1581-1584. [PubMed] [DOI] |
| 25. | Wang D, You Y, Case SM, McAllister-Lucas LM, Wang L, DiStefano PS, Nuñez G, Bertin J, Lin X. A requirement for CARMA1 in TCR-induced NF-kappa B activation. Nat Immunol. 2002;3:830-835. [PubMed] [DOI] |
| 26. | Gaide O, Favier B, Legler DF, Bonnet D, Brissoni B, Valitutti S, Bron C, Tschopp J, Thome M. CARMA1 is a critical lipid raft-associated regulator of TCR-induced NF-kappa B activation. Nat Immunol. 2002;3:836-843. [PubMed] [DOI] |
| 27. | Schmitz ML, Bacher S, Dienz O. NF-kappaB activation pathways induced by T cell costimulation. FASEB J. 2003;17:2187-2193. [PubMed] [DOI] |
| 28. | Streubel B, Lamprecht A, Dierlamm J, Cerroni L, Stolte M, Ott G, Raderer M, Chott A. T(14; 18)(q32; q21) involving IGH and MALT1 is a frequent chromosomal aberration in MALT lymphoma. Blood. 2003;101:2335-2339. [PubMed] [DOI] |
| 29. | Du MQ. MALT lymphoma: many roads lead to nuclear factor-κb activation. Histopathology. 2011;58:26-38. [PubMed] [DOI] |
| 30. | Lenz G, Davis RE, Ngo VN, Lam L, George TC, Wright GW, Dave SS, Zhao H, Xu W, Rosenwald A. Oncogenic CARD11 mutations in human diffuse large B cell lymphoma. Science. 2008;319:1676-1679. [PubMed] [DOI] |
| 31. | McCully RR, Pomerantz JL. The protein kinase C-responsive inhibitory domain of CARD11 functions in NF-kappaB activation to regulate the association of multiple signaling cofactors that differentially depend on Bcl10 and MALT1 for association. Mol Cell Biol. 2008;28:5668-5686. [PubMed] [DOI] |
| 32. | Thome M. CARMA1, BCL-10 and MALT1 in lymphocyte development and activation. Nat Rev Immunol. 2004;4:348-359. [PubMed] [DOI] |