修回日期: 2013-06-06
接受日期: 2013-07-03
在线出版日期: 2013-08-08
目的: 探讨胆囊区肝癌射频治疗联合腹腔镜胆囊切除(laparoscopic cholecystectomy, LC)手术安全性及有效性.
方法: 选取我院2006-01/2011-05, 12例胆囊区的肝癌和27例非胆囊区的肝癌, 前者行腹腔镜胆囊切除后再行B超引导或直视下射频消融治疗, 后者行B超引导射频消融治疗, 进行回顾性分析两组患者术前术后的临床资料, 住院时间、并发症发生率和总体生存率情况.
结果: 通过统计分析患者手术前后的肝功能结果发现, 两组患者术前、术后肝功能变化差异无统计学意义(均P>0.05), 两组患者在住院时间及术后并发症的发生率上差异无统计学意义(均P>0.05), 在手术时间上差异有统计学意义(P<0.01), 射频后肿瘤的坏死率, 胆囊旁组91.7%(11/12), 非胆囊旁组86.4%(19/22), 随访5年, 排除删失数据对结果的影响后发现两组5年生存率差异无统计学意义(P>0.05).
结论: 对于胆囊区的肝癌, 肝癌射频治疗术联合腹腔镜下胆囊切除, 有效避免了因射频消融引起的迟发型胆囊坏死穿孔, 手术安全, 长期随访疗效可靠.
核心提示: 腹腔镜下操作, 可发现术前影像学未发现肿物, 避免损伤空腔脏器, 全麻下治疗, 患者痛苦减少, 治疗彻底; 腹腔镜胆囊切除术应用广泛, 射频消融治疗肝癌, 风险小, 操作方便, 两者有机结合, 手术安全, 疗效可靠, 该技术可推广至基层医院开展.
引文著录: 赵希学, 由法平, 袁庆忠, 潘国政, 卜庆敖, 郝龙, 张建. 胆囊区肝癌射频治疗联合LC手术安全性评估. 世界华人消化杂志 2013; 21(22): 2212-2216
Revised: June 6, 2013
Accepted: July 3, 2013
Published online: August 8, 2013
AIM: To assess the safety and effectiveness of radiofrequency in combination with laparoscopic cholecystectomy (LC) in the management of liver cancer near the gallbladder.
METHODS: Twelve patients with liver cancer near the gallbladder and 27 patients with liver cancer far from the gallbladder, who were treated at our hospital from January 2006 to May 2011, were included in this retrospective study. Patients with liver cancer near the gallbladder underwent laparoscopic resection of gallbladder before ultrasound-guided radiofrequency ablation (combination group), while patients with liver cancer far from the gallbladder underwent ultrasound-guided radiofrequency ablation directly (control group). Preoperative clinical data, postoperative hospital stay, complication rate and overall survival were compared between the two groups.
RESULTS: The changes in liver function parameters between before and after surgery had no significant difference between the two groups of patients (all P > 0.05). There were also no statistically significant differences in hospitalization time and incidence of postoperative complications between the two groups (both P > 0.05). The difference in operative time was statistically significant between the two groups (P < 0.01). The tumor necrosis rate after radiofrequency was 91.7% (11/12) in the combination group and 86.4% (19/22) in the latter group. The 5-year survival rate was similar between the two groups (P > 0.05).
CONCLUSION: Radiofrequency combined with laparoscopic gallbladder excision is a safe and effective treatment for liver cancer near the gallbladder.
- Citation: Zhao XX, You FP, Yuan QZ, Pan GZ, Bu QA, Hao L, Zhang J. Safety and effectiveness of radiofrequency combined with laparoscopic cholecystectomy in management of liver cancer near the gallbladder. Shijie Huaren Xiaohua Zazhi 2013; 21(22): 2212-2216
- URL: https://www.wjgnet.com/1009-3079/full/v21/i22/2212.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i22.2212
原发性肝癌是世界上第5大常见恶性肿瘤, 其死亡率居世界第3位[1], 随着人寿命的延长肝癌的发病率也呈逐年上升的趋势[2]. 手术切除一直是肝细胞肝癌的首选治疗手段[3,4], 在我国肝癌患者多为高龄, 常伴有高血压、心脏病等慢性疾病, 耐受手术能力差. 因此, 微创治疗显得尤为重要, 由于射频消融热效率高, 升温快, 凝固坏死彻底, 受血流影响较小, 且对于小肝癌, 射频消融与手术切除可取得相同的治疗效果[5-7], 逐渐成为肝癌的另一种重要治疗手段. 但对于毗邻胆囊、肝门部、大血管等特殊部位的肝癌, 其安全性及有效性一直存在争议[8,9]. 近年来, 对于毗邻胆囊的肝癌报道逐渐增多[10,11], 但其治疗方法不一, 疗效及安全性无统一定论, 手术技巧要求高, 临床上开展存在一定难度. 本课题通过回顾性分析比较胆囊区和非胆囊区的肝癌患者的临床资料、住院时间、并发症发生率和总体生存率情况, 来评估肝癌射频治疗联合腹腔镜胆囊切除(laparoscopic cholecystectomy, LC)手术安全性及有效性.
采用回顾性分析研究, 选取我院肝胆外科2006-01/2011-06收治的200余例肝癌患者中选取12例毗邻胆囊区, 27例非胆囊区的肝癌. 术前诊断标准依据欧洲肝脏研究协会(EASL)指南. 病例纳入标准: (1)患者术前未接受其他抗癌治疗; (2)直径≤5 cm的单发肿瘤或最大直径≤3 cm的3个以内的多发肿瘤; (3)无癌栓; (4)肝功能Child-Pugh A或B级的患者, 或为C级, 但经积极保肝治疗后转为B或A级; (5)无严重心、脑、肾等严重器官功能障碍; (6)不愿意接受手术治疗的, 自愿接受微创治疗的患者. 射频治疗仪为美国Tyco Healthcare公司生产, 型号为CTRF-220, 治疗系统的输出功率为1-220 W±15%, 其射频频率为: 480 kHZ±3%, 温度检测范围为10 ℃-99 ℃, 系统的阻抗检测范围为: 10-1000 ohms, 专用电极包括单束射频电极和集束射频电极, 电极内部冷循环水流动, 有效地减少了临近组织的损伤, 该系统单次治疗的直径>5 cm, 消融时间为12 min.
1.2.1 手术: (1)腹腔镜联合B超引导下肝脏肿瘤射频消融组(A组): 仰卧位, 力月西+罗库溴胺+丙泊酚+舒芬太尼诱导麻醉, 气管插管全麻后丙泊酚+瑞芬太尼+罗库溴胺维持麻醉(具体药物计量根据患者身高体重调整), 全麻成功后建立CO2气腹, 腔镜下探查肝脏及腹腔情况, 三孔法行腹腔镜胆囊切除术, 若肿瘤位于胆囊床表面则直视下行射频消融治疗, 若切除胆囊后不能显示肿瘤, 则去除气腹, B超引导选取肿瘤最大切面, 决定进针路线, 射频针植入肿瘤内部, 功率设定在100 W, 治疗时间为12 min, 超声下见目标区域被高回声覆盖, 治疗结束, 复温60 s至90 ℃, 拔除射频针, 记录手术时间; (2)B超引导下射频消融组(B组): 仰卧位, 力月西+罗库溴胺+丙泊酚+舒芬太尼诱导麻醉, 气管插管全麻后丙泊酚+瑞芬太尼+罗库溴胺维持麻醉(具体药物计量根据患者身高体质量调整). 麻醉成功后, B超定位, 选取肿瘤最大切面, 决定进针路线, 射频仪功率设定在100 W, 治疗时间为12 min, 超声下见目标区域被高回声覆盖后治疗结束, 复温60 s至90 ℃, 拔除射频针, 记录手术时间.
A、B两组患者术后统一去麻醉恢复室复苏清醒后回病房, 整个治疗期间患者无痛苦, 心电监护心率血压均较平稳.
1.2.2 观察项目及疗效评价: 术前及术后24 h白蛋白、谷丙转氨酶(glutamic-pyruvic transaminase, ALT)、谷草转氨酶(glutamic-oxalacetic transaminase, AST)、总胆红素变化; 术后住院时间; 术后并发症情况, 术后1 mo复查肝脏增强CT, 动脉期无增强表示肿瘤毁损完全, 无复发; 以后第1年每3 mo复查一次, 以后每半年复查1次, 内容包括肝功能、甲胎蛋白(alpha-fetoprotein, AFP)、肝脏增强CT, 如复发记录继续治疗情况. 记录患者1、2、3、5年总体生存率情况.
统计学处理 计量资料采用mean±SD表示, 组间计量资料采用t检验 (one-way ANOVA, LSD method), 用Kaplan-Meier曲线评估事件的累计发生率, Log-rank test比较总体生存率. 应用SPSS18.0软件统计分析, 以P<0.05为具有统计学意义.
A、B两组患者临床病例资料如表1, 两组患者在性别、年龄上差别无统计学差异, 在手术前后胆红素、白蛋白、ALT、AST的变化差异上差别无统计学差异.
| 胆囊旁组(A组) | 非胆囊旁组(B组) | P值 | |
| 性别(男/女) | 9/3 | 15/7 | 0.688 |
| 年龄(岁) | 64.4(58-77) | 62.9(42-79) | 0.566 |
| HBsAg(+) | 7 | 11 | - |
| HCVAb(+) | 2 | 3 | - |
| △总胆红素(μmol/L) | 13.17±8.93 | 9.90±10.06 | 0.354 |
| △白蛋白(g/L) | 5.68±5.09 | 5.25±3.25 | 0.322 |
| △ALT(U/L) | 162.25±86.95 | 160.41±94.19 | 0.956 |
| △AST(U/L) | 157.58±103.97 | 205.23±149.12 | 0.334 |
| 肿瘤数目 | |||
| 单发 | 9 | 17 | - |
| 多发 | 3 | 5 | - |
| 肿瘤大小(cm) | |||
| <2 | 1 | 4 | - |
| 2-5 | 14 | 23 | - |
| AFP(μg/L) | |||
| <20 | 6 | 7 | - |
| >20 | 6 | 15 | - |
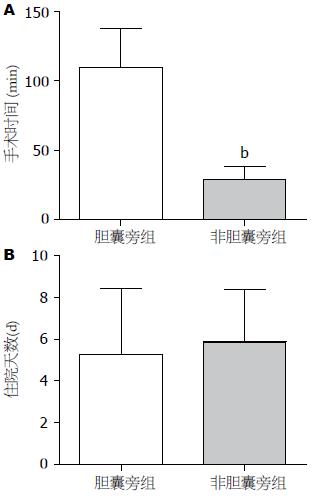
A、B两组在手术时间分别为137.50 min±20.17 min和81.95 min±38.14 min, 差别有统计学意义(P<0.01)(图1A), 考虑与手术切除胆囊所增加的时间有关; A、B两组患者住院天数分别为8.42 d±2.11 d和8.36 d±3.39 d, 差异无明显统计学意义(P = 0.961)(图1B).
在并发症发生例数上差异无统计学意义(P = 0.675). 其中A组患者中有4例患者出现发热, 3例患者出现腹痛, 1例出现大量腹水, 均对症处理后好转, 1例患者术后20 d胆道感染, 经保守治疗后好转出院, 所有患者均无严重并发症出现; B组患者中有6例患者出现发热, 2例出现大量腹水伴发热, 1例出现腹痛伴发热, 1例患者术后7 d为预防复发行介入治疗, 1例患者出院3 d后因上消化道大出血再次入院, 经保守治疗后好转出院.
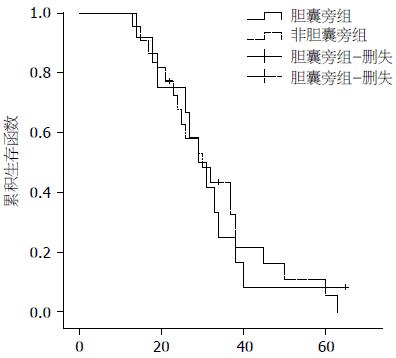
术后1 mo行增强CT扫描检查, 肿瘤坏死率为: A组91.7%(11/12), B组86.4%(19/22), 两组患者治疗坏死率相差较大. 1 mo后复查AFP, A组中术前阳性者6例, 有5例降至正常, 1例明显下降, B组中术前阳性者15例, 有13例降至正常, 2例明显下降. 复发的患者有1例行介入治疗, 3例再次行射频治疗. 随访5年, 其中A组中位生存时间为29.00 mo±3.46 mo, B组中位生存时间为30.00 mo±4.51 mo, 两组患者在5年内总体生存率上差异无统计学意义(P>0.05, 图2).
射频消融治疗肝癌, 热效率高, 容易控制, 可直接作用于肿瘤, 安全、微创、可反复使用, 现在已成为一种微创的肝脏肿瘤的主要治疗方法, 近十几年来在国内外发展迅速. 有报道[12-15], 可行腹腔镜辅助射频消融, 对于临近胆囊的肝癌可直视下控制进针方向和角度, 进行射频治疗; 陈敏华报告通过在胆囊床注水后, 再行射频治疗; 也可先行腹腔镜切除胆囊后再行肝癌射频消融, 治疗效果相差不大. 由于我国大部分肝癌患者均合并乙型肝炎肝硬化, 肝脏储备功能较差, 部分患者虽然术前评估为Child-Pugh A或B级, 但手术创伤可能对肝脏造成巨大的打击, 射频消融作为一种微创肝癌治疗方法, 创伤小, 对患者肝功能几乎无影响, 在临床上已应用十几年, 事实证明其安全可靠, 但对于腹腔镜切除胆囊后再行肝癌射频治疗, 其手术安全性尚未见系统报道, 本研究就腹腔镜胆囊切除联合肝癌射频治疗的安全性进行进一步阐述.
本研究将入选病例分为胆囊区组和非胆囊区组, 通过统计分析患者手术前后的肝功能结果发现, 两组患者术前、术后肝功能变化差异无统计学意义(均P>0.05), 两组患者在住院时间上及术后并发症的发生率上差异无统计学意义(均P>0.05), 在手术时间上差异有统计学意义(P<0.01), 考虑为腹腔镜切除胆囊增加的手术时间, 但增加手术的时间对患者肝功能、住院时间及术后并发生的发生率无影响. 射频后肿瘤的坏死率, 胆囊旁组91.7%(11/12), 非胆囊旁组86.4%(19/22), 两组患者治疗坏死率相差较大其原因可能为: (1)腹腔镜切除胆囊后, 消除射频对胆囊损伤的顾虑, 直视下销毁癌灶, 治疗更彻底, 效果更可靠; (2)可能与胆囊旁组患者样本较少有关, 若增加样本统计量两组患者差异可能会减小. 随访5年, 排除删失数据对结果的影响后发现两组5年生存率差异无统计学意义(P>0.05).
对于毗邻胆囊的肝脏恶性肿瘤, 我们治疗体会是: (1)直视下, 视野更加清晰, 可发现术前影像学检查无法发现的肿物; 同时避免损伤其他空腔脏器如结肠、胃、十二指肠; (2)全麻下治疗, 减轻了患者手术的痛苦, 治疗更加彻底; (3)腹腔镜下胆囊切除术已在基层医院开展, 射频消融治疗肝癌, 风险小, 操作方便, 两者有机结合, 可将该技术的使用范围扩展到基层医院.
总之, 对于胆囊区的肝癌, 肝癌射频治疗术联合腹腔镜下胆囊切除, 手术安全, 疗效可靠, 在基层医院实施无技术难度, 为该特殊部位的肝癌提供了一种安全、有效、实用的治疗方法. 但对于年龄大、体质差、不能耐受手术毗邻大血管、肝门区的等特殊部位的肝癌, 如何有效的进行射频治疗是我们进一步探索的方向.
手术切除一直是肝细胞肝癌的首选治疗手段, 在我国肝癌患者多为高龄, 常伴有高血压、心脏病等慢性疾病, 耐受手术能力差, 微创治疗显得尤为重要, 由于射频消融热效率高, 升温快, 凝固坏死彻底, 受血流影响较小, 且对于小肝癌, 射频消融与手术切除可取得相同的治疗效果, 逐渐成为肝癌的另一种重要治疗手段, 但对于毗邻胆囊、肝门部、大血管等特殊部位的肝癌, 其安全性及有效性一直存在较大争议.
郑鹏远, 教授, 主任医师, 郑州大学第二附属医院消化科
对于毗邻胆囊的肝癌治疗方法不一, 疗效及安全性无统一定论, 手术技巧要求高, 临床上开展存在一定难度.
刘建勇等, 超声导引下经皮微波消融治疗邻近危险区域肝癌临床观察; 田虎等, 腹腔镜辅助射频消融术治疗特殊部位肝癌的研究; 方和平等, 腹腔镜下胆囊旁肝癌的微波消融治疗; Chopra等, 对于毗邻胆囊的肝癌射频治疗的安全性及可行性研究; 霍苓等, 胆囊旁肝肿瘤射频消融治疗附加方法及疗效.
对于胆囊区的肝癌, 肝癌射频治疗术联合腹腔镜下胆囊切除, 手术安全, 疗效可靠.
肝癌射频治疗术联合腹腔镜下胆囊切除在基层医院实施无技术难度, 为该特殊部位的肝癌提供了一种安全、有效、实用的治疗方法.
本文立足临床, 有一定的临床应用价值.
| 1. | Llovet JM, Burroughs A, Bruix J. Hepatocellular carcinoma. Lancet. 2003;362:1907-1917. [PubMed] [DOI] |
| 2. | McKenna RJ. Clinical aspects of cancer in the elderly. Treatment decisions, treatment choices, and follow-up. Cancer. 1994;74:2107-2117. [PubMed] [DOI] |
| 4. | Müller C. Hepatocellular carcinoma--rising incidence, changing therapeutic strategies. Wien Med Wochenschr. 2006;156:404-409. [PubMed] [DOI] |
| 5. | Kobayashi M, Ikeda K, Kawamura Y, Hosaka T, Sezaki H, Yatsuji H, Akuta N, Suzuki F, Suzuki Y, Arase Y. Randomized controlled trial for the efficacy of hepatic arterial occlusion during radiofrequency ablation for small hepatocellular carcinoma--direct ablative effects and a long-term outcome. Liver Int. 2007;27:353-359. [PubMed] [DOI] |
| 6. | Ohmoto K, Yoshioka N, Tomiyama Y, Shibata N, Kawase T, Yoshida K, Kuboki M, Yamamoto S. Thermal ablation therapy for hepatocellular carcinoma: comparison between radiofrequency ablation and percutaneous microwave coagulation therapy. Hepatogastroenterology. 2006;53:651-654. [PubMed] |
| 7. | Lencioni R, Crocetti L. Radiofrequency ablation of liver cancer. Tech Vasc Interv Radiol. 2007;10:38-46. [PubMed] [DOI] |
| 8. | Ohmoto K, Yoshioka N, Tomiyama Y, Shibata N, Kawase T, Yoshida K, Kuboki M, Yamamoto S. Radiofrequency ablation versus percutaneous microwave coagulation therapy for small hepatocellular carcinomas: a retrospective comparative study. Hepatogastroenterology. 2007;54:985-989. [PubMed] |
| 9. | Wang ZL, Liang P, Dong BW, Yu XL, Yu de J. Prognostic factors and recurrence of small hepatocellular carcinoma after hepatic resection or microwave ablation: a retrospective study. J Gastrointest Surg. 2008;12:327-337. [PubMed] [DOI] |
| 14. | Chopra S, Dodd GD, Chanin MP, Chintapalli KN. Radiofrequency ablation of hepatic tumors adjacent to the gallbladder: feasibility and safety. AJR Am J Roentgenol. 2003;180:697-701. [PubMed] [DOI] |