修回日期: 2013-05-28
接受日期: 2013-06-05
在线出版日期: 2013-07-28
目的: 探讨胰腺癌放疗导致胃、十二指肠黏 膜放射性损伤及其影响因素.
方法: 收集我院胰腺癌放疗后行胃镜检查的31例患者, 临床症状根据RTOG/EORTC进行分期, 胃镜观察采用内镜分级分为Ⅰ级-Ⅳ级, 所有病例均行内镜下组织病理学活检. 对胰腺癌放疗导致的胃、十二指肠黏膜放射性损伤的影响因素进行统计学分析.
结果: 临床症状观察主要以腹胀、恶心、呕吐、腹痛、出血等急性期胃肠道反应为主. 胃镜观察: Ⅰ级胃、十二指肠黏膜正常4例; Ⅱ级轻度胃、十二指肠黏膜炎6例; Ⅲ级糜烂性胃炎3例; Ⅳ级病变包括: 单纯胃溃疡6例, 胃溃疡伴胃窦变形1例; 单纯十二指肠溃疡5例, 吻合口溃疡1例, 十二指肠溃疡合并狭窄4例. 所有病例均经胃镜下组织病理学活检, 符合炎症或溃疡性改变. γ-刀、3-D、TOMO 3种不同放疗技术对比结果显示: γ-刀对比3-D总病变率(80.0% vs 80.0%, P>0.0167); γ-刀对比TOMO总病变率(80.0% vs 72.7%, P>0.0167); 3-D对比TOMO总病变率(80.0% vs 72.7%, P>0.0167). γ-刀不同放疗剂量对比, 总病变率为(90% vs 100% vs 100%), 3组结果分别比较P<0.0167. 放疗前手术组16例, 非手术组15例, 总病变率(87.5% vs 66.7%, P>0.05). 同步GEM化疗9例, 非同步化疗22例, 总病变率(66.7% vs 91.9%, P>0.05). 预防应用胃肠黏膜保护药物16例, 未预防应用胃肠黏膜保护药物15例, 总病变率为(68.7% vs 100%, P<0.05). 放疗期间使用氨磷汀14例, 未使用氨磷汀17例, 总病变率为(85.7% vs 82.4%, P>0.05). 有慢性合并症患者14例, 无慢性合并症患者17例, 总病变率为(78.6% vs 76.5%, P>0.05).
结论: 本研究胃镜观察结果显示胰腺癌放疗后胃、十二指肠黏膜放射性损伤发生率高, 病变以胃黏膜糜烂、溃疡, 十二指肠黏膜溃疡、狭窄等中重度病变为主. 对影响放射性胃、十二指肠黏膜损伤因素分析显示: 随着放疗剂量的增加, 胃、十二指肠黏膜损伤加重; 预防使用胃肠黏膜保护药物可以减少放射性胃、十二指肠黏膜损伤的病变率, 差异有统计学意义; 但不同放疗技术、是否应用氨磷汀、是否有腹部手术史、是否有慢性合并症对放射性胃、十二指肠黏膜放射性损伤病变率比较无统计学差异.
核心提示: 以胃镜客观评估放疗引起的胃、十二指肠黏膜损伤, 分析影响放射性损伤的影响因素, 以进一步指导治疗, 减少放射性损伤的发生.
引文著录: 薛安静, 周平, 王济东, 夏廷毅. 胰腺癌放疗对胃、十二指肠黏膜损伤的胃镜观察31例. 世界华人消化杂志 2013; 21(21): 2023-2030
Revised: May 28, 2013
Accepted: June 5, 2013
Published online: July 28, 2013
AIM: To observe gastric or duodenal mucosal injury induced by radiotherapy in patients with pancreatic carcinoma and to analyze possible influencing factors.
METHODS: Thirty-one patients with pancreatic carcinoma who underwent gastroscopy after radiotherapy were included. Their clinical symptoms were graded according to RTOG/EORTC. Gastroscopic findings were graded as I-IV. All patients underwent endoscopic biopsy for histopathological examination. Factors influencing radiotherapy-induced gastric or duodenal mucosal injury were analyzed.
RESULTS: Main clinical symptoms included abdominal distension, anorexia, acid reflux, nausea, vomiting, and abdominal pain. Endoscopic analysis indicated that 4 cases were classified as grade Ⅰ (no gastric or duodenal mucosa injury), 6 cases as grade Ⅱ (mild gastric or duodenal mucositis), 3 cases as grade Ⅲ (erosive gastritis), and 17 cases as grade Ⅳ ( including 6 with gastric ulcer, 1 with gastric ulcer and gastric antral deformation, 5 with duodenal ulcer, 1 with anastomotic ulcer, and 4 with duodenal ulcer and narrowing). Endoscopic biopsy and histopathological analysis proved that all cases had inflammatory or ulcerative changes. The rates of detection of gastric or duodenal mucosa injury by γ-ray, 3-D, TOMO or gastroscopy were: γ-ray therapy vs 3-D (80.0% vs 80.0%, P > 0.0167), γ-ray therapy vs TOMO (80.0% vs 72.7%, P > 0.0167), and 3-D vs TOMO (80.0% vs 72.7%, P > 0.0167). When γ-ray radiotheraphy dose was 51 Gy (10 cases), 48 Gy (3 cases) and 45 Gy (2 cases), the rates of gastric or duodenal mucosal injury were 90%, 100% and 100%, respectively. The rate of gastric or duodenal mucosal injury did not differ significantly between patients who underwent surgery (n = 16) and those who did not undergo (n = 15) (87.5% vs 66.7%, P > 0.05), between patients receiving concurrent chemoradiotherapy (n = 9) and those not receiving (n = 22) (66.7% vs 91.9%, P > 0.05), between those receiving amifostine during radiotherapy (n = 10) and not receiving (n = 15) (85.7% vs 82.4%, P > 0.05), or between patients having co-morbidities (e.g., diabetes mellitus, hypertension, or inflammatory bowel disease) (n = 14) and those not having (n = 17) (78.6% vs 76.5%, P > 0.05). In contrast, the rate of gastric or duodenal mucosal injury differed significantly between patients given gastrointestinal mucosal protective agents during radiotherapy (n = 16) and those not given (n = 15) (68.7% vs 100%, P < 0.05).
CONCLUSION: Gastroscopy is a preferred modality for the detection of gastric or duodenal injury induced by radiotherapy in patients with pancreatic carcinoma. High radiation dose is associated with a higher incidence of gastric or duodenal mucosal injury. The use of gastric or duodenal mucosal protective agents is a favorable factor for radiotherapy-induced gastric or duodenal mucosal injury. Radiotherapy techniques, amifostine, abdominal surgery or chronic complications have no significant impact on gastric or duodenum injury induced by radiation.
- Citation: Xue AJ, Zhou P, Wang JD, Xia TY. Gastric or duodenal injury induced by radiotherapy for pancreatic carcinoma: An analysis of 31 cases. Shijie Huaren Xiaohua Zazhi 2013; 21(21): 2023-2030
- URL: https://www.wjgnet.com/1009-3079/full/v21/i21/2023.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i21.2023
胰腺癌是一种恶性程度很高的消化系肿瘤, 近年来发病率及病死率也呈逐年上升趋势[1-3], 但由于其位置隐匿, 缺乏早期的临床表现, 发现时80%以上已失去手术切除机会, 而对于可切除胰腺癌术后复发率也高达50%-86%[4]. 对于已失去手术切除机会及术后局部复发的中晚期胰腺癌, 放化疗无疑是重要的治疗手段. 尤其是近年来立体定向放疗(γ-stereotactic radiotherapy, γ-SBRT)、三维适形放射治疗(three dimensional conformal radiation therapy, 3D-CRT)、自适应放疗(adaptive radiation therapy, ART)如螺旋断层放射治疗等放射治疗技术在我国的发展应用, 使得放疗成为中晚期胰腺癌治疗的主要手段之一[4]. 由于胰腺癌本身的生物学行为对放疗不敏感, 达到根治肿瘤剂量要求>45 Gy, 但邻近胰腺的胃、十二指肠接受>40 Gy的照射剂量就会出现不同程度的胃肠道反应. 由于既往胰腺癌放疗应用局限, 由其引起的胃、十二指肠黏膜放射性损伤的研究报道较少. 再者由于缺乏客观的观察指标, 对于胰腺癌放疗后出现的放射性胃、十二指肠黏膜病变普遍关注不足, 常误认为胰腺癌相关症状, 直至出现出血、梗阻、穿孔等严重的胃肠道症状才就诊并行胃镜检查. 胃镜在诊断和治疗胰腺癌放疗导致的胃、十二指肠黏膜损伤中具有重要的价值, 现就对我院胰腺癌放疗后行胃镜检查患者的胃镜观察结果报告如下.
收集我院2008-01/2013-01胰腺癌放疗后返院复查, 行胃镜检查的31例患者, 既往均无胃、十二指肠炎症、溃疡病史. 其中男18例, 女13例, 年龄在44-75岁之间, 平均年龄59岁, 所有病例均经实验室检查、影像学(CT、MRI、PET等)或病理学诊断为胰腺癌. 其中9例为胰体尾癌, 22例为胰头癌. 分期: ⅡB期5例, Ⅲ期19例, Ⅳ期7例.
1.2.1 放疗: 均采用现代放疗技术: γ-刀、三维适形放疗(3-D)、螺旋断层放射治疗(TOMO), 其中γ-刀治疗15例, 三维适形放疗5例, TOMO治疗10例. γ-刀处方剂量: 周边50%剂量线, GTV: 45 Gy/15 f-51 Gy/17 f, 单次剂量GTV: 3 Gy/f; 三维适形放疗处方剂量: 周边90%等剂量线处, CTV/GTV: 50 Gy/60 Gy/25 f, 单次剂量CTV/GTV: 2 Gy/2.4 Gy/f; TOMO处方剂量: 周边95%等剂量线处, CTV/GTV: 50 Gy/60 Gy/20 f. 单次平均剂量为CTV/GTV: 2.5 Gy/3 Gy/f. 治疗均采用常规分割, 1 f/1 d, 5 f/1 wk.
1.2.2 其他治疗: 31例患者中, 16例放疗前已行Whipple手术、剖腹探查术或ERCP及支架植入术; 9例放疗期间予吉西他滨1.0 g同步放化疗; 15例放疗期间给予抑酸及胃肠黏膜保护剂, 主要为质子泵抑制剂(奥美拉唑、兰索拉唑类)+胃肠黏膜保护剂(康复新液、硫糖铝、胶体果胶铋); 13例放疗期间给予氨磷汀防辐射治疗.
1.2.3 评价指标: (1)临床观察: 根据RTOG/EORTC急、慢性期胃肠道反应分级标准进行分级[4]. 急性反应多发生在放疗期间及放疗后1-3 mo, 临床表现为不同程度的腹痛、腹胀、恶心、呕吐、胃肠出血等. 慢性期, 起始于放疗后3 mo以上, 除了急性期症状, 还可表现为肠腔狭窄、肠梗阻、肠瘘等; (2)胃镜观察: 胃镜观察胰腺癌放疗对胃、十二指肠的损伤直观改变为胃肠黏膜损伤, 表现为黏膜充血水肿、糜烂, 溃疡形成, 或肠腔狭窄. 评价标准: 胃、十二指肠表现: 内镜下表现为Ⅰ级: 黏膜光滑, 无变形, 绒毛好; Ⅱ级: 黏膜轻度充血、肿胀, 血管网显露, 绒毛感不明显; Ⅲ级: 黏膜充血、肿胀, 伴组织脆性增加, 接触性出血; Ⅳ级: 黏膜质脆出血、糜烂, 溃疡形成, 肠腔狭窄. 所有病例均行内镜下组织病理学活检.
统计学处理 对胰腺癌放疗导致的胃、十二指肠黏膜放射性损伤的影响因素(放疗技术、放疗剂量、放疗前腹部手术、同步化疗、预防应用胃肠黏膜保护药物、预防应用氨磷汀、慢性合并症)进行表格统计, 对所得样本率用确切概率法计算, 以P<0.05为差异具有统计学意义. 所有统计数据均采用SPSS12.0统计软件分析.
临床症状观察结果如表1所示: 该组病例急性期反应发生在开始放疗后3 d到放疗结束后50 d, 中位时间为30 d. 晚期反应发生在放疗结束后3-18 mo, 中位时间为7 mo. 急性期胃肠道反应发生率为71.0%, 中重度(3-4级) 胃肠道反应发生率: 急性期为19.4%, 慢性期为20.0%. 一般情况下1-2级胃肠道反应一般不需特殊治疗; 3-4级胃肠道反应常需要药物治疗, 必要时住院治疗.
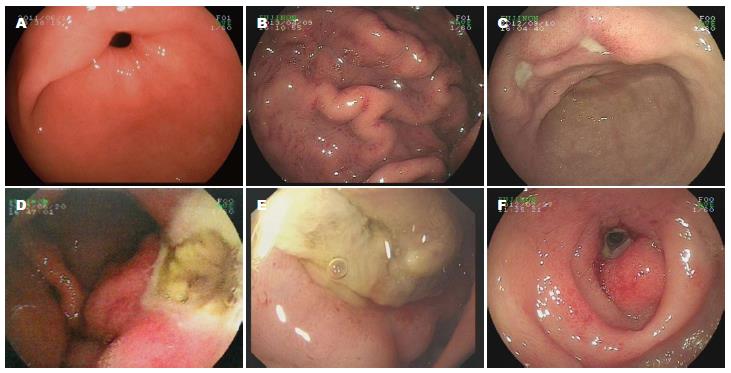
胃镜观察结果如表2所示: 胃镜观察时间为放疗结束至放疗后18 mo, 中位时间为3 mo. 胃镜下表现为(图1) : Ⅰ级胃、十二指肠黏膜正常4例; Ⅱ级轻度胃、十二指肠黏膜炎症6例, 包括为胃、十二指肠黏膜充血、水肿, 慢性萎缩性胃炎; Ⅲ级糜烂性胃炎3例; Ⅳ级病变包括: 单纯胃溃疡6例, 包括胃底、胃体、胃角、胃窦溃疡以及胃多发溃疡, 胃溃疡伴胃窦变形1例; 单纯十二指肠溃疡5例, 包括十二指肠球部和十二指肠降段溃疡以及多发十二指肠溃疡, 吻合口溃疡1例, 十二指肠溃疡合并狭窄4例; 无同时合并胃、十二指肠溃疡患者, 部分患者为胃溃疡合并十二指肠球部炎症或十二指肠溃疡合并胃部炎症. 所有病例均经胃镜下组织病理学活检, 符合炎症或溃疡性改变. 胃镜下观察: 总病变率为87.1%, Ⅱ级病变率为19.4%, Ⅲ-Ⅳ级病变率为67.8%; Ⅱ级病变一般不需要特殊诊治; Ⅲ-Ⅳ级病变需药物治疗, 对于十二指肠溃疡合并狭窄的患者需行支架植入治疗.
表3-8为可能影响放射性胃、十二指肠黏膜损伤的因素, 在胃镜观察下的不同结果, 除外1例为肿瘤侵犯致十二指肠狭窄. 观察指标主要包括放疗技术、放疗总剂量(表3), 放疗前腹部手术史(表4), 同步化疗(表5), 是否预防应用胃肠黏膜保药物剂(表6), 应用氨磷汀(表7), 慢性合并症(如慢性肠病、高血压、糖尿病等)(表8)对放射性胃肠损伤的影响.
| γ-刀 | 3-D | TOMO | |
| Ⅰ级 | 3(20.0) | 1(20.0) | 3(27.3) |
| Ⅱ级 | 2(13.3) | 2(40.0) | 1(9.1) |
| Ⅲ级 | - | 1(20.0) | 1(9.1) |
| Ⅳ级 | 10(66.7) | 1(20.0) | 6(54.6) |
| 合计 | 15 | 5 | 11 |
| 手术史 | 无手术史 | |
| Ⅰ级 | 2(12.5) | 5(33.3) |
| Ⅱ级 | 3(18.7) | 2(13.3) |
| Ⅲ级 | 1(6.3) | 1(6.7) |
| Ⅳ级 | 10(62.5) | 7(46.7) |
| 合计 | 16 | 15 |
| 同步GEM化疗 | 非同步化疗 | |
| Ⅰ级 | 3(33.3) | 2(9.1) |
| Ⅱ级 | 1(11.1) | 4(18.2) |
| Ⅲ级 | 1(11.1) | 3(13.6) |
| Ⅳ级 | 4(44.5) | 13(59.1) |
| 合计 | 9 | 22 |
| 预防用药 | 未预防用药 | |
| Ⅰ级 | 5(31.3) | - |
| Ⅱ级 | 3(18.7) | 2(13.3) |
| Ⅲ级 | 1(6.3) | 3(20.0) |
| Ⅳ级 | 7(43.7) | 10(66.7) |
| 合计 | 16 | 15 |
| 氨磷汀 | 未用氨磷汀 | |
| Ⅰ级 | 2(14.3) | 3(17.6) |
| Ⅱ级 | 3(21.4) | 2(11.8) |
| Ⅲ级 | 2(14.3) | 2(11.8) |
| Ⅳ级 | 7(50.0) | 10(58.8) |
| 合计 | 14 | 17 |
| 有慢性合并症 | 无慢性合并症 | |
| Ⅰ级 | 3(21.4) | 4(23.5) |
| Ⅱ级 | 2(14.3) | 3(17.6) |
| Ⅲ级 | 1(7.1) | 1(5.9) |
| Ⅳ级 | 8(57.1) | 9(52.9) |
| 合计 | 14 | 17 |
结果如表3所示, 其中γ-刀放疗剂量为GTV: 45 Gy/15 f-51 Gy/17 f, 单次剂量为3 Gy; 3-D放疗剂量为CTV/GTV: 50 Gy/ 60 Gy/25 f, 单次平均剂量为CTV/GTV: 2 Gy/2.4 Gy/f; TOMO放疗CTV/GTV: 50 Gy/60 Gy/20 f, 单次平均剂量为CTV/GTV: 2.5 Gy/3 Gy/f. 表3显示γ-刀、3-D、TOMO不同技术治疗后胃镜观察结果: 3组结分别比较, γ-刀对比3-D总病变率(80.0% vs 80.0%, P>0.0167), Ⅲ-Ⅳ级病变率(66.7% vs 40.0%, P<0.0167); γ-刀对比TOMO总病变率(80.0% vs 72.7%, P>0.0167), Ⅲ-Ⅳ级病变率(66.7% vs 63.7%, P<0.0167); 3-D对比TOMO总病变率(80.0% vs 72.7%, P>0.0167), Ⅲ-Ⅳ级病变率(40.0% vs 63.7%, P<0.0167).
γ-刀治疗剂量51 Gy(10例), 48 Gy(3例), 45 Gy(2例), 总病变率为(90% vs 100% vs 100%), 3组结果分别比较P<0.0167.
观察结果对比如表4所示: 本组资料中腹部手术史为: 胰十二指肠切除术1例(胃镜检查黏膜正常), 剖腹探查术9例, 减黄术6例. 表4胃镜观察结果显示: 放疗前手术组患者16例, 非手术组患者15例, 总病变率(87.5% vs 66.7%, P>0.05).
结果对比如表5所示: 该亚组显示同步GEM化疗方案中, GEM用量为1.0 g/m2, 最高用量1.5 g, 化疗2个周期, 化疗前后均给予预防恶心、呕吐等药物, 化疗期间出现胃肠道反应与血液学毒性反应症状, 给予对症治疗. 如表5胃镜观察结果所示: 同步GEM方案9例, 非同步GEM方案22例, 总病变率(66.7% vs 91.9%, P>0.05).
如表6所示, 该组患者预防使用胃肠黏膜保护药物为抑酸剂(奥美拉唑、雷贝拉唑或泮托拉唑)+胃肠黏膜保护剂(康复新液、硫糖铝或胶体果胶铋)的组合用药. 表6胃镜观察结果所示: 放疗期间预防用药16例, 放疗期间未预防用药15例, 总病变率为(68.7% vs 100%, P = 0.04).
如表7所示: 氨磷汀4 mg溶于100 mL 0.9%氯化钠溶液中, 于每次放疗前30 min静滴. 表8胃镜观察结果所示: 放疗期间使用氨磷汀14例, 放疗期间未使用氨磷汀17例, 总病变率为(85.7% vs 82.4%, P>0.05).
慢性合并症指放疗期间合并有如慢性胃、十二指肠黏膜病变(如炎症、溃疡)、高血压、糖尿病等慢性病史的患者, 本组资料的患者主要指高血压、糖尿病, 无慢性胃肠病患者. 表8胃镜观察结果显示: 有慢性合并症患者14例, 无慢性合并症患者17例, 总病变率为(8.6% vs 76.5%, P>0.05).
伦琴于1895年发现了X射线, 为恶性肿瘤开创了新的有效的治疗方法, 但不到2年时间就有了关于盆腹部放射治疗后发生急性胃肠道并发症的报道[5]. 放疗可以直接通过电子能量转换辐射损伤DNA, 也可以通过间接作用产生氧自由基, 引起单链或双链DNA断裂, 阻止DNA的转录和复制, 从而导致细胞的裂解和凋亡. 放射线还可以直接破坏细胞膜, 导致细胞的裂解死亡[6-8]. 由于细胞对放疗的敏感性取决于所处的细胞周期, 处在G2和M期的细胞对放疗最为敏感. 因此, 增生较快的组织如小肠隐窝细胞和上皮细胞对放疗尤为敏感[8]. 粟永萍等[9]动物实验研究表明, 小鼠12 Gy全身照射后24 h, 小肠隐窝即出现大量变性坏死和凋亡细胞, 18-26 Gy则极少或全无再生隐窝出现. 生理情况下, 胃肠黏膜由机械屏障、化学屏障、免疫屏障、生物屏障组成, 维持肠道正常的消化和吸收功能, 同时阻止致病微生物和毒素越过肠黏膜屏障侵入肠道, 持肠道功能、保护肠道环境[10-13]. 放疗通过直接及间接破坏各个胃肠道屏障功能[14-17], 从而引起链式反应, 导致胃肠黏膜屏障功能障碍, 引起放射性胃肠炎.
放疗的病理学变化从放射治疗刚开始就已经发生, 但发展到组织学变化和出现临床症状可能需要几周, 几个月甚至数年[18]. 根据发病缓急及病理组织学变化, 放射性胃肠炎可分为2个阶段: (1)急性期, 发生于放疗辐射期间或放疗后3 mo内, 主要病变在黏膜层, 多表现为浆细胞和多核型粒细胞浸润、肠黏膜变薄、绒毛缩短, 毛细血管扩张, 同时由于干细胞缺失和隐窝有丝分裂的减少, 上皮细胞变性脱落, 形成隐窝微脓肿和黏膜溃疡. 由于上皮细胞功能障碍, 导致营养素和水分的缺失, 临床表现为腹痛、腹胀、腹泻、黏液血便、胃肠出血等; (2)慢性期, 起始于照射后3个月以上, 也有报道放射治疗15年之后发生放射性损伤[19]. 主要损伤黏膜下层及其脉管, 常见的组织病理学特征为进行性闭塞性脉管炎和间质纤维化. 闭塞性脉管炎导致组织缺血、坏死, 淋巴管扩张, 导致小肠黏膜萎缩变薄, 肠管长期缺血坏死, 肠蠕动减弱. 同时间充质细胞激活和胶原沉积导致黏膜下层致密纤维化, 小肠无规则黏连和萎缩狭窄, 肠管间正常间隙缺失, 相邻肠管黏连、融合, 改变了小肠正常解剖关系[20]. 临床表现为幽门变形狭窄、肠道狭窄、肠梗阻、肠瘘等.
由于胰腺组织对射线不敏感, 其所需治疗剂量高达(50-70 Gy), 与胰腺周围组织如胃、十二指肠的最小最大耐受剂量(45-55 Gy)、(50-65 Gy)非常接近. 因此, 胰腺癌放疗后的胃肠道反应发生率较高. 虞晓林等[21]报道行立体定向放疗的156例患者, 出现以恶心、呕吐为主的急性消化道反应发生率为66.67%, 少数伴腹泻. 高宏等[22]报道的112例患者接受立体定向放疗, 其中106例出现返酸、恶心、乏力、上腹部不适等情况, 胃肠道反应发生率高达94.6%. 孙曙光等[23]报道的接受立体定向放疗的患者, 治疗过程中均有不同程度恶心、呕吐等胃肠反应, 对症处理后完全缓解. 3例患者于放疗后2-4 mo出现腹痛, 胃镜检查显示存在十二指肠溃疡. 张洪珍等[24]与杨小文等[25]也报道胃肠道反应发病率高于50%, 本组资料统计显示急性胃肠道反应发生率为71.0%, 晚期胃肠道反应发生率为85.0%, 急性期胃肠道反应发生率与文献报道相符. 由于本组资料的患者多半由于出现相应胃肠道症状来院就诊并行胃镜检查, 因此晚期胃肠道反应发生率要高于文献报道.
既往由于胰腺癌放疗应用局限, 加上缺乏对放射性胃肠损伤的客观评价指标, 人们对放射性胃肠损伤关注较少. 因此胃镜在胰腺癌放疗引起胃、十二指肠黏膜损伤的报道较少. Andreyev等[26]收集的256例接受盆腔放疗后出现胃肠道症状的患者中, 经肠镜检查显示发现34%的患者与放疗无关; 12%的患者则是由于盆腔肿瘤复发引起的胃肠道反应, 只有54%的患者为放疗后引起的胃肠道反应. Pasha等[27]应用双气囊内镜对放疗后引起的胃肠道出血进行了诊治. 这也证明了胃肠镜检查在放射性胃十二指肠黏膜病变诊断和治疗中的重要作用. 本组资料中31例患者通过胃镜观察胰腺癌放疗后胃、十二指肠黏膜的变化, 结果显示胃、十二指肠黏膜总病变率为87.1%, 高于单纯临床观察的急慢性胃肠道反应率(71.0%, 85.0%); Ⅲ-Ⅳ级病变21例, 病变率为67.8%, 而临床实际出现中重度(3-4级)胃肠道反应病例数及发生率: 急性期6例, 发生率19.4%, 慢性期4例, 发生率20.0%; 1例患者为肿瘤浸润致十二指肠狭窄, 引起恶心、呕吐等胃肠道症状, 发生比率为3.2%. 当患者出现胃肠道症状再行胃镜检查, 病变主要以Ⅲ-Ⅳ病变为主, 胃镜下表现不同, 主要有胃糜烂、溃疡(胃体、胃角、胃窦等)、出血, 十二指肠溃疡(球部、降段)、狭窄等. 研究表明胃镜观察到的病例数要高于临床实际就诊的患者, 部分患者虽然已形成糜烂性或溃疡性病变等, 但由于临床症状轻微, 缺乏客观的诊断依据, 从而延误治疗. 部分患者虽然出现较严重的临床症状, 可能为原发肿瘤浸润或转移所致, 但由于缺乏客观诊断依据及病理学活检, 使得部分患者过度治疗胃肠道症状而延误肿瘤的诊治. 因此对于胰腺癌放疗后行胃镜检查观察胃、十二指肠病变必要可行, 以便根据病变采取针对性治疗措施. 胃镜检查能直接观察到胃、十二指肠黏膜的病变情况, 同时可以通过胃镜对可疑病变部位进行病理活检及细胞学检查, 以进一步明确诊断, 对于出血、梗阻也可直接进行内镜下止血、放置支架等治疗. 通过胃镜检查可以直观的观察放疗前后胃、十二指肠黏膜的变化, 对于放疗前已经存在胃、十二指肠病变的患者及时治疗, 以预防更严重的胃肠道反应发生, 使患者顺利完成放疗. 同时通过胃镜观察放疗后胃、十二指肠黏膜的变化, 分析影响放射性胃、十二指肠病变的因素.
据文献报道[28,29]放射性胃肠炎的发生、发展与放疗的技术、剂量、放疗时程及剂量分割、患者的营养状态、是否有手术治疗及化疗等有关. Theis等[30]也指出, 患者有并发症(高血压、糖尿病、炎症性肠病等)、吸烟、既往行腹部手术、放射治疗的总剂量以及联合化疗等因素可能影响放射性胃肠损伤的发生. 本组资料中, 对影响放射性胃、十二指肠黏膜损伤的因素进行单因素分析, 结果显示放疗技术、放疗剂量影响放射性胃、十二指肠黏膜损伤的发生. 3种放疗技术比较, TOMO对放射性胃、十二指肠黏膜损伤的程度最小, 而3-D引起的放射性胃、十二指肠黏膜损伤程度最大. 本研究对比了γ-刀不同剂量放疗后胃、十二指肠黏膜变化, 结果显示随着放疗剂量的增加, 胃、十二指肠黏膜损伤发生率增高, 差异有统计学意义. 根据本资料显示, 由于腹部手术史包括胰十二指肠切除术、剖腹探查术和胆肠吻合的减黄术, 由于胰十二指肠切除术后, 胃肠解剖结构改变, 放疗后胃肠黏膜损伤与剖腹探查术胃镜观察结果可能存在差异, 但目前鲜见相关文献报道, 本资料中胰十二指肠切除患者1例, 胃镜观察放疗后胃、十二指肠黏膜正常, 预防使用胃肠黏膜保护药物可以减少放射性胃、十二指肠黏膜损伤的发生, 差异有统计学意义; 本组结果表明放疗期间使用氨磷汀并没有减少放射性胃、十二指肠黏膜损伤的发生, 由于本组资料为回顾性分析, 存在一定的资料偏差, 且样本量较小, 有一定局限性, 因此尚需要多中心、大样本量的临床资料观察放疗引起的胃、十二指肠黏膜损伤情况并分析影响放射性胃、十二指肠黏膜损伤发生的因素, 为胃、十二指肠道黏膜损伤的预防和治疗提供依据.
胰腺癌发病率逐渐升高, 且手术切除率低, 术后复发率高, 对于失去手术切除机会及术后复发的中晚期胰腺癌, 放化疗是其主要治疗手段, 近年来放疗技术的发展, 使得越来越多的胰腺癌患者接受放疗, 但由于胰腺癌本身的解剖关系, 以及对放疗剂量较高的要求, 使得放疗引起的胃, 十二指肠黏膜损伤不可不免, 既往由于缺乏客观的观察指标, 对放疗引起的胃、十二指肠黏膜损伤关注不足, 因此我们期望寻求一种客观的观察指标以直观观察胃、十二指肠黏膜损伤.
潘阳林, 副主任医师, 副教授,中国人民解放军第四军医大学西京医院消化病医院消化六科
目前对放疗导致的胃、十二指肠黏膜损伤的研究集中在对损伤的治疗, 以改善患者生活质量.
Andreyev等对256例接受盆腔放疗后出现胃肠道症状的患者进行肠镜检查发现34%的患者与放疗无关; 12%的患者则是由于盆腔肿瘤复发引起的胃肠道反应, 只有54%的患者为放疗后引起的胃肠道反应, 说明了建立客观的观察指标的必要性, Theis等指出, 患者体质量下降、合并(高血压、糖尿病、炎症性肠病等)并发症、吸烟、既往行腹部手术、放疗的总剂量以及联合化疗可能影响放射性胃肠损伤的发生, 与本文所述的相关因素一致, 探讨影响放射损伤的因素对治疗有一定的临床意义.
率先建立以胃镜评估胰腺癌放疗导致的胃、十二指肠黏膜损伤情况, 分析其影响因素, 以指导进一步治疗.
根据胃镜观察结果对病变情况进行治疗, 同时避免误诊; 分析其影响因素, 进一步预防和治疗放射性损伤的发生发展.
本本文整体质量较高, 具有一定指导意义.
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 3. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Murray T, Thun MJ. Cancer statistics, 2008. CA Cancer J Clin. 2008;58:71-96. [PubMed] [DOI] |
| 5. | Walsh D. Deep Tissue Traumatism from Roentgen Ray Exposure. Br Med J. 1897;2:272-273. [PubMed] [DOI] |
| 6. | Hall EJ. Radiobiology for the radiologist. Philadelphia: Lippin-cott Williams & Wilkins 2000; 165-167. |
| 7. | Bismar MM, Sinicrope FA. Radiation enteritis. Curr Gastroenterol Rep. 2002;4:361-365. [PubMed] [DOI] |
| 8. | Nguyen NP, Antoine JE, Dutta S, Karlsson U, Sallah S. Current concepts in radiation enteritis and implications for future clinical trials. Cancer. 2002;95:1151-1163. [PubMed] [DOI] |
| 10. | Liboni KC, Li N, Scumpia PO, Neu J. Glutamine modulates LPS-induced IL-8 production through IkappaB/NF-kappaB in human fetal and adult intestinal epithelium. J Nutr. 2005;135:245-251. [PubMed] |
| 11. | 马 涛, 尤 胜义. 淋巴细胞凋亡, 免疫抑制和脓毒症. 国外医学•外科学分册. 2005;32:35-38. |
| 12. | Arrieta MC, Bistritz L, Meddings JB. Alterations in intestinal permeability. Gut. 2006;55:1512-1520. [PubMed] [DOI] |
| 13. | Barrett KE. New ways of thinking about (and teaching about) intestinal epithelial function. Adv Physiol Educ. 2008;32:25-34. [PubMed] [DOI] |
| 15. | Freeman SL, MacNaughton WK. Ionizing radiation induces iNOS2 mediated epithelial dysfunction in the absenceof an inflammatory response. AmJ Physiol Gastroinest Liver Physiol. 2000;278:243-250. |
| 16. | Freeman SL, MacNaughton WK. Nitric oxide inhibitable isoforms of adenylate cyclase mediate epithelial secretory dysfunction following exposure to ionising radiation. Gut. 2004;53:214-221. [PubMed] [DOI] |
| 18. | Stone HB, Coleman CN, Anscher MS, McBride WH. Effects of radiation on normal tissue: consequences and mechanisms. Lancet Oncol. 2003;4:529-536. [PubMed] [DOI] |
| 19. | Galland RB, Spencer J. The natural history of clinically established radiation enteritis. Lancet. 1985;1:1257-1258. [PubMed] [DOI] |
| 26. | Andreyev HJ, Vlavianos P, Blake P, Dearnaley D, Norman AR, Tait D. Gastrointestinal symptoms after pelvic radiotherapy: role for the gastroenterologist? Int J Radiat Oncol Biol Phys. 2005;62:1464-1471. [PubMed] [DOI] |
| 27. | Pasha SF, Harrison ME, Leighton JA. Obscure GI bleeding secondary to radiation enteritis diagnosed and successfully treated with retrograde double-balloon enteroscopy. Gastrointest Endosc. 2007;65:552-554. [PubMed] [DOI] |
| 28. | Chon BH, Loeffler JS. The effect of nonmalignant systemic disease on tolerance to radiation therapy. Oncologist. 2002;7:136-143. [PubMed] [DOI] |
| 29. | Sauer R, Becker H, Hohenberger W, Rödel C, Wittekind C, Fietkau R, Martus P, Tschmelitsch J, Hager E, Hess CF. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med. 2004;351:1731-1740. [PubMed] [DOI] |
| 30. | Theis VS, Sripadam R, Ramani V, Lal S. Chronic radiation enteritis. Clin Oncol (R Coll Radiol). 2010;22:70-83. [PubMed] [DOI] |