修回日期: 2013-05-29
接受日期: 2013-06-05
在线出版日期: 2013-07-18
目的: 通过核因子κB(nuclear factor κB, NF-κB)、Bcl-2在大鼠非酒精性肝病(non-alcoholic fatty liver disease, NAFLD)中的表达, 研究线粒体损伤途径在肝细胞凋亡中的作用及NAFLD的发病机制.
方法: 将36只SD大鼠随机分为正常组18只, 模型组18只, 分别于6、10、14 wk处死各组大鼠, 6只在光镜下观察肝组织病理学形态; 血浆肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)采用放免法测定; TUNNEL法测肝细胞凋亡百分数; 免疫组织化学检测Bcl-2、NF-κB蛋白在肝细胞中的表达情况.
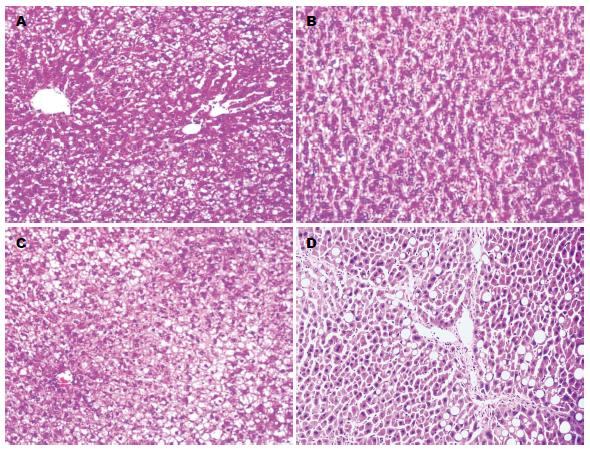
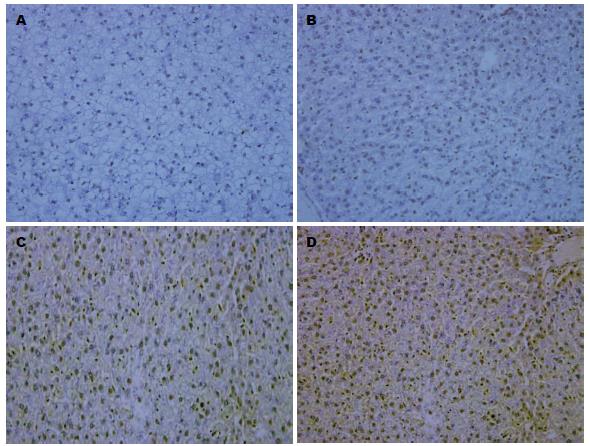
结果: 肝组织病理结果提示正常组肝组织结构正常, 模型组第6、10、14周大鼠肝小叶脂肪变性, 门管区及周围及腺泡第10、14周大鼠可见炎性细胞浸润, 第14周大鼠出现胶原纤维生成. 细胞凋亡百分数结果提示正常组在各时间段有散在凋亡阳性表现, 模型组凋亡细胞表达明显高于正常组, 且随时间的延长表达逐渐增多. 免疫组织化学结果显示造模组随时间的延长Bcl-2表达逐步增加, 且脂肪变明显的区域阳性染色细胞较相对正常肝细胞染色深. NF-κB定位于细胞质和/或细胞核, 模型组第6、10、14周大鼠肝细胞内可见NF-κB明显活化, 而且随造模时间延长, 其表达随之增多. 各组大鼠血浆TNF-α测定模型组各组大鼠血浆TNF-α表达随着造模时间的延长逐渐增高, 且均高于同时间段正常组表达.
结论: 细胞凋亡是NAFLD病情进展的重要阶段, NF-κB、Bcl-2在NAFLD肝细胞凋亡中起到重要作用.
核心提示: Bcl-2及其家族成员是调节肝细胞凋亡的核心机制之一, 而核因子κB对Bcl-2家族蛋白的调节起着重要作用, 可以利用促凋亡蛋白的抑制剂或者抑制凋亡蛋白的保护剂作为抗肝细胞凋亡的药物, 阻止肝细胞凋亡的过程, 延缓疾病进展, 以期待对非酒精性脂肪性肝病(non-alcoholic fatty liver disease)的治疗有新的方法.
引文著录: 石海燕, 李珏宏, 李昌平, 康敏, 钟晓琳. NF-κB、Bcl-2在大鼠非酒精性肝病肝细胞凋亡中的作用. 世界华人消化杂志 2013; 21(20): 1955-1960
Revised: May 29, 2013
Accepted: June 5, 2013
Published online: July 18, 2013
AIM: To examine the expression of nuclear factor κB (NF-κB) and Bcl-2 in non-alcoholic fatty liver disease (NAFLD) in rats and to investigate the role of the mitochondrial injury pathway in hepatocyte apoptosis and the pathogenesis of NAFLD.
METHODS: Thirty-six rats were randomly and equally divided into two groups: a control group and an experimental group. The rats were killed at weeks 6, 10, and 14, and histopathological features of the liver were observed by microscopy. Plasma levels of tumor necrosis factor-α (TNF-α) were measured by radioimmunoassay, hepatocyte apoptosis was assessed by TUNNEL assay, and expression of Bcl-2 and NF-κB proteins in hepatocytes was measured by immunohistochemistry.
RESULTS: Histopathological staining showed the liver structure was normal in the control group. However, lobular steatosis was observed in the model group. Portal and periportal inflammation and lobular inflammation were noted at week 10, and liver fibrosis was visible at week 14. Compared to the control group, apoptosis was increased in the model group, and this process was time-dependent. A time-dependent increase in the expression of Bcl-2 and NF-κB in liver tissue and serum levels of TNF-α was also found in the model group compared to the control group.
CONCLUSION: Apoptosis is a critical step for the development of NAFLD, and NF-κB and Bcl-2 play an important role in hepatocyte apoptosis in NAFLD.
- Citation: Shi HY, Li YH, Li CP, Kang M, Zhong XL. Role of NF-κB and Bcl-2 in hepatocyte apoptosis in rats with NAFLD. Shijie Huaren Xiaohua Zazhi 2013; 21(20): 1955-1960
- URL: https://www.wjgnet.com/1009-3079/full/v21/i20/1955.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i20.1955
随着社会经济发展, 非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)发病率逐年增加, 成为一种危害人类健康的常见慢性肝脏疾病. 全球流行病学调查表明, 成人的NAFLD发病率为20%-33%, 肥胖或2型糖尿病患者中NAFLD发病率达到75%, 最新的研究发现该病呈低龄化趋势. 为此, NAFLD在西方国家和世界其他地区越来越受到重视[1-3]. 随着对NAFLD的研究的深入, 肝细胞凋亡在NAFLD发病中的作用也逐渐被重视[4]. 肝细胞凋亡有多种途径, 其中, 线粒体损伤途径是NAFLD中肝细胞发生凋亡的中心环节, 是诱导肝细胞凋亡的执行者[5]. 本实验通过观察NAFLD大鼠中核因子κB(nuclear factor κB, NF-κB)、Bcl-2、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)的表达及肝细胞凋亡百分数等, 进一步研究线粒体损伤途径在NALFD肝细胞凋亡中的作用机制.
TUNNEL试剂盒, TNF-α放免试剂盒购自上海沪宇生物科技有限公司; 兔抗大鼠NF-κB多克隆抗体、兔抗大鼠Bcl-2多克隆抗体、二抗羊抗兔IgG、SP免疫组织化学染色试剂盒、DAB显色试剂盒购自上海博谷生物科技有限公司.
1.2.1 分组及造模: 将健康成年SPF级♂SD大鼠36只, 体质量150 g±30 g, 随机分为正常组18只(普通饮食喂养), 模型组18只(高脂饮食喂养: 胆固醇2.0%, 胆酸钠0.5%, 丙硫氧嘧啶0.2%, 蔗糖5.0%, 猪油10.0%, 基础饲料82.3%由泸州医学院实验动物中心新鲜配制)自由进水, 于第6、10、14周处死各组大鼠6只, 分离出的血清和取出的肝脏组织放置-80 ℃冰箱保存.
1.2.2 检测指标: 肝脏病理学检查: 将取出的肝组织用10%多聚甲醛固定1 d, 石蜡包埋并切片, 行HE染色, 在光镜下观察肝组织病理学形态; 血浆TNF-α采用放免法测定; TUNNEL法测肝细胞凋亡百分数, 肝脏组织切片依次脱蜡、水化, 再清除内源性过氧化物酶, 以TUNEL反应液作用50 min, 转化POD, DBA显色3 min; 随即中性树胶封片. 阴性对照标本上不加酶溶液, 仅加标记液. 结果分析: 对5个高倍视野下进行阳性细胞定量分析. 棕黄色或棕褐色颗粒为阳性表达, 计算方法: 凋亡细胞数/总细胞数×100%; 免疫组织化学检测Bcl-2、NF-κB蛋白在肝细胞中的表达情况, 结果评定: NF-κB主要在细胞膜或细胞浆出现棕褐色染色. Bcl-2主要在胞浆内着色, 偶见核膜着色. 每张切片取5个高倍镜视野(每个视野>500个细胞), 分别计算阳性率, 阳性率 = 阳性细胞数/总细胞数×100%.
统计学处理 使用SPSS17.0软件进行统计学分析. P<0.05为差异有统计学意义. 计量资料用mean±SD表示, 不同时间段正常组与模型组比较采用两样本均数比较的t检验, 不同时间点模型组与模型组, 正常组与正常组间比较采用方差分析, 并进行方差齐性检验, 方差齐者采用单因素方差分析.
各时间段(第6、10和14周)正常组HE染色后的肝组织切片, 肝小叶结构保持完整, 模型组第6周大鼠肝小叶内33%以上的肝细胞可见脂肪变性, 门管区及腺泡内未见明显炎性细胞浸润, 无明显胶原纤维生成, 无纤维化, 属于脂肪肝变化肝细胞脂肪变阶段. 模型组第10周大鼠肝脏脂肪变肝细胞占总数的50%以上, 部分在66%以上, 腺泡3带明显气球样变, 腺泡内见点状肝细胞坏死, 门管区出现炎性细胞, 属于非酒精性肝炎阶段. 造模组第14周可见程度不等的小叶内炎症、汇管区炎症, 腺泡3带广泛气球样变, 还有汇管区变性及点状, 灶状坏死, 甚至部分坏死融合成片, 门管区及门管区周围炎症明显, 4/6只大鼠出现肝细胞窦周纤维化(图1).
正常组在各时间段有散在凋亡阳性表达, 模型组凋亡细胞表达明显高于正常组(P<0.01), 且随时间的延长表达逐渐增多(P<0.05)(表1, 图2).
Bcl-2主要在胞浆内着色, 偶见核膜着色, 正常组大鼠Bcl-2的表达均为部分肝细胞散在弱阳性表达; 模型组第6周为肝细胞散在阳性表达较对照组组有所增强, 造模组随时间的延长Bcl-2表达逐步增加, 且脂肪变明显的区域阳性染色细胞较相对正常肝细胞染色深. NF-κB细胞染色呈黄色或棕黄色为阳性, 定位于细胞质和/或细胞核, 模型组第6、10、14周大鼠肝细胞内可见NF-κB明显活化, 而且随造模时间延长, 其表达随之增多(表2).
NAFLD是一类与代谢相关的肝脏疾病谱, 其发病与胰岛素抵抗(insulin resistance, IR)、肥胖、高甘油三酯血症和遗传易感性有密切关系[6]其病理学改变与酒精性肝病(alcoholic liver disease, ALD)相似, 但无过量饮酒史[7]. 病程包括单纯性脂肪肝及由演变而来的非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)和非酒精性脂肪性肝纤维化, 最后可能导致肝硬化和肝癌、肝衰竭、移植肝复发等问题. 多个研究发现NAFLD存在肝细胞凋亡, 并随病情进展加重. Feldstein等[8]通过对NASH患者肝组织活检标本应用TUNEL法检测肝细胞凋亡比单纯脂肪肝组或正常对照组显著增加, 并随NASH炎症与纤维化严重程度增加而增加, 而Shimizu等[9]也发现在酒精性肝炎和非酒精性肝病以及相关的肝纤维化中, 均有明显的肝细胞凋亡现象发生. Nan等[10]在小鼠NASH实验模型中也证实此观点. 本研究通过动态建立非酒精性肝病模型并测定不同时间点肝细胞凋亡百分数再次说明细胞凋亡在该病中占重要地位.
NAFLD肝细胞凋亡有3种途径: 由Fas、Fas-L介导的死亡受体途径、线粒体损伤途径和内质网应激(endoplasmic reticulum stress, ERS)途径. 其中ERS为高同型半胱氨酸血症和氧化应激等因素所诱导的机体的一种保护机制[11], 而线粒体损伤途径是NAFLD中肝细胞发生凋亡的中心环节, 是诱导肝细胞凋亡的执行者, 因为所有的信号物质均直接或间接地以线粒体为靶目标, 另两种途径均需要经过线粒体途径进一步放大. 线粒体途径主要由NF-κB介导的Bcl-2家族蛋白调控, 包括抑制凋亡的Bcl-2家族蛋白(如Bcl-2和Bcl-xL)和促进凋亡的Bcl-2家族蛋白(如Bid、Bax和Bak). 现阶段研究认为NF-κB、Bcl-2信号途径在肝细胞凋亡中发挥着主导作用[12].
NF-κB是一种能与免疫球蛋白κ链基因启动子序列特异性结合的核蛋白因子, 1986年在B淋巴细胞核提取物中首次发现, 属于NF-κB/Rel家族一员. 该家族包含2类共5种蛋白: NF-κB1(p50)、NF-κB2(p52); RelA(p65)、RelB、c-ReJ, 他们可以两两之间形成同源或异源二聚体, NF-κB多以p50和p65的异源二聚体形式存在, 由于p50、p65的前体包含有NF-κB的抑制因子IκB, 故在细胞静息状态下此异源二聚体尚与IκB结合, 以保证NF-κB处于失活状态. Rel家族蛋白同都有一个由300个氨基酸组成的氨基末端, 称为Rel同源区, 此区域即为Rel蛋白与DNA、其他细胞因子结合或形成二聚体的功能区, 该区域可以识别不同的κB序列而产生不同的细胞特性, 故NF-κB活化后因刺激源的不同而结合不同的κB序列而产生多种生物学效应[13].
本研究结果说明, 在模型组中, 随着造模时间的延长, 肝组织病理检查证明肝脏的脂肪变、炎症、纤维化的出现, 肝细胞凋亡的增多, NF-κB、TNF-α表达逐渐增加, 其机制可能因为NF-κB二聚体的组成不同, 以及调控不同靶基因时DNA序列各异, NF-κB对肝细胞凋亡调节具有抑制和诱导的双向作用, 其抑制凋亡作用主要通过包含Bcl-2家族蛋白在内的一系列与凋亡蛋白酶相作用的抗凋亡蛋白蛋白来实现. 如TNFR-associated factor: TRAF1、TRAF-2、JNK等[14], 其中Bcl-2家族包括抗细胞凋亡的Bcl-2、Bcl-X1、BHRF1和促细胞凋亡的Bax、Bcl-Xs、Bad、Bak及参与细胞存活调节的Al、Mcl-1等. 有研究发现, Bcl-2、Bcl-X1基因上有κB结合位点, 而Bax、Bad则无该位点. NF-κB激活可引起Bcl-2家族中抗细胞凋亡的基因表达增加, 进而发挥降低线粒体膜的通透性、抑制线粒体去极化及细胞色素C释放的抗凋亡作用[15-17]. 活化的NF-κB又能促进抗凋亡基因如 FLICE抑制蛋白和X连锁凋亡抑制蛋白的转录, 这些抗凋亡蛋白可从不同水平干扰TNF引起的半胱天冬酶活化从而抑制肝细胞凋亡. 其次, NF-κB活化后主要作用于TNF-α, 血清中TNF-α与其受体TNF-Rl结合, 刺激Bcl-2家族的另一促凋亡因子bid, bid介导bax改变自身构象, 并向线粒体移动, 插入线粒体内启动凋亡机制, 而ROS增多亦能放大这一信号途径, 另外TNF-α还可以通过死亡受体通路激活一系列caspase分子引起肝细胞凋亡[18]并产生大量炎性介质, 激活bax等线粒体上的促凋亡蛋白, 导致肝细胞凋亡.
肝细胞凋亡是非酒精性肝病发病的中心环节已经得到肯定. 但是由于肝细胞凋亡是一把双刃剑, 有必要对其具体的调控环节, 特别是各种调控之间的关系进行深层次的研究, Bcl-2及其家族成员是调节肝细胞凋亡的核心机制之一, 而NF-κB对Bcl-2家族蛋白的调节起着重要作用, 并通过改变抑制凋亡蛋白和促进凋亡蛋白的比值起双向调节作用, 可以利用促凋亡蛋白的抑制剂或者抑制凋亡蛋白的保护剂作为抗肝细胞凋亡的药物, 阻止肝细胞凋亡的过程, 延缓肝细胞的损伤, 炎症及纤维化的发生, 以期待对NAFLD的治疗有新的方法.
非酒精性肝病(non-alcoholic fatty liver disease, NAFLD)是以肝实质细胞脂肪变性和脂肪储积为特征的临床综合征, 病理学改变与酒精性肝病(alcoholic fatty liver disease, ALD)相似, 但无过量饮酒史. 其病理过程包括单纯性脂肪肝、脂肪性肝炎和脂肪性肝纤维化, 最后导致肝硬化、肝衰竭, 并可能引起肝癌、移植肝复发等问题. 近年来, 随着社会经济发展, NAFLD发病率逐年增加, 成为一种危害人类健康的常见慢性肝脏疾病, 其发病机制尚未阐明.
朱传武, 主任医师, 苏州市第五人民医院传染科
随着对NAFLD的研究的深入, 肝细胞凋亡在NAFLD发病中的作用也逐渐被重视. 多个研究发现NAFLD存在肝细胞凋亡, 并随病情进展加重, 但其具体机制尚不清楚.
Feldstein通过对非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)患者肝组织活检标本应用TUNEL法检测肝细胞凋亡比单纯脂肪肝组或正常对照组显著增加, 并随NASH炎症与纤维化严重程度增加而增加, 而Nitchell等也发现在酒精性肝炎和非酒精性肝病以及相关的肝纤维化中, 均有明显的肝细胞凋亡现象发生. Nan等在小鼠NASH实验模型中也证实此观点. 细胞核因子NF-κB是一种具有多向性调节作用的蛋白质因子, 有研究表明NF-κB及其调控产物的过度表达在肝脏慢性炎症、肝纤维化的发生及发展中起重要作用. 已经有实验证明Bcl-2其作为NK-κB的下游因子, 可以通过该条途径起抗细胞凋亡作用.
本实验通过改良高脂饮食建立非酒精性脂肪性肝病大鼠模型, 并随着其病变进展在不同时间点观察肝细胞凋亡、炎症、纤维化以及相关的蛋白BCL-2、NF-κB的表达情况, 从而探讨以上两种相关蛋白在非酒精性肝病中的作用及其机制.
通过NF-κB、Bcl-2在大鼠NAFLD中的表达, 研究线粒体损伤途径在肝细胞凋亡中的作用及NAFLD的发病机制, 进一步揭示了细胞凋亡在该病中占有重要地位, 而NF-κB可能是发病的中心环节.
本文研究了大鼠NAFLD模型的相关凋亡因子, 对揭示肝细胞凋亡与NAFLD发病机制具有一定的参考意义.
| 1. | Angulo P. GI epidemiology: nonalcoholic fatty liver disease. Aliment Pharmacol Ther. 2007;25:883-889. [PubMed] [DOI] |
| 2. | Delgado JS. Evolving trends in nonalcoholic fatty liver disease. Eur J Intern Med. 2008;19:75-82. [PubMed] [DOI] |
| 3. | Fan JG, Saibara T, Chitturi S, Kim BI, Sung JJ, Chutaputti A. What are the risk factors and settings for non-alcoholic fatty liver disease in Asia-Pacific? J Gastroenterol Hepatol. 2007;22:794-800. [PubMed] [DOI] |
| 4. | Nishitani Y, Okazaki S, Imabayashi K, Katada R, Umetani K, Yajima H, Matsumoto H. Saturated and monounsaturated fatty acids increase interleukin-10 production in rat hepatocytes. Nihon Arukoru Yakubutsu Igakkai Zasshi. 2007;42:32-35. [PubMed] |
| 5. | Chen DF, Wang CH. [The relationship between the opening of mitochondrial permeability transition pores of cultured hepatocytes with their apoptoses in a non-alcoholic fatty liver disease model]. Zhonghua Ganzangbing Zazhi. 2007;15:837-839. [PubMed] |
| 6. | Sanyal AJ, Campbell-Sargent C, Mirshahi F, Rizzo WB, Contos MJ, Sterling RK, Luketic VA, Shiffman ML, Clore JN. Nonalcoholic steatohepatitis: association of insulin resistance and mitochondrial abnormalities. Gastroenterology. 2001;120:1183-1192. [PubMed] [DOI] |
| 8. | Feldstein AE, Canbay A, Angulo P, Taniai M, Burgart LJ, Lindor KD, Gores GJ. Hepatocyte apoptosis and fas expression are prominent features of human nonalcoholic steatohepatitis. Gastroenterology. 2003;125:437-443. [PubMed] [DOI] |
| 9. | Shimizu I, Kohno N, Tamaki K, Shono M, Huang HW, He JH, Yao DF. Female hepatology: favorable role of estrogen in chronic liver disease with hepatitis B virus infection. World J Gastroenterol. 2007;13:4295-4305. [PubMed] |
| 10. | Nan YM, Wu WJ, Yao XX, Wang L. [The role of apoptosis and the related genes in non-alcoholic steatohepatitis]. Zhonghua Ganzangbing Zazhi. 2007;15:41-46. [PubMed] |
| 11. | 吴 涛, 季 光, 郑 培永, 柳 涛. 内质网应激与肝细胞凋亡. 世界华人消化杂志. 2007;15:2507-2515 Available from: http://www.wjgnet.com/1009-3079/15/2507.pdf. |
| 12. | Moniaux N, Song H, Darnaud M, Garbin K, Gigou M, Mitchell C, Samuel D, Jamot L, Amouyal P, Amouyal G. Human hepatocarcinoma-intestine-pancreas/pancreatitis-associated protein cures fas-induced acute liver failure in mice by attenuating free-radical damage in injured livers. Hepatology. 2011;53:618-627. [PubMed] [DOI] |
| 13. | Elsharkawy AM, Mann DA. Nuclear factor-kappaB and the hepatic inflammation-fibrosis-cancer axis. Hepatology. 2007;46:590-597. [PubMed] [DOI] |
| 14. | Kucharczak J, Simmons MJ, Fan Y, Gélinas C. To be, or not to be: NF-kappaB is the answer--role of Rel/NF-kappaB in the regulation of apoptosis. Oncogene. 2003;22:8961-8982. [PubMed] [DOI] |
| 15. | Adams JM, Cory S. The Bcl-2 protein family: arbiters of cell survival. Science. 1998;281:1322-1326. [PubMed] [DOI] |
| 16. | Luo X, Budihardjo I, Zou H, Slaughter C, Wang X. Bid, a Bcl2 interacting protein, mediates cytochrome c release from mitochondria in response to activation of cell surface death receptors. Cell. 1998;94:481-490. [PubMed] [DOI] |