修回日期: 2013-04-08
接受日期: 2013-04-12
在线出版日期: 2013-05-28
目的: 评价国内恩替卡韦联合苦参素治疗HBeAg阳性慢性乙型肝炎(chronic hepatitis B, CHB)的疗效与安全性.
方法: 检索国内2005-2012年公开发表的恩替卡韦联合苦参素与单用恩替卡韦比较治疗HBeAg阳性CHB的随机对照试验, 以比值比(odds ratio, OR)为效应量进行异质性检验和统计量合并分析. 采用Cochrane协作网提供的RevMan 5.2软件进行荟萃分析.
结果: 经筛选共纳入10项随机对照试验, 合计765例患者, 其中治疗组382例, 对照组383例. 荟萃分析结果显示, 在治疗结束时, 治疗组血清HBV-DNA转阴率高于对照组(81.3% vs 66.5%, OR = 2.49, 95%CI: 1.70-3.66), 血清HBeAg转阴率高于对照组(52.3% vs 26.5%, OR = 3.27, 95%CI: 2.23-4.80), 丙氨酸转氨酶复常率高于对照组(88.4% vs 68.0%, OR = 3.62, 95%CI: 2.43-5.39), HBeAg血清转换率高于对照组(45.3% vs 23.2%, OR = 2.98, 95%CI: 2.00-4.44), 差异均有统计学意义(P<0.01).
结论: 恩替卡韦联合苦参素对HBeAg阳性CHB的抗病毒疗效显著优于恩替卡韦单用, 具有较好的安全性和耐受性.
核心提示: 恩替卡韦联合苦参素对HBeAg阳性慢性乙型肝炎(chronic hepatitis B)的抗病毒疗效显著优于恩替卡韦单用, 具有较好的安全性和耐受性.
引文著录: 齐有涛, 左维泽. 恩替卡韦联合苦参素治疗e抗原阳性慢性乙型肝炎的荟萃分析. 世界华人消化杂志 2013; 21(15): 1432-1436
Revised: April 8, 2013
Accepted: April 12, 2013
Published online: May 28, 2013
AIM: To compare the efficacy of entecavir-matrine combination therapy versus entecavir monotherapy in the management of HBeAg-positive chronic hepatitis B in China.
METHODS: A computer-based search of relevant randomized controlled trials was performed. The pooled odds ratio and 95% confidence interval (CI) of outcome indicators were used to measure the magnitude of the efficacy. Meta-analysis was carried out using RevMan 5.2 software.
RESULTS: Ten trials including 765 patients were identified. The combination therapy was remarkably more effective than monotherapy at the end of the treatment in terms of rates of HBV-DNA negative conversion (81.3% vs 66.5%, OR = 2.49, 95%CI: 1.70-3.66), HBeAg loss (52.3% vs 26.5%, OR = 3.27, 95%CI: 2.23-4.80), ALT normalization (88.4% vs 68.0%, OR = 3.62, 95%CI: 2.43-5.39) and HBeAg seroconversion (45.3% vs 23.2%, OR = 2.98, 95%CI: 2.00-4.44).
CONCLUSION: Entecavir-matrine combination therapy achieves superior efficacy with no increase in adverse effects as compared with entecavir monotherapy in the management of HBeAg-positive hepatitis B.
- Citation: Qi YT, Zuo WZ. Entecavir plus matrine vs entecavir monotherapy for HBeAg-positive chronic hepatitis B: A Meta-analysis. Shijie Huaren Xiaohua Zazhi 2013; 21(15): 1432-1436
- URL: https://www.wjgnet.com/1009-3079/full/v21/i15/1432.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i15.1432
乙型肝炎病毒(hepatitis B virus, HBV)感染是一个全球性的公共卫生健康问题, 全球约有20亿人曾感染过HBV, 其中3.5亿人为慢性HBV感染者[1,2], 每年约有100万人死于HBV感染所致的肝衰竭、肝硬化和肝细胞癌[2]. 2005年, 恩替卡韦被美国食品和药品管理局批准用于治疗慢性乙型肝炎(chronic hepatitis B, CHB), 因其较好的抗病毒效能和理想的耐药性, 成为各指南中推荐使用的一线口服药物, 但其疗效仍不能令人满意[1-3]. 近来, 我国学者开始尝试恩替卡韦联合苦参素治疗CHB并取得了较好的效果. 本研究就国内恩替卡韦与苦参素联合疗效公开发表的有关文献进行荟萃分析.
选取2005-2012国内公开发表的恩替卡韦联合苦参素治疗CHB相关论文及会议论文.
1.2.1 检索策略: 检索范围包括中国期刊全文数据库、万方数字化期刊全文数据库、中国科技期刊数据库(维普)、中国生物医学文献数据库及中国医院知识仓库会议论文全文数据库. 检索词包括: 恩替卡韦、苦参素、CHB、随机对照试验. 限定检索词在篇名、关键词和摘要.
1.2.2 纳入与排除标准: 纳入标准: (1)研究类型: 随机对照试验, 无论是否采用盲法及隐蔽分组; (2)研究对象: HBeAg阳性的CHB患者, 诊断标准符合2000年西安会议制定的《病毒性肝炎防治方案》[4], 病程在6 mo以上; (3)干预措施: 治疗组为恩替卡韦与苦参素联合治疗; 对照组为恩替卡韦单药治疗. 疗程至少24 wk. 排除标准: (1)不符合纳入标准; (2)发表重复的文献或研究; (3)文献数据无法转换或无法获取全文; (4)合并有其他病毒性肝炎、自身免疫性肝炎、药物性肝炎、遗传性肝病等; (5)疑有或确诊为肝硬化、肝细胞癌者; (6)近期曾使用过抗病毒药物、免疫调节剂等中西药物.
1.2.3 疗效判定指标: 血清HBV-DNA转阴率(HBV-DNA水平低于检测值下限300 copies/mL)、血清HBeAg转阴率、丙氨酸转氨酶(alanine aminotransferase, ALT)复常率和HBeAg血清学转换率.
1.2.4 数据提取和文献质量评价: 由2名评价员采用统一量表(文献质量评价表和文献资料提取表)独立进行, 完成后进行交叉核对, 如有分歧通过讨论解决. 文献质量评价参照Cochrane Handbook 5.1.0[5]关于随机对照试验质量评价标准: (1)随机方法是否正确; (2)是否进行分配隐藏; (3)是否实施盲法; (4)有无描述失访或退出; (5)如有失访或退出时, 有无采用意向性(intention-to-treat, ITT)分析. 所有质量评价标准均满足, 低风险偏倚, 评为A级; 一个或多个质量评价标准仅部分满足(或不清楚), 中度风险偏倚, 评为B级; 一个或多个质量评价标准都不满足(未使用或不正确), 高度风险偏倚, 评为C级.
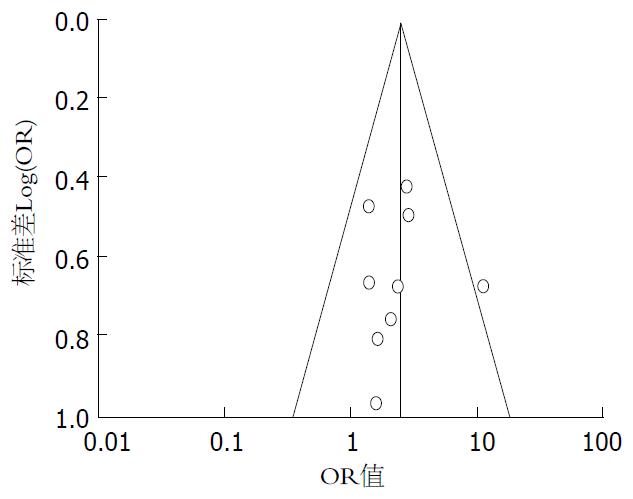
统计学处理 采用Cochrane协作网提供的RevMan 5.2软件进行统计学分析. 首先对纳入研究进行异质性检验, 若无异质性(P>0.10, I2<50%), 采用固定效应模型合并; 反之, 则采用随机效应模型, 并对其进行敏感性分析. 二分类变量采用比值比(odds ratio, OR)作为系统评价指标, 区间估计采用95%可信区间(CI), P<0.05为差异有统计学意义. 采用倒漏斗图分析可能的发表偏倚.
根据检索策略, 年限从2005-01/2012-12, 共检索到相关文献35篇, 文献来源主要是中国期刊全文数据库和维普数据库, 阅读文题排除无关和重复文献后, 最后筛选出10篇[6-15]符合纳入和排除标准的文献. 入选研究共包括CHB患者765例(试验组382例, 对照组383例), 其中3项研究[6,9,13]采用苦参素注射制剂, 余研究均采用苦参素口服制剂. 10篇文献均在文中提及"随机"但未进行详细描述; 均未报道盲法及分配隐藏的情况; 1篇[7]有失访报道, 但未进行ITT分析; 均提及基线有可比性. 质量评级均为C级. 10项研究的结果见表1.
| 纳入研究 | 年份 | HBV-DNA转阴率 | HBeAg转阴率 | ALT复常率 | HBeAg血清转换率 | ||||
| 治疗组 | 对照组 | 治疗组 | 对照组 | 治疗组 | 对照组 | 治疗组 | 对照组 | ||
| 刘兴峰[7] | 2007 | 26/29 | 25/31 | - | - | 27/29 | 22/31 | 15/29 | 3/31 |
| 颜晶晓[8] | 2009 | 35/39 | 44/51 | 14/39 | 5/51 | 34/39 | 31/51 | 9/39 | 5/51 |
| 邵志林等[9] | 2010 | 40/48 | 28/44 | 39/48 | 26/44 | 38/48 | 33/44 | 33/48 | 21/44 |
| 邱明华[10] | 2011 | 18/20 | 17/20 | - | - | 20/20 | 20/20 | 17/20 | 11/20 |
| 尹蔚华等[11] | 2011 | 26/30 | 22/30 | 17/30 | 10/30 | - | - | 10/30 | 6/30 |
| 丁月荷[12] | 2011 | 32/35 | 26/30 | 14/35 | 5/30 | 33/35 | 24/30 | - | - |
| 张天晓等[13] | 2012 | 38/41 | 21/40 | 19/41 | 10/40 | 37/41 | 19/40 | 16/41 | 7/40 |
| 张小河等[14] | 2012 | - | - | 25/40 | 4/34 | 36/40 | 18/34 | - | - |
| 杨亦德等[15] | 2012 | 49/60 | 37/60 | - | - | 55/60 | 46/60 | 21/60 | 11/60 |
| 余建国等[16] | 2012 | 14/40 | 12/43 | 15/40 | 12/43 | 31/40 | 27/43 | - | - |
| 合计 | 278/342 | 232/349 | 143/273 | 72/272 | 311/352 | 240/353 | 121/267 | 64/276 | |
异质性检验结果示各项研究间无异质性(P>0.10, I2<50%), 选择固定效应模型合并OR值, 并计算合并OR值的95%CI. 4个结局指标合并OR值的95%CI均不包括1, P<0.01, 差异有统计学意义, 认为恩替卡韦联合苦参素对HBeAg阳性CHB的抗病毒疗效显著优于恩替卡韦单用(表2).
| 疗效判定指标 | 率(%) | 异质性检验 | 合并效应量 | |||||
| 治疗组 | 对照组 | P值 | I2值(%) | OR值 | 95%CI | Z值 | P值 | |
| 血清HBV DNA转阴率 | 81.3 | 66.5 | 0.43 | 0 | 2.49 | 1.70, 3.66 | 4.67 | <0.01 |
| 血清HBeAg转阴率 | 52.3 | 26.5 | 0.23 | 27 | 3.27 | 2.23, 4.80 | 6.07 | <0.01 |
| 转氨酶ALT复常率 | 88.4 | 68.0 | 0.15 | 34 | 3.62 | 2.43, 5.39 | 6.31 | <0.01 |
| HBeAg血清转换率 | 45.3 | 23.2 | 0.65 | 0 | 2.98 | 2.00, 4.44 | 5.37 | <0.01 |
采用Cochrane图书馆推荐倒漏斗图识别发表偏倚, 对纳入研究的HBV-DNA转阴率绘制倒漏斗图, 倒漏斗图基本以中线为中心对称排列, 表明发表偏倚小(图1). 对各疗效判定指标采用随机效应模型进行敏感性分析, 前后两次结论均相同, 表明分析结果稳定.
CHB治疗目的是减少或阻止失代偿肝硬化和原发性肝细胞癌的发生, 提高生活质量, 延长生存时间[1-3], 而有效的抑制病毒复制, 使血清HBV-DNA水平持续低于检测值下限(<300 copies/mL)能降低疾病进展的风险[16,17].
恩替卡韦是一种有效的、选择性抑制病毒复制的环戊酰鸟嘌呤核苷类似物, 由Bristol-Myers Squibb公司研究开发. Ⅱ、Ⅲ期临床试验表明, 成人口服0.5 mg/d能有效的抑制HBV DNA复制, 无论HBeAg阳性或阴性的CHB, 疗效均优于拉米夫定[18,19]; 对于肝功能失代偿期CHB患者, 每日口服1.0 mg治疗效果优于阿德福韦酯, 表现出较好的疗效和安全性[20]; 对于初治的CHB患者连续治疗1、3、5年, 变异耐药检出率分别为0%、1.2%和1.2%[21,22], 而对于耐拉米夫定的病毒突变患者仍有较好的疗效, 且每日口服剂量1.0 mg治疗效果要优于0.5 mg[23]; 体外细胞实验未见线粒体毒性[24], 虽有文献[25]报道了恩替卡韦在治疗肝功能失代偿期CHB中出现了乳酸酸中毒病例, 但未服用恩替卡韦的肝功能失代偿患者亦会出现乳酸酸中毒[26], 因此未有足够证据证明其是恩替卡韦所致. 尽管恩替卡韦较其他核苷(酸)类药物取得了较好的成绩, 但仍未满足CHB患者的医疗需求. 最新的研究发现, 恩替卡韦治疗CHB血清HBsAg转阴率欧美种族患者最高可达21%, 而亚裔种族患者仅为0.5%[27]. 苦参素是从中药苦豆子或苦参中提取的有效成分, 主要成分是氧化苦参碱, 临床试验证实有直接抗病毒、免疫调节、抗纤维化、降酶、退黄的作用[28,29]. 苦参素制剂是我国首创的治疗药物, 安全性好, 不良反应少而轻, 停药后随访6 mo有持久疗效[28]. 在恩替卡韦治疗CHB的基础上加用苦参素能否提高患者血清病毒标志物转阴率, 值得探讨.
为此, 本研究收集了2005-2012年国内恩替卡韦联合苦参素治疗HBeAg阳性CHB的所有相关文献, 对治疗结束时的血清HBV-DNA转阴率、血清HBeAg转阴率、ALT复常率和HBeAg血清转换率4个指标进行了荟萃分析. 结果表明: (1)在恩替卡韦治疗HBeAg阳性CHB基础上加用苦参素制剂, 其疗效优于恩替卡韦单用, 两者有协同抗病毒作用; (2)联合方案使用安全方便, 具有良好的依从性和耐受性, 未出现因不良反应或实验室指标异常而终止治疗的病例, 有利于完成抗病毒治疗的规范疗程, 值得临床推广.
荟萃分析纳入较为严格的临床设计研究, 从不同地方不同人群汇集较多的病例来观察同一个问题, 采用较为客观的疗效判定指标, 使分析的结果更加真实可靠. 但荟萃分析结果的论证强度受制于纳入研究的质量. 本研究纳入的每篇文献样本量偏小, 且多数忽视了对失访、脱落、混杂因素及ITT分析等方法学质量上的控制以及无法收集到很难发表的阴性结果的研究, 使得分析结果的质量受到一定程度的影响. 目前我国苦参素制剂有针剂和胶囊两种类型, 但两者在血清病毒标志物转阴和肝功复常上无显著性差异(P>0.05)[29]. 因此, 本研究未对其进行具体的分类. 本研究仅评价恩替卡韦联合苦参素治疗HBeAg阳性CHB近期疗效和安全性, 对于其远期随访疗效如何、延长疗程能否提高疗效、治疗HBeAg阴性CHB的疗效如何等, 尚待设计严谨的临床研究加以证实.
慢性乙型肝炎(chronic hepatitis B, CHB)已经成为我国公共卫生的重大负担, 近年来尽管对于CHB的抗病毒治疗取得很大进展, 特别是随着恩替卡韦这一抗病毒能力强, 耐药率低的抗乙型肝炎病毒(hepatitis B virus, HBV)药物在中国推广使用, 越来越多的乙肝患者病情得到控制, 然而总体来讲, 目前HBV治疗疗效尚不能令人满意. 苦参素是我国研制的抗病毒药物, 多项临床试验证实苦参素具有抑制HBV复制的作用, 然而苦参素联合恩替卡韦是否具有协同作用值得进一步深入研究.
白浪, 副教授, 四川大学华西医院感染性疾病中心; 杨江华, 副教授, 皖南医学院弋矶山医院感染科
目前普遍认为HBV的慢性感染是病毒和宿主机体免疫相互作用的结果, 机体免疫系统在控制病毒复制中发挥了至关重要的作用. 在恩替卡韦抗病毒的基础上, 加用具有抗病毒、免疫调节等作用的苦参素能否提高治疗效果, 值得探讨.
杨诗杰等对拉米夫定联合苦参素对CHB血清HBsAg的影响进行荟萃分析, 结果显示疗程为12 mo时联合组血清HBsAg转阴率优于拉米夫定单用, 且随着疗程的延长, 联合治疗组血清HBsAg转阴率的疗效有优于单用拉米夫定的趋势.
本文采用荟萃分析的方法, 从统计学角度系统分析了恩替卡韦联合苦参素与单用恩替卡韦比较治疗HBeAg阳性CHB的疗效, 具有一定创新性, 对临床使用苦参素抗病毒治疗提高循证医学依据.
恩替卡韦为新一代核苷(酸)类似物, 具有较强的抗病毒效能和理想的耐药性. 苦参素制剂是我国首创的治疗药物, 安全性好, 不良反应少而轻, 停药后随访6 mo有持久疗效. 两者有协同抗病毒作用, 安全有效, 值得临床推广.
本文从统计学角度分析恩替卡韦联合苦参素与单用恩替卡韦比较治疗HBeAg阳性CHB的疗效, 研究方法合理, 数据真实可信, 具有一定创新性, 为临床使用苦参素抗病毒治疗提供循证医学依据.
编辑: 田滢 电编: 鲁亚静
| 1. | Liaw YF, Kao JH, Piratvisuth T, Chan HLY, Chien RN, Liu CJ, Gane E, Locarnini S, Lim SG, Han KH. Asian-Pacific consensus statement on the management of chronic hepatitis B: a 2012 update. Hepatol Int. 2012;6:531-561 In press. [DOI] |
| 2. | European Association For The Study Of The Liver. EASL clinical practice guidelines: Management of chronic hepatitis B virus infection. J Hepatol. 2012;57:167-185. [PubMed] [DOI] |
| 3. | Lok AS, McMahon BJ. Chronic hepatitis B: update 2009. Hepatology. 2009;50:661-662. [PubMed] [DOI] |
| 5. | Higgins JPT, Green S, editors . Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0. 2011-03. Available from: http: //handbook.cochrane.org/. |
| 8. | 邵 志林, 张 炳煌. 恩替卡韦联合苦参素治疗HBeAg阳性慢性乙型肝炎的疗效观察. 中国中西医结合消化杂志. 2010;18:92-94. |
| 16. | Chen CJ, Yang HI. Natural history of chronic hepatitis B REVEALed. J Gastroenterol Hepatol. 2011;26:628-638. [PubMed] [DOI] |
| 17. | Chen CF, Lee WC, Yang HI, Chang HC, Jen CL, Iloeje UH, Su J, Hsiao CK, Wang LY, You SL. Changes in serum levels of HBV DNA and alanine aminotransferase determine risk for hepatocellular carcinoma. Gastroenterology. 2011;141:1240-128, 1240-128. [PubMed] [DOI] |
| 18. | Chang TT, Gish RG, de Man R, Gadano A, Sollano J, Chao YC, Lok AS, Han KH, Goodman Z, Zhu J. A comparison of entecavir and lamivudine for HBeAg-positive chronic hepatitis B. N Engl J Med. 2006;354:1001-1010. [PubMed] [DOI] |
| 19. | Lai CL, Shouval D, Lok AS, Chang TT, Cheinquer H, Goodman Z, DeHertogh D, Wilber R, Zink RC, Cross A. Entecavir versus lamivudine for patients with HBeAg-negative chronic hepatitis B. N Engl J Med. 2006;354:1011-1020. [PubMed] [DOI] |
| 20. | Liaw YF, Raptopoulou-Gigi M, Cheinquer H, Sarin SK, Tanwandee T, Leung N, Peng CY, Myers RP, Brown RS, Jeffers L. Efficacy and safety of entecavir versus adefovir in chronic hepatitis B patients with hepatic decompensation: a randomized, open-label study. Hepatology. 2011;54:91-100. [PubMed] [DOI] |
| 21. | Yuen MF, Seto WK, Fung J, Wong DK, Yuen JC, Lai CL. Three years of continuous entecavir therapy in treatment-naïve chronic hepatitis B patients: VIRAL suppression, viral resistance, and clinical safety. Am J Gastroenterol. 2011;106:1264-1271. [PubMed] [DOI] |
| 22. | Tenney DJ, Rose RE, Baldick CJ, Pokornowski KA, Eggers BJ, Fang J, Wichroski MJ, Xu D, Yang J, Wilber RB. Long-term monitoring shows hepatitis B virus resistance to entecavir in nucleoside-naïve patients is rare through 5 years of therapy. Hepatology. 2009;49:1503-1514. [PubMed] [DOI] |
| 23. | Chang TT, Gish RG, Hadziyannis SJ, Cianciara J, Rizzetto M, Schiff ER, Pastore G, Bacon BR, Poynard T, Joshi S. A dose-ranging study of the efficacy and tolerability of entecavir in Lamivudine-refractory chronic hepatitis B patients. Gastroenterology. 2005;129:1198-1209. [PubMed] [DOI] |
| 24. | Mazzucco CE, Hamatake RK, Colonno RJ, Tenney DJ. Entecavir for treatment of hepatitis B virus displays no in vitro mitochondrial toxicity or DNA polymerase gamma inhibition. Antimicrob Agents Chemother. 2008;52:598-605. [PubMed] [DOI] |
| 25. | Lange CM, Bojunga J, Hofmann WP, Wunder K, Mihm U, Zeuzem S, Sarrazin C. Severe lactic acidosis during treatment of chronic hepatitis B with entecavir in patients with impaired liver function. Hepatology. 2009;50:2001-2006. [PubMed] [DOI] |
| 26. | Shim JH, Lee HC, Kim KM, Lim YS, Chung YH, Lee YS, Suh DJ. Efficacy of entecavir in treatment-naïve patients with hepatitis B virus-related decompensated cirrhosis. J Hepatol. 2010;52:176-182. [PubMed] [DOI] |
| 27. | Lampertico P, Liaw YF. New perspectives in the therapy of chronic hepatitis B. Gut. 2012;61 Suppl 1:i18-i24. [PubMed] [DOI] |