修回日期: 2013-04-14
接受日期: 2013-04-18
在线出版日期: 2013-05-08
目的: 观察γ-射线立体定向体部放射治疗局限期胰腺癌的疗效和放射治疗反应, 探讨影响其预后的相关因素.
方法: 这是一项前瞻性的临床研究, 对符合入组条件的65例局限期胰腺癌患者给予γ-射线立体定向体部放射治疗. 采用50%剂量线覆盖计划靶区(planning target volume, PTV), PTV边缘剂量3-5 Gy/次, 5次/wk, 总剂量45-51 Gy/2-3 wk的高分次剂量治疗模式. 生存分析采用Kaplan-Meier法, 多因素分析采用Cox比例风险回归模型, 分析影响患者预后的相关因素.
结果: 全组患者原发灶完全缓解率23%、部分缓解率48%, 总有效率为71%. 1年总生存率为52.4%, 中位生存期13 mo. 放疗后急性消化系反应, 1级为51%, 2级为18%, 未见3级不良反应. 骨髓抑制1级为28%, 2级为8%, 经对症处理后患者均能按计划完成治疗. 多因素分析结果显示TNM分期、治疗前CA199≥425.8 U/mL是胰腺癌患者独立预后因素.
结论: γ-射线立体定向体部放射治疗局限期胰腺癌采用3-5 Gy/次, 5次/wk, PTV边缘50%等剂量线处总剂量45-51 Gy的治疗模式是安全有效的, 对局限期胰腺癌可获得较好的局控率和生存率, 并可缓解疼痛, 提高生活质量. 其TNM分期、CA199水平可为胰腺癌的预后判定提供参考依据.
核心提示: 本文采用具有独特聚焦性的体部伽玛刀治疗局限期胰腺癌, 计划要求50%剂量线覆盖100%计划靶区(planning target volume, PTV), 采用PTV边缘剂量3-5 Gy/次, 5次/wk, 总剂量45-51 Gy/2-3 wk的高分次剂量短疗程治疗模式是安全有效的, 且可以提高胰腺癌患者的局控率, 总生存率及无进展生存期, 疼痛明显缓解, KPS评分明显改善, 生活质量提高.
引文著录: 康晓黎, 王颖杰, 邵银剑, 李宏奇, 李平, 王济东, 王轩, 夏廷毅. γ-射线立体定向体部放射治疗局限期胰腺癌65例. 世界华人消化杂志 2013; 21(13): 1266-1272
Revised: April 14, 2013
Accepted: April 18, 2013
Published online: May 8, 2013
AIM: To evaluate the efficacy and toxicity of γ-ray stereotactic body radiation therapy in the management of locally advanced pancreatic carcinoma, and to analyze factors affecting prognosis of locally advanced pancreatic carcinoma.
METHODS: Sixty patients with locally advanced pancreatic carcinoma who were treated with the γ-ray stereotactic body radiation therapy in our department were prospectively enrolled. Depending on tumor size, a total dose of 45-51 Gy was delivered at 3-5 Gy/fraction over 2-3 wk in 5 fractions per week to the 50% isodose line covering the planning target volume. Survival and prognostic factors were analyzed using the Kaplan-Meier method and Cox proportional hazard model, respectively. Univariate and multivariate analyses were performed to examine factors affecting clinical outcome.
RESULTS: Of all lesions, 15 (23%) completely disappeared, and 31 (48%) had a partial response. The total response rate was 71%. The overall 1-year survival rate was 52.4% and the median survival time was 13 mo. All patients tolerated the treatment well and completed the planned therapy. Grade Ⅰ acute gastrointestinal toxicity developed in 33 (51%) patients, and grade Ⅱ gastrointestinal toxicity was observed in 12 (18%) patients. Eighteen (28%) patients were diagnosed with grade Ⅰ leukocytopenia, and 5 (8%) patients had grade Ⅱ leukocytopenia. Multivariate analysis demonstrated that TNM stage and CA199 ≥ 425.8 U/mL were independent prognostic factors for pancreatic cancer.
CONCLUSION: γ-ray stereotactic body radiation therapy can result in a good curative effect and local control in the treatment of locally advanced pancreatic cancer. No severe adverse events occurred. TNM stage and CA199 ≥ 425.8 U/mL are independent prognostic factors for locally advanced pancreatic carcinoma.
- Citation: Kang XL, Wang YJ, Shao YJ, Li HQ, Li P, Wang JD, Wang X, Xia TY. Efficacy and toxicity of γ-ray stereotactic body radiation therapy in management of locally advanced pancreatic carcinoma: Our experience with 65 cases. Shijie Huaren Xiaohua Zazhi 2013; 21(13): 1266-1272
- URL: https://www.wjgnet.com/1009-3079/full/v21/i13/1266.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i13.1266
近几年胰腺癌发病率呈逐年增加趋势, 因其起病隐匿、病情进展快、恶性程度高, 而有"癌中之王"之称. 大量临床研究表明仅有10%-15%的患者可手术切除, 其中根治者仅占5.0%-7.5%, 胰腺癌患者中位生存时间不足6 mo, 5年生存率低于5%[1,2]. 文献报道[3-5]常规放疗+化疗以及手术+放化疗等多种治疗手段的联合也未显著提高胰腺癌患者的生存率. 随着放疗技术的发展, 精确放疗取得了巨大进步, 体部伽马刀作为我国自主创新的立体定向放射治疗(stereotactic body radiation therapy, SBRT)技术, 在胰腺癌的治疗方面获得了巨大的进步[6,7]. 选取2010-01/2012-07符合入组条件的65例局限期胰腺癌患者行γ-射线立体定向体部放射治疗, 初步效果良好, 现分析如下.
自2010-01/2012-07共65例局限期胰腺癌入组, 男患者36例, 女29例; 中位年龄62岁(29-80岁). 入院后进行详细的病史询问、体格检查和相关辅助检查, 包括血常规、肝肾功、肿瘤标志物、腹部增强CT/MRI、颈部超声等, 部分患者行PET/CT检查期. 65例患者均签署放疗知情同意书. 每周复查血常规、肝肾功能, 评估各种不良反应.
1.2.1 入组标准: (1)年龄≤85岁; (2)KPS评分: 60-100分; (3)组织学或细胞学或临床诊断为局限期胰腺癌; (4)外科会诊无手术指征, 或因内科疾病不能手术, 或患者拒绝手术; (5)有梗阻黄疸已行减黄处理后; 无远处转移或无胃肠广泛浸润, 无腹水; (6)65例患者均签署知情同意书. 排除标准: (1)曾患其他恶性肿瘤; (2)有精神系统病变者; (3)有重要器官的严重疾病或严重感染; (4)受试者既往接受过放疗; (5)正在进行其他药物试验或入组前1 mo内参加其他新药临床试验者; (6)怀孕或哺乳期妇女、处于生育期而未采取有效避孕措施者.
1.2.2 治疗方法: 采用OUR-QGD型立体定向γ射线全身治疗系统, 简称体部γ刀(奥沃公司, 深圳). 定位前20 min口服浓度为2%的碘帕醇溶液100 mL, 以显示胃、十二指肠和小肠的位置. 患者取仰卧位, 双手上举置于额头前, 用体位固定床和真空负压垫固定体位, 固定胸腹部, 体表标记重复摆位点, 扫描前5-10 s静脉注射碘帕醇100 mL. 采用CT模拟定位技术, 在平静呼吸下行腹部CT增强扫描, 层厚5 mm, 层间距5 mm, 扫描范围自膈顶至第四腰椎椎体水平, 包括肿瘤范围、淋巴引流区和有可能涉及到的区域如: 全肝、双侧肾脏、胃、十二指肠和部分肠道, CT图像经网络传输到全身γ刀治疗计划系统.由医生在增强CT图像上勾画靶区: 肿瘤靶区(gross target volume, GTV)(包括原发肿瘤和转移的淋巴结); 临床靶区(clinical target volume, CTV), 在GTV基础上外扩5 mm; 计划靶区(planning target volume, PTV), 在CTV基础上外扩5 mm; 勾画危及器官(肝脏、胃、十二指肠、小肠、肾脏、脊髓等).
计划要求50%剂量线覆盖100%PTV, PTV边缘剂量3-5 Gy/次, 5次/wk, 总剂量45-51 Gy/2-3 wk的高分次剂量治疗模式.危及器官限量: 十二指肠50 Gy< 3 cc, 45 Gy<5 cc; 小肠≤45 Gy; 胃50 Gy<5 cc, 45 Gy<10 cc; 脊髓≤30 Gy; 30%肝脏体积受照射剂量≤30 Gy; 30%双侧肾脏体积受照射剂量≤20 Gy, 10%双侧肾脏体积受照射剂量≤50 Gy. 对靶区和危及器官用剂量-体积直方图(dose-volume histogram, DVH)评价计划.
1.2.3 疗效及不良反应评价: 在治疗期间, 每周记录患者的临床症状改善情况和放射治疗反应: VAS法记录疼痛评分、KPS评分情况, 根据美国放射肿瘤治疗协作组(radiation therapy oncology group, RTOG)放射反应分级标准进行分级. 评估近期疗效参照世界卫生组织(world health organization)实体瘤通用评价方法完全缓解(complete response)、部分缓解(partial response)、疾病稳定(stable disease)和疾病进展(progressive disease)作为疗效评价标准.
1.2.4 随访: 所有患者在放疗结束后第1、3、6 mo复查, 以后每3 mo复查一次, 最后随访时间为2012-12, 中位随访时间10 mo(4-29 mo), 随访率100%.
统计学处理 应用SPSS17.0统计软件包进行统计分析. 对计量资料以中位数、mean±SD来描述, 对计数资料以例数、百分比来描述. 对局控率和生存率用Kaplan-Meier法计算, 组间生存率比较用Log-rank检验, 预后因素采用Cox多因素分析方法, P<0.05为差异有统计学意义.
65例患者按UICC 2002临床分期标准: Ⅱ期9例, Ⅲ期56例, 其中52例患者肿瘤位于胰头部, 13例位于胰体尾部. 18例经病理学诊断为腺癌, 1例为神经内分泌癌. 46例患者根据临床症状、影像学检查及肿瘤标志物检测诊断为胰腺癌. 其中49例行PET/CT检查确诊分期, 58例患者CA199超出正常范围之内, 全组患者CA199中位数为425.8 U/mL. 临床出现腹痛症状56例, 21例患者因黄疸就诊, 其中行胆肠吻合减黄术5例, 经皮肝穿刺胆道引流(percutaneous transhepatic cholangial drainage, PTCD), PTCD加胆道支架置入减黄16例, 行剖腹探查无手术指征行胆肠吻合术5例. 放疗中3例患者出现黄疸行PTCD加胆道支架置入术. 2例患者在放疗后1年后因黄疸行PTCD加胆道支架置入术. 49例患者治疗前体重下降超过5 kg. 治疗前患有糖尿病者21例, 临床资料见表1.
| 分组 | n | 百分比(%) |
| 性别 | ||
| 男 | 36 | 55 |
| 女 | 29 | 45 |
| 年龄(岁) | ||
| <60 | 27 | 42 |
| ≥60 | 38 | 58 |
| 临床分期 | ||
| II期 | 9 | 14 |
| Ⅲ期 | 56 | 86 |
| 肿瘤部位 | ||
| 头 | 52 | 80 |
| 体尾部 | 13 | 20 |
| CA199(U/mL) | ||
| ≥425.8 | 33 | 51 |
| <425.8 | 32 | 49 |
| 疼痛分级 | ||
| 无痛(0分) | 9 | 14 |
| 轻度(1-3分) | 19 | 29 |
| 中度(4-6分) | 16 | 25 |
| 重度(7-10分) | 21 | 32 |
| PET-CT分期 | ||
| 是 | 49 | 75 |
| 否 | 16 | 25 |
| 胆肠吻合术 | ||
| 是 | 10 | 15 |
| 否 | 55 | 85 |
| PTCD+胆道支架置入术 | ||
| 是 | 19 | 29 |
| 否 | 46 | 71 |
| 体质量下降 | ||
| 是 | 49 | 75 |
| 否 | 16 | 25 |
| 糖尿病 | ||
| 是 | 21 | 32 |
| 否 | 44 | 68 |
在放疗结束后1-3 mo全部病例行腹部增强CT检查, 部分患者3-6 mo后行PET-CT检查评价疗效(表2). 疼痛缓解率89%(50/56), KPS评分改善率92%(60/65).
| 完全缓解 | 部分缓解 | 疾病稳定 | 疾病进展 | 客观缓解 |
| 23(15/65) | 48(31/65) | 28(18/65) | 2(1/65) | 71(46/65) |
全组患者1年总生存率为52.4%, 中位生存期13 mo, 1年局部无进展生存率为86.1%, 1年无远转生存率为37.4%.
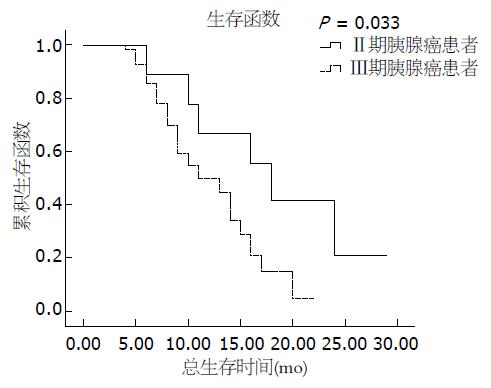
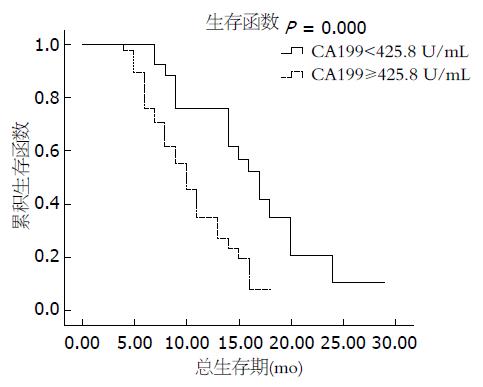
单因素风险分析示TNM分期(P = 0.033)、治疗前CA199升高≥425.8 U/mL(中位数水平)(P = 0.000, 图1, 2)是影响胰腺癌患者预后的危险因素, 而性别、年龄、肿瘤部位、疼痛程度、PET-CT分期检查、行减黄手术、放疗前体质量下降程度、合并糖尿病与胰腺癌患者的预后无关(表3).
| 分组 | n | 百分比(%) | 1年生存率(%) | 中位生存时间(mo) | P值 |
| 性别 | 0.497 | ||||
| 男 | 36 | 55 | 50.9 | 14 | |
| 女 | 29 | 45 | 54.4 | 13 | |
| 年龄(岁) | 0.181 | ||||
| <60 | 27 | 42 | 37.8 | 11 | |
| ≥60 | 38 | 58 | 64.3 | 14 | |
| 临床分期 | 0.033 | ||||
| II期 | 9 | 14 | 66.7 | 18 | |
| Ⅲ期 | 56 | 86 | 50.0 | 11 | |
| 肿瘤部位 | 0.400 | ||||
| 头 | 52 | 80 | 56.0 | 14 | |
| 体尾部 | 13 | 20 | 38.9 | 10 | |
| CA199(U/mL) | 0.000 | ||||
| ≥425.8 | 33 | 51 | 34.9 | 10 | |
| <425.8 | 32 | 49 | 75.7 | 17 | |
| 疼痛分级 | 0.173 | ||||
| 无痛(0分) | 9 | 14 | 77.8 | 18 | |
| 轻度(1-3分) | 19 | 29 | 57.4 | 13 | |
| 中度(4-6分) | 16 | 25 | 39.1 | 9 | |
| 重度(7-10分) | 21 | 32 | 45.0 | 11 | |
| PET-CT分期 | 0.295 | ||||
| 是 | 49 | 75 | 52.2 | 13 | |
| 否 | 16 | 25 | 53.0 | 14 | |
| 胆肠吻合术 | 0.890 | ||||
| 是 | 10 | 15 | 60.0 | 14 | |
| 否 | 55 | 85 | 53.1 | 13 | |
| PTCD+胆道支架植入术 | 0.943 | ||||
| 是 | 19 | 29 | 51.0 | 13 | |
| 否 | 46 | 71 | 53.1 | 13 | |
| 体质量下降 | 0.368 | ||||
| 是 | 49 | 75 | 48.5 | 16 | |
| 否 | 16 | 25 | 64.9 | 11 | |
| 糖尿病 | 0.203 | ||||
| 是 | 21 | 32 | 58.1 | 16 | |
| 否 | 44 | 68 | 50.2 | 13 |
Cox多因素分析表明TNM分期、治疗前CA199的水平是胰腺癌患者能否获得长期生存的独立预后因素, 其中TNM分期越早的患者生存期越长, 确诊时CA199<425.8 U/mL的患者生存期明显长于CA199≥425.8 U/mL升高的患者(表4).
| 危险因素 | B | SE | Wald | df | Sig | Exp(B) |
| CA199 | -1.156 | 0.349 | 10.961 | 1 | 0.001 | 0.315 |
| 临床分期 | -1.019 | 0.487 | 4.370 | 1 | 0.037 | 0.361 |
急性放射反应: 消化系反应1级为51%(33/65), 2级为18%(12/65), 未见3级的反应. 血液系统反应骨髓抑制1级为28%(18/65), 骨髓抑制2级为8%(5/65). 所有的患者经对症支持治疗后症状基本消失, 均能按计划完成放射治疗. 晚期放射反应: 2例出现2级胃、十二指肠浅表性溃疡, 经内科给予抗炎、抑酸、营养等治疗后好转, 未见3级放射反应(表5).
| 毒性反应(分级) | 0 | 1 | 2 | 3 | 4 |
| 急性反应 | |||||
| 消化系反应 | 20 | 33 | 12 | 0 | 0 |
| 血液学反应 | 42 | 18 | 5 | 0 | 0 |
| 晚期反应 | |||||
| 胃溃疡 | 64 | 0 | 1 | 0 | 0 |
| 十二指肠溃疡 | 63 | 0 | 2 | 0 | 0 |
| 十二指肠纤维化狭窄 | 0 | 0 | 0 | 0 | 0 |
在死亡的46例患者中, 因远处转移和/或多脏器功能衰竭死亡33例, 占72%(33/46). 因肿瘤未控或局部复发导致死亡11例, 占24%(11/46), 其中肿瘤进展致胃、出血死亡占82%(9/11), 胆道梗阻死亡占18%(2/11), 2例患者死于心脑血管疾病.
胰腺癌因其位置隐匿、早期症状不典型, 不易发现, 待肿瘤压迫胆道出现黄疸、或侵及周围组织出现疼痛症状而就诊时, 肿瘤往往已发展为晚期, 丧失手术治疗时机[8]. 本组65例患者, 其中56例Ⅲ期患者因肿瘤侵及大血管(腹腔干或肠系膜上动脉)而无法行手术治疗, 余9例Ⅱ期患者因高龄、合并内科疾病或存在手术风险的其他疾病, 经外科会诊为手术禁忌, 或患者及家属拒绝行手术治疗. 因胰腺癌对化疗药物不敏感, 且不良反应大, 加之胰腺癌患者多存在上消化系症状, 使用全身化疗后不良反应更加明显, 耐受差, 所以患者往往不愿意接受全身化疗. 到目前为止, 单一化疗可采用5-FU或吉西他滨等方案, 但效果均不理想[9,10]. 由于受到周围正常组织的剂量限制(如胃、十二指肠、小肠、脊髓、肾脏、脾脏等), 常规放疗很难达到肿瘤的根治性剂量, 随着精确放疗技术的发展, 在给予肿瘤致死剂量的同时能够很好的保护周围正常组织, 因此对于改善胰腺癌患者预后、提高生存率发挥着极其重要的作用. 随着伽马刀技术的应用[11,12], 其在聚焦方式、剂量分布、放射生物效应及适形度方面具有4方面优势: 对于胰腺癌的治疗存在着显著优势, 突破了胰腺癌放射治疗的瓶颈. OUR-QGD全身伽马刀有4大优势: (1)通过旋转锥面聚焦方式将30个钴-60放射源经准直器引导向一点聚焦, 使焦点处受到持续性的高剂量照射, 焦点外受到瞬时低剂量照射; (2)剂量高度集中, 肿瘤范围形成高剂量平台, 剂量线以同心圆状向中心层层递增, 周边剂量下降陡峭, 类似于质子线的Bragg峰, 有利于靶外正常组织的保护; (3)伽马刀可实施高分次剂量短疗程放疗, 缩短总治疗时间, 避免肿瘤细胞的加速再增殖及再群体化; (4)适形度方面, 可通过不同孔径准直器的组合, 实现靶区的全面包裹, 肿瘤较小时采用单靶点照射.当肿瘤大, 形状不规则时采用多个不同大小准直器的多靶点拟合照射, 将准直器进行位置和权重的合理组合, 可获得理想的剂量分布, 具有更好的适形度.
本组65例局限期胰腺癌患者应用体部伽玛刀技术, 采用高分次剂量短疗程的治疗模式, 使得肿瘤剂量分布大大提升, 同时周围正常组织剂量明显下降. 56例患者在治疗初或治疗中具有上腹和/或腰背部疼痛症状, 50例在放疗期间疼痛缓解, 放疗后疼痛缓解率89%; 放疗有效率71%, 1年总生存率为52.4%, 中位生存期13 mo, 1年局部无进展生存率为86.1%; 1年无远转生存率为37.4%; 高于或等于国内外报道的SBRT治疗胰腺癌的结果[13-15], 也明显优于肖振中等[16]、党亚正等[17]的报道, 提示体部伽马刀高分次剂量短疗程模式治疗局限晚期胰腺癌可进一步提高患者生活质量, 改善局控率和生存率. 目前临床上TNM分期是公认的判断胰腺癌患者预后的指标之一. 本研究进一步验证了TNM分期是胰腺癌患者预后的独立性因素. 这一结果与张文仙等[18]报道的TNM分期是胰腺癌患者预后的独立危险因素的结果一致. 从最早Del Villano等[19]报道的CA199对胰腺癌的诊断意义, 最近大量的研究证实CA199是胰腺癌最敏感和特意的指标肿瘤标志物, 与胰腺癌患者肿瘤的负荷与转移有关[20-22]. Micke等[23]报道的95例不能手术切除的局部晚期胰腺癌患者接受同步放化疗, CA199的敏感性为100%, 特异性为88%.治疗前CA199水平低于中位值(420 U/mL)的患者生存期较高于中位值者明显延长. 本研究中, 低于CA199水平的中位值(425.8 U/mL)的患者生存期较高于中位值者明显延长(MST 17 mo vs 10 mo, P = 0.000), 多因素分析进一步证明CA199为胰腺癌独立的预后危险因素, 与文献报道相似[24,25]. 有无阻塞性黄疸多与胰腺癌患者的生存期相关[26,27], 但在本组临床资料中, 差异无统计学意义, 这可能是由于患者在出现黄疸早期已行胆道支架置入术或外科减黄手术治疗, 肝功能无明显受损, 使患者治疗的耐受性增加.
Schellenberg等[28]研究的高剂量的SBRT较传统放疗有较好的局控率但是晚期不良反应较重. 而本研究放疗副反应轻微, 这可能与合适的放疗剂量模式有关. 本研究表明这种高分次剂量短疗程、靶中靶治疗的模式, 不仅能使肿瘤靶区获得高剂量, 且能更好的保护胰腺周围正常组织, 降低了不良反应, 提高了肿瘤局控率, 从而提高了生存率. 本研究中死亡的46例患者中, 因远处转移并发多脏器功能衰竭而死亡33例, 占72%, 说明了远处转移是胰腺癌患者死亡的重要死因, 应进一步加强联合化疗、靶向、生物、基因等综合治疗的研究.
总之, 本研究表明采用体部伽玛刀治疗局限期胰腺癌的高分次剂量短疗程模式是安全的, 近期疗效较好, 不良反应轻微, 可缓解疼痛, 提高生活质量. 随着离线验证技术、限制呼吸动度技术, 更优的分割剂量模式的应用, 胰腺癌的治疗一定会获得更好的疗效.
胰腺癌是常见的消化系恶性肿瘤, 但因其起病隐匿, 待肿瘤侵及或压迫胆道出现黄疸、或侵及周围组织出现疼痛症状而就诊时, 肿瘤往往已处于晚期. 确诊时20%可获手术切除, 超过40%的患者为局部进展期, 其余患者均伴有远处转移. 目前针对局部进展期胰腺癌采用常规放疗、单纯化疗、放疗+化疗等未见疗效明显改善, 仍有较高的远位转移和局部失败率, 中位生存期仅6-10 mo. 因此, 积极探索局部进展期胰腺癌的治疗方法具有重要的临床意义.
康春博, 副主任医师, 北京大学航天临床医院普通外科
目前应用体部伽玛刀技术, 采用高分次剂量短疗程的模式治疗不能手术的胰腺癌, 取得了很好的局控率.
夏廷毅教授在国内较早开展了胰腺癌的体部伽马刀治疗, 为以后胰腺癌的体部伽马刀治疗及剂量模式的选择奠定了基础.
失去了手术机会的局部晚期胰腺癌患者, 传统治疗疗效不佳, 预后差, 生活质量下降, 病死率高. 应用我国自主知识产权的体部伽马刀技术, 采用高分次剂量短疗程的治疗模式, 达到了与手术切除相媲美的治疗结果, 且不良反应轻微, 生活获益率提高.
本研究为早期胰腺癌患者提供了手术之外的治疗手段, 为不能手术胰腺癌患者提供了放疗联合手术或化疗、靶向治疗、基因治疗的有利证据, 并证实了TNM分期、治疗前CA199升高≥425.8 IU/mL是胰腺癌患者体部伽马刀治疗长期生存的独立预后因素.
本文具有一定的创新性与开拓性, 给无法手术切除的局限期胰腺癌提供了新颖的治疗方法, 该方法在疗效上确切, 又最大限度地减少了放疗的不良反应.
编辑: 田滢 电编: 鲁亚静
| 1. | 夏 廷毅, 康 静波. 体部肿瘤伽玛刀治疗学. 北京: 人民卫生出版社 2010; 171-183. |
| 2. | Goldstein D, Carroll S, Apte M, Keogh G. Modern management of pancreatic carcinoma. Intern Med J. 2004;34:475-481. [PubMed] [DOI] |
| 3. | Philip PA, Benedetti J, Corless CL, Wong R, O'Reilly EM, Flynn PJ, Rowland KM, Atkins JN, Mirtsching BC, Rivkin SE. Phase III study comparing gemcitabine plus cetuximab versus gemcitabine in patients with advanced pancreatic adenocarcinoma: Southwest Oncology Group-directed intergroup trial S0205. J Clin Oncol. 2010;28:3605-3610. [PubMed] [DOI] |
| 4. | Cascinu S, Berardi R, Labianca R, Siena S, Falcone A, Aitini E, Barni S, Di Costanzo F, Dapretto E, Tonini G. Cetuximab plus gemcitabine and cisplatin compared with gemcitabine and cisplatin alone in patients with advanced pancreatic cancer: a randomised, multicentre, phase II trial. Lancet Oncol. 2008;9:39-44. [PubMed] [DOI] |
| 5. | Brunner TB. Neoadjuvant therapy for potentially resectable pancreatic cancer: an emerging paradigm? Curr Oncol Rep. 2013;15:162-169. [PubMed] [DOI] |
| 8. | 殷 蔚伯, 谷 铣之. 肿瘤放射治疗学. 第四版. 北京: 中国协和医科大学出版社 2008; 837-854. |
| 10. | Sun C, Ansari D, Andersson R, Wu DQ. Does gemcitabine-based combination therapy improve the prognosis of unresectable pancreatic cancer? World J Gastroenterol. 2012;18:4944-4958. [PubMed] [DOI] |
| 13. | Gurka MK, Collins SP, Slack R, Tse G, Charabaty A, Ley L, Berzcel L, Lei S, Suy S, Haddad N. Stereotactic body radiation therapy with concurrent full-dose gemcitabine for locally advanced pancreatic cancer: a pilot trial demonstrating safety. Radiat Oncol. 2013;8:44. [PubMed] [DOI] |
| 14. | Rwigema JC, Parikh SD, Heron DE, Howell M, Zeh H, Moser AJ, Bahary N, Quinn A, Burton SA. Stereotactic body radiotherapy in the treatment of advanced adenocarcinoma of the pancreas. Am J Clin Oncol. 2011;34:63-69. [PubMed] [DOI] |
| 19. | Del Villano BC, Brennan S, Brock P, Bucher C, Liu V, McClure M, Rake B, Space S, Westrick B, Schoemaker H. Radioimmunometric assay for a monoclonal antibody-defined tumor marker, CA 19-9. Clin Chem. 1983;29:549-552. [PubMed] |
| 21. | Berger AC, Meszoely IM, Ross EA, Watson JC, Hoffman JP. Undetectable preoperative levels of serum CA 19-9 correlate with improved survival for patients with resectable pancreatic adenocarcinoma. Ann Surg Oncol. 2004;11:644-649. [PubMed] [DOI] |
| 22. | Kim JE, Lee KT, Lee JK, Paik SW, Rhee JC, Choi KW. Clinical usefulness of carbohydrate antigen 19-9 as a screening test for pancreatic cancer in an asymptomatic population. J Gastroenterol Hepatol. 2004;19:182-186. [PubMed] [DOI] |
| 23. | Micke O, Bruns F, Kurowski R, Horst E, deVries AF, Hausler JW, Willich N, Schäfer U. Predictive value of carbohydrate antigen 19-9 in pancreatic cancer treated with radiochemotherapy. Int J Radiat Oncol Biol Phys. 2003;57:90-97. [PubMed] [DOI] |
| 28. | Schellenberg D, Goodman KA, Lee F, Chang S, Kuo T, Ford JM, Fisher GA, Quon A, Desser TS, Norton J. Gemcitabine chemotherapy and single-fraction stereotactic body radiotherapy for locally advanced pancreatic cancer. Int J Radiat Oncol Biol Phys. 2008;72:678-686. [PubMed] [DOI] |