修回日期: 2013-03-05
接受日期: 2013-03-29
在线出版日期: 2013-04-18
目的: 观察表没食子儿茶素没食子酸酯[(-)-epigallocatechin-3-gallate, EGCG)]对阿霉素诱导的胃癌细胞MKN28衰老的影响.
方法: Western blot检测EGCG对EZH2蛋白表达的影响; 阿霉素诱导经EGCG处理的MKN28细胞衰老, 衰老相关-β-半乳糖苷酶(senescence associated-β-galactosidase, SA-β-gal)染色检测各组细胞衰老情况, 激光共聚焦显微镜检测各组细胞核中衰老相关异染色质灶(senescence-associated heterochromatic foci, SAHF)的形成; 噻唑蓝比色法(MTT)和流式细胞术检测EGCG对MKN28细胞生长和周期的影响, 并比较在阿霉素诱导下各组细胞的相应变化.
结果: EGCG可明显抑制EZH2蛋白表达, 经EGCG处理的MKN28细胞在阿霉素诱导下SA-β-gal染色阳性率和SAHF形成比例明显高于阿霉素组和EGCG组,分别为72.16%±4.03%、34.42%±7.06%、15.40%±1.70%和86.44%±4.33%、47.73%±3.03%、80.28%±1.24%; 与空白对照组相比, 经不同浓度EGCG处理的MKN28细胞其周期G0/G1比例以及生长抑制率会随浓度的增高而增大(P<0.05), 在阿霉素的诱导下此趋势更为明显.
结论: EGCG可通过抑制EZH2表达来促进阿霉素对MKN28细胞的衰老诱导作用.
核心提示: 表没食子儿茶素没食子酸酯[(-)-epigallo-catechin-3-gallate, EGCG]可显著降低胃癌MKN28细胞系中EHZ2蛋白的表达水平, 从而促进阿霉素对胃癌细胞的衰老诱导作用, 可延长胃癌细胞周期并抑制其生长, 诱导其出现衰老相关特征. 通过探讨EGCG与EZH2的关系及其对胃癌细胞系MKN28衰老的作用, 为胃癌的临床治疗提供新的思路.
引文著录: 白洁, 马牧原, 蔡明, 许飞, 陈俊华, 帅晓明, 陶凯雄. EGCG对阿霉素诱导的胃癌细胞MKN28衰老的影响. 世界华人消化杂志 2013; 21(11): 970-977
Revised: March 5, 2013
Accepted: March 29, 2013
Published online: April 18, 2013
AIM: To investigate the effect of treatment with (-)-epigallocatechin-3-gallate (EGCG) on EZH2 expression and doxorubicin-induced cell senescence in gastric cancer cell line MKN28.
METHODS: MKN28 cells were treated with EGCG in the presence or absence of doxorubicin. Protein expression of EZH2 was detected by Western blot. Doxorubicin-induced senescence of MKN28 cells was analyzed by senescence-associated β-galactosidase (SA-β-gal) staining. The formation of senescence-associated heterochromatic foci (SAHF) was measured by laser confocal microscopy. Cell cycle progression and cell proliferation of treated MKN28 cells were measured by flow cytometry and MTT assay, respectively.
RESULTS: EGCG effectively suppressed the expression of EZH2 protein and promoted doxorubicin-induced cell senescence and formation of SAHF in MKN28 cells. In the EGCG + doxorubicin group, the percentages of cells positive for SA-β-gal and SAHF formation proportion were increased more significantly than those in the doxorubicin group and EGCG group (72.16% ± 4.03% vs 34.42% ± 7.06%, 15.40% ± 1.70%; 86.44% ± 4.33% vs 47.73% ± 3.03%, 80.28% ± 1.24%). In EGCG-treated MKN28 cells, the proportion of cells in G0/G1 phase and reduced rate of cell proliferation increased with the increase in the concentration of EGCG, and this effect was more notable in the presence of doxorubicin.
CONCLUSION: EGCG can effectively suppress the expression of EZH2 and therefore promote doxorubicin-induced cell senescence in MKN28 cells.
- Citation: Bai J, Ma MY, Cai M, Xu F, Chen JH, Shuai XM, Tao KX. Treatment with EGCG promotes doxorubicin-induced cell senescence in gastric cancer cell line MKN28. Shijie Huaren Xiaohua Zazhi 2013; 21(11): 970-977
- URL: https://www.wjgnet.com/1009-3079/full/v21/i11/970.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i11.970
肿瘤细胞在一定条件下可被诱导进入衰老状态, 诱导肿瘤细胞衰老是一种可行的抗肿瘤治疗策略. EZH2(enhancer of zeste homolog 2)属于PcG(polycomb group)基因家族, 催化核小体组蛋白H3第27位赖氨酸三甲基化, 参与细胞的表观遗传学调控, 与细胞衰老有着密切联系[1-3]. 胃癌中EZH2的表达增加, 与肿瘤分期及不良预后关系密切[4]. 表没食子儿茶素没食子酸酯[(-)-epigallocatechin-3-gallate, EGCG]是绿茶多酚的主要活性成分, 他可明显降低PcG基因家族的多种蛋白表达, 并抑制组蛋白H3第27位赖氨酸的三甲基化[5,6]. 本研究使用EGCG处理胃癌MKN28细胞系, 检测其对EHZ2蛋白表达的影响; 观察EGCG对阿霉素诱导的胃癌细胞衰老的影响, 以及对胃癌细胞周期及生长的影响, 探讨EGCG与EZH2的关系及其对胃癌细胞系MKN28衰老的作用, 以寻找新的胃癌治疗靶点.
胎牛血清、RPMI 1640培养基购自Hyclone公司; EGCG、MTT和PI购自sigma公司; 阿霉素购自Pfizer公司; EZH2、GAPDH抗体和β-半乳糖苷酶(SA-β-gal)染色试剂盒购自Cell Signaling公司; 辣根过氧化物酶标记的羊抗兔二抗购自武汉博士德公司; DAPI购自Roche公司.
1.2.1 细胞培养: 人胃癌细胞株MKN28由华中科技大学附属协和医院腹腔镜实验室保存. 用含10%胎牛血清的RPMI 1640培养基, 在37 ℃、5%CO2的饱和湿度培养箱内培养.
1.2.2 Western blot检测EZH2蛋白表达: 分别使用10、50、100 μmol/L EGCG处理MKN28细胞, 48 h后提取蛋白. 取30 μg蛋白经6%SDS-PAGE分离, 电泳后转膜, 加入l:1 000稀释的EZH2一抗4 ℃孵育过夜, 内参照选用GAPDH, 二抗室温孵育1 h, 洗膜后ECL显影, 重复3次实验, 选取适宜EGCG浓度行后续实验.
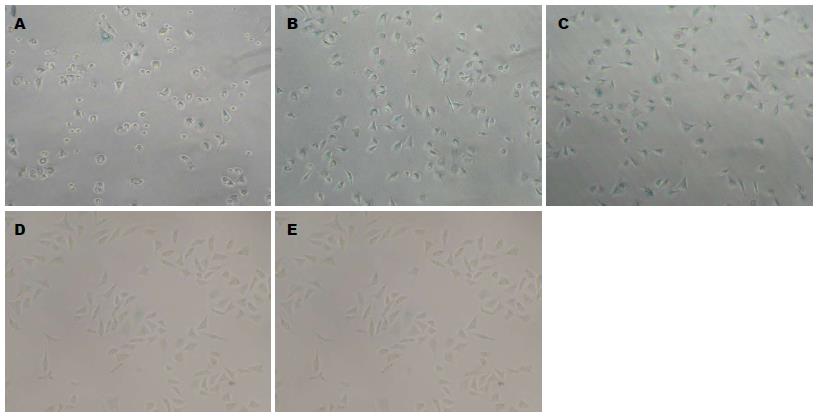
1.2.3 阿霉素诱导MKN28细胞衰老: 分别使用不同浓度(100、50、25、10 μmol/L)阿霉素处理MKN28细胞, 2 h后换为完全培养基, 继续培养48 h, 在pH 6.0的条件下, 按SA-β-gal染色试剂盒说明书操作, 倒置显微镜下计数衰老细胞, 计算衰老染色率. 选择衰老诱导效果最好的阿霉素浓度行后续实验.
1.2.4 SA-β-gal染色检测细胞衰老: 向经EGCG处理48 h后的细胞加入阿霉素, 2 h后换为完全培养基, 继续培养48 h, 作为EGCG+阿霉素组, 同时设立阿霉素组、EGCG组以及空白对照组, 行SA-β-gal染色, 计算衰老染色率.
1.2.5 激光共聚焦显微镜观察细胞核中SAHF形成: 按上述方法分组并处理细胞, 4%多聚甲醛室温固定15 min, PBS适当洗涤后加入DAPI染色液避光室温孵育15 min, 在激光共聚焦显微镜下观察, 计数SAHF阳性细胞, 计算阳性比率.
1.2.6 流式细胞仪检测细胞周期: 分别使用不同浓度(10、30、50、70 μmol/L)EGCG处理MKN28细胞48 h作为不同浓度EGCG组, 同时设立空白对照组, 75%乙醇4 ℃固定过夜, 次日离心收集细胞, 4 ℃预冷的PBS洗涤2遍, 每组加入0.5 mL浓度为100 μg/mL的PI溶液, 4 ℃避光孵育30 min, 上机检测细胞周期.
按上述方法分组并处理细胞, 48 h后加入25 μmol/L阿霉素, 2 h后换为完全培养液, 继续培养48 h后收集细胞, 作为EGCG+阿霉素组, 同时设立阿霉素组以及空白对照组, 后续操作如前. 用Modfit LTTM软件进行结果分析.
1.2.7 MTT比色法检测细胞增殖: 按1×104个/孔的细胞密度接种96孔板, 分别使用不同浓度(10、50、100、150、200 μmol/L)EGCG干预MKN28细胞, 每组设置6个复孔, 分别培养24、48、72 h, 同时设立空白对照组. 每孔加入MTT溶液(5 mg/mL)20 μL, 培养4 h后每孔加入150 μL DMSO, 摇床震荡10 min. 在490 nm波长下用酶联免疫检测仪测定每板各孔吸光度值. 计算细胞增殖抑制率.
按上述方法种板, 分别使用不同浓度(10、30、50、70、100 μmol/L)EGCG处理MKN28细胞48 h后加入阿霉素, 2 h后换以完全培养液, 继续培养48 h, 同时设立阿霉素组以及空白对照组, 后续操作如前.
统计学处理 所有的实验均重复3次, 所有数据均以mean±SD表示, 多组间均数的比较使用单因素方差分析(one-way ANOVA test, SPSS软件12.0)进行统计分析. 以P<0.05为有统计学差异.
分别使用10、50、100 μmol/L EGCG处理MKN28细胞, 48 h后使用Western blot检测EZH2的蛋白水平. 结果显示50、100 μmol/L EGCG均能显著抑制细胞中EZH2的蛋白表达水平, 但以50 μmol/L最为适宜(图1). 遂选取50 μmol/L作为后续实验的EGCG浓度.
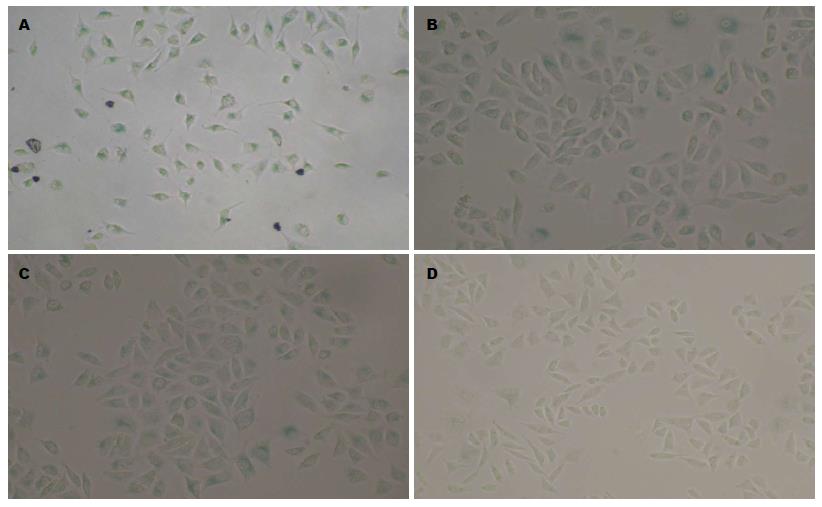
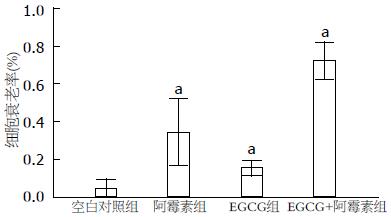
实验中25 μmol/L阿霉素组的SA-β-gal染色阳性率高于其他各组(图2), 遂后续实验采用25 μmol/L阿霉素诱导衰老. MKN28细胞经50 μmol/L EGCG处理后再经阿霉素诱导, 其SA-β-gal阳性率显著高于阿霉素组和EGCG组, 分别为72.16%±4.03%、34.42%±7.06%和15.40%±1.70%(P<0.05), 而正常细胞的染色率为4.50%±2.07%, 结果提示EGCG能促进阿霉素诱导的MKN28细胞衰老(图3, 4).
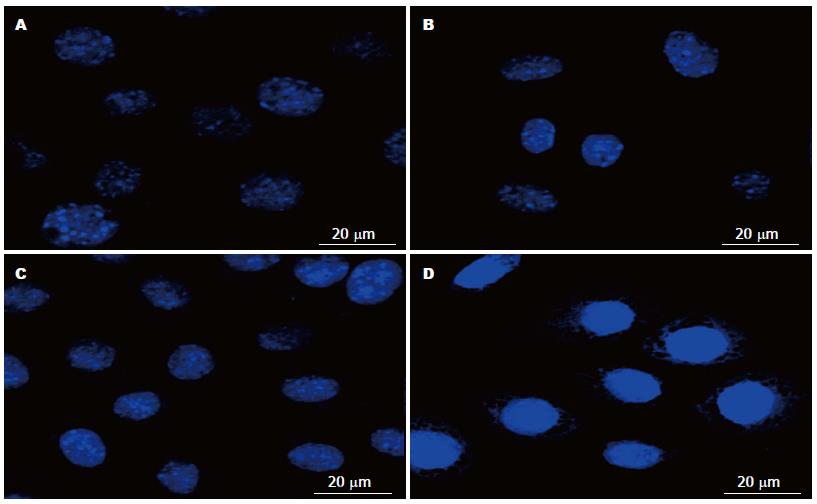
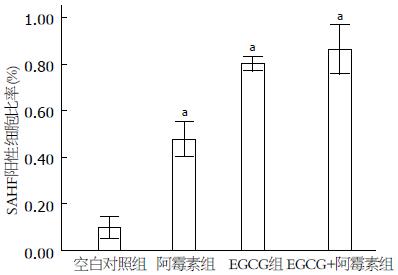
DAPI染色后激光共聚焦显微镜观察显示, EGCG+阿霉素组、阿霉素组和EGCG组的细胞核中均显示有DNA点状聚集异染色质灶形成, 但前者的数量明显多于后两者, 分别为86.44%±4.33%、47.73%±3.03%和80.28%±1.24%(P<0.05), 正常组为9.65%±1.85%. 结果提示EGCG能促进阿霉素诱导的MKN28细胞衰老, 并促进形成特征性的SAHF(图5, 6).
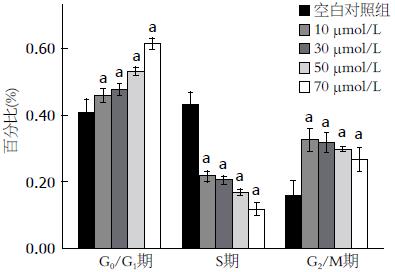
EGCG处理MKN28细胞48 h后G0/G1期比例均明显高于与空白对照组, 且呈剂量效应关系, 分别为10 μmol/L: 45.92%±0.83%; 30 μmol/L: 47.73%±0.70%; 50 μmol/L: 53.24%±0.54%; 70 μmol/L: 61.60%±0.69%; 空白对照组: 40.94%±1.59%(P<0.05). 与空白对照组相比, 各EGCG组的S期比例均显著降低, G2/M期比例均显著上升(图7).
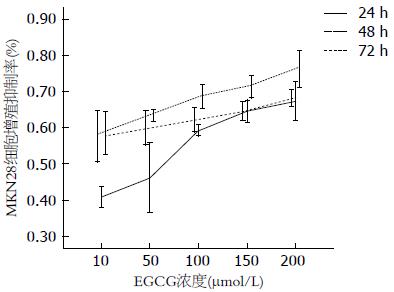
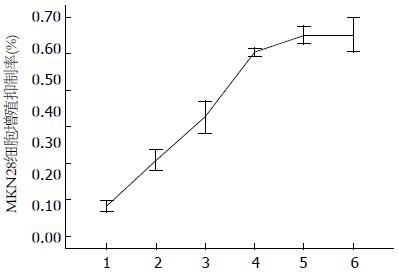
EGCG对MKN28细胞增殖有显著的抑制作用, 在不同浓度、不同作用时间下, 各处理组的吸光度平均值和空白对照组相比均有统计学差异(P<0.05), 随着作用时间的延长, 抑制作用愈加明显(图8).
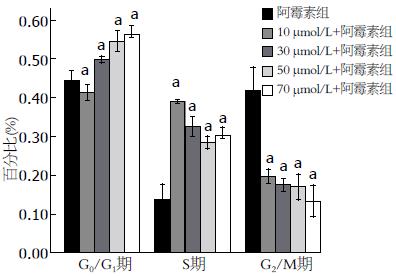
与阿霉素组相比, 除10 μmol/L EGCG+阿霉素组之外, 其他各组细胞周期均明显停滞于G0/G1期, 并呈剂量-效应依赖关系, 分别为30 μmol/L+阿霉素组: 49.87%±0.35%; 50 μmol/L +阿霉素组: 54.60%±1.07%; 70 μmol/L+阿霉素组: 56.33%±0.90%; 阿霉素组: 44.45%±1.01%(P<0.05). 提示EGCG促进了阿霉素诱导的MKN28细胞周期停滞, G0/G1期比例进一步增加(图9).
MTT结果显示各EGCG+阿霉素组MKN28细胞的抑制率均高于阿霉素组, 且随着浓度的增加, 抑制作用愈加明显(图10), 说明EGCG促进了阿霉素对MKN28细胞的增殖抑制作用.
衰老是细胞脱离细胞周期并不可逆地丧失增殖能力后进入的一种相对稳定状态, 其具有特定的生物学特征, 表现为细胞周期停滞在G0/G1期, 细胞生长出现不可逆的停止, 细胞表型改变, 表达衰老相关SA-β-gal, 以及细胞核中出现SAHF等[7,8]. 肿瘤细胞在一定条件下, 如遗传学操作、化疗药物、辐射等也可被诱导衰老, 同样会出现上述改变[9]. 研究发现化疗药物诱导荷瘤小鼠肿瘤细胞衰老后,衰老细胞比例与预后密切相关[10]. 同样在小鼠肿瘤模型中, 通过活化原癌基因而诱导衰老的肝癌细胞可向外界释放多种细胞因子, 如白介素-1α(interleukin-1α, IL-1α)、瘦蛋白、MCP1和RANTES, 而且衰老细胞还可活化CD4+ T细胞介导的免疫应答,从而清除肿瘤细胞, 这种清除肿瘤细胞的机制被称为"衰老监督"(senescence surveilance)[11]. 这些鼓舞人心的结果为衰老成为继诱导细胞凋亡策略后的新策略提供了有力证据.
EZH2是果蝇zeste基因增强子的人类同源物, 属于PcG基因家族. PcG家族包括PRC1和PRC2两种复合体, 分别起着维持基因抑制状态和启动基因沉默程序的作用[12]. EZH2与EED、SUZ12共同构成PRC2复合物, 通过组蛋白甲基转移酶中高度保守的SET区域催化组蛋白H3第9位和第27位赖氨酸三甲基化, 从而抑制转录, 在染色体水平调节基因活性[1]. EZH2的异常表达是肿瘤发生发展的重要驱动元素, 近期有研究显示乳腺癌中EZH2不仅参与肿瘤干细胞的形成, 还能扩增恶性肿瘤干细胞的数量, 从而促进肿瘤的发展进程[13]. 在多种肿瘤中, 人们都发现通过转染EZH2-siRNA和使用特异性抑制剂的方法降低EZH2表达能有效抑制细胞增殖并减少肿瘤的形成[14]. 此外, EZH2与细胞衰老有着密切联系. 高表达EZH2可使鼠胚胎成纤维细胞逃逸衰老, 并使鼠造血干细胞长期保持再生能力, 防止其耗竭[3]. 在早衰性疾病hutchinson-gilford progeria综合征患者的皮肤成纤维细胞中发现了全基因组范围内H3K27me3水平的下降, 可能与EZH2的表达下调有关[15].
EGCG作为绿茶多酚的主要活性成分已被证实对卵巢癌、乳腺癌、结肠癌和宫颈癌等多种肿瘤有增殖抑制作用[16-19]. 此外, 其还可提高宫颈癌及艾式腹水肿瘤对化疗药物的敏感性[20,21], 促进人正常上皮角化细胞的分化[22], 并通过PcG复合物影响皮肤肿瘤细胞的生长[5]. 过去的研究大多着重于EGCG对PRC1中Bmi-1的影响, 对EZH2的关注较少, 但PRC1复合体与染色体的结合依赖PRC2对染色体组蛋白的催化作用[23], 本实验将实验重点放在EZH2, 探讨了EGCG通过抑制EZH2表达对阿霉素诱导胃癌细胞MKN28衰老的影响.
在预实验中我们发现50 μmol/L EGCG能有效抑制EZH2蛋白的表达, 25 μmol/L低浓度阿霉素能有效诱导MKN28细胞衰老, 故选用上述浓度试剂进行实验. 结果显示EGCG+阿霉素组SA-β-gal染色阳性细胞比例及胞核中SAHF形成数量均明显高于阿霉素组、EGCG组和空白对照组. 此外, EGCG能有效阻滞细胞周期于G0/G1期、抑制细胞增殖、促进阿霉素的细胞周期阻滞和抗增殖效应. 以上结果表明, EGCG能通过抑制EZH2表达, 促进低剂量阿霉素诱导的胃癌MKN28细胞衰老.
在对人皮肤鳞状细胞癌细胞株的研究中发现, EGCG可增加EZH2和Bmi-1泛素化水平, 导致二者蛋白被蛋白酶体降解[6], 而胃癌细胞株中EGCG抑制EZH2的机制是否也与蛋白酶体有密切的联系, 其过程是否依赖于泛素化还是有其他机制作用其中, 有待于我们的深入研究.
p53/p21和p16/pRB途径是影响细胞衰老两条重要通路, 衰老细胞中EZH2表达下调, 同时H3K27me3水平下降并解除BMI1对p16的抑制作用[24], 也可通过去除CDKN1A转录起始位点及下游区域的组蛋白去乙酰酶, 使其乙酰化从而目击RNA聚合酶Ⅱ, 活化p21/CDKN1A[25]. 除此之外, EZH2还能募集DNA甲基转移酶到靶基因启动子(如MYT1), 直接控制DNA甲基化[26], 而启动子甲基化是其表达调控的重要机制. EGCG对EZH2表达的抑制作用是否可以通过影响上述一条或两条通路来影响周期进程和细胞衰老也是我们下一步研究需要解决的问题.
现已在乳腺癌、前列腺癌等多种肿瘤中发现了EZH2高表达, 其高表达与肿瘤的高侵袭性亚群相关[27]. 在55.6%-60.6%的胃癌组织中有EZH2高表达, 其表达与肿瘤大小、侵犯深度、血管侵犯、淋巴结转移、临床分期直接相关, EZH2高表达的患者预后差[28]. 而EGCG作为绿茶中的茶多酚, 其天然属性对其获取、加工乃至后期的临床应用都有着得天独厚的优势, 其对EZH2表达的抑制作用可能有益于多种肿瘤的治疗. 化疗是临床广泛应用的治疗手段, 高浓度化疗药物可以诱导肿瘤细胞发生凋亡或坏死, 而低浓度化疗药物可以诱导肿瘤细胞衰老, 如果临床中采取诱导肿瘤衰老的策略, 会大幅度降低药物的不良反应. 此外, 肿瘤对化疗药物诱导的细胞凋亡容易产生耐药性, 而相比之下, 肿瘤细胞则难以对化疗药物诱导的细胞衰老产生耐药性[29]. 本实验结果显示单用阿霉素诱导衰老的效率有限, 而将EGCG与小剂量阿霉素联合应用, 明显促进了胃癌细胞MKN28衰老进程, 这就为将来的肿瘤治疗提供了一个不良反应小, 衰老诱导效率高的治疗途径.
已有研究表明EZH2的异常表达是多种肿瘤发生发展的重要驱动因素, 而且与细胞衰老也有着密切联系.
陈光, 教授, 吉林大学第一医院消化器官外科; 张小晋, 主任医师,北京积水潭医院
胃癌组织中存在EZH2的高表达, 与肿瘤大小、侵犯深度、血管侵犯、淋巴结转移、临床分期和预后直接相关. 而抑制胃癌细胞系中EZH2表达是否可诱导胃癌细胞衰老, 目前尚未有人报道.
在多种肿瘤中, 通过转染EZH2-siRNA和使用特异性抑制剂的方法降低EZH2表达能有效抑制细胞增殖并减少肿瘤的形成, 而高表达EZH2可使鼠胚胎成纤维细胞逃逸衰老, 并使鼠造血干细胞保持长期的再生能力, 防止其耗竭; 在对人皮肤鳞状细胞癌细胞株的研究中发现, EGCG可增加EZH2和Bmi-1泛素化水平, 导致二者蛋白被蛋白酶体降解, 从而降低二者的表达水平.
本文通过EGCG特异性抑制EZH2表达, 研究胃癌细胞系中EZH2对细胞衰老的影响以及对阿霉素诱导细胞衰老的促进作用, 为胃癌的临床治疗提供新的思路.
本文通过研究EZH2与胃癌细胞系衰老之间的关系, 为临床将EZH2作为靶点,协同阿霉素诱导胃癌细胞衰老, 从而治疗胃癌提供新的理论基础.
本文创新性强, 实验设计科学、合理, 对胃癌化疗的研究有一定的参考价值, 在研究方法上可以为胃肠肿瘤的治疗提供一些借鉴, 较好地反映我国及国际胃肠病学临床和基础研究的先进水平.
编辑: 田滢 电编: 鲁亚静
| 1. | Simon JA, Lange CA. Roles of the EZH2 histone methyltransferase in cancer epigenetics. Mutat Res. 2008;647:21-29. [PubMed] [DOI] |
| 2. | Shumaker DK, Dechat T, Kohlmaier A, Adam SA, Bozovsky MR, Erdos MR, Eriksson M, Goldman AE, Khuon S, Collins FS. Mutant nuclear lamin A leads to progressive alterations of epigenetic control in premature aging. Proc Natl Acad Sci U S A. 2006;103:8703-8708. [PubMed] [DOI] |
| 3. | Kamminga LM, Bystrykh LV, de Boer A, Houwer S, Douma J, Weersing E, Dontje B, de Haan G. The Polycomb group gene Ezh2 prevents hematopoietic stem cell exhaustion. Blood. 2006;107:2170-2179. [PubMed] [DOI] |
| 4. | Choi JH, Song YS, Yoon JS, Song KW, Lee YY. Enhancer of zeste homolog 2 expression is associated with tumor cell proliferation and metastasis in gastric cancer. APMIS. 2010;118:196-202. [PubMed] [DOI] |
| 5. | Balasubramanian S, Adhikary G, Eckert RL. The Bmi-1 polycomb protein antagonizes the (-)-epigallocatechin-3-gallate-dependent suppression of skin cancer cell survival. Carcinogenesis. 2010;31:496-503. [PubMed] [DOI] |
| 6. | Choudhury SR, Balasubramanian S, Chew YC, Han B, Marquez VE, Eckert RL. (-)-Epigallocatechin-3-gallate and DZNep reduce polycomb protein level via a proteasome-dependent mechanism in skin cancer cells. Carcinogenesis. 2011;32:1525-1532. [PubMed] [DOI] |
| 7. | Ben-Porath I, Weinberg RA. The signals and pathways activating cellular senescence. Int J Biochem Cell Biol. 2005;37:961-976. [PubMed] [DOI] |
| 8. | Narita M, Nũnez S, Heard E, Narita M, Lin AW, Hearn SA, Spector DL, Hannon GJ, Lowe SW. Rb-mediated heterochromatin formation and silencing of E2F target genes during cellular senescence. Cell. 2003;113:703-716. [PubMed] [DOI] |
| 9. | Roninson IB. Tumor cell senescence in cancer treatment. Cancer Res. 2003;63:2705-2715. [PubMed] |
| 10. | Nardella C, Clohessy JG, Alimonti A, Pandolfi PP. Pro-senescence therapy for cancer treatment. Nat Rev Cancer. 2011;11:503-511. [PubMed] [DOI] |
| 11. | Kang TW, Yevsa T, Woller N, Hoenicke L, Wuestefeld T, Dauch D, Hohmeyer A, Gereke M, Rudalska R, Potapova A. Senescence surveillance of pre-malignant hepatocytes limits liver cancer development. Nature. 2011;479:547-551. [PubMed] [DOI] |
| 12. | Lund AH, van Lohuizen M. Polycomb complexes and silencing mechanisms. Curr Opin Cell Biol. 2004;16:239-246. [PubMed] [DOI] |
| 13. | Chang CJ, Yang JY, Xia W, Chen CT, Xie X, Chao CH, Woodward WA, Hsu JM, Hortobagyi GN, Hung MC. EZH2 promotes expansion of breast tumor initiating cells through activation of RAF1-β-catenin signaling. Cancer Cell. 2011;19:86-100. [PubMed] [DOI] |
| 14. | Piunti A, Pasini D. Epigenetic factors in cancer development: polycomb group proteins. Future Oncol. 2011;7:57-75. [PubMed] [DOI] |
| 15. | McCord RP, Nazario-Toole A, Zhang H, Chines PS, Zhan Y, Erdos MR, Collins FS, Dekker J, Cao K. Correlated alterations in genome organization, histone methylation, and DNA-lamin A/C interactions in Hutchinson-Gilford progeria syndrome. Genome Res. 2013;23:260-269. [PubMed] [DOI] |
| 16. | Spinella F, Rosanò L, Di Castro V, Decandia S, Albini A, Nicotra MR, Natali PG, Bagnato A. Green tea polyphenol epigallocatechin-3-gallate inhibits the endothelin axis and downstream signaling pathways in ovarian carcinoma. Mol Cancer Ther. 2006;5:1483-1492. [PubMed] |
| 17. | Tang Y, Zhao DY, Elliott S, Zhao W, Curiel TJ, Beckman BS, Burow ME. Epigallocatechin-3 gallate induces growth inhibition and apoptosis in human breast cancer cells through survivin suppression. Int J Oncol. 2007;31:705-711. [PubMed] |
| 18. | Du GJ, Zhang Z, Wen XD, Yu C, Calway T, Yuan CS, Wang CZ. Epigallocatechin Gallate (EGCG) is the most effective cancer chemopreventive polyphenol in green tea. Nutrients. 2012;4:1679-1691. [PubMed] [DOI] |
| 19. | Sharma C, Nusri Qel-A, Begum S, Javed E, Rizvi TA, Hussain A. (-)-Epigallocatechin-3-gallate induces apoptosis and inhibits invasion and migration of human cervical cancer cells. Asian Pac J Cancer Prev. 2012;13:4815-4822. [PubMed] |
| 20. | Singh M, Bhui K, Singh R, Shukla Y. Tea polyphenols enhance cisplatin chemosensitivity in cervical cancer cells via induction of apoptosis. Life Sci. 2013; Feb 9. [Epub ahead of print]. [PubMed] [DOI] |
| 21. | Ray L, Kumar P, Gupta KC. The activity against Ehrlich's ascites tumors of doxorubicin contained in self assembled, cell receptor targeted nanoparticle with simultaneous oral delivery of the green tea polyphenol epigallocatechin-3-gallate. Biomaterials. 2013;34:3064-3076. [PubMed] [DOI] |
| 22. | Balasubramanian S, Eckert RL. Green tea polyphenol and curcumin inversely regulate human involucrin promoter activity via opposing effects on CCAAT/enhancer-binding protein function. J Biol Chem. 2004;279:24007-24014. [PubMed] [DOI] |
| 23. | Hernández-Muñoz I, Taghavi P, Kuijl C, Neefjes J, van Lohuizen M. Association of BMI1 with polycomb bodies is dynamic and requires PRC2/EZH2 and the maintenance DNA methyltransferase DNMT1. Mol Cell Biol. 2005;25:11047-11058. [PubMed] [DOI] |
| 24. | Agherbi H, Gaussmann-Wenger A, Verthuy C, Chasson L, Serrano M, Djabali M. Polycomb mediated epigenetic silencing and replication timing at the INK4a/ARF locus during senescence. PLoS One. 2009;4:e5622. [PubMed] [DOI] |
| 25. | Fan T, Jiang S, Chung N, Alikhan A, Ni C, Lee CC, Hornyak TJ. EZH2-dependent suppression of a cellular senescence phenotype in melanoma cells by inhibition of p21/CDKN1A expression. Mol Cancer Res. 2011;9:418-429. [PubMed] |
| 26. | Lanigan F, Geraghty JG, Bracken AP. Transcriptional regulation of cellular senescence. Oncogene. 2011;30:2901-2911. [PubMed] [DOI] |
| 27. | Bachmann IM, Halvorsen OJ, Collett K, Stefansson IM, Straume O, Haukaas SA, Salvesen HB, Otte AP, Akslen LA. EZH2 expression is associated with high proliferation rate and aggressive tumor subgroups in cutaneous melanoma and cancers of the endometrium, prostate, and breast. J Clin Oncol. 2006;24:268-273. [PubMed] [DOI] |
| 28. | Matsukawa Y, Semba S, Kato H, Ito A, Yanagihara K, Yokozaki H. Expression of the enhancer of zeste homolog 2 is correlated with poor prognosis in human gastric cancer. Cancer Sci. 2006;97:484-491. [PubMed] [DOI] |
| 29. | Gordon RR, Nelson PS. Cellular senescence and cancer chemotherapy resistance. Drug Resist Updat. 2012;15:123-131. [PubMed] [DOI] |