修回日期: 2012-12-25
接受日期: 2013-03-21
在线出版日期: 2013-04-18
目的: 探讨阻断肾素-血管紧张素-醛固酮系统不同环节抗大鼠肝纤维化的作用及其机制.
方法: 取6周龄SD大鼠50只, 随机分为正常对照组、模型组、卡托普利组、氯沙坦组和螺内酯组, 每组10只. 正常对照组皮下注射橄榄油, 其余大鼠给予40%CCl4腹壁皮下注射, 3 mL/kg, 首剂加倍, 1次/3 d, 制备大鼠肝纤维化模型; 次日, 卡托普利组给予血管紧张素转换酶抑制剂卡托普利60 mg/kg、氯沙坦组给予血管紧张素Ⅱ的Ⅰ型受体阻断剂氯沙坦10 mg/kg、螺内酯组给予醛固酮受体拮抗剂螺内酯100 mg/kg, 模型组和正常对照组给予等量的生理盐水, 1次/d, 均经胃管内灌注, 各组动物均于第8周处死, 取材, HE染色和Masson染色观察肝组织病理变化, 分别应用Real-time PCR及Western blot法检测肝组织转化生长因子β1及结缔组织生长因子mRNA和蛋白质表达情况.
结果: 与模型组相比, 卡托普利组、氯沙坦组和螺内酯组肝纤维化程度较模型组明显减轻; 肝组织转化生长因子β1及结缔组织生长因子mRNA和蛋白质表达: 模型组高于正常对照组(P<0.05); 卡托普利组、氯沙坦组、螺内酯组较模型组均显著下降(P<0.05), 卡托普利组、氯沙坦组、螺内酯组间无差异(P>0.05).
结论: 阻断肾素-血管紧张素-醛固酮系统不同环节均可抑制肝纤维化形成, 其作用机制可能与其显著抑制转化生长因子β1及结缔组织生长因子表达有关.
核心提示: 运用CCl4诱导的大鼠肝纤维化模型, 说明阻断肾素-血管紧张素-醛固酮系统不同环节对实验性大鼠肝纤维化具有抑制作用.
引文著录: 焦占江, 周杰, 崔忠林, 钱建平, 曾德华. 阻断肾素-血管紧张素-醛固酮系统不同环节抗大鼠肝纤维化的实验研究. 世界华人消化杂志 2013; 21(11): 957-962
Revised: December 25, 2012
Accepted: March 21, 2013
Published online: April 18, 2013
AIM: To observe the preventive effect of blockage of the renin-angiptensin-aldosterone system at different levels against hepatic fibrosis in rats and to explore the possible mechanisms involved.
METHODS: Fifty 6-week-old SD rats were equally randomized into five groups: normal control group, model group, captopril group, losartan group and Spironolactone group. The normal group received subcutaneous injection of olive oil, while the other groups received subcutaneous injection of CCl4 to induce hepatic fibrosis. Next day, rats of the three treatment groups were injected daily with captopril 60 mg/kg, losartan 10 mg/kg and Spironolactone 100 mg/kg, respectively, while the control group and model group were given equal volume of normal saline. All rats were sacrificed at 8 wk. Hepatic fibrosis was evaluated by hematoxylin-eosin staining and Masson staining. The expression of transforming growth factor β1 and connective tissue growth factor was assessed by real-time PCR and Western blot.
RESULTS: Compared to the model group, the progression of hepatic fibrosis was significantly inhibited in the captopril group, losartan group and spironolactone group. The expression of transforming growth factor β1 and connective tissue growth factor in liver tissue was significantly higher in the model group than in the control group (all P < 0.05), but was significantly decreased in the captopril group, losartan group and spironolactone group compared to the model group (all P < 0.05). There was no significant difference in the expression of transforming growth factor β1 and connective tissue growth factor among the three treatment groups.
CONCLUSION: Blockage of the renin-angiptensin-aldosterone system at different levels could suppress the progression of hepatic fibrosis in rats possibly via mechanisms associated with inhibition of expression of transforming growth factor β1 and connective tissue growth factor.
- Citation: Jiao ZJ, Zhou J, Cui ZL, Qian JP, Zeng DH. Preventive effect of blockage of renin-angiptensin-aldosterone system at different levels against hepatic fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2013; 21(11): 957-962
- URL: https://www.wjgnet.com/1009-3079/full/v21/i11/957.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i11.957
肝纤维化是诸多肝病共同的病理改变. 转化生长因子β1(transforming growth factor-β, TGF-β)及结缔组织生长因子(connective tissue growth factor, CTGF)在肝纤维化形成过程中起着重要的作用. 肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system, RAAS)为一内分泌系统, 具有广泛的生物学效应, 作用于全身多个器官. 除了循环系统中存在RAAS. 许多器官, 如心、肾、肺、胰腺及肝脏都存在局部或器官内的RAAS[1]. 研究表明, 肝脏局部的RAAS参与肝纤维化的发展[2]. 虽然RAAS系统在肝病中的作用及机制还没有被完全阐明, 但RAAS可能是抗肝纤维化治疗的潜在靶点.
本实验旨在通过研究阻断RAAS不同环节对CCl4诱导的肝纤维化大鼠模型的保护作用, 并对其可能机制进行探讨, 为拮抗RAAS不同环节抗肝纤维化提供实验依据.
6周龄清洁级SD大鼠(福建医科大学动物实验中心提供)50只, 雌雄不限, 体质量135-155 g, 室温20 ℃-23 ℃, 湿度50%-60%, 精制饲料喂养. 氯沙坦钾片购自杭州默沙东制药有限公司; 卡托普利片(湖南湘雅制药有限公司产品); 螺内酯片(杭州民生药业集团有限公司产品); Masson三色染色试剂盒购自福建迈新生物技术开发有限公司; TGF-β1抗体、CTGF抗体、β-actin抗体购自Abcam公司; 二抗购自Cellsignaling公司.
1.2.1 动物分组、模型制备及用药: 将50只大鼠按随机区组设计分为正常组、模型组、卡托普利组、氯沙坦组和螺内酯组, 各10只. 正常组皮下注射橄榄油, 其余大鼠予40%CCl4腹壁皮下注射, 3 mL/kg, 首剂加倍, 1次/3 d, 复制大鼠肝纤维化模型; 次日, 卡托普利组用血管紧张素转换酶抑制剂卡托普利60 mg/kg、氯沙坦组用血管紧张素Ⅱ的Ⅰ型受体阻断剂氯沙坦10 mg/kg、螺内酯组用醛固酮受体拮抗剂螺内酯100 mg/kg, 模型组和正常对照组给予等量生理盐水, 均经胃管灌注, 1次/d. 各组动物均于第8周处死, 取右肝组织, 液氮保存, 备测.
1.2.2 观察指标: (1)观察大鼠体质量、精神、饮食、活动、死亡等一般情况; (2)肝组织病理学改变: 肝组织用10%多聚甲醛固定, 常规石蜡包埋, 5 μm厚连续切片, 行HE和Massion染色. 观察肝组织病理学改变, 对肝损伤程度采用Knodell指数进行盲法比较和评分[3], 0级: 无纤维化; 1级: 汇管区纤维化; 2级: 汇管区纤维化扩大; 3级: 桥接样纤维化; 4级: 肝硬化. 大鼠肝组织切片Masson染色后, 每张切片选取四周及中央区域, 选取胶原纤维含量最多的视野, 采用HIPAS-2000型计算机图像分析系统, 通过显微摄像系统摄取图像并输入图像分析系统进行灰度的变换, 使胶原纤维着色区域与背景分开, 自动记录着色面积和总面积. 于100倍镜下测定胶原纤维面积百分比, 计算方法为: 胶原纤维面积/肝组织面积×100%.
1.2.3 Real-time PCR检测: 取100 mg冻存肝组织标本, 应用TRIzol法抽提组织总RNA. 将总RNA进行逆转录获得cDNA. 引物由Invitrogen公司合成. 序列为: TGF-β1(166 bp)上游, 5'-ACCAACTACTGCTTCAGCTCCACA-3'; 下游, 5'-TGTACTGTGTGTCCAGGCTCCAAA-3'; CTGF(153 bp)上游, 5'-TGCCTACCGACTGGAAGACACATT-3'; 下游, 5'-TCCAGCCTGCAGAAGGTATTGTCA-3'; β-actin(159 bp)上游, 5'-TTGCTGACAGGATGCAGAAGGAGA-3'; 下游, 5'-ACTCCTGCTTGCTGATCCACATCT-3'. Real time PCR反应: 根据引物序列设置扩增程序, 94 ℃ 5 min、94 ℃ 30 s、56 ℃ 30 s、72 ℃ 30 s、72 ℃ 10 min; 共40个循环. 在200 μL的灭菌离心管中加入(25 μL反应体系): 模板cDNA 0.5 μL; 上游引物0.5 μL; 下游引物0.5 μL, SYBR green supermix, 12.5 μL; 去离子水, 11 μL. 把离心管迅速放入PCR扩增仪, 按扩增程序进行PCR扩增. 数据分析采用仪器自带ABI Prism 7300 SDS Software软件分析, 基因的表达量应用2-△△Ct法计算.
1.2.4 Western blot检测: 称取50 mg组织, 加入少量PBS匀浆, 加入蛋白裂解液100 μL Rippa(含1%PMSF蛋白酶抑制剂), 4 ℃反应20 min, 然后12 000 r/min离心30 min, 收集裂解物总蛋白, 取40 μg组织蛋白行十二烷基磺酸钠一聚丙烯酰胺凝胶电泳(SDS-PAGE)并原位电转印至PVDF膜, PVDF膜用脱脂奶粉封闭1 h后, 加入1:1 000一抗孵育4 ℃过夜, 用PBS-T洗膜3次, 每次10 min, 加入二抗, 室温孵育2 h. 再用PBS-T洗膜3次, 每次5 min. 洗完膜使之稍干, 按1:1加入AB显影液(与二抗HRP结合), 在Odyssey infrared imaging system中扫描. 然后用ImageJ软件分析灰度值, 再进行计算灰度系数比.
统计学处理 采用SPSS11.0统计软件. 数据以mean±SD表示, 多组计量资料比较采用方差分析, 计以P<0.05表示差异有统计学意义.
各组大鼠无死亡, 正常对照组大鼠精神良好, 毛色光泽, 运动活泼, 反应敏锐, 进食、饮水正常, 体质量增加; 模型组大鼠精神萎靡, 活动少, 反应迟钝, 进食、饮水少, 体质量下降明显; 卡托普利组、氯沙坦组及螺内酯组大鼠精神、活动、反应、饮食、体质量均较模型组好.
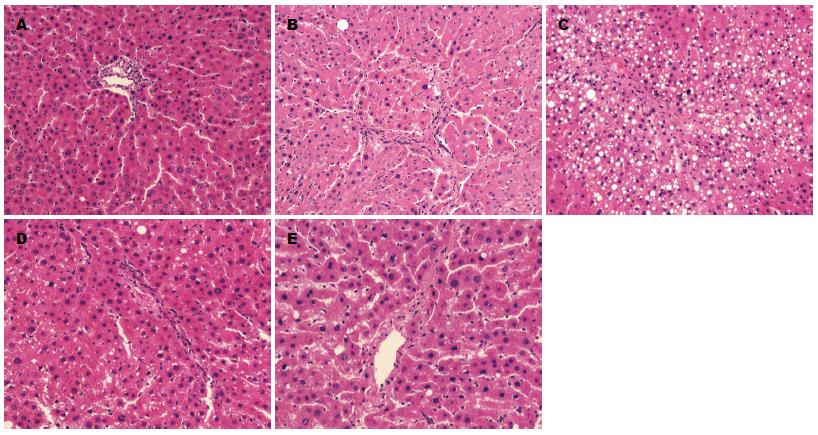
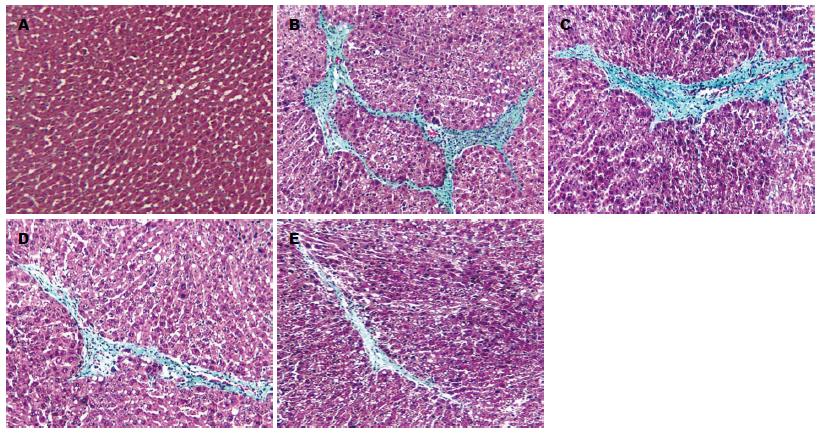
HE染色显示正常组见肝细胞以中央静脉为中心向周围呈放射状排列, 结构完整. 模型组显示肝细胞索排列紊乱, 肝细胞呈弥漫性脂肪变性, 空泡形成, 汇管区扩大, 汇管区和肝小叶内可见淋巴细胞浸润, 假小叶形成. 卡托普利组、氯沙坦组、螺内酯组治疗组见肝细胞坏死及空泡变性减少, 淋巴细胞浸润减少(图1). Masson染色可见正常组胶原纤维在血管周围少量表达, 模型组纤维增生明显, 纤维间隔形成, 可见弓形纤维, 部分区域形成假小叶, 卡托普利组、氯沙坦组、螺内酯组胶原纤维减少, 形成的纤维间隔和假小叶明显减少(图2). 各组胶原面积以及运用Knodell指数对肝纤维化程度进行评分, 结果显示, 模型组与正常对照组比较差异有统计学意义, 卡托普利组、氯沙坦组、螺内酯组同模型组比较差异有统计学意义(表1, P<0.05), 而卡托普利组、氯沙坦组、螺内酯组间无差异(P>0.05).
Real-time PCR结果分析显示, 肝纤维化模型组肝脏TGF-β1 mRNA及CTGF mRNA的表达显著高于正常对照组; 卡托普利组、氯沙坦组、螺内酯组较正常对照组增高(P = 0.000、0.004、0.000), 较模型组显著下降(P = 0.000、0.000、0.000), 卡托普利组、氯沙坦组及螺内酯组间无差异(P>0.05, 表2).
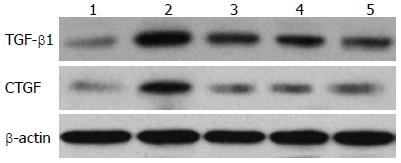
运用Western blot法检测肝脏TGF-β1及CTGF蛋白的表达, 结果显示, 肝纤维化模型组肝脏TGF-β1及CTGF的表达显著高于正常对照组; 卡托普利组、氯沙坦组、螺内酯组TGF-β1及CTGF的表达高于正常对照组(P = 0.000、0.000、0.000), 较模型组显著下降(P = 0.000、0.000、0.000), 卡托普利组、氯沙坦组、螺内酯组间无差异(P>0.05, 图3, 表2).
不同病因(如病毒、乙醇、寄生虫、铜铁沉积等)引起的慢性肝损伤最终导致以胶原为主的细胞外基质(extracellular matri, ECM)成分合成增多, 降解相对不足, 过多沉积在肝内引起肝纤维化[4,5]. 肝纤维化属可逆性病变, 肝硬化则难以逆转. 肝纤维化是肝细胞肝癌的危险因素之一[5].
传统的观念认为: RAAS是一个循环的内分泌系统, 近年陆续研究发现, 完整的RAAS生化链广泛存在于心、脑、血管、肺和肝脏等肾外组织. 且与脏器纤维化密切相关. 研究发现, 各种慢性损害因素引起肝损伤的病理过程中, 损害因素可直接或间接介导免疫病理损伤, 从而导致肝星状细胞、肝窦内皮细胞、枯否细胞以及纤维化附近的炎症细胞等分泌大量的TGF-β1; 同时TGF-β1又可活化星状细胞, 进一步促进ECM成分的合成, 同时抑制ECM的分解, 导致ECM的大量沉积, 从而引发肝纤维化的形成[6,7]. 有报道TGF-β1在肝纤维化过程中可活化肝星状细胞(hepatic stellate cell, HSC), 还可促进胶原基因的表达, 从而促进细胞外基质的合成与沉积, 是肝纤维化过程中最重的始动因子之一, TGF-β1作用涉及面广, 具有双向作用, 即其正常表达时可抑制炎症反应、抑制细胞增殖, 异常表达时可诱导细胞增殖、纤维蛋白的形成, 从而促进纤维化的发生和发展[8].
研究表明, TGF-β1在调控纤维化发生发展的中起着核心作用[9], 具有促进肝脏间质细胞分化和增殖, 增加ECM的沉积, 抑制其降解的作用[10]. TGF-β1可抑制肝细胞再生, 促其凋亡, 使肝实质细胞与间质成分比例失调, 导致肝脏外基质代谢紊乱, 在Disse间隙过度沉积. 肝脏过表达TGF-β1的转基因小鼠导致肝纤维化快速进展, 运用TGF-β1反义寡核苷酸能够显著抑制CCl4诱导的大鼠肝纤维化[11]. 因此, 通过抑制TGF-β1的合成和/或其信号传导是治疗纤维化的重要策略. 但TGF-β1在纤维化过程中并不是孤立存在和发挥作用, 而是与其他因子协同发挥作用[12,13]. 各种细胞因子网络对肝纤维化进程进行调控, 一方面影响肝星状细胞活化, 另一方面调节细胞外基质和降解平衡[14]. 既往研究表明, CTGF和TGF-β1与各种纤维化进程的关系极为密切, 两者的单独作用及协同作用对肝纤维化进程有着重大影响[15].
CTGF是一种富含半胱氨酸的蛋白质具有广泛的细胞生物学作用. 可启动一系列介导组织创伤和再生的生物学过程[16]. 在肝纤维化形成过程中, CTGF主要来源于HSC, 具有诱导HSC迁移、增殖、黏附和促进Ⅰ型胶原的表达[17]. 研究表明CTGF mRNA和蛋白表达水平与肝纤维化的程度成正相关, 而与疾病的类型无关; 有研究表明, 在肝组织中CTGF主要来源于HSC, 随着HSC由原代向活化状态转化, CTGF mRNA随着感染时间延长呈进行性上调[18]. 多项研究表明, CTGF在肝纤维化的晚期仍有高水平表达, 可能与CTGF持续的致纤维化作用密切相关[19,20]. 实验证实, CTGF抑制剂可选择性地封闭TGF-β的致纤维化负面效应[21], CTGF可能是扳动肝纤维化发生、发展的总开关[18,22].
研究表明, 运用siRNA使CTGF的表达沉默可具有防治肝纤维化的作用[23]. 结果显示, 同正常大鼠相比, CCl4诱导的肝纤维化大鼠肝脏在出现组织病理学异常的同时伴有TGF-β1和CTGF表达增高. 大量体内外研究结果表明CTGF为TGF-β1下游的纤维化活性效应分子. TGF-β1引起的CTGF表达上调在肝纤维化形成的过程中可能发挥着关键作用[24,25].
本实验运用CCl4诱导的大鼠肝纤维化模型, 结果显示卡托普利组、氯沙坦组、螺内酯组较模型组纤维化程度明显减轻, 说明阻断RAAS不同环节对实验性大鼠肝纤维化具有抑制作用. Real-time PCR和Western blot结果显示, 模型组大鼠肝脏中TGF-β1及CTGF的表达明显增强, 而卡托普利组、氯沙坦组、螺内酯组较模型组表达明显减弱, 并与肝纤维化程度相一致, 提示阻断RAAS不同环节对实验性大鼠肝纤维化的预防作用机制可能与TGF-β1和CTGF的表达减低有关.
肝纤维化是诸多肝病共同的病理改变. 转化生长因子β1(TGF-β1)及结缔组织生长因子(CTGF)在肝纤维化形成过程中起着重要的作用. 肾素-血管紧张素-醛固酮系统(RAAS)为一内分泌系统, 具有广泛的生物学效应, 研究表明, 肝脏局部的RAAS参与肝纤维化的发展.
高润平, 教授, 吉林大学第一医院肝胆胰内科; 姚鹏, 副教授, 中国人民解放军北京军区总医院全军肝病中心
TGF-β1在调控纤维化发生发展的过程中起核心作用, 促进肝脏间质细胞分化和增殖, 增加ECM的沉积, 抑制其降解; CTGF在肝纤维化的晚期仍高表达, 可能与CTGF持续的致纤维化作用密切相关. 实验证实, CTGF抑制剂可选择性地封闭TGF-β的致纤维化负面效应, CTGF可能是扳动肝纤维化发生、发展的总开关.
TGF-β1在肝纤维化过程中可活化肝星状细胞, 还可促进胶原基因的表达, 从而促进细胞外基质的合成与沉积, 是肝纤维化过程中最重的始动因子之一.
结果显示卡托普利组、氯沙坦组、螺内酯组较模型组纤维化程度明显减轻, 说明阻断RAAS不同环节对实验性大鼠肝纤维化具有抑制作用.
本文通过阻断大鼠肝纤维化模型中RAAS不同环节, 探讨该系统在肝纤维化中的作用及机制, 在国内具有一定先进性.
编辑: 翟欢欢 电编: 鲁亚静
| 1. | Bataller R, Sancho-Bru P, Ginès P, Lora JM, Al-Garawi A, Solé M, Colmenero J, Nicolás JM, Jiménez W, Weich N. Activated human hepatic stellate cells express the renin-angiotensin system and synthesize angiotensin II. Gastroenterology. 2003;125:117-125. [PubMed] [DOI] |
| 2. | Paizis G, Gilbert RE, Cooper ME, Murthi P, Schembri JM, Wu LL, Rumble JR, Kelly DJ, Tikellis C, Cox A. Effect of angiotensin II type 1 receptor blockade on experimental hepatic fibrogenesis. J Hepatol. 2001;35:376-385. [PubMed] [DOI] |
| 3. | Brunt EM. Grading and staging the histopathological lesions of chronic hepatitis: the Knodell histology activity index and beyond. Hepatology. 2000;31:241-246. [PubMed] [DOI] |
| 4. | Friedman SL. Liver fibrosis -- from bench to bedside. J Hepatol. 2003;38 Suppl 1:S38-S53. [PubMed] |
| 5. | Ginès P, Cárdenas A, Arroyo V, Rodés J. Management of cirrhosis and ascites. N Engl J Med. 2004;350:1646-1654. [PubMed] [DOI] |
| 6. | Kothary PC, Badhwar J, Weng C, Del Monte MA. Impaired intracellular signaling may allow up-regulation of CTGF-synthesis and secondary peri-retinal fibrosis in human retinal pigment epithelial cells from patients with age-related macular degeneration. Adv Exp Med Biol. 2010;664:419-428. [PubMed] [DOI] |
| 7. | Sobrevals L, Rodriguez C, Romero-Trevejo JL, Gondi G, Monreal I, Pañeda A, Juanarena N, Arcelus S, Razquin N, Guembe L. Insulin-like growth factor I gene transfer to cirrhotic liver induces fibrolysis and reduces fibrogenesis leading to cirrhosis reversion in rats. Hepatology. 2010;51:912-921. [PubMed] [DOI] |
| 8. | Ruddell RG, Hoang-Le D, Barwood JM, Rutherford PS, Piva TJ, Watters DJ, Santambrogio P, Arosio P, Ramm GA. Ferritin functions as a proinflammatory cytokine via iron-independent protein kinase C zeta/nuclear factor kappaB-regulated signaling in rat hepatic stellate cells. Hepatology. 2009;49:887-900. [PubMed] [DOI] |
| 9. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] [DOI] |
| 11. | Doh KO, Jung HK, Moon IJ, Kang HG, Park JH, Park JG. Prevention of CCl4-induced liver cirrhosis by ribbon antisense to transforming growth factor-beta1. Int J Mol Med. 2008;21:33-39. [PubMed] |
| 12. | Chu D, Luo Q, Li C, Gao Y, Yu L, Wei W, Wu Q, Shen J. Paeoniflorin inhibits TGF-beta1-mediated collagen production by Schistosoma japonicum soluble egg antigen in vitro. Parasitology. 2007;134:1611-1621. [PubMed] [DOI] |
| 13. | Huang J, Huang H, Jiao Y, Ai G, Huang T, Li L, Yu H, Ma K, Xiao F. Effect of anluohuaxian tablet combined with gamma-IFN on schistosomal liver fibrosis. J Huazhong Univ Sci Technolog Med Sci. 2009;29:53-58. [PubMed] [DOI] |
| 14. | Techau ME, Johansen MV, Aasted B, Lind P, Ornbjerg N, Oswald IP. Cytokine mRNA profiles in pigs exposed prenatally and postnatally to Schistosoma japonicum. Vet Res. 2007;38:25-36. [PubMed] [DOI] |
| 15. | Gressner OA, Lahme B, Demirci I, Gressner AM, Weiskirchen R. Differential effects of TGF-beta on connective tissue growth factor (CTGF/CCN2) expression in hepatic stellate cells and hepatocytes. J Hepatol. 2007;47:699-710. [PubMed] [DOI] |
| 17. | Gao R, Ball DK, Perbal B, Brigstock DR. Connective tissue growth factor induces c-fos gene activation and cell proliferation through p44/42 MAP kinase in primary rat hepatic stellate cells. J Hepatol. 2004;40:431-438. [PubMed] [DOI] |
| 18. | Paradis V, Dargere D, Bonvoust F, Vidaud M, Segarini P, Bedossa P. Effects and regulation of connective tissue growth factor on hepatic stellate cells. Lab Invest. 2002;82:767-774. [PubMed] |
| 19. | Paradis V, Dargere D, Vidaud M, De Gouville AC, Huet S, Martinez V, Gauthier JM, Ba N, Sobesky R, Ratziu V. Expression of connective tissue growth factor in experimental rat and human liver fibrosis. Hepatology. 1999;30:968-976. [PubMed] [DOI] |
| 20. | Yang AP, Bai YF, You H. Connective tissue growth factor: a fibrogenic master switch in fibrotic liver diseases. Chinese Hepatology. 2009;14:337-339. |
| 21. | Gressner OA, Gressner AM. Connective tissue growth factor: a fibrogenic master switch in fibrotic liver diseases. Liver Int. 2008;28:1065-1079. [PubMed] [DOI] |
| 22. | Zhou WL, Wang Y, Zhang J. Inhibitory effects of shRNA targeting CTGF in transforming growth factor β1-induced collagensynthesis in human renal tubular epithelial cells. China Journal of Modern Medicine. 2006;16:981-984. |
| 23. | Li G, Xie Q, Shi Y, Li D, Zhang M, Jiang S, Zhou H, Lu H, Jin Y. Inhibition of connective tissue growth factor by siRNA prevents liver fibrosis in rats. J Gene Med. 2006;8:889-900. [PubMed] [DOI] |
| 24. | Rachfal AW, Brigstock DR. Connective tissue growth factor (CTGF/CCN2) in hepatic fibrosis. Hepatol Res. 2003;26:1-9. [PubMed] [DOI] |
| 25. | Sun K, Wang Q, Huang XH. PPAR gamma inhibits growth of rat hepatic stellate cells and TGF beta-induced connective tissue growth factor expression. Acta Pharmacol Sin. 2006;27:715-723. [PubMed] [DOI] |