修回日期: 2013-03-04
接受日期: 2013-03-14
在线出版日期: 2013-04-08
目的: 分析内镜下胃底组织黏合剂注射治疗(gastric varices injection, GVI)术后胃底静脉曲张再出血的发生率及与肝硬化疾病相关的影响其再出血的危险因素.
方法: 回顾性分析我院2010-06/2012-04因肝硬化伴重度胃底静脉曲张住院并行首次胃底组织黏合剂治疗的患者52例. 记录其性别、年龄、肝硬化原因、是否合并肝癌、Child分级、腹水、门静脉栓塞、门静脉直径、脾静脉直径、脾脏厚度、脾脏长径、血常规、肝肾功能、凝血功能、空腹血糖(fasting blood sugar, FBs)、甲胎蛋白(alpha-fetal Protein, AFP)、Child评分、MELD评分以及内镜下静脉曲张情况等指标. 寻找其与肝硬化疾病相关的影响首次GVI术后胃底静脉曲张破裂出血(gastric variceal bleeding, GVB)可能的危险因素.
结果: 首次GVI术后胃底静脉曲张破裂再出血率34.6%, 平均再出血时间为5.5 mo±4.9 mo. Logistic回归分析表明, Child-Pugh B/C级、γ-谷氨酰转肽酶(gamma-glutamyl transpeptidase, GGT)、脾脏长径是与肝硬化疾病相关的影响GVI术后GVB的危险因素, P值分别为0.036、0.009、0.033, OR值分别为15.262、47.684、38.249, 95%CI分别为1.197-194.573、2.604-873.328、1.339-1 092.543. GGT、脾脏长径的ROC曲线下面积分别为0.773、0.704, 敏感度分别为66.7%、93.8%, 特异度分别为85.7%和52.6%.
结论: Child-Pugh B/C、GGT及脾脏长径是与肝硬化相关的影响GVI术后胃底静脉曲张再出血的危险因素.
核心提示: Child-Pugh B/C级、γ-谷氨酰转肽酶(gamma-glutamyl transpeptidase)>60.5 U/L、脾脏长径>13.25 cm是组织黏合剂注射治疗术后与肝硬化疾病相关的影响胃底静脉曲张再出血的危险因素.
引文著录: 田念念, 向慧玲, 吕洪敏, 王芳, 聂新华. 组织黏合剂治疗胃底静脉曲张术后再出血的相关因素. 世界华人消化杂志 2013; 21(10): 908-914
Revised: March 4, 2013
Accepted: March 14, 2013
Published online: April 8, 2013
AIM: To investigate the rate of re-bleeding after injection of cyanoacrylate for gastric varices in patients with large gastric varices and to identify probable risk factors for re-bleeding.
METHODS: A retrospective analysis was carried out in 52 cirrhotic patients who had large gastric varices and underwent endoscopic cyanoacrylate injection at our hospital from June 2010 to April 2012. To identify probable risk factors for re-bleeding after injection of cyanoacrylate for gastric varices, various factors were collected and analyzed, including gender, age, types of cirrhosis, coexistent hepatocellular carcinoma, Child-Pugh classification, presence of ascites, portal vein thrombosis, diameter of portal vein and spleen vein, spleen length, spleen thickness, routine blood tests, liver function tests, renal function tests, coagulation function tests, fasting blood sugar, α fetal protein, Child score, MELD score, and endoscopic variceal characteristics.
RESULTS: Recurrent bleeding occurred in 18 patients (34.62%) after initial cyanoacrylate injection, and the mean re-bleeding time was 5.5 mo ± 4.9 mo. Logistic regression analysis revealed that Child-Pugh classification, gamma-glutamyl transpeptidase (GGT) and spleen length were probable risk factors for recurrent bleeding after cyanoacrylate injection (P = 0.036, 0.009, 0.033; OR = 15.262, 47.684, 38.249; 95%CI: 1.197-194.573, 2.604-873.328, 1.339-1 092.543). The areas under ROC curve of GGT and spleen length in the diagnosis of re-bleeding were 0.773 and 0.704, with sensitivities of 66.7% and 93.8% and specificities of 85.7% and 52.6%.
CONCLUSION: Recurrent bleeding after injection of cyanoacrylate for gastric varices is affected by Child-Pugh B or C, GGT and spleen length.
- Citation: Tian NN, Xiang HL, Lv HM, Wang F, Nie XH. Factors affecting re-bleeding after injection of cyanoacrylate for gastric varices. Shijie Huaren Xiaohua Zazhi 2013; 21(10): 908-914
- URL: https://www.wjgnet.com/1009-3079/full/v21/i10/908.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i10.908
胃底静脉曲张破裂出血(gastric variceal bleeding, GVB)是肝硬化门脉高压患者较为常见的并发症. 18%-70%的门脉高压患者会发生胃底静脉曲张. 其中, 10%-36%的胃底静脉曲张患者会发生破裂出血[1]. 虽然GVB较食道静脉曲张破裂出血发生率低, 但其一旦发生出血, 病情更凶险, 如治疗不及时, 可因急性大出血发生休克而致生命危险, 死亡率高达45%-55%[2]. 在急性出血控制后, 仍有较高的再出血率. 内镜下组织黏合剂注射已被公认为治疗胃底静脉曲张出血的首选方法, 内镜诊疗规范推荐的胃底静脉曲张组织黏合剂注射治疗一般进行一次, 在疗效不满意时可以重复治疗[3]. 但影响其首次疗效的危险因素还有待进一步研究. 现对我院2010-06/2012-04 52例行胃底组织黏合剂治疗的肝硬化患者的资料进行回顾性分析, 报道如下.
收集2010-06/2012-04我院肝内科住院的肝硬化伴重度胃底静脉曲张并行内镜下组织黏合剂治疗的患者52例. 病例入选标准: 所有患者据病史、体征、实验室检查、B超、CT或肝穿刺活检证实为肝硬化, 内镜证实伴有重度胃底静脉曲张, 并行首次胃底组织黏合剂注射治疗(gastric varices injection, GVI). 排除标准: (1)内镜下仅有食道静脉曲张者; (2)胃底组织黏合剂注射联合套扎或硬化剂注射治疗者; (3)仅行内镜下胃底套扎或硬化剂注射治疗者.
1.2.1 研究指标: 查阅病历, 记录52例患者的性别、年龄、肝硬化原因、合并症(原发性肝癌HCC)、Child分级、有无腹水、门静脉血栓、门静脉直径、脾静脉直径、脾脏厚度、脾脏长径、血常规、肝肾功能、凝血功能、空腹血糖、甲胎蛋白AFP、Child评分、MELD评分以及内镜下静脉曲张情况.
1.2.2 再出血的判断: 再出血: 组织黏合剂注射治疗后72 h至静脉曲张消失前发生出血或静脉曲张消失后再发出血. 再次出血的征象: 出血控制后再次有活动性出血的表现(呕血或黑便; 收缩压降低>20 mmHg或心率增加>20次/min; 在没有输血的情况下血红蛋白含量下降>30 g/L)[3].
1.2.3 再出血原因的判断: 排胶出血: 急性出血控制后复查胃镜, 可见原注射部位排胶改变或排胶部位残留鲜血、咖啡样液体或血痂. 胃底静脉曲张再出血: (1)首次GVI术后到胃底静脉曲张消失前再出血, 出血控制后复查胃镜, 可见胃底静脉曲张仍然存在, RC(+)或胃底残留鲜血或咖啡样液体, 但无明显排胶改变; (2)胃底静脉曲张消失后再次出血, 复查胃镜可见胃底静脉曲张再次出现.
1.2.4 分组: 胃底静脉曲张再出血组: GVI术后胃底静脉曲张再出血. 未出血组: GVI术后随访期间均未发生排胶出血和胃底静脉曲张再出血.
统计学处理 单因素分析: 符合正态分布的计量资料, 变量值用mean±SD表示, 两组间比较采用独立样本t检验; 不符合正态分布的计量资料, 变量值用四分位数表示, 两组间比较采用Mann-Whitney检验; 计数资料分析采用χ2检验或Fisher确切概率法. 多因素分析: 对单因素分析有意义的计量资料, 利用ROC曲线计算Cut-off值, 依据Cut-off值赋值, 进行向前逐步Logistic回归分析, 并计算各危险因素的OR值和OR值的95%CI. 用敏感度、特异度和ROC曲线下面积评价指标价值, 一般认为ROC曲线下面积(area under the curve, AUC)>0.7时即有临床价值. 所有数据采用SPSS17.0统计软件进行分析, P<0.05为差异有统计学意义.
52例患者中男37例, 女15例, 年龄28-82岁, 平均年龄57.31岁±11.42岁. 病毒性肝硬化28例, 酒精性肝硬化8例, 原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)5例, 其他原因肝硬化11例. 随访时间3-22 mo, 平均随访时间15.3 mo±11.4 mo. 有24例患者出现术后出血, 其中排胶出血6例, 平均时间为1.5 mo±0.8 mo; 胃底静脉曲张再出血18例, 平均时间为5.5 mo±4.9 mo, 未出血患者28例.
胃底静脉曲张再出血组与未出血组患者一般情况比较(表1). 经单因素分析, 肝硬化原因(P = 0.004)、Child分级(P = 0.038)、γ-谷氨酰转肽酶(gamma-glutamyl transpeptidase, GGT)(P = 0.022)、脾脏长径(P = 0.030), 各组间差别均有统计学意义.
| 指标 | 胃底静脉曲张再出血组 | 未出血组 | P值 |
| n | 18 | 28 | |
| 性别 | 0.197 | ||
| 男(33) | 15(15/18, 83.3%) | 18(18/28, 64.3%) | |
| 女(13) | 3 | 10 | |
| 肝硬化 | 0.004 | ||
| 病毒性 | 6(6/18, 33.3%)b | 19(19/28,67.9%) | |
| 酒精性/PBC | 9 | 2 | |
| 其他 | 3 | 7 | |
| 肝癌 | 0.688 | ||
| 是 | 2(2/18, 11.1%) | 5(5/28, 17.9%) | |
| 否 | 16 | 23 | |
| Child评分 | 0.038 | ||
| A | 5(5/18 , 27.8%)a | 17(17/28, 60.7%) | |
| B/C | 13 | 11 | |
| 血栓 | 0.191 | ||
| 有 | 4(4/18, 22.2%) | 2(2/28, 7.1%) | |
| 无 | 14 | 26 | |
| 腹水 | 0.753 | ||
| 有 | 6(6/18, 33.3%) | 8(8/28, 28.6%) | |
| 无 | 12 | 20 | |
| 年龄(岁) | 55.78±9.245 | 58.64±13.262 | 0.433 |
| 白细胞(×109/L) | 4.88(2.76, 7.08) | 3.80(2.02, 6.68) | 0.333 |
| 中性粒细胞比例(%) | 68.99±9.08 | 67.12±11.43 | 0.943 |
| 血红蛋白(g/L) | 84.72±34.53 | 101.93±29.55 | 0.198 |
| 血小板计数(×109/L) | 83.50(44.75, 100.50) | 74.00(51.00, 109.50) | 0.888 |
| 凝血酶原活动度(%) | 58.67±13.67 | 58.93±12.65 | 0.456 |
| 国际标准化比值 | 1.43(1.32, 1.65) | 1.49(1.27, 1.61) | 0.678 |
| 白蛋白(g/L) | 29.53±5.68 | 32.11±6.33 | 0.111 |
| 球蛋白(g/L) | 26.30(22.25, 29.40) | 24.15(23.33, 27.13) | 0.249 |
| 丙氨酸氨基转移酶(U/L) | 24.50(17.00, 27.50) | 23(18.25, 31.50) | 0.890 |
| 天冬氨酸氨基转移酶(U/L) | 35.50(24.25, 56.00) | 31.50(27.00, 51.75) | 0.738 |
| 总胆红素(μmol/L) | 24.60(12.78, 36.90) | 21.90(13.65, 27.83) | 0.254 |
| 直接胆红素(μmol/L) | 13.95(7.25, 20.95) | 10.05(6.13, 15.50) | 0.140 |
| 碱性磷酸酶(U/L) | 74.94±31.99 | 75.11±24.06 | 0.695 |
| γ-谷氨酰转肽酶(U/L) | 84.50(31.00, 127.50)a | 37.00(21.25, 44.75) | 0.022 |
| 空腹血糖(mmol/L) | 6.46(5.62, 7.49) | 6.07(4.95, 9.17) | 0.596 |
| 甲胎蛋白(ng/mL) | 6.06(5.11, 9.00) | 7.16(4.51, 10.39) | 0.612 |
| 血尿素氮(mmol/L) | 6.25(4.41, 12.07) | 6.06(4.33, 10.95) | 0.773 |
| 血肌酐(μmol/L) | 60.50(50.50, 74.00) | 64.00(57.25, 74.75) | 0.217 |
| Child评分 | 7.50±1.79 | 6.75±1.60 | 0.157 |
| MELD评分 | 9.17±4.10 | 9.04±4.71 | 0.579 |
| 门静脉直径(cm) | 1.34±0.18 | 1.31±0.15 | 0.940 |
| 脾静脉直径(cm) | 1.04±0.35 | 1.02±0.28 | 0.900 |
| 脾脏厚度(cm) | 5.84±1.17 | 5.34±0.91 | 0.109 |
| 脾脏长径(cm) | 15.60(13.50, 17.85)a | 13.20(12.30, 15.40) | 0.030 |
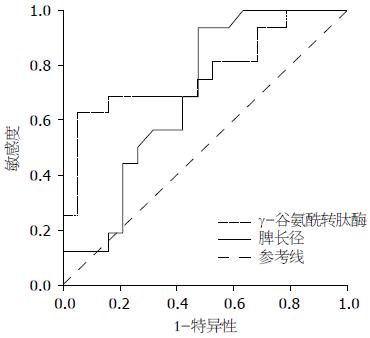
选取两组间有统计学意义的连续性变量指标, 绘制ROC曲线(图1), 得出相应AUC, 以最靠近左上角的点(敏感性与特异性之和最大)作为最适临界点, 即Cut-off值(表2).
| 指标 | 曲线下面积 | Cut-off值 | 敏感性(%) | 特异性(%) | 阳性预测值(%) | 阴性预测值(%) |
| γ-谷氨酰转肽酶 | 0.773 | 60.50 U/L | 66.7 | 85.7 | 75.0 | 80.0 |
| 脾脏长径 | 0.704 | 13.25 cm | 93.8 | 52.6 | 62.5 | 90.9 |
为排除混杂因素影响, 据Cut-off值对上述指标赋值(表3), 采用逐步向前Logistic回归分析, 寻找GVI术后与肝硬化疾病相关的影响胃底静脉曲张破裂再出血的可能危险因素, 有意义的危险因素(表4).
| 指标 | 变量名 | 赋值说明 |
| 肝硬化原因 | X1 | 病毒性 = 1; 酒精性/PBC = 2; 其他 = 3 |
| Child分级 | X2 | Child A级 = 1; Child B/C级 = 2 |
| γ-谷氨酰转肽酶(U/L) | X3 | ≤60.5 U/L = 0; > 60.5 U/L = 1 |
| 脾脏长径(cm) | X4 | ≤13.25 cm = 0; >13.25 cm = 1 |
| 胃底静脉曲张破裂再出血 | Y | GV再出血 = 1; 未出血 = 0 |
| 指标 | 回归系数(B) | 回归系数标准误 | Wald值 | P值 | Exp(B) | Exp(B)的95%CI |
| Child分级 | 2.725 | 1.299 | 4.404 | 0.036 | 15.262 | (1.197, 194.573) |
| γ-谷氨酰转肽酶 | 3.865 | 1.484 | 6.786 | 0.009 | 47.684 | (2.604, 873.328) |
| 脾长径 | 3.644 | 1.710 | 4.540 | 0.033 | 38.249 | (1.339, 1 092.543) |
胃底静脉曲张是肝硬化门脉高压患者上消化道出血的重要原因. 虽然较食道静脉曲张破裂出血少见, 但是GVB病情凶险、治疗困难、具有较高的复发出血率和死亡率. 目前, GVB的治疗手段有药物治疗、三腔二囊管压迫止血、内镜治疗(组织黏合剂治疗、凝血酶治疗、硬化剂治疗、套扎)、经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt, TIPS)、经静脉逆行球囊闭塞术(balloon-occluded retrograde transvenous obliteration, BRTO)、胃冠状静脉栓塞术(percutaneous transhepatic variceal embolization, PTVE)、脾动脉栓塞术及外科手术治疗. 与其他治疗方法相比, 内镜治疗具有操作简便、并发症少的优点而广泛应用于临床. 美国肝脏研究学会、美国消化内镜协会、欧洲肝脏研究协会都推荐组织黏合剂注射治疗作为胃底静脉曲张出血的一线治疗方法[4-6].
目前常用的组织黏合剂是氰基丙烯酸盐, 注射到血管里接触到血液时会在数秒内发生聚合反应, 形成固体, 并在固体的黏合剂外面形成一层膜, 使黏合剂与血管完全隔离开, 从而闭塞血管[7]. 自1986年德国的Soehendra等报道组织黏合剂治疗胃底静脉曲张以来, 国内外研究均证实组织黏合剂注射治疗胃底静脉曲张出血是一种有效的、较为安全的方法[8,9]. 但其术后复发出血一直是临床医生关注的问题. 固体黏合剂在血管最薄弱的地方, 穿破血管, 排入胃腔(俗称: 排胶). 已有研究表明, 86.1%的患者在术后1 mo内排胶, 排胶出血率为6.2%, 且排胶出血量一般不大[10]. 因此, 有必要对GVI术后胃底静脉曲张导致的再出血加以重视. 我们主要从肝硬化疾病的角度分析影响GVI术后胃底静脉曲张再出血的危险因素, 排胶出血未纳入本研究中.
组织黏合剂治疗术后胃底静脉曲张再出血率8%-37%[11,12]. 本研究中, GVI术后胃底静脉曲张破裂再出血患者18例, 再出血率34.6%, 与文献报道一致. 再出血的平均时间为5.5 mo±4.9 mo. 通过再出血组与未出血组单因素分析发现, Child B/C级、GGT、脾脏长径, 两组间差别有统计学意义, 且通过Logistic回归分析, 去除了混杂因素的影响. 而肝硬化原因、门静脉栓塞、合并肝癌、血小板计数、腹水等在本研究中未发现与GVI术后胃底静脉曲张再出血有必然联系.
美国肝病学会肝硬化食管胃底静脉曲张及出血诊治指南中指出, 肝硬化伴胃食管静脉曲张与肝病的严重程度有关, Child C级患者85%并发静脉曲张. 失代偿期肝硬化(Child B/C级)为胃静脉曲张出血的高危因素之一[4]. Paik等[13]对110例胃底静脉曲张出血患者组织黏合剂治疗的研究发现, 肝功能Child C级是GVI术后再出血的危险因素(OR = 7.4; 95%CI: 2.0-27.0). Wu等[14]研究GVI术后胃底静脉曲张再出血及生存率的Meta分析中发现, Child B/C级是影响胃底静脉曲张再出血的危险因素, OR值为2.72; 95%CI为1.53-4.84. 本研究显示, 肝功能Child B、C级较Child A级更易复发出血, OR值15.262, 95%CI为(1.197, 194.573). 与文献报道一致. GVI术前、术后对患者肝功能进行合理评估、积极预防和治疗是有必要的, 可能会降低术后胃底静脉曲张再出血率.
静脉曲张出血是肝硬化门脉高压直接引起的并发症. 脾大是门脉高压的重要体征. Hayashi等[15]研究表明, 脾脏体积是预测门脉高压存在的敏感指标. 在门静脉压力为250 mm H2O时, ROC的AUC为0.926, 具有较可靠的诊断意义. Min等[16]研究表明, 脾脏体积是预测胃底静脉曲张最有力的指标. 在本研究中, 胃底静脉曲张破裂再出血组的脾脏长径大于未出血组的脾脏长径. 多元Logistic回归分析表明, 脾脏长径是GVI术后胃底静脉曲张再出血的危险因素, OR值为38.249, 95%CI为1.339-1092.543, 灵敏度为93.8%, 特异度为52.6%, ROC的AUC为0.704, 具有一定的临床价值. 对脾脏长径>13.25 cm的GVI术后患者, 发生胃底静脉曲张破裂再出血的阳性预测值为62.5%, 阴性预测值为90.9%, 正确率为71.4%. 在临床上, 可通过B超、CT测量脾脏长径、厚度等评价脾脏大小, 且为非侵入性方法, 简单易行. 因此, 脾脏长径可能成为临床工作中预测GVI术后胃底静脉曲张再出血的一项监测指标.
GGT是一种含巯基的糖蛋白, 与氨基酸转运和机体内解毒过程密切相关. 酒精可损伤肝细胞, 使细胞膜上GGT释放入血引起血清GGT升高; 还可通过诱导微粒体酶使GGT升高[17]. 另外, GGT的升高还与肝内胆汁淤积有关[18]. 2007年美国肝病学会肝硬化食管胃底静脉曲张及出血诊治指南中指出, 胆汁性肝硬化患者静脉曲张及出血发生较早, 甚至发生在肝硬化之前[4]. 本研究提示, GGT是预测GVI术后胃底静脉曲张再出血的危险因素之一, 其OR值为47.684, 95%CI为2.604-873.328, 灵敏度为66.7%, 特异度为85.7%, ROC的AUC为0.773, 具有一定的可靠性. 经Logistic回归分析发现, 肝硬化原因不是GVI术后胃底静脉曲张破裂再出血的独立危险因素. 但是, 与酒精性肝硬化和原发性胆汁性肝硬化相关的指标GGT则是GVI术后再出血的独立危险因素. 对GGT>60.5 U/L的GVI术后患者, 发生胃底静脉曲张破裂再出血的阳性预测值为75%(12/16), 阴性预测值为80%(24/30), 正确率为78.3%(26/46). 因此, 在临床工作中, 对于GGT>60.5 U/L的酒精性或原发性胆汁性肝硬化患者, 应积极预防GVI术后再出血.
血清中的GGT主要来自肝Kupffer细胞和胆管, 在一些分化或致癌的病理生理条件下, 其活动水平会发生改变[19]. HCC时, 癌细胞的逆分化作用可诱导肝细胞生成GGT, 同时肝癌细胞也会合成GGT, 因而肝癌患者GGT异常升高[20]. GGT在原发性肝癌中表达水平增高, 阳性率为85.7%, 敏感性为90%[18]. 因此, GGT可能成为合并胃底静脉曲张的肝癌患者GVI术后胃底静脉曲张破裂再出血风险的预测指标. Paik等[13]研究表明, HCC是预测GVI术后再出血的危险因素, OR值为3.3, 95%CI为1.0-11.1. Chang等[21]研究表明, 合并HCC的胃底静脉曲张患者预后较差. GVB前后2 mo诊断的原发性肝癌患者, 5、30 d发生门脉高压相关再出血的比例分别为23.5%、76.0%. 黄丽芳等[19]研究表明, 高水平的GGT与原发性肝癌患者的门静脉栓塞相关. Wu等[14]研究表明, 晚期肝癌患者的门静脉栓塞是影响胃底静脉曲张复发出血的危险因素. 本研究中包括原发性肝癌患者7例, 门静脉栓塞患者6例. 研究发现, 原发性肝癌、门静脉栓塞不是影响GVI术后再出血的危险因素, 可能与样本量较小, 合并肝癌、门静脉栓塞的患者较少有关. 但是, 与HCC及HCC患者的门静脉栓塞相关的GGT则是GVI术后胃底静脉曲张破裂再出血的危险因素. 因此, 对肝硬化伴胃底静脉曲张患者进行有关HCC的详细检查、监测和随访是有必要的, 对合并胃底静脉曲张的HCC患者注意监测并控制GGT水平, 有可能会降低GVI术后胃底静脉曲张破裂再出血的发生率.
总之, Child-Pugh B/C级、GGT>60.5 U/L、脾脏长径>13.25 cm是与肝硬化疾病相关的影响组织黏合剂注射治疗术后胃底静脉曲张再出血的危险因素. 在临床工作中, 对GVI的肝硬化患者, 应根据其危险因素进行合理评价, 预测术后胃底静脉曲张破裂再出血率的可能性, 并在治疗前进行合理的干预; 对术后再出血的高危人群, 应积极随访监测, 并采取各种可能的措施加以预防.
虽然本研究已排除混杂因素的影响, 但所纳入的观察指标并不能覆盖所有与肝硬化疾病相关的影响因素, 因此还有待进一步扩大样本量和开展临床对照, 且本研究为回顾性研究, 对病例的选择可能存在一定的偏倚, 对相关结论仍需进一步探讨.
胃底静脉曲张破裂出血(GVB)是肝硬化患者上消化道出血的重要原因, 组织黏合剂注射治疗已被国内外公认为首选的治疗方法, 具有疗效确切, 并发症少的特点, 但其术后仍有较高的再出血率. 因此, 研究影响其术后再出血的危险因素, 进一步指导临床治疗是有必要的.
陈海龙, 教授, 大连医科大学附属第一医院院办
目前, 对于胃底静脉曲张再出血的危险因素的研究主要集中在肝静脉压力梯度、胃底曲张静脉直径大小以及是否合并红色征等方面, 本文旨在通过血液学、影像学等无创性检查, 探索其与肝硬化疾病相关的危险因素.
Hayashi等研究表明, 脾脏体积是预测门脉高压存在的敏感指标. 在门静脉压力为250 mm H2O时, ROC的曲线下面积为0.926, 具有较可靠的诊断意义.
本研究通过血液学、影像学等无创性检查方法对术后患者随访, 发现Child分级、γ-谷氨酰转肽酶及脾脏长径可作为组织黏合剂治疗胃底静脉曲张患者的术后随访检测指标, 对预防再出血有一定的临床价值.
本研究对组织黏合剂治疗胃底静脉曲张术后患者进行随访, 发现无创性方法的某些检测指标也可对术后再出血的预测有一定临床价值.
组织黏合剂: 一种α-氰基丙烯酸酯同系物经改性而制成的快速医用人体组织胶. 其与组织相容性好, 黏合强度高, 具有止血、止痛、保护创面、抑制细菌、预防感染、促进愈合等特点.
本文是对组织黏合剂注射术后胃底静脉曲张再出血肝脏相关危险因素的分析, 有一定的学术意义和临床指导价值. 指标选用比较全面, 分析方法比较合理, 结果可信.
编辑: 田滢 电编:闫晋利
| 1. | Kang EJ, Jeong SW, Jang JY, Cho JY, Lee SH, Kim HG, Kim SG, Kim YS, Cheon YK, Cho YD. Long-term result of endoscopic Histoacryl (N-butyl-2-cyanoacrylate) injection for treatment of gastric varices. World J Gastroenterol. 2011;17:1494-1500. [PubMed] [DOI] |
| 2. | Saad WE, Darcy MD. Transjugular Intrahepatic Portosystemic Shunt (TIPS) versus Balloon-occluded Retrograde Transvenous Obliteration (BRTO) for the Management of Gastric Varices. Semin Intervent Radiol. 2011;28:339-349. [PubMed] [DOI] |
| 4. | Garcia-Tsao G, Sanyal AJ, Grace ND, Carey W. Prevention and management of gastroesophageal varices and variceal hemorrhage in cirrhosis. Hepatology. 2007;46:922-938. [PubMed] [DOI] |
| 5. | Qureshi W, Adler DG, Davila R, Egan J, Hirota W, Leighton J, Rajan E, Zuckerman MJ, Fanelli R, Wheeler-Harbaugh J. ASGE Guideline: the role of endoscopy in the management of variceal hemorrhage, updated July 2005. Gastrointest Endosc. 2005;62:651-655. [PubMed] [DOI] |
| 6. | de Franchis R. Revising consensus in portal hypertension: report of the Baveno V consensus workshop on methodology of diagnosis and therapy in portal hypertension. J Hepatol. 2010;53:762-768. [PubMed] [DOI] |
| 9. | Choudhuri G, Chetri K, Bhat G, Alexander G, Das K, Ghoshal UC, Das K, Chandra P. Long-term efficacy and safety of N-butylcyanoacrylate in endoscopic treatment of gastric varices. Trop Gastroenterol. 2010;31:155-164. [PubMed] |
| 11. | Chang YJ, Park JJ, Joo MK, Lee BJ, Yun JW, Yoon DW, Kim JH, Yeon JE, Kim JS, Byun KS. Long-term outcomes of prophylactic endoscopic histoacryl injection for gastric varices with a high risk of bleeding. Dig Dis Sci. 2010;55:2391-2397. [PubMed] [DOI] |
| 12. | Mosca I, Ligorría R, Tufare F, Villaverde A, Baldoni F, Martínez H, Chopita N. [N-butyl-2-cyanoacrylate for the treatment of gastric varices]. Acta Gastroenterol Latinoam. 2012;42:27-32. [PubMed] |
| 13. | Paik CN, Kim SW, Lee IS, Park JM, Cho YK, Choi MG, Chung IS. The therapeutic effect of cyanoacrylate on gastric variceal bleeding and factors related to clinical outcome. J Clin Gastroenterol. 2008;42:916-922. [PubMed] [DOI] |
| 14. | Wu CY, Yeh HZ, Chen GH. Pharmacologic efficacy in gastric variceal rebleeding and survival: including multivariate analysis. J Clin Gastroenterol. 2002;35:127-132. [PubMed] |
| 15. | Hayashi H, Beppu T, Okabe H, Nitta H, Imai K, Doi K, Chikamoto A, Baba H. Combined measurements of serum bile acid level and splenic volume may be useful to noninvasively assess portal venous pressure. J Gastroenterol. 2012;47:1336-1341. [PubMed] [DOI] |
| 16. | Min YW, Bae SY, Gwak GY, Paik YH, Choi MS, Lee JH, Paik SW, Yoo BC, Koh KC. A clinical predictor of varices and portal hypertensive gastropathy in patients with chronic liver disease. Clin Mol Hepatol. 2012;18:178-184. [PubMed] [DOI] |
| 21. | Chang CJ, Hou MC, Liao WC, Lee FY, Lin HC, Lee SD. Risk factors of early re-bleeding and mortality in patients with ruptured gastric varices and concomitant hepatocellular carcinoma. J Gastroenterol. 2012;47:531-539. [PubMed] [DOI] |