修回日期: 2013-01-11
接受日期: 2013-02-20
在线出版日期: 2013-04-08
目的: 探讨抑制/激活蛋白(repressor/activator protein, Rap1)对肝癌细胞凋亡的影响及其作用机制.
方法: 肝癌细胞HepG2实验分组为: Rap1 miRNA转染组、空质粒组、对照组(空白对照组). 用流式细胞仪检测各组肝癌细胞凋亡率. 采用Western blot检测各组细胞中Rap1的表达,用逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)检测核因子κB(nuclear factor-κB, NF-κB)p65的表达.
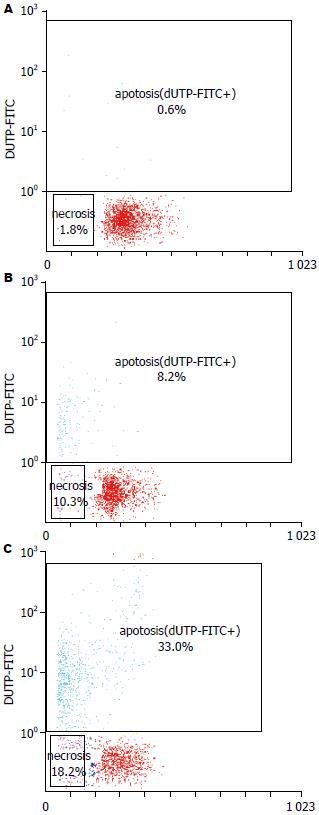
结果: 流式细胞仪检测结果提示, 转染后72 h, Rap1 miRNA组肝癌细胞凋亡率, 比空质粒组和对照组高(33.0%±5.8% vs 8.2%±2.5%, 0.6%±0.2%, P<0.05). Rap1 miRNA转染组中Rap1, NF-κB p65表达下降.
结论: miRNA干扰Rap1能促进肝癌细胞凋亡. 同时伴有NF-κB p65表达下降.
核心提示: 原发性肝细胞癌是危害人类健康的重大疾病之一, 在世界范围内是位居第6位的常见肿瘤. 原发性肝癌的发生发展与凋亡障碍存在密切的联系. 现有研究表明, 端粒结合蛋白和一些肿瘤细胞的凋亡障碍有关. 抑制/激活蛋白(repressor/activator protein, Rap1)是端粒遮蔽蛋白的成分之一. 然而, Rap1在原发性肝癌发生、发展中的作用, 文献中鲜有报道. 本研究探讨Rap1在原发性肝癌细胞凋亡调节中的作用及其作用机制, 分析针对Rap1的靶向治疗对原发性肝癌的治疗价值.
引文著录: 甘平, 查勇, 姚乾, 陈真, 谭晶. miRNA干扰Rap1对肝癌细胞凋亡的影响. 世界华人消化杂志 2013; 21(10): 894-898
Revised: January 11, 2013
Accepted: February 20, 2013
Published online: April 8, 2013
AIM: To investigate the role of repressor/activator protein 1 (Rap1) in nuclear factor-κB (NF-κB)-mediated apoptosis of liver cancer cells.
METHODS: Hepatocellular carcinoma HepG2 cells were divided into three groups: control group, empty plasmid-transfected group, and Rap1 miRNA group. Apoptosis was determined by flow cytometry 72 h after transfection. The expression of Rap1 protein was measured by Western blot, and the expression of NF-κB p65 mRNA was measured by RT-PCR.
RESULTS: Compared to the control group and empty plasmid-transfected group, the level of Rap1 was significantly decreased and apoptosis rate (33.0% ± 5.8% vs 8.2% ± 2.5%, 0.6% ± 0.2%, both P < 0.05) was significantly increased 72 h after miRNA transfection. Cells in the Rap1 miRNA group had a significant reduction in the level of NF-κB p65 mRNA compared to controls.
CONCLUSION: Rap1 miRNA increases apoptosis in hepatocellular carcinoma cell line HepG2 by decreasing the expression of NF-κB p65.
- Citation: Gan P, Zha Y, Yao Q, Chen Z, Tan J. miRNA interference-mediated Rap1 gene silencing increases apoptosis in hepatocellular carcinoma cell line HepG2. Shijie Huaren Xiaohua Zazhi 2013; 21(10): 894-898
- URL: https://www.wjgnet.com/1009-3079/full/v21/i10/894.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i10.894
有效的DNA修复是肿瘤细胞对治疗产生耐受的一个重要原因[1]. 端粒是位于染色体末端的DNA-蛋白结构, 由TTAGGG重复序列和大量的端粒结合蛋白组成[1,2]. 遮蔽蛋白是端粒中的重要结构之一, 他由6个端粒结合蛋白构成: 端粒重复序列结合因子1(telomeric repeat binding factor 1, TRF1)、TRF2、端粒保护蛋白1(protection of telomeres protein 1, POT1)、端粒重复序列结合因子1相互作用核因子2(TRF1 interacting nuclear factor 2, TIN2)、三肽肽酶(tripeptidyl peptidase1, TPP1)和抑制/激活蛋白(repressor/activator protein, Rap1), 遮蔽蛋白复合体起着保护端粒的作用[3,4]. Rap1亦称为端粒重复序列结合因子2相互作用蛋白, 是端粒遮蔽蛋白中的重要成员之一[5,6]. 有研究发现端粒酶活性与肿瘤凋亡、肿瘤的发展、化学治疗耐受存在密切的关系[7-12]. 但有关Rap1与肝癌细胞及凋亡关系的报道较少. 在本研究中我们研究Rap1表达与肝癌细胞凋亡耐受的影响, 为探索有效的肝癌生物治疗的分子靶点提供实验依据.
宿主菌大肠埃希菌DH5α、Rap1 miRNA(Invitrogen公司合成提供, Gene ID: 54386)、HepG2细胞株购自中科院上海细胞库; Rap1引物由上海生工生物公司合成(表1); 高糖DMEM培养基(Dulbecco's Modified Eagle Medium, DMEM)、胎牛血清购自Hyclone公司; Tunel细胞凋亡检测试剂盒、两步法逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)试剂盒购自Invitrogen公司; 转染载体pcDNA6. 2-GW/EmGFP-miR(Invitrogen, Catalog no. K4936-00), 壮观霉素(Sigma, Catalog no. S4014, 培养基中的终浓度50 μg/mL), Western bolt检测一抗: RAP1(Santa公司、60 kDa、mouse)、β-actin(Abmart公司、43 kDa、mouse); 二抗: Goat anti-rabbit and mouse IgG-HRP(Abmart公司); RNA抽提液TRIzol、一步法RT-PCR试剂盒购自Invitrogen公司.
| 目的基因 | 引物序列 |
| β-actin | 5'-TTAGCTCTCGCGCTACTCCTCTC-3' |
| 3'-GTCGGATTGATGAAACCCAGACACA-5' | |
| NF-κB p65 | 5'-GGGAAGGAACGCTGTCAGAG-3' |
| 3'-TAGCCTCAGGGTACTCCATCA-5' |
1.2.1 分组: HepG2肝癌细胞为研究对象, 按照处理因素的不同实验分组为: Rap1 miRNA转染组、空质粒组、对照组(空白对照组), 采用脂质体2000转染.
1.2.2 细胞培养: 采用高糖DMEM培养(Hyclone公司), 培养液中含100 mL/L的胎牛血清, 置入含50 mL/L CO2的培养箱中, 温度为37 ℃.
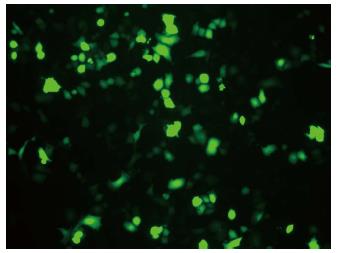
1.2.3 细胞转染: 待HepG2细胞成对数期生长时, 用0.25%胰酶消化、铺板于6孔板中, 每孔细胞数约2×105个, 采用含10% 0 mL/L胎牛血清的培养液培养, 待细胞生长至满60%-80%视野时, 开始转染试验. 以脂质体2000为载体, 具体操作步骤按照Invitrogen公司提供的实验方案. 转染后72 h在荧光倒置显微镜下观察绿色荧光, 评估转染效率.
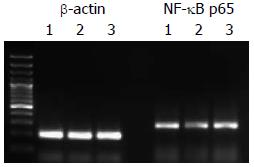
1.2.4 采用Western blot检测miRNA干扰后Rap1的表达: 收集各组细胞, 裂解细胞并提取蛋白, 取30 μg总蛋白行12%聚丙烯酰胺凝胶电泳, 电转移至聚偏二氟乙烯膜上, 5%脱脂奶粉封闭1 h后, RAP1鼠抗人单克隆抗体(1:300稀释)4 ℃过夜. TBST洗膜后, 加辣根过氧化物酶标记的二抗(1:5 000稀释)室温温育1 h. 同时以β-actin为参照: 转膜后蛋白先与β-actin一抗(1:1 000稀释)反应, 再与其相应二抗(1:5 000稀释)反应. TBST洗膜后, ECL增强发光, X线曝光1-5 min. 测定条带的吸光度代表蛋白表达强度, RAP1蛋白相对表达水平.
1.2.5 流式细胞仪检测肝癌细胞的凋亡: 收集72 h各组细胞, 将细胞先用冷PBS洗涤. 用Tunel细胞凋亡检测试剂盒检测细胞凋亡率, 按试剂盒提供的方法进行染色, 加入含有10 μg/mL PI和0.1% RNase A的PBS液500 μL, 室温避光染色30 min后上流式细胞仪测定细胞周期及凋亡率. 流式细胞仪检测细胞凋亡率.
1.2.6 采用RT-PCR检测miRNA干扰后核因子κB p65的表达: 采用TRIzol法提取各组细胞总RNA, 总 RNA紫外分光光度计测A260、A280值, 标本的总RNA的A260/A280值均在1.6-1.8之间. RNA产物暂时保存于-80 ℃冰箱或直接用于RT-PCR实验.
按照Invitrogen一步法RT-PCR试剂盒设置反应体系. PCR反应条件, 核因子κB(nuclear factor-κB, NF-κB)p65的反应参数为94 ℃ 45 s, 55 ℃ 45 s, 72 ℃ 45 s, 32循环, 最后72 ℃ 10 min(扩增产物长为204 bp); β2-actin的反应参数为94 ℃ 45 s, 55.5 ℃ 45 s, 72 ℃ 45 s, 32循环, 最后72 ℃ 10 min(扩增产物长为264 bp).
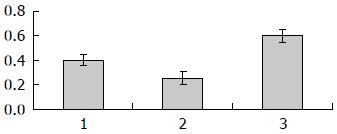
将PCR产物电泳后, 用美国Gene-Genus凝胶电泳成像系统对DNA电泳条带进行光密度β扫描, 以目标基因与β-actin的密度比值作为目标基因表达水平的参数.
统计学处理 采用SPSS11.0统计软件, 计量资料用mean±SD表示, 两样本均数比较采用成组t检验, 计数资料比较采用χ2检验. P<0.05认为具有统计学意义.
pcDNA6.2-GW/EmGFP-miR转染细胞, 倒置荧光显微镜下观察细胞, 约80%以上的细胞发出较强的绿色荧光(图1).
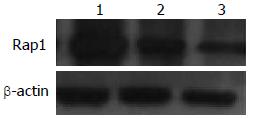
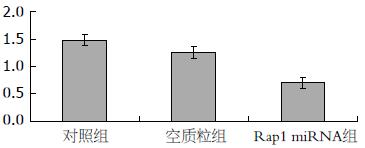
为了观察脂质体转染Rap1 miRNA的效率, 我们采用Western blot检测Rap1 miRNA转染后72 h Rap1的表达,并与对照组、空质粒组比较. 结果显示, Rap1 miRNA组Rap1表达量比对照组及空质粒组显著降低. 提示Rap1 miRNA达到了对Rap1转录的有效抑制(图2, 3).
为了检测Rap1 miRNA对肝癌细胞HepG2凋亡的影响, 我们采用流式细胞仪检测各组肝癌细胞的凋亡率. 结果提示, Rap1 miRNA组肝癌细胞凋亡率, 比空质粒组和对照组高(33.0%±5.8% vs 8.2%±2.5%, 0.6%±0.2%, P<0.05, 图4).
为了进一步的明确Rap1对肝细胞癌凋亡的调节与NF-κB转录因子的关系, 我们采用RT-PCR检测NF-κB p65的表达. 结果显示, Rap1 miRNA转染组中NF-κB p65表达下降, 与对照组相比, 差异具有显著性. 本研究结果提示, Rap1 miRNA促进肝癌细胞的凋亡可能是通过下调NF-κB p65表达而发挥生物学效应(图5, 6).
近年来研究表明, 端粒和端粒酶在肿瘤的发生和发展中起着重要的作用, 端粒酶的激活是恶性肿瘤发生学上的一个共同途径, 而端粒酶则是各种恶性肿瘤细胞一个共同的分子标志物[13]. 亦有研究发现端粒和端粒酶参与肿瘤细胞的凋亡调节[7,14]. 遮蔽蛋白是一种重要的端粒酶复合物, 他由6种蛋白复合物构成, 亚单元TRF1独立的结合于TTAGGG重复序列, POT1识别悬挂于端粒末端的短链序列, TPP1、TIN2和Rap1在其中起着连接的作用, 同时具有保护DNA避免损伤和促进损伤DNA末端修复的功能[3,14]. Rap1是遮蔽蛋白的亚单元之一, 可与TRF2相互作用. Rap1在防止染色体端粒再结合、可防止姐妹染色单体互换、断裂中起着重要的作用, Rap1过度表达时可导致端粒延长[14]. 亦有发现Rap1同时具有端粒和非端粒功能, 与乳腺癌等肿瘤细胞的凋亡调节有关[15].
现有研究表明Rapl在一些肿瘤中表达增加, 与肿瘤分级及患者预后存在密切的关系. 在Teo等[16]的研究中, 作者采用免疫组织化学和组织芯片技术观察Rap1在乳腺癌中的表达, 结果显示在非肿瘤组织中阴性表达, 在肿瘤组织中有较高的阳性表达率, 在浸润性导管癌中的阳性表达率为96%, 在浸润性小叶癌中的阳性表达率为100%, 与肿瘤周围组织存在显著的差异, P<0.01. 而且Rap1的表达强度与浸润性导管癌的分级成正相关. Bailey等[17]的研究表明, Rap1可促进前列腺癌的进展和转移, 采用miRNA抑制Rap1A后, 前列腺癌细胞的侵袭、迁移能力受到抑制. 在本研究中我们发现, 采用Rapl miRNA抑制Rapl表达后肝癌细胞凋亡率增加, 表明Rapl具有抑制肿瘤细胞凋亡的功能.
Martinez等[14]的研究表明Rap1同时具有端粒和非端粒功能, 位于端粒中Rap1可调节端粒的功能, 位于细胞浆中的Rap1与基因的转录有关, 端粒的长度可影响端粒结合Rap1和细胞浆中Rap1比例. 最近亦有研究采用免疫共沉淀的方法发现Rap1存在IKK复合物中, Teo等[16]的研究发现, 抑制Rap1和IκB激酶2(IκB Kinase 2, IKK2)均可导致等比例的p65磷酸化水平降低, 同时增加肿瘤坏死因子诱导MCF7凋亡的敏感性. 抑制Rap1和IKK2可产生同等强度的凋亡效应, 抑制Rap1同时可降低乳腺癌细胞的侵袭性. Guo等[18]研究表明在肝癌细胞株HepG2中顺铂可诱导NF-κB p65和hTERT的表达增加, 同时伴有端粒酶活性及NF-κB活性增强. 抑制hTERT和NF-κB均可使肝癌的化疗敏感性增强. 以上研究提示, Rap1在肿瘤凋亡调节中的作用可能与NF-κB转录因子有关. 我们的结果显示, Rap1 miRNA转染组中NF-κB p65表达下降, 与对照组相比, 差异具有显著性. 本研究结果提示, Rap1 miRNA促进肝癌细胞的凋亡可能是通过下调NF-κB p65表达而发挥生物学效应.
总之, 抑制Rap1可提高肝癌细胞增加凋亡率, 提示Rap1是原发性肝癌中有意义的生物治疗靶点, 其机制与NF-κB转录因子有关.
肝癌细胞的凋亡是一个多基因参与的复杂的调控体系, 当促凋亡基因与抑制凋亡基因失去正常的调控导致肿瘤的发生与发展. 端粒酶是一种蛋白与小分子RNA组成的核糖核酸酶,与细胞周期和肿瘤凋亡基因表达关系密切.
陈海龙, 教授, 大连医科大学附属第一医院院办
抑制/激活蛋白(Rap1)是端粒酶中遮蔽蛋白的重要成员之一, 最近研究发现Rap1存在IκB激酶复合物中. 然而端粒与核因子κB(NF-κB)对肝癌细胞凋亡调节的关系尚未完全明确.
Teo等的研究发现, 抑制Rap1和IκB激酶2均可导致等比例的p65磷酸化水平降低, 同时增加TNF-α诱导MCF7凋亡的敏感性.
本研究结果显示, 抑制Rap1表达可促进肝癌细胞凋亡, 伴有NF-κB p65表达下降.
Rap1是原发性肝癌中有意义的生物治疗靶点, 其作用机制与NF-κB转录因子有关.
Rap1: 亦称为端粒重复序列结合因子2相互作用蛋白, 是端粒遮蔽蛋白中的重要成员之一, 其与肿瘤凋亡、肿瘤的发展、化学治疗耐受存在密切的关系.
本文主要是利用肝癌细胞系HepG2来研究miRNA干扰Rap1对肝癌细胞凋亡的影响, 思路清楚, 重点突出, 有一定的科学意义.
编辑: 李军亮 电编:闫晋利
| 1. | Kang TH, Lindsey-Boltz LA, Reardon JT, Sancar A. Circadian control of XPA and excision repair of cisplatin-DNA damage by cryptochrome and HERC2 ubiquitin ligase. Proc Natl Acad Sci U S A. 2010;107:4890-4895. [PubMed] [DOI] |
| 2. | Lu W, Zhang Y, Liu D, Songyang Z, Wan M. Telomeres-structure, function, and regulation. Exp Cell Res. 2013;319:133-141. [PubMed] [DOI] |
| 3. | Giraud-Panis MJ, Teixeira MT, Géli V, Gilson E. CST meets shelterin to keep telomeres in check. Mol Cell. 2010;39:665-676. [PubMed] [DOI] |
| 4. | Mukherjee S, Firpo EJ, Wang Y, Roberts JM. Separation of telomerase functions by reverse genetics. Proc Natl Acad Sci U S A. 2011;108:E1363-E1371. [PubMed] [DOI] |
| 5. | Sfeir A, Kabir S, van Overbeek M, Celli GB, de Lange T. Loss of Rap1 induces telomere recombination in the absence of NHEJ or a DNA damage signal. Science. 2010;327:1657-1661. [PubMed] [DOI] |
| 6. | Arat NÖ, Griffith JD. Human Rap1 interacts directly with telomeric DNA and regulates TRF2 localization at the telomere. J Biol Chem. 2012;287:41583-41594. [PubMed] [DOI] |
| 7. | Demarse NA, Ponnusamy S, Spicer EK, Apohan E, Baatz JE, Ogretmen B, Davies C. Direct binding of glyceraldehyde 3-phosphate dehydrogenase to telomeric DNA protects telomeres against chemotherapy-induced rapid degradation. J Mol Biol. 2009;394:789-803. [PubMed] [DOI] |
| 8. | Cosconati S, Rizzo A, Trotta R, Pagano B, Iachettini S, De Tito S, Lauri I, Fotticchia I, Giustiniano M, Marinelli L. Shooting for selective druglike G-quadruplex binders: evidence for telomeric DNA damage and tumor cell death. J Med Chem. 2012;55:9785-9792. [PubMed] [DOI] |
| 9. | Taboski MA, Sealey DC, Dorrens J, Tayade C, Betts DH, Harrington L. Long telomeres bypass the requirement for telomere maintenance in human tumorigenesis. Cell Rep. 2012;1:91-98. [PubMed] [DOI] |
| 10. | Tao SF, Zhang CS, Guo XL, Xu Y, Zhang SS, Song JR, Li R, Wu MC, Wei LX. Anti-tumor effect of 5-aza-2'-deoxycytidine by inhibiting telomerase activity in hepatocellular carcinoma cells. World J Gastroenterol. 2012;18:2334-2343. [PubMed] [DOI] |
| 11. | Miyazaki T, Pan Y, Joshi K, Purohit D, Hu B, Demir H, Mazumder S, Okabe S, Yamori T, Viapiano M. Telomestatin impairs glioma stem cell survival and growth through the disruption of telomeric G-quadruplex and inhibition of the proto-oncogene, c-Myb. Clin Cancer Res. 2012;18:1268-1280. [PubMed] [DOI] |
| 12. | Xu T, He K, Wang L, Goldkorn A. Prostate tumor cells with cancer progenitor properties have high telomerase activity and are rapidly killed by telomerase interference. Prostate. 2011;71:1390-1400. [PubMed] [DOI] |
| 14. | Martinez P, Thanasoula M, Carlos AR, Gómez-López G, Tejera AM, Schoeftner S, Dominguez O, Pisano DG, Tarsounas M, Blasco MA. Mammalian Rap1 controls telomere function and gene expression through binding to telomeric and extratelomeric sites. Nat Cell Biol. 2010;12:768-780. [PubMed] [DOI] |
| 15. | Papai G, Tripathi MK, Ruhlmann C, Layer JH, Weil PA, Schultz P. TFIIA and the transactivator Rap1 cooperate to commit TFIID for transcription initiation. Nature. 2010;465:956-960. [PubMed] [DOI] |
| 16. | Teo H, Ghosh S, Luesch H, Ghosh A, Wong ET, Malik N, Orth A, de Jesus P, Perry AS, Oliver JD. Telomere-independent Rap1 is an IKK adaptor and regulates NF-kappaB-dependent gene expression. Nat Cell Biol. 2010;12:758-767. [PubMed] [DOI] |
| 17. | Bailey CL, Kelly P, Casey PJ. Activation of Rap1 promotes prostate cancer metastasis. Cancer Res. 2009;69:4962-4968. [PubMed] [DOI] |