修回日期: 2012-01-10
接受日期: 2012-03-10
在线出版日期: 2012-03-18
目的: 探讨硫化氢(hydrogen sulfide, H2S)代谢酶抑制剂对肝硬化大鼠肝细胞凋亡的影响, 进一步了解内源性H2S在大鼠肝硬化过程中发挥保护性作用的机制.
方法: 将40只♀SD大鼠分为4组, 正常对照组(N组), 正常对照组+炔丙基甘氨酸(PPG)组(P组), 肝硬化组(H组), 肝硬化+PPG组(PH组). H组、PH组利用CCL4复合因素法复制肝硬化大鼠模型, P组和PH组给予腹腔注射PPG(30 mg/kg·d)减少大鼠体内H2S含量; N组和H组腹腔注射同等剂量的生理盐水. 免疫组织化学法检测大鼠肝组织中细胞胱硫醚γ裂解酶(CSE)的表达, Tunel法检测大鼠肝组织中肝细胞的凋亡, Western-blot法检测大鼠肝组织中凋亡相关蛋白Bax、Bcl-2的表达.
结果: H组与N组相比, 凋亡指数(AI)明显升高(P = 0.000), 凋亡促进蛋白Bax表达升高(P= 0.001); PH组与H组相比, CSE表达降低(P = 0.029), AI明显升高(P = 0.000), Bax表达增高(P = 0.021), 差异均具有统计学意义. Bcl-2在各组间的表达无显著性差异(P = 0.742).
结论: H2S代谢酶抑制剂可促进肝硬化大鼠肝细胞的凋亡, 其作用机制可能与其调节Bax的表达有关.
引文著录: 刘浩, 郑勇, 陈卫刚, 赵瑾, 李睿, 张宁, 刘芳, 阎继攀. 内源性硫化氢对肝硬化大鼠肝细胞凋亡的影响. 世界华人消化杂志 2012; 20(8): 670-674
Revised: January 10, 2012
Accepted: March 10, 2012
Published online: March 18, 2012
AIM: To explore the effect of a metabolic inhibitor of hydrogen sulfide on apoptosis of liver cells in rats with cirrhosis, and to explore the mechanism underlying the protective effect of hydrogen sulfide against cirrhosis.
METHODS: Forty female SD rats were randomly divided into four groups: normal controls (group N), normal controls treated with propargylglycine (PPG) (group P), cirrhotic rats (group H), and cirrhotic rats treated with PPG (group PH). Rats in groups H and PH were subjected to induction of cirrhosis by injecting carbon tetrachloride (CCl4). Rats in groups P and PH were injected with PPG (30 mg/kg·d) to decrease the content of hydrogen sulfide in the liver. Rats in groups N and H were injected with equal volume of normal saline. The distribution of cystathionine-γ-lyase (CSE) in the liver was examined by immunohistochemistry. The apoptosis of liver cells was detected by TUNEL assay. The expression of Bax and Bcl-2 in liver cells was detected by Western blot.
RESULTS: Compared to group N, apoptosis index (AI) significantly increased (P = 0.000) and expression of Bax was significantly up-regulated (P = 0.001) in group H. Compared to group H, AI and expression of Bax significantly increased (P = 0.000, 0.021), and CSE decreased (P = 0.029) in group PH.
CONCLUSION: Inhibition of hydrogen sulfide promotes apoptosis of liver cells in rats with cirrhosis possibly by regulating the expression of Bax.
- Citation: Liu H, Zheng Y, Chen WG, Zhao J, Li R, Zhang N, Liu F, Yan JP. Effect of endogenous hydrogen sulfide on apoptosis of cirrhosis rat liver cells. Shijie Huaren Xiaohua Zazhi 2012; 20(8): 670-674
- URL: https://www.wjgnet.com/1009-3079/full/v20/i8/670.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i8.670
内源性硫化氢(hydrogen sulfide, H2S)是继NO和CO之后发现的第3种新型气体信号分子, 在体内主要是通过细胞胱硫醚β合成酶(CBS)、CSE催化L-半胱氨酸而产生. 目前研究证实其存在于人体多个系统中, 具有扩张血管[1]、心肌保护[2]、抗炎等作用[3]. 近年研究证实其在肝纤维化及门脉高压的发生发展过程中起着重要的保护性作用[4-6]. 本实验通过复制肝硬化大鼠模型, 给予干预措施改变大鼠体内H2S含量后观察肝组织中肝细胞凋亡的变化及凋亡相关蛋白Bax、Bcl-2表达的变化, 进而探讨H2S在肝硬化过程中发挥保护性作用的机制.
实验所用40只SD大鼠(SPF级)购自新疆医科大学实验动物中心, 为同期出生纯种系, ♀, 体质量200 g左右. Tunel试剂盒购自Roche公司; 小鼠抗大鼠CSE单克隆一抗购自SANTA Cruz公司; 兔抗鼠Bcl-2多克隆一抗购自Abcam公司; 兔抗鼠Bax单克隆一抗购自SANTA Cruz公司; 二抗检测试剂盒均购自北京中杉金桥有限公司, 化学光试剂盒购自Pierce公司; 变性型裂解液购自Bioteke公司; PPG购自Sigma公司, 其余试剂为国产分析纯.
1.2.1 大鼠分组及肝硬化模型的制备: 将40只大鼠平均分为4组, H组、PH组给予皮下注射40%的CCL4植物油溶液, 4 d 1次, 以30%的乙醇溶液代替饮用水; 先给予高脂饮食2 wk, 再给予高胆固醇饮食; 非造模组大鼠给予同期皮下注射同等剂量的生理盐水. 造模时间为52 d. 模型制备成功后, P组与PH组大鼠给予腹腔注射PPG(30 mg/kg·d)干预体内H2S的合成, 进而降低体内H2S的含量, N组和H组给予腹腔注射同等剂量的生理盐水, 共注射7 d.
1.2.2 标本的留取: 干预措施完成后, 采用颈椎脱臼法处死大鼠. 取大鼠肝组织一块置于30%甲醛溶液中固定后进行石蜡包埋, 另取新鲜肝组织一块置于液氮中速冻后转移至-80 ℃冰箱备用.
1.2.3 免疫组织化学法检测肝组织中CSE蛋白的表达: 石蜡包埋组织制作切片(4 μm). 切片常规脱蜡至水, 3%双氧水甲醇中浸泡10 min以阻断内源性过氧化物酶. 枸橼酸修复液微波炉中高火修复至冒泡后再低火修复20 min, 冷却至室温后加小鼠抗大鼠CSE一抗(1:1 200), 置于4 ℃冰箱过夜. 次日PBS冲洗切片5 min×3, 后加山羊抗小鼠二抗(两步法PV60002), 37 ℃温箱中孵育30 min后PBS冲洗5 min×3, DAB显色, 显微镜下边显色边观察以观察控制显色时间, 显色后用自来水冲洗去DAB, 苏木素复染, 脱水, 透明, 中性树胶封片. 阳性部位在胞质处显棕黄色. 按阳性细胞百分率及染色强度进行双评分每张标本切片随机选择5个区域, 计数阳性细胞数和阴性细胞数, 进而计算其阳性表达率(%) = 阳性细胞数/(阳性细胞数+阴性细胞数)×100%.
1.2.4 Tunel法检测肝组织中肝细胞的凋亡: 石蜡切片常规脱蜡至水, 3%双氧水甲醇中浸泡10 min以阻断内源性过氧化物酶, PBS冲洗5 min×3; 蛋白酶K(15 mg/L)37 ℃温箱中孵育7 min; 200 mL/L胎牛血清室温下封闭20 min; 用滤纸吸去残留液后滴加反应液50 μL(TdT 3 μL, 荧光素连接的核苷酸混合缓冲液47 μL, 阴性对照片不加TdT), 37 ℃温箱中孵育45 min, PBS冲洗5 min×3; 20%山羊血清室温下封闭20 min, 加POD转换剂(原液1:2稀释), 置于37 ℃温箱中孵育30 min, 显微镜下DAB显色, 苏木素复染, 脱水, 透明, 封片. 阳性部位在细胞核处显棕黄色或棕褐色. 计数5个高倍镜视野下100个肝细胞核中阳性细胞的个数, 取其均值为凋亡指数.
1.2.5 Western Blot法检测肝组织中Bax、Bcl-2的表达: 组织裂解液提取肝组织中总蛋白, 核算测定仪测定蛋白浓度, 均衡各组间蛋白浓度后加上样缓冲液煮沸, 置于-20 ℃冰箱保存备用. 加样10 μL在SDS-PAGE凝胶中进行电泳分离, Mark进行位置标记. 湿转法将蛋白从凝胶中转至PVDF膜上(21 V 40 min). 5%BSA室温下封闭2 h, 分别加Bax(1:400)、Bcl-2(1:400)一抗, 室温下孵育2 h后转至4 ℃冰箱过夜. TBST洗膜后加入辣根过氧化物酶标记的二抗, 室温下孵育90 min, TBST洗膜后加入化学发光试剂曝光, 显影、定影后将胶片置于凝胶成像系统中测条带吸光度(A)值.
统计学处理 采用SPSS17.0软件进行统计学分析, 采用完全随机设计方差分析法及χ2检验对数据进行组间比较, P<0.05有统计学意义.
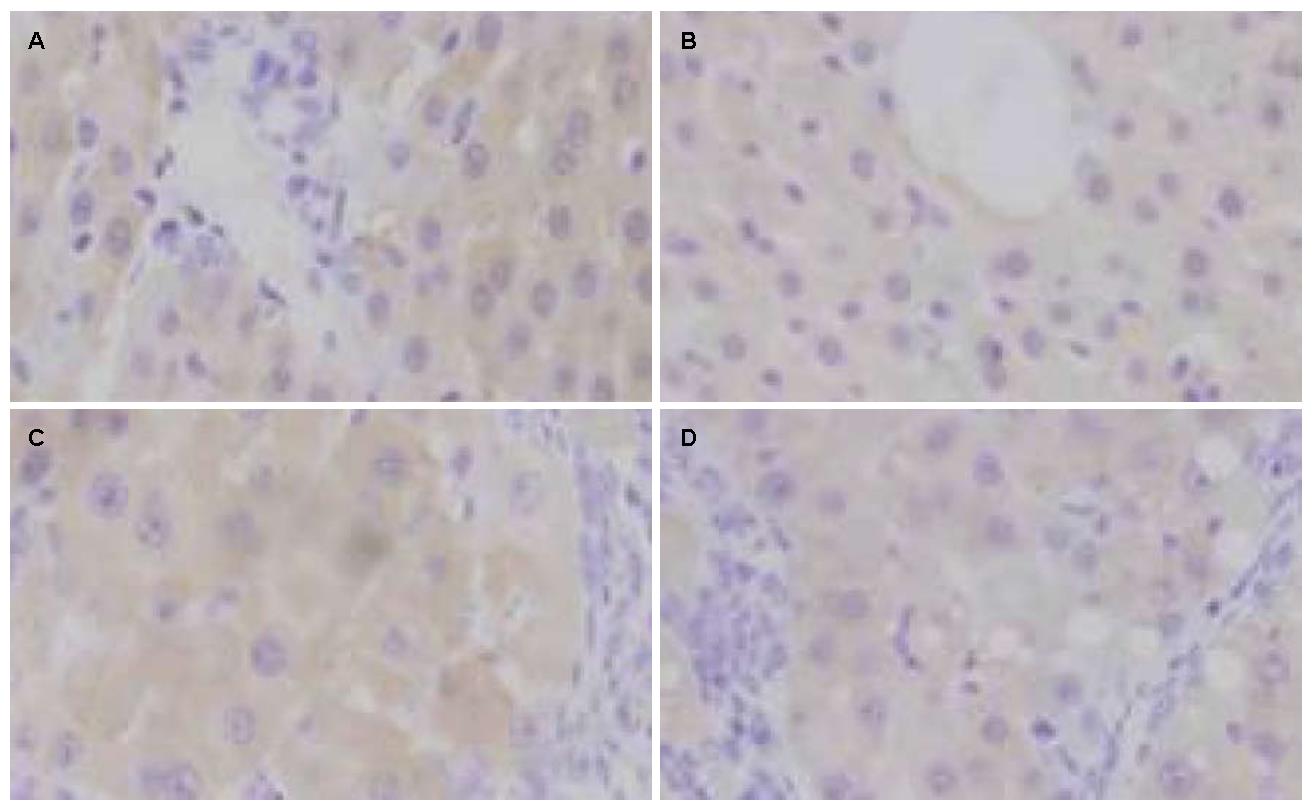
CSE蛋白定位于细胞浆, 染色后呈棕黄色(图1). 主要表达于肝细胞, 各组大鼠肝组织CSE蛋白表达(表1). PH组(40%)较H组(88.9%)表达降低, 两组之间的差异有统计学意义(P<0.05). H组较N组阳性率略降低, 差异无统计学意义.
凋亡肝细胞核呈棕黄色或黄褐色. N组大鼠偶见肝细胞凋亡, P组大鼠较N组大鼠其凋亡指数略降低, 差异无统计学意义. H组大鼠凋亡指数较N组明显增高(P<0.01), 给予PPG干预后的PH组其凋亡指数较H组明显升高(P<0.05), 差异均具有统计学意义(表1).
凋亡抑制蛋白Bcl-2条带的A值在各组之间无明显差异. 与N组比较, H组Bax条带的A值降低, 表明其蛋白表达升高(P<0.05); 与H组相比, PH组Bax条带的A值降低, 表明其蛋白表达增高(P<0.05), 差异均具有统计学意义(表2).
肝硬化是一种由不同损伤因素长期作用于肝脏, 引起的以肝组织弥漫性纤维化、假小叶和结节再生形成为特征的慢性肝病. 临床上有多系统受累, 以肝功能损害和门静脉高压为主要表现, 晚期常出现消化系出血、肝性脑病、继发感染等严重并发症. H2S是一种新型的内源性气体信号分子, 存在于人体多个系统中, 有着广泛的生物学效应. 课题组前期研究结果表明H2S在肝硬化的发生发展过程中表达逐渐降低且门静脉血中H2S的下降程度大于下腔静脉[6,7]; 肝硬化大鼠给予H2S代谢酶抑制剂后门静脉压力升高[4,5]; 且H2S与先前的2种气体信号分子NO、CO存在相互作用[8]. 提示H2S在肝硬化的发生发展过程中及调节门静脉压力方面发挥重要的作用.
肝细胞凋亡是肝脏疾病中最重要的影响因素之一, 在正常肝脏发育及多种肝脏疾病的发生过程中起着重要作用[9,10]. 肝脏在受到持续性损伤因素作用时, 体内预存的肝细胞死亡程序被激活, 肝细胞凋亡增加, 产生大量的凋亡小体. 凋亡小体被肝星状细胞吞噬后则可激活肝星状细胞, 进而产生大量的细胞外基质及胶原蛋白, 最终导致肝纤维化的形成. 因此, 可以认为肝细胞病理性凋亡和肝纤维化发生密切相关, 病理性肝细胞的凋亡启动并促进了肝纤维化的发生[11]. 在细胞凋亡过程中, Bcl-2家族成员起着至关重要的作用. Bcl-2家族可以分为2大类: 一类凋亡促进基因, 包括Bax、Bad、Bak等; 另一类是以Bcl-2为代表的凋亡抑制基因. 研究发现Bax/Bcl-2两蛋白之间的比例关系是决定对细胞凋亡抑制作用强弱的关键因素, 因此认为, Bax是极重要的促细胞凋亡基因之一. 已有研究表明, H2S在调节各种病理性细胞凋亡中发挥重要作用. 在自发性高血压大鼠中, H2S缺乏可引起大鼠主动脉平滑肌细胞凋亡减少[12], 促进了血管的重建, 加重自发性高血压的高压状态; 另外, H2S还可调节由缺氧诱导的人胚肺成纤维细胞的凋亡[13]; 在心肌及肝脏缺血再灌注损伤中, H2S缺乏均可加重由缺血再灌注引起的心肌细胞及肝细胞的凋亡[14,15].
本实验的研究结果表明, 正常肝组织中存在CSE的表达, 肝硬化大鼠肝组织中CSE的表达较正常组略降低, 肝硬化大鼠在给予H2S代谢酶抑制剂PPG后CSE表达明显降低, 这与课题组前期研究结果一致, 表明PPG可下调H2S/CSE体系, 进而引起肝组织中H2S含量的降低. 细胞凋亡在确保组织的正常发育及维持内环境稳定方面发挥重要作用, 因此正常大鼠中偶可见凋亡细胞, 正常大鼠给予PPG后凋亡指数无明显变化, 表明在正常大鼠中, 病理性凋亡程序未被启动时H2S对细胞的凋亡无明显调节作用; 肝硬化发生时体内预存的肝细胞死亡程序被激活, 所以凋亡细胞较正常大鼠明显增多, 而给予H2S代谢酶抑制剂降低肝组织H2S含量后肝硬化大鼠肝细胞凋亡进一步增多, 说明H2S缺乏可促进肝硬化大鼠肝细胞凋亡.
有研究表明, H2S在心肌缺血再灌注损伤时发挥其保护性作用是通过调节心肌中Bax的表达来实现的, 而该过程中Bcl-2的表达则无明显变化; 关于H2S调节中性粒细胞的凋亡实验也表明H2S可调节中性粒细胞的凋亡, 而在该调节过程中凋亡抑制蛋白Bcl-2的表达则无明显变化[16]. Bax和Bcl-2作为线粒体凋亡通路上的2个凋亡调节蛋白, 具有相互拮抗的作用, 每一种蛋白的表达变化均不能反应凋亡的发展, 而最终能决定凋亡进展方向的是Bax/Bcl-2的比值. 在本实验中, 尽管给予PPG后Bcl-2的表达无明显变化, 但由于Bax的明显升高引起Bax/Bcl-2的升高, 仍可以促使细胞向凋亡方向发展.
所以, 我们推测肝硬化大鼠给予了H2S代谢酶抑制剂后H2S/CSE体系表达下调, H2S的下调引起Bax表达的上调, 而对Bcl-2的表达无显著影响, 故Bax/Bcl-2比值增高, 进而促使肝细胞向凋亡方向发展, 使肝细胞凋亡增多. 而肝细胞凋亡后产生的凋亡小体被肝星状细胞吞噬后引起肝星状细胞激活, 进而引起细胞因子生成增加, 细胞外基质合成增加,Ⅰ、Ⅲ型胶原合成增多. 同时, 由于肝细胞凋亡增多, 肝细胞代谢、降解细胞外基质及胶原的能力降低, 引起细胞外基质的生成与降解的失衡, 进而促进肝纤维化的发生与发展. 另外, 肝内细胞外基质及胶原的增多, 可引起肝血窦闭塞或窦周纤维化, 进而引起窦性门静脉循环受阻, 最终导致H2S缺乏状态下门静脉压力的进一步升高.
总之, 我们的研究结果表明, 在H2S缺乏的状态下, 肝硬化大鼠肝细胞的凋亡增加, 进而促进肝纤维化启动与发生甚至引起门静脉压力的进一步增高. 而在调节凋亡这一过程中, H2S又有可能通过调节肝组织中Bax的表达进而改变Bax/Bcl-2比值来实现的.
硫化氢是存在于哺乳动物体内的第3种新型的内源性气体信号分子, 有着广泛的生物学效应. 近年研究证实其具有调节病理状态下细胞凋亡的作用, 课题组前期研究也表明其在肝纤维化的发生发展过程中及门脉高压的调节方面起着重要作用.
刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科
肝细胞的病理性凋亡是各种肝脏疾病中最重要的影响因素之一, 研究表明其可启动并促进肝纤维化的发生, 因此, 如何能有效阻止肝细胞的病理性凋亡将成为慢性肝病治疗的新方向.
康凯等的研究表明, 在大鼠缺血再灌注损伤模型建立后, 大鼠肝细胞的凋亡明显增加, 而给予H2S代谢酶抑制剂降低组织中H2S含量后, 肝细胞的凋亡进一步增加, 表明H2S缺乏可促进缺血再灌注所引起的这种病理性肝细胞凋亡.
本研究结果表明, 肝硬化大鼠H2S缺乏可促进肝细胞的病理性凋亡, 而病理性凋亡又可能通过相应的途径加快肝纤维化的进展, 甚至增加门静脉压力. 因此, 如何避免体内H2S缺乏甚至增加体内H2S含量可能会成为肝硬化及门脉高压治疗的新的发展方向.
本文设计合理, 结果可靠, 具有一定的学术价值.
编辑: 曹丽鸥 电编: 鲁亚静
| 1. | Mel'nik AV, Voloshchouk NI, Pentyuk NO, Znichko KO. Role of Hydrogen Sulfide and Sulfur-Containing Amino Acids in Regulation of Tone of Smooth Muscles of the Vascular Wall in Rats. Neurophysiology. 2010;42:104-109. [DOI] |
| 3. | Hirata I, Naito Y, Takagi T, Mizushima K, Suzuki T, Omatsu T, Handa O, Ichikawa H, Ueda H, Yoshikawa T. Endogenous hydrogen sulfide is an anti-inflammatory molecule in dextran sodium sulfate-induced colitis in mice. Dig Dis Sci. 2011;56:1379-1386. [PubMed] [DOI] |
| 4. | 陈 卫刚, 郑 勇, 宋 丽秀, 刘 维国, 李 文娟, 刘 清华, 张 宁, 齐 翠花. 内源性H2S对大鼠实验性肝硬化门脉高压的影响. 世界华人消化杂志. 2011;19:467-471. [DOI] |
| 5. | 李 文娟, 郑 勇, 陈 卫刚. 内源性硫化氢对实验性肝硬化门静脉高压调节作用. 中华实用诊断与治疗杂志. 2010;24:429-432. |
| 6. | 张 宁, 郑 勇, 王 于理, 李 睿, 孙 侃, 常 向云, 陈 卫刚, 赵 瑾, 李 洪安. 内源性硫化氢在不同时期大鼠肝硬化中的作用. 世界华人消化杂志. 2009;17:307-311. [DOI] |
| 7. | 张 宁, 郑 勇, 李 睿, 周 婷, 孙 侃, 陈 卫刚, 常 向云, 杨 军. 不同时期肝硬化大鼠门静脉血与下腔静脉血中内源性硫化氢的比较. 石河子大学学报(自然科学版). 2009;27:51-54. |
| 8. | 宋 丽秀, 郑 勇, 陈 卫刚, 刘 清华, 张 宁, 刘 维国, 李 文娟. 大鼠肝硬化形成中气体信号分子一氧化氮、一氧化碳对硫化氢/胱硫醚-γ裂解酶体系的影响. 现代生物医学进展. 2010;10:1213-1216. |
| 9. | Kiliçarslan A, Kahraman A, Akkiz H, Yildiz Menziletoğlu S, Fingas CD, Gerken G, Canbay A. Apoptosis in selected liver diseases. Turk J Gastroenterol. 2009;20:171-179. [PubMed] [DOI] |
| 10. | Guicciardi ME, Gores GJ. Apoptosis as a mechanism for liver disease progression. Semin Liver Dis. 2010;30:402-410. [PubMed] [DOI] |