修回日期: 2012-01-25
接受日期: 2012-02-09
在线出版日期: 2012-03-08
目的: 分析比较自身免疫性肝炎(AIH)、原发性胆汁性肝硬化(PBC)、原发性硬化性胆管炎(PSC)及其重叠综合征的组织病理学变化, 提高对自身免疫性肝病(AILD)的认识.
方法: 对27例AIH、67例PBC、4例PSC、1例AIH-PSC重叠综合征和10例AIH-PBC重叠综合征患者的肝穿组织病理资料进行回顾性分析.
结果: AILD患者多发于中年女性(73.3%), 肝组织病理变化以界面性肝炎为主(77.7%), 在重度患者则出现重度界面性肝炎、桥样坏死等. PBC患者早期(Ⅰ、Ⅱ)占28.3%, 而晚期(Ⅲ、Ⅳ)占71.7%, 肝组织病理变化以小胆管减少甚至消失为主(62.6%). AIH-PBC重叠综合征患者并非罕见, 他的肝组织病理学具有AIH和PBC的双重特征.
结论: AILD是非病毒性肝病的重要组成部分, 其诊断需综合临床表现、生化、免疫指标和组织学变化.
引文著录: 尧颖, 徐智媛, 高建鹏, 申丽娟, 王辉, 龙云, 杨晋辉. 自身免疫性肝病活检组织病理学特征分析109例. 世界华人消化杂志 2012; 20(7): 605-609
Revised: January 25, 2012
Accepted: February 9, 2012
Published online: March 8, 2012
AIM: To analyze and compare the histopathological characteristics of autoimmune hepatitis (AIH), primary biliary cirrhosis (PBC), primary sclerosing cholangitis (PSC) and their overlap syndromes.
METHODS: The histopathological changes in the liver of 27 patients with AIH, 67 patients with PBC, 4 patients with PSC, 1 patient with AIH-PSC overlap syndrome, and 10 patients with AIH-PBC overlap syndrome were investigated retrospectively.
RESULTS: Autoimmune liver diseases most frequently affected middle-aged women (73.3%). The main histological change in the liver was interface hepatitis (77.7%), and bridging necrosis was observed in severe AIH cases. Approximately 28.3% of PBC patients had early disease (stages I and II) and late disease (stages III and IV). The AIH-PBC overlap syndrome is not rare, and its pathological characteristics showed both characteristics of PBC and AIH.
CONCLUSION: Autoimmune liver diseases are not rare in China, and their diagnosis should be based on clinical presentations, biochemical, immunological and histological changes.
- Citation: Yao Y, Xu ZY, Gao JP, Shen LJ, Wang H, Long Y, Yang JH. Histopathological changes in the liver of patients with autoimmune liver diseases: an analysis of 109 cases. Shijie Huaren Xiaohua Zazhi 2012; 20(7): 605-609
- URL: https://www.wjgnet.com/1009-3079/full/v20/i7/605.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i7.605
自身免疫性肝病(autoimmune liver diseases, AILD)是一组与自身免疫异常有关的肝胆疾病, 包括以肝实质细胞损害为主的自身免疫性肝炎(autoimmune hepatitis, AIH)、以胆管损害及胆汁淤积为主的原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)和原发性硬化性胆管炎(primary sclerosing cholangitis, PSC)及其重叠综合征. 在疾病早期, 各型AILD的临床表现并不明显, 主要根据生化、免疫学、影像学和组织病理学特点进行综合诊断; 因此, 肝活检对于AILD的诊断以及严重程度和预后判断有着非常重要的临床价值, 本研究对109例AILD患者的组织病理学特征进行回顾性分析.
2007-01/2011-05昆明医学院附属延安医院和昆明医学院第二附属医院住院并经肝穿刺病理学检查确诊的AILD患者共109例, 所有患者多次检查常见血清肝炎病毒标志物均阴性, 无大量饮酒或服用已知对肝脏有损害的药物史, 亦无致肝脏损害的其他疾病.
1.2.1 观察指标: (1)一般情况: 包括患者的性别、年龄; (2)肝穿刺组织学检查: B超引导下采用快速穿刺法取肝组织, 标本长1.2-2.0 cm, 镜下包括至少6个汇管区, 常规脱水、石蜡包埋、切片, 行HE染色、Masson染色和网状纤维染色, 常规行HBsAg、HBcAg、HCV免疫组织化学检查, 由昆明医学院病理教研室采用同一标准阅片[1].
1.2.2 诊断标准: AIH的诊断根据1999年国际自身免疫性肝炎小组(IAIHG)推荐的标准[2]进行记分诊断或进行描述性诊断, 总分在入院时超过15分为确定诊断AIH, 10-15分者为可能的AIH; PBC的诊断符合2000年美国肝脏病研究协会(AASLD)的PBC处理指南[3]; PSC的诊断符合2002年美国胃肠病学会(ACG)的PSC处理指南[4]; AIH-PBC重叠综合征的诊断参照文献[5]标准.
统计学处理 应用SPSS13.0统计软件进行统计分析, 计量资料以mean±SD表示; 计数资料以例数或百分比表示, P<0.05为差异有统计学意义.
AILD患者中女性多见(80/109, 73.3%), 年龄在16-78岁, 平均年龄(50.8±13.4)岁, AIH、PBC及AIH-PBC重叠综合征发病以中年女性为主, 女性所占比重分别为(22/27, 81.4%)、(46/67, 68.6%)、(8/10, 80%), 平均年龄分别为53.4岁±7.6岁、52.1岁±14.7岁、45.7岁±12.4岁, 而PSC发病年龄则相对较小, 平均年龄为39.0岁±16.2岁, 具体年龄分布见表1.
| 女:男 | 年龄 | n | 百分比(%) | |
| AIH | 22:5 | 53.4±7.6 | 27 | 24.8 |
| PBC | 46:21 | 52.1±14.7 | 67 | 61.5 |
| PSC | 3:1 | 39.0±16.2 | 4 | 3.7 |
| AIH-PBC | 8:2 | 45.7±12.4 | 10 | 9.1 |
| AIH-PSC | 1:0 | 39 | 1 | 0.9 |
| 合计 | 80:29 | 50.8±13.4 | 109 | 100.0 |
所有患者均进行了肝穿刺病理学检查, 未发生出血和胆漏等并发症, 具体镜下表现见表2.
| 分组 | n | 界面性肝炎 | 汇管区周围肝炎 | 桥接坏死 | 淋巴细胞浸润 | 肉芽肿 | 小胆管增生 | 小胆管减少、消失 | 假小叶 |
| AIH | 27 | 21 | 0 | 10 | 22 | 0 | 0 | 0 | 8 |
| PBC | 67 | 5 | 15 | 9 | 24 | 5 | 14 | 42 | 22 |
| PSC | 4 | 2 | 0 | 0 | 2 | 0 | 1 | 3 | 1 |
| AIH-PBC | 10 | 6 | 0 | 3 | 4 | 0 | 2 | 6 | 2 |
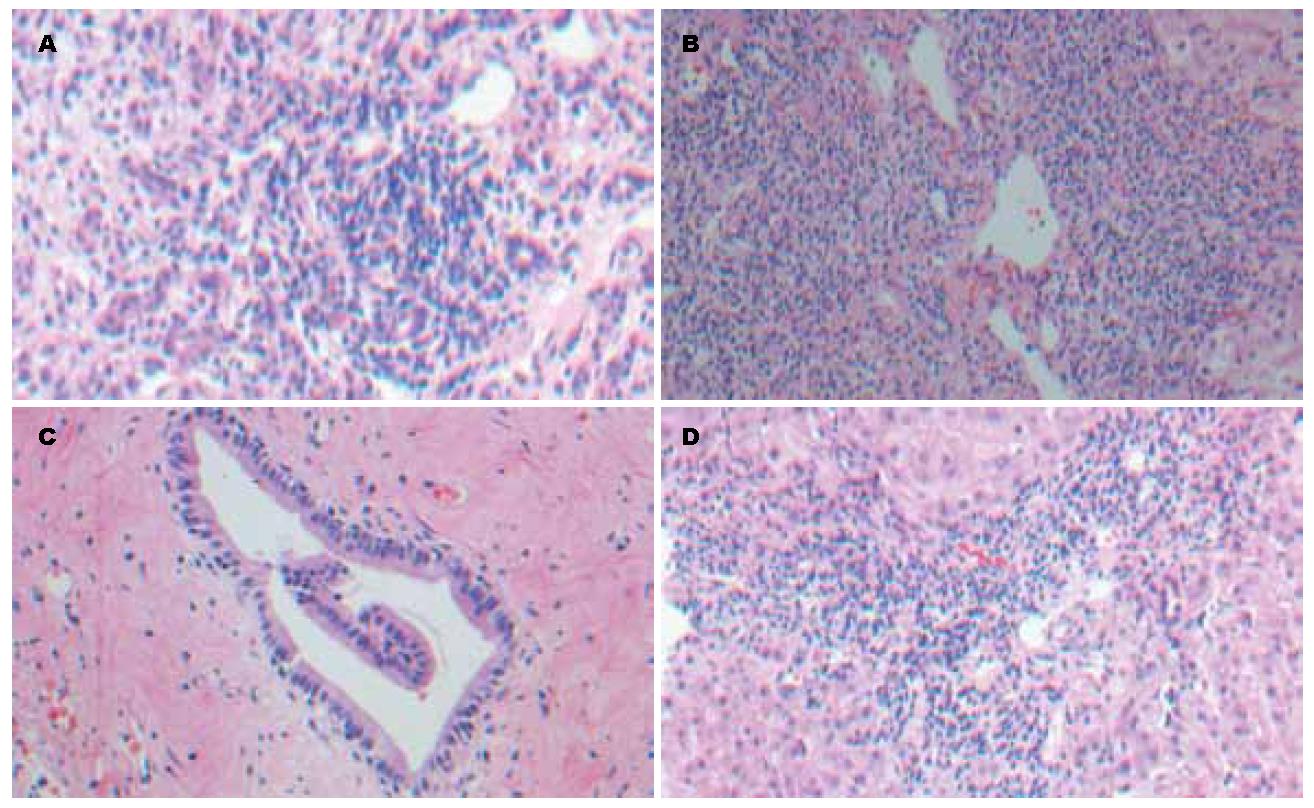
2.2.1 自身免疫性肝炎: AIH患者病变程度从G1S1至G4S4不等, AIH的主要组织学特征为界面性肝炎(21/27, 77.7%), 22例出现汇管区淋巴细胞浸润(22/27, 81.4%), 并形成淋巴滤泡(图1A), 其中12例出现重度界面炎(12/27, 44.4%), 10例重症患者出现桥样坏死(10/27, 37.1%), 具体发病年龄及性别分布见表3.
2.2.2 原发性胆汁性肝硬化: PBC主要的组织学特征为肉芽肿形成和小胆管缺失(图1B), 本组资料有5例早期患者出现PBC特征性的肉芽肿, 42例患者出现小胆管减少甚至消失(42/67, 62.6%), 67例PBC患者早期(Ⅰ、Ⅱ)占28.3%, 而晚期(Ⅲ、Ⅳ)占71.7%(表4).
| 病理分期 | n | 女:男 | 年龄(岁) | |||||
| 0-25 | 26-35 | 36-45 | 46-55 | 56-65 | >65 | |||
| PBCⅠ期 | 7 | 6:1 | 0 | 0 | 0 | 3 | 4(1) | 0 |
| PBCⅡ期 | 12 | 9:3 | 0 | 1 | 1 | 3 | 3(1) | 4(2) |
| PBCⅢ期 | 20 | 13:7 | 2(1) | 6(1) | 3(1) | 3(1) | 4(2) | 2(1) |
| PBCⅣ期 | 28 | 18:10 | 2 | 0 | 4(2) | 9(4) | 7(2) | 6(2) |
2.2.3 原发性硬化性胆管炎: 本组资料中, 有3例PSC患者出现胆管减少甚至消失伴有淋巴细胞浸润, 其中1例女性患者出现典型的组织学表现即增生的纤维组织包绕胆管呈同心圆排列(图1C), 4例患者均为中晚期病例(表5).
| 病例 | 性别 | 年龄(岁) | 病理分期 |
| 1 | 男 | 27 | PSCⅡ期 |
| 2 | 女 | 32 | PSCⅣ期 |
| 3 | 女 | 63 | PSCⅢ期 |
| 4 | 女 | 34 | PSCⅣ期 |
2.2.4 重叠综合征: 10例AIH-PBC重叠综合征在组织学上则兼有AIH和PBC的双重特点(表2, 6), 其中6例患者见到中、重度界面性肝炎, 伴有小胆管的增生或消失(图1D), 值得注意的是, 本研究发现AILD中罕见的AIH-PSC重叠综合征1例.
| 病例 | 性别 | 年龄(岁) | 病理分期 |
| 1 | 女 | 53 | AIHG2S2-PBCⅡ期 |
| 2 | 女 | 55 | AIHG2S2-PBCⅡ期 |
| 3 | 女 | 50 | AIHG3S3-PBCⅢ期 |
| 4 | 女 | 27 | AIHG3S4-PBCⅣ期 |
| 5 | 男 | 33 | AIHG3S3-PBCⅢ期 |
| 6 | 女 | 56 | AIHG2S2-PBCⅡ期 |
| 7 | 女 | 57 | AIHG3S3-PBCⅢ期 |
| 8 | 女 | 59 | AIHG3S3-PBCⅢ期 |
| 9 | 女 | 31 | AIHG3S4-PBCⅣ期 |
| 10 | 男 | 36 | AIHG3S3-PBCⅢ期 |
| 11 | 女 | 39 | AIHG3S3-PSCⅢ期 |
AIH、PBC和PSC被认为是具有相同的自身免疫性发病机制和相似的病理变化.即疾病早期炎症位于门管区及汇管区周围.疾病的终末期均发生肝硬化. 然而在这些相似的病变背景下, AIH、PBC和PSC出现明显的组织病理学变化的差异, 提示这些疾病有着不同的发病机制, 即各有特定的损害部位(自身免疫的靶区)[6].
AIH关键性的组织病理学变化是界面性肝炎, 即碎屑样坏死. 门管区和门管区周围炎是AIH的主要组织病理学表现, 其特点为炎症始于门管区, 然后破坏肝界板, 进而引起门管周围慢性渐进性单个或小簇肝细胞坏死, 此种变化从肝细胞坏死角度称为碎屑样坏死, 由于碎屑样坏死伴有的炎性细胞浸润位于肝小叶实质区与间质区交界处, 从炎症角度又称为界面性肝炎[7]. AIH的另一组织病理学特点为门管区和门管区周围浸润的炎性细胞主要为淋巴-浆细胞, 这种碎屑样坏死又称淋巴细胞性碎屑样坏死. PBC最主要的病变是破坏性肉芽肿性胆管炎, 病变始于小叶间胆管基底膜破裂, 淋巴细胞通过胆管基底膜破口进入胆管上皮细胞内, 引起胆管上皮变性坏死, 进而引起上皮样组织细胞增生, 形成肉芽肿, 这种形态学特点提示胆管上皮是PBC免疫攻击的目标[8].
从PBC早期发展为肝硬化, 组织病理学上分4期: Ⅰ期(门管期), 表现为门管性肝炎、汇管区扩大、淋巴细胞浸润; Ⅱ期(门管周围期), 表现为门管周围性肝炎, 汇管区炎症进一步加重, 波及汇管去周围肝细胞, 伴汇管区及周围小胆管明显增生, 形成胆汁性碎屑样坏死; Ⅲ期(间隔期), 表现为汇管区之间纤维间隔形成, 胆管数量明显减少, 汇管区周围肝细胞胆汁淤积呈羽毛状变性; Ⅳ期(硬化期) [9], 表现为特征性的胆汁性肝硬化, 正常肝小叶结构毁坏, 汇管区之间纤维间隔包绕肝细胞再生结节, 形成假小叶, 胆管甚至消失, 合并肝实质内严重的胆汁淤积[10,11]. PSC的特征性组织病理学变化是纤维性阻塞性胆管炎, 表现为胆管及胆管周围炎症, 浸润的炎症细胞主要为淋巴细胞, 增生的纤维结缔组织像一团纤维线团围绕在胆管周围新出洋葱皮样同心圆结构[12], 早期表现为胆管上皮变性, 逐渐进展至上皮缺损、消失, 被纤维疤痕组织取代. PSC从早期进展到肝硬化, 组织学上分为4期, Ⅰ、Ⅱ期病变在肝穿标本中难以和PBC鉴别, 晚期则形成纤维间隔, 胆管消失. 重叠综合征的组织病理学表现, 必须兼顾肝炎性和胆管炎性成分的组织病理学证据[13], 只有当有典型的界面性肝炎, 同时出现明确的坏死性肉芽肿胆管炎或纤维性阻塞性胆管炎时, 才考虑真正重叠综合征, 同时还必须结合实验室自身免疫抗体检测, 才能做出诊断. 肝穿刺活检病理学检查是诊断AILD重要而可靠的依据[14], 一方面可排除少部分血清病毒标志物阴性的隐匿性病毒性肝炎、脂肪性肝病及遗传代谢性肝病等, 另一方面可明确AILD患者的组织学分期, 以便进一步指导临床诊治, 尤其对于AIH的炎症活动分级的评估、免疫抑制剂的使用和撤除具有重要的参考价值.
本研究结果显示, 组织学分期在G2S2以上的中晚期AIH患者数较多(18/27, 66.6%), 多表现为中、重度界面性肝炎, 伴汇管区淋巴细胞浸润, 其中10例患者病情较重, 出现桥样坏死. 本组资料有4例PBC患者无任何临床症状, 仅单位体检发现单纯GGT升高前来就诊, AMA/AMA-M2阴性, 后经肝穿刺病理学检查诊断为PBCⅠ期, 但大多数PBC患者就诊时病情较严重, 其中(Ⅲ、Ⅳ)期占71.7%, 22例患者出现肝硬化特征性的病理表现假小叶, 说明PBC已进入晚期, 药物治疗效果不佳, 预后差, 需考虑肝移植[15]; 4例PSC患者中有1例出现PSC特征性的纤维组织增生包绕胆管, 形成洋葱皮样同心圆结构; 而AIH-PBC重叠综合征患者有6例同时见到中、重度界面性肝炎, 伴有小胆管的增生或消失, 提示这部分患者同时有肝细胞和胆管的损害.
总之, AILD在我国日趋增多, 当患者尤其是中年女性出现不明原因的肝功能异常时, 在排除其他常见原因引起的肝病后, 应想到AILD的可能, 尤其对于疾病早期、症状不典型、血清自身抗体阴性的患者, 及早行肝穿刺活检, 进一步明确诊断和组织学分期, 为患者作出早期诊断和及时治疗.
自身免疫性肝病可表现为严重的肝脏病变, 并进展至肝硬化. 肝穿刺活检病理学检查是诊断自身免疫性肝病重要而可靠的依据.
宣世英, 主任医师, 青岛市市立医院
研究表明AIH、PBC和PSC被认为是具有相同的自身免疫性发病机制和相似的病理变化, 即疾病早期炎症位于门管区及汇管区周围, 疾病的终末期均发生肝硬化. 然而在这些相似的病变背景下, AIH、PBC和 PSC出现明显的组织病理学变化的差异.
本文研究表明肝脏活检组织病理学对于自身免疫性肝病的诊治具有重要的临床意义, 一方面可以发现一些早期病变; 另一方面, 对于明确疾病组织学分期, 从而更好的指导临床治疗方案的选择. .
本文学术性较好, 肝脏组织病理学对于自身免疫性肝病的诊治具有较好的实用价值, 对进一步认识自身免疫性肝病的病理学变化有重要的意义.
编辑: 张姗姗 电编: 何基才
| 2. | Alvarez F, Berg PA, Bianchi FB, Bianchi L, Burroughs AK, Cancado EL, Chapman RW, Cooksley WG, Czaja AJ, Desmet VJ. International Autoimmune Hepatitis Group Report: review of criteria for diagnosis of autoimmune hepatitis. J Hepatol. 1999;31:929-938. [PubMed] [DOI] |
| 3. | Heathcote EJ. Management of primary biliary cirrhosis. The American Association for the Study of Liver Diseases practice guidelines. Hepatology. 2000;31:1005-1013. [PubMed] [DOI] |
| 4. | Lee YM, Kaplan MM. Management of primary sclerosing cholangitis. Am J Gastroenterol. 2002;97:528-534. [PubMed] [DOI] |
| 5. | Lohse AW, zum Büschenfelde KH, Franz B, Kanzler S, Gerken G, Dienes HP. Characterization of the overlap syndrome of primary biliary cirrhosis (PBC) and autoimmune hepatitis: evidence for it being a hepatitic form of PBC in genetically susceptible individuals. Hepatology. 1999;29:1078-1084. [PubMed] [DOI] |
| 7. | 周 晓军, 张 丽华. 肝脏诊断病理学. 第1版. 南京: 江苏科学技术出版牡. 2006;88-94. |
| 9. | 张 福奎, 贾 继东, 王 宝恩, 钱 林学, 尹 珊珊, 王 宇, 崔 焱, 尤 红, 王 惠吉, 张 长淮. 45例原发性胆汁性肝硬化的临床特征. 中华内科杂志. 2002;41:163-167. |
| 12. | Cullen SN, Chapman RW. Review article: current management of primary sclerosing cholangitis. Aliment Pharmacol Ther. 2005;21:933-948. [PubMed] [DOI] |
| 15. | Bjøro K, Brandsaeter B, Foss A, Schrumpf E. Liver transplantation in primary sclerosing cholangitis. Semin Liver Dis. 2006;26:69-79. [PubMed] [DOI] |