修回日期: 2011-12-19
接受日期: 2012-02-26
在线出版日期: 2012-02-28
目的: 评价胰管内注射乌司他丁对内镜逆行胆胰管造影术(encoscopic retrograde cholangio-pancreatography, ERCP)术后胰腺损伤的预防作用.
方法: 将实验犬随机分为3组, 分别为乌司他丁组(A组)、生理盐水组(B组)、对照组(C组), 每组8只. 在麻醉状态下行ERCP检查, 内镜通过幽门, 在十二指肠降段找到十二指肠乳头开口后, A、B两组导丝插入胆管, 并向胆管内注入三代显10.0 mL胆管显影后, 将导丝选择性插入胰管, A组注入向胰管内缓慢注入乌司他丁10万单位(2.0 mL)(溶于0.9%氯化钠8.0 mL)、B组向胰管内缓慢注入0.9%氯化钠10.0 mL. 5 min后, A、B两组均在1 min内注入三代显10.0 mL, 使胰管显影; C组将导丝插入胆管, 并向胆管内注入三代显10.0 mL, 胰管不插管. 3组实验犬术后定时采静脉血, 生化仪测量血淀粉酶含量, ELISA方法测定3组各时段IL-6、IL-8及胰蛋白酶原激活肽的含量. 于ERCP术后第6天处死所有动物, 取胰腺标本进行组织学检查. 比较各组组织病理学指标的变化情况, 综合判断ERCP术后胰腺损伤的发生情况.
结果: (1)ERCP术后2 hA组血清淀粉酶、IL-6、IL-8及TAP值分别为391.0 U/L±67.2 U/L, 51.91 ng/L±4.87 ng/L, 4.070 μg/L±0.089 μg/L, 3.234 nmol/L±0.185 nmol/L, B组分别为1 077.0 U/L±246.1 U/L, 78.11 ng/L±11.25 ng/L, 4.520 μg/L±0.195 μg/L, 4.001 nmol/L±0.237 nmol/L, IL-6及IL-8随时间延长而逐渐降低, TAP及血清淀粉酶在24 h达峰值, 后逐渐降低, 与C组相比均有升高, B组各值均高于A组; (2)胰腺病理学检测结果: A组损害较B组无明显差异.
结论: 胰管内注射乌司他丁可以使ERCP术后胰腺损伤的发病情况减轻.
引文著录: 吕志武, 李易晨, 贾莉, 迟宝荣. 胰管内注射乌司他丁对实验犬ERCP术后胰腺损伤的预防. 世界华人消化杂志 2012; 20(6): 467-472
Revised: December 19, 2011
Accepted: February 26, 2012
Published online: February 28, 2012
AIM: To evaluate the prophylactic effect of infusion of ulinastatin via the pancreatic duct on pancreatic injury after endoscopic retrograde cholangiopancreatography (ERCP) in a canine model.
METHODS: Twenty-four dogs were randomized into three groups: ulinastatin group (group A), iobitridol group (group B) and normal group (group C). A duodenoscope was routinely inserted to the duodenal papilla under general anesthesia in dogs of each group. A guide wire was introduced into the bile duct in groups A and B to inject 10.0 mL of iobitridol, and the guide wire was then introduced into the pancreatic duct to slowly administer 100 000 units of ulinastatin and 8.0 mL of sodium chloride in group A and 10.0 mL of sodium chloride in group B. Five minutes later, 10.0 mL of iobitrdol was transfused into the pancreatic ducts in both groups within less than 1 min. A guide wire was introduced into the bile duct in group C to administer 10.0 mL of iobitridol. The contents of serum IL-6, IL-8, amylase and plasma TAP were determined by ELISA. Pancreatic tissues were pathologically examined 6 days after ERCP.
RESULTS: The contents of serum IL-6, IL-8, amylase and plasma TAP were significantly lower in group A than in group B (391.0 U/L ± 67.2 U/L vs 1 077.0 U/L ± 246.1 U/L, 51.91 ng/L ± 4.87 ng/L vs 78.11 ng/L ± 11.25 ng/L,
4.070 μg/L ± 0.089 μg/L vs 4.520 μg/L ± 0.195 μg/L, 3.234 nmol/L ± 0.185 nmol/L vs
4.001 nmol/L ± 0.237 nmol/L (all P < 0.05), and significantly higher in groups A and B than in group C. Under light microscopy, the pathological changes in pancreatic tissues in the ulinastatin group were less significant than those in other groups.
CONCLUSION: Pancreatic injury induced by ERCP could be ameliorated effectively and safety by infusion of ulinastatin via the pancreatic duct in dogs.
- Citation: Lv ZW, Li YC, Jia L, Chi BR. Infusion of ulinastatin via the pancreatic duct for prophylaxis of pancreatic injury after endoscopic retrograde cholangiopancreatography in dogs. Shijie Huaren Xiaohua Zazhi 2012; 20(6): 467-472
- URL: https://www.wjgnet.com/1009-3079/full/v20/i6/467.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i6.467
内镜逆行胆胰管造影术(encoscopic retrograde cholangio-pancreatography, ERCP)是诊断胰腺和胆道疾病的重要手段, 但造影剂对胰管及胰腺实质的影响使得术后胰腺炎成为ERCP最严重的并发症[1]. 乌司他丁是从人尿液中分离并纯化获得的一种蛋白酶抑制剂, 属糖蛋白, 具有抑制胰蛋白酶等各种胰酶活性的作用[2,3]. ERCP术中及术后静脉应用乌司他丁是目前预防ERCP术后胰腺炎的常用方法之一[4-6]. 但直接胰管内给药, 未见文献报道. 本实验为ERCP术前向胰管内注入乌司他丁, 研究其对降低ERCP术后胰腺损伤的发生率的作用, 为ERCP术后胰腺炎的防治提供了新的理论依据及实验数据.
正常成年犬24只, 雌雄不限, 体质量20-25 kg, 购买并饲养于哈尔滨医科大学附属二院动物中心, 术前禁食水12 h. 主要设备是olympusGIF-260V内镜, 黄斑马导丝(BOSTON), 造影管(欧林巴斯), PHILIPS X光机(荷兰).
1.2.1 造模: 实验犬随机分为3组: 乌司他丁组(A组), 三代显组(B组), 正常对照组(C组), 每组8只. 实验前24 h各组犬自由饮食, 术前12 h禁食, 自由饮水. 实验前, 每只实验犬给予肌肉注射氯胺酮20.0 mg/kg, 地西泮10.0 mL/kg诱导麻醉, 诱导成功后, 前肢头静脉安置静脉通路, 给予30.0 g/L巴比妥钠25.0 mg/kg静脉麻醉. 麻醉成功后, 实验犬俯卧位, 固定四肢, 口部安装口垫, 将十二指肠镜经口垫推进犬口腔, 循腔进镜, 可见十二指肠主乳头及副乳头, A、B两组先把导丝插入胆管, 并向胆管内注入三代显10 mL后, 摄片. 再行副乳头插导丝, 导丝入胰管, 造影管沿导丝插入胰腺, 退出导丝, A组注入向胰管内缓慢注入乌司他丁10万单位加9 g/L氯化钠8 mL, B组向胰管内缓慢注入9 g/L氯化钠10 mL. 5 min后, A、B两组均在1 min内向胰管内注入三代显10 mL, X光下胰管显影; C组主乳头插管, 胆管内注入三代显10.0 mL, 胆管、胆囊显影, 胰管不插管. ERCP过程中给予9.0 g/L氯化钠经前肢静脉通路滴注. ERCP完成后, 拔出静脉通路装置, 实验犬运回实验中心, 禁食水2 h.
1.2.2 标本的采集及检测: 于术后2 h, 24 h, 2 d及6 d采集静脉血, 静置后2 000 g, 速度离心20 min, 取上清, 应用ELISA方法检测血清IL-6、IL-8及血浆胰蛋白酶原激活肽的含量. 生化仪检测血清淀粉酶含量.
1.2.3 组织学检测: 术后6 d处死犬, 取胰腺组织, 送哈尔滨医科大学附属第二医院病理科做组织学检查. 以改良Schimidt法, 并参照Pozsar等[7]的方法对胰腺损伤进行评分: (1)水肿: 0分, 无; 1分, 轻度叶间隙增宽; 2分, 重度叶间隙增宽; 3分, 腺泡间隙增宽; 4分, 细胞间隙增宽; (2)坏死: 0分, 无; 1分, 坏死面积1%-10%; 2分, 坏死面积11%-20%; 3分, 坏死面积21%-30%; 4分, 坏死面积>30%; (3)出血: 0分, 无; 1分, 有; (4)炎细胞浸润: 计数高倍视野下血管周围或小叶内白细胞数量, 0分, 0-1个; 1分, 2-10个; 2分, 11-20个; 3分, 21-30个; 4分, >30个或出现微脓肿. (1)、(2)、(3)及(4)之和为胰腺损伤积分.
统计学处理 实验数据以mean±SD表示. 应用方差分析对实验数据进行统计学分析, P<0.05时为差异具有统计学意义.
C组ERCP前后IL-6、 IL-8, 及血浆TAP无明显变化. B组术后IL-6、 IL-8及血浆TAP较C组升高明显, 均于术后2 h开始升高, 24 h为峰值, 然后缓慢下降, 6 d时降到正常水平. A组较C组亦升高, 峰值较B组明显降低(表1, 2).
| 分组 | 2 h | 24 h | 2 d | 6 d | |
| 乌司他丁组 | IL-6 | 51.91±4.87 | 53.57±4.35 | 30.39±3.18 | 23.95±2.34 |
| IL-8 | 4.07±0.089 | 1.85±0.012 | 1.44±0.014 | 1.24±0.009 | |
| 生理盐水组 | IL-6 | 78.11±11.25 | 61.85±8.75 | 53.70±5.26 | 51.28±6.37 |
| IL-8 | 4.52±0.195 | 4.37±0.174 | 1.89±0.076 | 1.45±0.023 | |
| 对照组 | IL-6 | 30.16±5.03 | 31.40±4.95 | 30.23±4.74 | 29.97±4.37 |
| IL-8 | 1.90±0.013 | 2.41±0.021 | 1.57±0.016 | 1.38±0.011 |
| 分组 | 2 h | 24 h | 2 d | 6 d |
| 乌司他丁组 | 3.234±0.185 | 2.963±0.156 | 2.297±0.176 | 1.050±0.099 |
| 生理盐水组 | 4.001±0.237 | 4.943±0.256 | 3.472±0.197 | 2.906±0.175 |
| 对照组 | 1.975±0.075 | 2.244±1.021 | 1.594±0.026 | 1.594±0.032 |
正常对照组血清淀粉酶水平接近正常且无明显变化, 三代显组明显升高, 乌司他丁组亦有升高, 但幅度小于三代显组(表3).
| 分组 | 2 h | 24 h | 2 d | 6 d |
| 乌司他丁组 | 391±67.2 | 984±184.4 | 842±135.1 | 808±209.2 |
| 生理盐水组 | 1077±246.1 | 4821±1995.9 | 2008±575.2 | 962±307.5 |
| 对照组 | 753±238.6 | 680±210.5 | 705±150.8 | 637±173.2 |
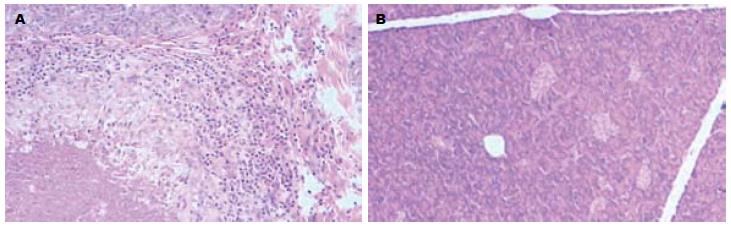
镜下可以见到三代显组胰腺组织腺泡肿胀, 腺体结构不清, 小叶间导管内有大量渗出的粉红色坏死物, 小叶间结缔组织有大量炎细胞浸润. 乌司他丁组仅有部分腺体组织水肿, 组织间隙增宽, 少有炎性细胞浸润(图1). 按照Schmidt评分标准评定的结果表明, 乌司他丁组评分低于三代显组, 结果有显著性差异(表4).
| 分组 | 水肿 | 坏死 | 出血 | 炎细胞浸润 | 总分 |
| 乌司他丁组 | 1.00±0.09 | 0.83±0.12 | 0.17±0.07 | 0.83±0.12 | 2.50±0.16 |
| 生理盐水组 | 1.67±0.11 | 1.67±0.14 | 0.67±0.08 | 1.84±0.13 | 5.83±0.19 |
| 对照组 | 0.16±0.01 | 0.00 | 0.00 | 0.00 | 0.16±0.01 |
自1968年ERCP问世以来, ERCP已成为临床诊断和治疗胆胰疾病的重要手段, 经过数十年的发展, 他已经成为较为成熟的微创介入诊疗技术. 对于一些胆胰系统疾病的治疗可以做到创伤小、恢复快、疗效确切作用. 但ERCP是一项具有一定风险的侵入性操作, 与其操作有关的并发症并不罕见. 其中ERCP术后胰腺损伤为其最常见且最凶险的并发症之一[8]. 其机制可能与造影剂注入胰腺实质导致胰腺损伤, 并促使胰蛋白酶、胰淀粉酶活性增高而导致胰腺自身消化时胰腺蛋白酶的活化、胰腺微循环障碍, 可刺激粒细胞、巨噬细胞、血管内皮细胞释放IL-6、IL-8等细胞因子. 这些炎性介质的释放, 更进一步加重胰腺局部炎性反应和组织损伤, 可使胰腺损伤从胰腺炎水肿型向坏死型发展; 局部炎性反应产生的细胞因子进入血液循环, 又通过"瀑布样"级联反应生成大量炎性细胞因子, 产生全身效应, 局部的炎性反应进展成系统性炎症反应综合征, 甚至病情急剧恶化发生弥散性血管内凝血[9,10].
乌司他丁为从新鲜男性尿液中分离提取出来的蛋白酶抑制剂, 属第三代广谱水解酶抑制剂, 是一种分子量为67 kDa的糖蛋白, 对胰蛋白酶、胰淀粉酶及脂肪酶等酶类有广泛的抑制作用, 有研究表明乌司他丁还具有稳定溶酶体膜、抑制炎症介质过度释放, 并能改善胰腺血循环, 减少氧自由基的过度释放. 且由于他是从人尿中提取, 免疫原性小, 安全性高, 已被广泛应用于胰腺炎的治疗且获得了良好的效果[11-15].
IL-6是在炎性刺激下, 由多种细胞释放的介导急性期反应的主要炎症因子之一, IL-6可由多种细胞产生, 包括单核-巨噬细胞、内皮细胞、纤维母细胞、平滑肌细胞等. IL-6可改变胞内G蛋白活性、促进中性粒细胞功能上调、调节各种炎症介质(如细胞因子、黏附分子、NO等)的转录, 在胰腺细胞凋亡中发挥重要作用. 其引起胰腺局部和全身器官损伤的机制可能与其刺激肝细胞产生一系列急性期蛋白、改变细胞内急性期蛋白活性和参与多核中性粒细胞功能上调等作用有关[16,17]. 急性胰腺损伤早期IL-6即有变化, 其表达水平与胰腺炎发生及发展密切相关. 发病后24 h内检测血浆IL-6含量, 预测的敏感性为89%-100%, 准确性达91%, 是早期评价胰腺炎严重程度的理想指标[18,19]. IL-8是具有有效的中性粒细胞趋化和激活活性的细胞因子, 由多种类型细胞以基础分泌或前炎症递质刺激下的形式分泌, 在炎症的过程中, 可由成纤维细胞、单核细胞、上皮细胞等细胞分泌. 其具有激活诱导T、B细胞分化, 增强NK细胞杀伤靶细胞, 促进吞噬等功能, IL-8可吸引中性粒细胞至炎症部位, 包括胰和肺, 激活中性粒细胞使其释放弹力蛋白酶, 并可改变中性粒细胞外形. 此外IL-8对部分(10%)人的外周血T淋巴细胞有趋化作用, T淋巴细胞对IL-8的敏感性比中性粒细胞高2-10倍, 有学者认为高水平的IL-8提示胰腺炎患者有感染和胰腺坏死可能, 还有研究显示入院后1 d内重型胰腺炎患者IL-8含量明显大于轻型胰腺炎患者. 故IL-8也已成为急性胰腺损伤预测和分型的早期标志物[20,21]. 其已被认为是一个新的中性粒细胞活化肽. 增高的机制可能与胰腺损伤患者的细胞免疫功能受抑, T、B细胞调节紊乱有关; 其次可能由于胰腺损伤刺激单核细胞、上皮细胞, 造成血中IL-8水平增高, 诱导嗜碱性粒细胞释放组胺, 参与局部的炎症反应. 本实验三代显组IL-6、IL-8于术后24 h明显高于对照组, 乌司他丁组升高幅度小于三代显组, 且
2 d、6 d值均低于三代显组. 表明乌司他丁可调节IL-6、 IL-8的分泌和释放, 从而切断炎症因子的级联效应, 减轻胰腺损伤及全身炎症性反应.
急性胰腺炎时, 酶的异常激活而导致胰腺自身消化, 而胰蛋白酶原激活肽(TAP)则为胰蛋白酶原激活时释放出的多肽, 其位于胰蛋白酶原的氨基末端. 典型的激活肽为6肽或8肽, 分子量67 kDa, 在哺乳动物中有高度同源性. 胰蛋白酶原异位活化产生的TAP进入血液循环再随尿液排出体外. 因此检测TAP变化可直接反映胰蛋白酶原激活的程度, 是胰蛋白酶原激活的分子标志物, 并具有高度的特异性[22-24]. TAP一般在发病后数小时即进入血液循环, 24 h左右达高峰, 有研究指出, 急性胰腺炎时, TAP浓度的变化早于其病理变化, 已成为胰腺炎早期诊断的最佳指标[25,26]. 本实验乌司他丁组TAP水平低于三代显组, 表明乌司他丁可抑制胰酶的激活, 从而减少胰酶对胰腺的自身消化, 保护胰腺组织.
ERCP插管对十二指肠乳头的创伤能引起Oddi's括约肌水肿、痉挛, 继而使胰液外流受阻, 胰管内造影剂注射引起的管内压力升高或多次胰管显影能使胰管上皮细胞及胰腺腺泡损伤, 主要破坏细胞膜及细胞间的紧密连接, 因而使管内容物反流至间质间隙, 均能引起胰腺损伤. 乌司他丁组淀粉酶水平已明显低于三代显组, 表明乌司他丁可以减轻胰腺炎症反应. 原因可能与其抑制胰淀粉酶异位活化, 防止胰腺进一步水肿及胰管内压增高有关.
目前对ERCP术后胰腺损伤的预防和治疗已有多种方法[27], 如使用生长抑素及乌司他丁静脉途径给药[28], 这些方法虽能对术后胰腺损伤的发生与发展起到一定的作用, 但由于药物进入血液循环后需经一定时间才能作用于胰腺组织, 起效相对较慢; 近些年有人用区域动脉灌注的方法治疗胰腺炎[29-31], 但更适用于急性重症胰腺炎的治疗, 且为有创治疗方法, 故应用于ERCP术后胰腺损伤的预防和治疗的可行性还有待验证. 本实验提出ERCP术中使用乌司他丁, 对于因造影剂损伤胰腺而致的各种胰酶的活化可以起到一定的抑制作用, 减轻胰腺的自身消化, 从源头上保护胰腺组织. 此方法为ERCP术本身的步骤之一, 操作简单, 并发症少, 且改善了之前传统的治疗方法的治疗滞后性, 应用于ERCP术后胰腺损伤的临床预防和治疗有着良好的前景. 由于ERCP术后胰腺损伤的发生与注射量及注射速度等因素亦有相关性, 故应用于临床时注射造影剂与乌司他丁时的量与速度的掌握还有待研究.
近年来, ERCP术成为胆胰疾病诊断及治疗的主要手段之一; 但由于术中造影剂的注射, 使ERCP术后胰腺损伤成为其最常见的并发症, 严重者可发展为重症胰腺炎及系统性炎症反应综合征, 危及患者生命.
陈海龙, 教授, 大连医科大学附属第一医院
目前对ERCP术后胰腺损伤进行预防及治疗, 以求在损伤形成前或形成初期保护胰腺组织, 阻止瀑布样级联反应发生. 故有研究者提出术前用药或区域动脉灌注方法, 但静脉用药使胰腺局部血药浓度较低, 区域动脉灌注方法创伤较大, 其临床应用前景尚不明朗.
有研究提出术前及术后静脉使用抑制胰酶活性及分泌量的药物, 创伤较小, 患者易于接受;另有研究提出区域动脉灌注方法给药, 提高了胰腺局部血药浓度, 起效快, 但尚未应用于临床.
本方法为ERCP术本身的步骤之一, 操作简单, 并发症少, 药物起效早, 改善了之前传统的治疗方法的滞后性, 可广泛应用于临床.
乌司他丁: 是从人尿液中分离并纯化获得的一种蛋白酶抑制剂, 属糖蛋白, 具有抑制胰蛋白酶等各种胰酶活性的作用.
本文通过胰管注射乌司他丁预防ERCP术后胰腺的损伤, 有一定新意, 也有临床应用价值.
编辑: 张姗姗 电编:闫晋利
| 5. | Zhang ZF, Yang N, Zhao G, Zhu L, Zhu Y, Wang LX. Preventive effect of ulinastatin and gabexate mesylate on post-endoscopic retrograde cholangiopancreatography pancreatitis. Chin Med J (Engl). 2010;123:2600-2606. [PubMed] |
| 6. | Tsujino T, Kawabe T, Omata M. Antiproteases in preventing post-ERCP acute pancreatitis. JOP. 2007;8:509-517. [PubMed] |
| 7. | Pozsar J, Berger Z, Simon K, Kovacsai A, Marosi E, Pap A. Biphasic effect of prostaglandin E1 on the severity of acute pancreatitis induced by a closed duodenal loop in rats. Pancreas. 1996;12:159-164. [PubMed] [DOI] |
| 8. | Ueki T, Otani K, Kawamoto K, Shimizu A, Fujimura N, Sakaguchi S, Matsui T. Comparison between ulinastatin and gabexate mesylate for the prevention of post-endoscopic retrograde cholangiopancreatography pancreatitis: a prospective, randomized trial. J Gastroenterol. 2007;42:161-167. [PubMed] [DOI] |
| 12. | Seta T, Noguchi Y. Protease inhibitors for preventing complications associated with ERCP: an updated meta-analysis. Gastrointest Endosc. 2011;73:700-706. e1-e2. [PubMed] |
| 13. | Chen S, Shi H, Zou X, Luo H. Role of ulinastatin in preventing post-endoscopic retrograde cholangiopancreatography pancreatitis: the Emperor's New Clothes or Aladdin's Magic Lamp? Pancreas. 2010;39:1231-1237. [PubMed] [DOI] |
| 23. | Jun G, Zhi-jun T, Bao-liang Q, Fei L, Jia-bang S. Significance of trypsinogen activation peptides and interleukin-6 in experimental acute pancreatitis. Zhongguo Yixue Kexueyuan Xuebao. 2011;33:205-209. [PubMed] |
| 28. | 蔡 蔚. 乌司他丁治疗急性胰腺炎32例疗效分析. 苏州大学学报(医学版). 2006;26:1013-1014. |