修回日期: 2012-01-10
接受日期: 2012-02-16
在线出版日期: 2012-02-18
目的: 探讨超声内镜弹性成像(endoscopic ultrasound, EUS)在胰腺占位病变良恶性鉴别中的应用价值.
方法: 影像学结果并经超声内镜检查确定有胰腺占位性病变的患者入选, 对目标病变行超声内镜弹性成像检查, 按照弹性成像5分法对组织弹性成像进行评分, 将弹性成像评分为1, 2分归为良性, 3-5分归为恶性病变.
结果: 自2009-06/2011-06, 共27例符合标准的胰腺占位病变患者入选, 其中胰腺癌19例, 超声内镜弹性成像评分3分(n = 11)、4分(n = 5)、5分(n = 3), 无功能性良性内分泌肿瘤(4分)及低度恶性神经内分泌肿瘤(5分)各1例, 炎性病变6例, 评分1分(n = 1)、2分(n = 3)、3分(n = 2). 超声内镜弹性成像对27例胰腺占位病变良恶性鉴别中24例诊断准确, 诊断灵敏度100%, 特异度57.14%, 阳性预测值86.96%, 阴性预测值100%.
结论: 超声内镜弹性成像对胰腺良恶性病变的鉴别具有较高的准确性, 可望为疾病诊断提供新的影像学手段, 但其仍为一种影像学手段, 具有一定的局限性, 并不替代胰腺的细胞病理学检查.
引文著录: 徐凯, 徐萍, 任大宾, 李清华, 杨静, 于海滨. 超声内镜弹性成像在良恶性胰腺病变鉴别中的应用价值. 世界华人消化杂志 2012; 20(5): 425-429
Revised: January 10, 2012
Accepted: February 16, 2012
Published online: February 18, 2012
AIM: To investigate the usefulness of endoscopic ultrasound (EUS) elastography for the differential diagnosis of malignant and benign pancreatic masses.
METHODS: Patients with pancreatic masses were enrolled in this study. All patients were examined by EUS and EUS elastography. Elastographic pattern was scored with whole numbers from 1 to 5 based on the color of elastographic images. Scores 1 and 2 were classified as benign and scores 3 to 5 as malignant.
RESULTS: Elastography was successfully performed in all patients and there were no procedure-related complications. Nineteen patients were finally diagnosed with pancreatic carcinoma, 1 with malignant pancreatic neuroendocrine tumor, 1 with benign endocrine tumor and 6 with focal pancreatitis. According to our diagnostic criteria of elastography, the overall accuracy of EUS elastography for the differential diagnosis of focal pancreatic masses was 88.89% (24/27), with a sensitivity, specificity, positive predictive value and negative predictive value of 100%, 57.14%, 86.96% and 100%, respectively.
CONCLUSION: EUS elastography has a relatively high accuracy for the differentiation of benign and malignant pancreatic lesions and may provide an alternative method when EUS-FNA reveals negative results or cannot be performed because of technical problems.
- Citation: Xu K, Xu P, Ren DB, Li QH, Yang J, Yu HB. EUS elastography for the differential diagnosis of pancreatic masses. Shijie Huaren Xiaohua Zazhi 2012; 20(5): 425-429
- URL: https://www.wjgnet.com/1009-3079/full/v20/i5/425.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i5.425
超声弹性成像技术是超声影像诊断新技术, 通过对组织弹性系数的量化和可视化分析, 可对病变的良恶性做出鉴别, 目前已广泛应用于甲状腺、乳腺、肝脏等疾病的诊断. 近年来, 随着超声内镜技术的突飞猛进, 弹性成像技术也随之引入到超声内镜领域. 2006年, Giovannini等[1]首次报道了超声内镜弹性成像(endoscopic ultrasound, EUS)在淋巴结及胰腺肿块诊断应用中的初步研究, 随后, 国内外相继有文献报道超声内镜弹性成像在淋巴结、胰腺占位等的良恶性鉴别中的应用价值. 我们的初步研究也显示正常胰腺组织、胰腺良恶性病变有着不同的弹性成像特征[2]. 本研究旨在通过对不同胰腺病变超声内镜弹性成像特征的分析, 探讨其在良恶性鉴别中的应用价值.
具有超声实时弹性成像功能的Hitachi EUB-8500型彩色多普勒超声诊断仪(日立公司); EG-3630 UR环扫型电子超声内镜(PENTAX公司, 最大末端直径12.1 mm, 工作长度1 250 mm; 扫描范围270°, 超声频率5-10 MHz可变); EG-3830 UT凸面线阵型电子超声内镜(最大末端直径12.8 mm, 工作长度1 250 mm; 扫描范围120°, 超声频率5-10 MHz可变); 超声内镜穿刺针选用日本OLYMPUS公司NA-200H-8022型22G超声内镜专用穿刺针.
1.2.1 入选及剔除标准: 入选标准: (1)影像学发现并经超声内镜检查确定有胰腺占位性病变的患者; (2)18岁≤年龄≤80岁, 能够耐受超声内镜检查的患者; (3)签署知情同意书. 剔除标准: (1)因肿瘤浸润等造成消化系管腔高度狭窄无法行超声内镜检查者; (2)一般状况极差, 无法耐受超声内镜检查者; (3)最终无法获得明确诊断的患者; (4)拒绝签署知情同意书的患者.
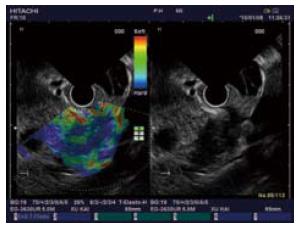
1.2.2 超声内镜弹性成像检查方法: 检查方法同常规超声内镜检查, 首先通过B模式灰阶成像进行常规检查, 了解病灶的部位、大小、形态及内部回声特征, 然后根据探查结果确定拟行超声弹性成像的目标区域. 将超声影像切换至实时弹性成像模式, 此时超声显示器同时同步显示超声弹性成像影像(左侧)和常规灰阶成像超声影像(右侧), 调整超声感兴趣区域(region of interest, ROI)至适当的大小, 包括目标区域及其周围适当大小的临近组织区域, 对组织的压迫借助呼吸运动、胸、腹腔大动脉搏动及探头的压迫产生加压作用, 从而获取目标部位的弹性成像图像. 因超声弹性成像常不稳定、且色彩多变, 为保证准确性, 只有弹性成像影像可稳定持续5 s者保存图像以供分析.
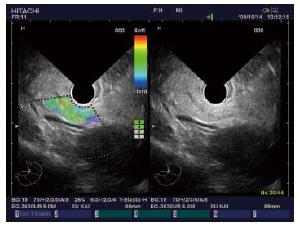
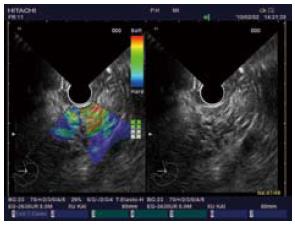
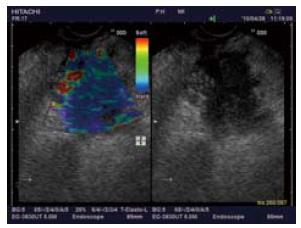
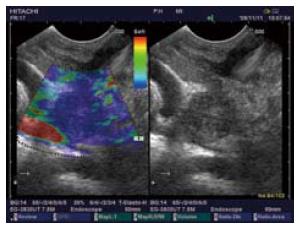
1.2.3 超声内镜弹性成像评分及诊断标准: 根据我们前期初步研究的结果并参考国内外文献报道[1-3], 将超声内镜弹性成像影像分为: 目标组织与周围组织呈均匀的绿色为1分; 组织呈绿、黄、红互相混杂的马赛克状为2分; 蓝色与其他颜色相混杂呈蜂窝状结构为3分; 呈均匀蓝色为4分; 呈蓝色为主, 其间混有较大的红色或绿色区为5分. 将弹性成像评分为1, 2分的病变判断为良性病变, 3-5分为恶性病变.
1.2.4 诊断标准: (1)行外科手术治疗的患者以手术切除标本病理学诊断为诊断标准; (2)EUS-FNA细胞/病理学诊断为恶性的非手术治疗患者, 以穿刺细胞/病理学诊断为诊断标准; (3)EUS-FNA为阴性或未行EUS-FNA且未行手术治疗的患者, 依据临床症状、影像学(CT、MR、EUS等)特征、肿瘤标志物等做出临床诊断并随访至患者因胰腺癌死亡或至少1年的临床随访排除恶性病变作为诊断标准.
2009-06/2011-06, 共27例符合标准的胰腺占位病变患者入选, 其中男(n = 15), 女(n = 12), 年龄最大77岁, 最小40岁, 平均63.5岁. 病变位于胰腺头部(n = 16)、体部(n = 8)、尾部(n = 3), 病变直径最大7.7 cm, 最小1.5 cm, 平均3.56 cm.
病变最终诊断为胰腺癌19例, 无功能性良性内分泌肿瘤及低度恶性神经内分泌肿瘤各1例, 炎性病变6例. 7例胰腺癌及2例内分泌肿瘤行手术切除治疗确诊, 其中3例胰腺癌患者同时行EUS-FNA, 1例阳性、2例阴性; 另3例胰腺癌患者仅行EUS-FNA并均获得阳性结果而确诊, 其余9例胰腺癌患者未行手术及EUS-FNA, 为临床诊断并均随访至患者因病死亡而确诊, 自诊断至死亡的时间为1-5 mo, 平均2.4 mo. 6例诊断为炎性病变患者均经临床随访1年以上排除恶性病变, 随访期为12-19 mo, 平均14.7 mo. 其中1例曾行EUS-FNA为阴性.
所有入选患者均成功进行了超声内镜实时弹性成像检查并获得了满意的弹性成像图像, 所有患者包括7例行EUS-FNA的患者均无操作相关不良反应及并发症发生.
2.2.1 超声内镜弹性成像评分: 6例炎性病变的超声内镜弹性成像中, 评分1分(n = 1)、2分(n = 3)、3分(n = 2); 良性内分泌肿瘤为4分、恶性内分泌肿瘤为5分; 19例胰腺癌中3分(n = 11)、4分(n = 5)、5分(n = 3). 2例EUS-FNA为阴性的胰腺癌患者, 1例病变位于胰腺钩突部位, 1例病变位于胰腺体部但患者存在严重的脊柱畸形, 均因穿刺困难导致假阴性, 但超声内镜弹性成像评分均为3分, 提示为恶性病变并得到了手术切除标本的病理证实(图1-5).
2.2.2 超声内镜弹性成像对病变良恶性判断准确性: 与最终诊断相对照, 1例胰腺良性内分泌肿瘤评分为4分, 2例炎性病变评分为3分, 按照超声内镜弹性成像诊断标准误判为恶性病变, 其余患者均判断正确. 超声内镜弹性成像对27例胰腺占位病变良恶性判断24例准确, 诊断灵敏度100%, 特异度57.14%, 阳性预测值86.96%, 阴性预测值100%.
EUS为诊断胰腺癌和胰腺其他占位性病变的最佳方法, 对胰腺占位性病变, 特别对检出直径<2 cm的病灶非常敏感, 甚至可发现直径小于5 mm的微小病灶. 研究显示其对早期胰腺癌的显示率>90%, 敏感性达98%, 优于腹部超声和CT等[4,5]. 然而, 对于检出的胰腺占位性病变, 仅依据EUS及其他影像学特征, 往往难以对其良、恶性做出准确的判断. 故近年来, 临床上尝试开展了一系列的新技术以提高超声内镜影像学诊断的准确性, 包括造影增强超声内镜及超声内镜弹性成像技术等[6-8].
超声弹性成像技术是通过探头压迫目标部位, 对采集图像内感兴趣区域(region of interest, ROI)进行多种声学参数的测定, 得到组织内部位移, 推算出其应变分布及弹性系数分布成像, 并以相应的颜色显示, 使组织弹性系数(软硬度)得以量化和可视化. 他在明确病变性质和鉴别病变良恶性方面提供了有效补充, 表现出了良好的应用前景, 是近年来临床上出现的一种超声影像诊断新技术, 已经被应用于甲状腺、乳腺、肝脏等疾病的诊断、研究中[9]. 但由于胰腺位于后腹膜深部, 常规腹部超声探查易受临近脏器及气体的干扰, 造成显像不清, 且无法应用探头压迫, 影响了超声弹性成像技术在胰腺疾病诊断的应用.
超声内镜实时组织弹性成像技术是将超声弹性成像与超声内镜相融合的最新超声内镜诊断技术, 使对胰腺疾病的超声弹性成像检查成为可能. 在超声内镜探查的同时, 借助呼吸运动、动脉搏动及探头的压迫对病变进行超声弹性成像, 在获得组织常规超声影像的同时, 可对其弹性系数(软硬度)做出判断, 从而对病变性质及良恶性鉴别方面提供进一步的信息. 该技术目前国内外已在临床初步展开, 2009年Giovannini等[3]的一项多中心临床研究显示超声内镜弹性成像对胰腺良恶性病变的诊断准确度、灵敏度、特异度、阳性预测值和阴性预测值分别达89.2%、92.3%、80.0%、93.3%、77.4%, 对良恶性淋巴结分别为88.1%、91.8%、82.5%、88.8%、86.8%, 优于常规超声内镜. 国内, 孙思予等[10]的研究结果显示超声内镜弹性成像对恶性淋巴结判断的灵敏度和特异度分别为91.1%和60%. 上述结果初步证实了该技术的有效性及其临床价值.
本研究尝试根据超声内镜弹性成像评分对胰腺占位病变良恶性进行判断, 探讨该技术在胰腺疾病鉴别诊断中的临床应用价值, 结果显示超声内镜弹性成像对胰腺良恶性的判断有着较高的准确性. 我们前期研究显示正常胰腺及良性病变质地柔软、顺应性良好, 弹性成像评分多呈1-2分, 相反恶性病变则质地僵硬弹性差, 故弹性成像常以蓝色为主, 评分呈3-5分, 故本研究将弹性成像良恶性判断标准设定为弹性成像1-2分为良性病变, 3-5分为恶性病变. 根据该判断标准, 本组27例胰腺占位病变患者24例判断准确, 其诊断的灵敏度、特异度、阳性预测值、阴性预测值分别为100%、57.14%、86.96%、100%, 与国外近期类似临床研究报道的结果接近. 对3例误判的患者进行分析显示, 1例为良性无功能性内分泌肿瘤, 呈弹性成像评分4分, 查阅国外文献报道也显示内分泌肿瘤多呈均一的蓝色改变, 与本研究结果一致, 但所涉病例数均较少, 有待于进一步临床积累[11]. 另2例误判患者为炎性病变, 因评分为3分而判断为恶性, 分析其原因可能与部分炎性病变内部常存在不同程度的组织纤维化改变有关, 从而使病变局部组织较周边组织僵硬, 而造成弹性成像的误判, 国外部分研究也认为超声内镜弹性成像在炎性病变与恶性病变的判断上具有一定的局限性[12]. 这提示如何将弹性影像特征进一步细化以提高对炎性病变及内分泌肿瘤的鉴别准确性仍是弹性成像研究中的难点.
尽管超声内镜作为一种影像学检查手段仍具有一定的局限性, 但对于不愿或不适合进行超声内镜引导细针穿刺抽吸术(endoscopic ultrasound guided fine needle aspiration, EUS-FNA)的患者, 超声内镜弹性成像可为鉴别诊断提供重要的影像学. 本组27例胰腺占位患者中20例患者因各种原因未行EUS-FNA, 但根据弹性成像影像特点对绝大多数患者做出了正确的诊断. 此外, 将超声内镜弹性成像与EUS-FNA相结合, 可望提高其诊断的准确性, 克服EUS-FNA阴性预测值相对较低的缺点, 本组2例患者因病变穿刺困难未获得满意的穿刺标本, 造成EUS-FNA假阴性, 但结合超声内镜弹性成像做出了正确的诊断, 并得到了手术结果的证实.
在研究过程中我们也发现, 进行超声内镜弹性成像检查时影像常不易稳定、且色彩多变, 同一病变因压力的不同可呈现不同的影像特征, 故易受到操作者的技术水平及个人主观性的影响. 本研究为克服上述缺点, 仅对弹性成像影像可稳定持续5 s以上者进行结果分析, 但检查结果仍易受超声内镜操作者的主观性的影响, 且弹性成像5分评分法为半定量分析方法, 在对超声内镜弹性成像进行结果分析时具有一定的缺陷. 近年来, 国外已开始尝试应用计算机辅助的连续动态定量化分析方法进行结果分析, 以克服前述缺陷[13-15]. 相信随着研究深入, 经验的积累, 新的结果分析手段的使用, 超声内镜弹性成像技术必将逐步克服其缺陷, 成为一项成熟的诊断技术应用于临床.
近年来, 随着科技的发展, 将弹性成像技术整合于超声内镜系统内, 利用超声内镜对胰腺等诊断的优势, 使对上述脏器的超声弹性成像检查得以实现, 目前国内外已展开了超声内镜弹性成像临床应用的初步探索.
孙明军, 教授, 中国医科大学附属第一医院内镜中心
超声内镜弹性成像技术是超声内镜影像学检查新技术. 目前研究主要集中在对淋巴结、胰腺占位等的良恶性鉴别中的应用.
国外相继有文献报道超声内镜弹性成像在淋巴结、胰腺占位等的良恶性鉴别中的应用价值, 均显示其较高的准确性和灵敏度. Săftoiu等尝试了对超声内镜弹性成像进行计算机连续动态定量分析方法在淋巴结及胰腺占位病变诊断中的应用, 并于2011年报道了欧洲多中心研究的结果.
本文尝试应用超声内镜弹性成像技术诊断胰腺占位病变的良恶性, 目前, 国内该领域相关经验及报道尚少. 根据我们前期的经验, 应用超声弹性5分法评分标准对良恶性胰腺病变进行判断, 显示其较高的准确度和灵敏度.
超声弹性成像: 是通过探头压迫目标部位, 对采集图像内感兴趣区域进行多种声学参数的测定, 得到组织内部位移, 推算出其应变分布及弹性系数分布成像, 并以相应的颜色显示, 使组织弹性系数(软硬度)得以量化和可视化.
超声内镜弹性成像技术是近年发展起来新技术, 本文应用超声内镜弹性成像技术总结了27例胰腺肿瘤的图像特点, 对临床具有一定的指导意义.
编辑: 张姗姗 电编:闫晋利
| 1. | Giovannini M, Hookey LC, Bories E, Pesenti C, Monges G, Delpero JR. Endoscopic ultrasound elastography: the first step towards virtual biopsy? Preliminary results in 49 patients. Endoscopy. 2006;38:344-348. [PubMed] [DOI] |
| 3. | Giovannini M, Thomas B, Erwan B, Christian P, Fabrice C, Benjamin E, Geneviève M, Paolo A, Pierre D, Robert Y. Endoscopic ultrasound elastography for evaluation of lymph nodes and pancreatic masses: a multicenter study. World J Gastroenterol. 2009;15:1587-1593. [PubMed] [DOI] |
| 4. | Hunt GC, Faigel DO. Assessment of EUS for diagnosing, staging, and determining resectability of pancreatic cancer: a review. Gastrointest Endosc. 2002;55:232-237. [PubMed] [DOI] |
| 5. | Shami VM, Mahajan A, Loch MM, Stella AC, Northup PG, White GE, Brock AS, Srinivasan I, de Lange EE, Kahaleh M. Comparison between endoscopic ultrasound and magnetic resonance imaging for the staging of pancreatic cancer. Pancreas. 2011;40:567-570. [PubMed] [DOI] |
| 7. | Săftoiu A, Iordache SA, Gheonea DI, Popescu C, Maloş A, Gorunescu F, Ciurea T, Iordache A, Popescu GL, Manea CT. Combined contrast-enhanced power Doppler and real-time sonoelastography performed during EUS, used in the differential diagnosis of focal pancreatic masses (with videos). Gastrointest Endosc. 2010;72:739-747. [PubMed] [DOI] |
| 8. | Sakamoto H, Kitano M, Matsui S, Kamata K, Komaki T, Imai H, Dote K, Kudo M. Estimation of malignant potential of GI stromal tumors by contrast-enhanced harmonic EUS (with videos). Gastrointest Endosc. 2011;73:227-237. [PubMed] [DOI] |
| 9. | Frey H. [Realtime elastography. A new ultrasound procedure for the reconstruction of tissue elasticity]. Radiologe. 2003;43:850-855. [PubMed] [DOI] |
| 11. | Iglesias-Garcia J, Larino-Noia J, Abdulkader I, Forteza J, Dominguez-Munoz JE. EUS elastography for the characterization of solid pancreatic masses. Gastrointest Endosc. 2009;70:1101-1108. [PubMed] [DOI] |
| 12. | Janssen J, Schlörer E, Greiner L. EUS elastography of the pancreas: feasibility and pattern description of the normal pancreas, chronic pancreatitis, and focal pancreatic lesions. Gastrointest Endosc. 2007;65:971-978. [PubMed] [DOI] |
| 13. | Săftoiu A, Vilmann P, Ciurea T, Popescu GL, Iordache A, Hassan H, Gorunescu F, Iordache S. Dynamic analysis of EUS used for the differentiation of benign and malignant lymph nodes. Gastrointest Endosc. 2007;66:291-300. [PubMed] [DOI] |
| 14. | Săftoiu A, Vilmann P, Gorunescu F, Gheonea DI, Gorunescu M, Ciurea T, Popescu GL, Iordache A, Hassan H, Iordache S. Neural network analysis of dynamic sequences of EUS elastography used for the differential diagnosis of chronic pancreatitis and pancreatic cancer. Gastrointest Endosc. 2008;68:1086-1094. [PubMed] [DOI] |