修回日期: 2011-12-05
接受日期: 2012-02-17
在线出版日期: 2012-02-18
目的: 探讨选择性环氧合酶-2(COX-2)抑制剂尼美舒利在乙基硝基亚硝基胍(ENNG)诱导大鼠胃癌癌前病变发展过程的作用以及可能机制.
方法: 6周龄♂Wistar大鼠给予浓度为100 mg/L的ENNG溶液饮用14 wk后, 使用浓度为300 mg/L和1 200 mg/L的尼美舒利溶液由大鼠自由饮用, 分别在喂养14、26和38 wk后观察大鼠胃黏膜病变. 使用免疫组织化学的方法观察大鼠病变胃黏膜COX-2蛋白、Bcl-2蛋白以及PCNA的表达, TUNEL法检测大鼠胃黏膜细胞凋亡.
结果: 药物干预的大鼠胃癌癌前病变的发生率显著低于对应的非用药组(P<0.05); 药物干预组大鼠病变胃黏膜的COX-2蛋白和Bcl-2蛋白表达分别为17.6%, 35.3%, 显著低于非用药组的60%和84%(P<0.05); 增殖指数18.9±4.57显著低于非用药组49.43±7.92(P<0.05); 凋亡指数13.6±1.82显著高于非用药组2.12±0.53(P<0.05); COX-2蛋白和Bcl-2蛋白与PCNA的表达以及凋亡指数具有相关性(P<0.01).
结论: 选择性COX-2抑制剂尼美舒利能有效抑制ENNG诱导的大鼠胃癌癌前病变的发展, 其机制可能是通过抑制COX-2、Bcl-2蛋白的表达, 从而抑制病变胃黏膜细胞的增殖以及诱导其凋亡.
引文著录: 张丽, 刘文忠, 陆红, 陈晓宇, 彭延申. 尼美舒利抑制乙基硝基亚硝基胍诱导大鼠胃癌癌前病变的作用机制. 世界华人消化杂志 2012; 20(5): 405-409
Revised: December 5, 2011
Accepted: February 17, 2012
Published online: February 18, 2012
AIM: To investigate the inhibitory effect of nimesulide, a selective cyclooxygenase (COX)-2 inhibitor, on the development of N-ethyl-N-nitro-N-nitrosoguanidine (ENNG)-induced gastric precanerous lesions in rats.
METHODS: Six-week-old male Wistar rats were given 100 mg/L of ENNG in their drinking water for 14 wk and then fed a diet containing nimesulide at doses of 300 mg/L and 1200 mg/L for 12 or 24 wk. The rats were sacrificed 14, 26 and 38 wk after nimesulide feeding to detect the changes in the gastric mucosa. The expression of COX-2, Bcl-2 and PCNA in the gastric mucosa was detected by immunohitochemistry, and cell apoptosis was determined using TUNEL assay.
RESULTS: Nimesulide significantly reduced the incidence of gastric precancerous lesions compared to controls (P < 0.05). The positive rates of COX-2 and Bcl-2 protein expression and proliferation index in the nimesulde group were significantly lower than those in the control group (17.6% vs 60%, 35.3% vs 84%, 18.9 ± 4.57 vs 49.43 ± 7.92, all P < 0.05), while the apoptotic index was significantly higher in the nimesulde group than in the control group (13.6 ± 1.82 vs 2.12 ± 0.53, P < 0.05). The expression of COX-2 and Bcl-2 protein was associated with proliferation index and apoptotic index (P < 0.01).
CONCLUSION: Nimesulide has inhibitory effects on the development of ENNG-induced gastric precancerous lesions in rats possibly via mechanisms associated with reducing COX-2 and Bcl-2 expression, inhibiting proliferation and inducing apoptosis of gastric epithelial cells.
- Citation: Zhang L, Liu WZ, Lu H, Chen XY, Peng YS. Inhibitory effect of nimesulide on the development of N-ethyl-N-nitro-N-nitrosoguanidine-induced gastric precancerous lesions in rats. Shijie Huaren Xiaohua Zazhi 2012; 20(5): 405-409
- URL: https://www.wjgnet.com/1009-3079/full/v20/i5/405.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i5.405
胃黏膜萎缩、肠化和不典型增生是胃癌的癌前病变, 与胃癌的发生关系密切, 对此类病变的预防和逆转是抑制胃癌发生的关键. 本研究通过观察选择性环氧合酶-2(Cyclooxygenase-2, COX-2)抑制剂尼美舒利(Nimesulide)对乙基硝基亚硝基胍(N-ethyl-N-nitro-N-nitrosoguanidine, ENNG)诱发大鼠胃癌前病变发展过程的影响, 探讨选择性COX-2抑制剂对胃癌前病变的抑制作用及其可能机制.
ENNG购自美国Aldrich Chem公司. 尼美舒利购自杭州尼生药业公司. ENNG储存溶液每周配置一次, 4 ℃保存; 尼美舒利液为当天新鲜配置; 两种药物均溶解于去离子水中. 浓度为100 mg/L的ENNG液和浓度为300 mg/L和1 200 mg/L的尼美舒利液由实验动物自行饮用. COX-2鼠多克隆抗体(160106), 美国Cayman公司产品; Bcl-2鼠单克隆抗体(SC-7382), 美国Santa Cruz公司产品; PCNA鼠单克隆抗体(ZM-0213), 广州中山产品; 免疫组化染色ABC试剂盒(PK-4001), 美国Vector公司; DAB显色剂(KT9001D3), 福州迈新生物技术开发有限公司; TUNEL试剂盒, 美国ONCOGENE产品.
1.2.1 分组: 实验动物为无特殊病原菌(S.P.F)级6周龄♂Wistar大鼠, 体质量160 g±8 g, 购于中国科学院动物中心, 置于标准实验条件下(室温24 ℃±2 ℃; 相对湿度55%±5%; 每12 h进行1次亮/暗循环)用混合饲料饲养. 96只大鼠随机分为8组, 每组12只.
1.2.2 给药: 阴性对照组(P组): 仅给予混合饲料和纯净水饲养; M1、M2、M3组: ENNG平均饮用量每只1.5 mg/d, 饮用14 wk后, M1组处死, M2和M3组分别饮用纯净水至26、38 wk后分别处死. NL1、NL2组: ENNG饮用量同M1、M2、M3组, 14 wk后开始饮用300 mg/L尼美舒利液, 平均饮用量为每只2 mg/d, 分别至26 wk、38 wk; NH1、NH2组: ENNG饮用量同M1、M2、M3组, 14 wk后开始饮用1 200 mg/L尼美舒利液, 平均饮用量为每只8 mg/d, 分别至26 wk、38 wk后分别处死. 大鼠每4 wk称体质量1次, 至各组实验结束, 所有大鼠都使用氯胺酮100 mg/kg麻醉后剖腹取胃并处死. 胃从大弯侧剖开, 进行大体标本观察后用10%甲醛固定. 固定的标本沿纵轴切为3-4小块, 石蜡包埋, 切片后分别用苏木精-伊红(HE)染色后进行病理组织学诊断、免疫组化测定以及TUNEL检测.
1.2.3 免疫组织化学测定: 切片厚4 μm, 载于赖氨酸涂抹玻片上, 烤片60 ℃ 1 h. 脱蜡和水化: 依次二甲苯30 min(间隔10 min换液1次)、100%乙醇10 min、95%乙醇20 min(间隔10 min换液1次)、水洗6 min(间隔3 min换液1次). 流水冲洗5 min、1×PBS缓冲液5 min×3次. 内源性过氧化物酶阻断试剂37 ℃ 10 min; PBS缓冲液5 min×3次. 10 mmol/L柠檬酸缓冲液(pH 6.0±0.1)微波炉高温抗原修复. 正常血清封闭抗原室温孵育30 min; 1×PBS缓冲液5 min×3次. COX-2鼠多克隆抗体(1/100)、Bcl-2鼠单克隆抗体(1/80)、PCNA鼠单克隆抗体(1/100), 每张切片加50 μL; 阴性对照加1×PBS 50 μL, 4 ℃过夜. 冰箱取出恢复至室温约90 min; 1×PBS缓冲液5 min×3次. 生物素标记的羊抗兔IgG室温孵育60 min; 1×PBS缓冲液5 min×3次. 卵白素-辣根酶标记生物素室温孵育60 min; 1×PBS缓冲液5 min×3次. DAB显色, 约30 s左右用流水中止反应; 流水5 min、苏木素复染1 min、盐酸分化2 s、风干; 中性树脂封片, 光学显微镜下观察实验结果. COX-2和Bcl-2蛋白的表达按照以下标准进行半定量分析: 染色的强度分为0、1(+)、2(++)、3(+++)和4(++++); 对应的阳性细胞的比例分别为0(0-10%)、1(11%-25%)、2(26%-50%)、3(50%-75%)和4(>75%); 将以上2项的分值相乘得到半定量的分值, 最小为0、最大为16.5个高倍视野下PCNA阳性的细胞比例作为增殖指数(PI).
1.2.4 TUNEL法测定凋亡: 根据TUNEL试剂盒的说明进行如下操作: 切片逐步脱蜡至水, 1×PBS冲洗. 蛋白酶K(10 mmol/L Tris-HCL中含20 mg/L)室温孵育20 min, 加入3%H2O2室温放置10 min, TDT标记反应混合物37 ℃ 60 min, 转化剂-POD 37 ℃ 30 min后DAB 显色、苏木素复染; 1×PBS代替一抗作为阴性对照, 封片后光学显微镜下观察实验结果. 5个高倍视野下TUNEL染色阳性的细胞比例作为凋亡指数(AI).
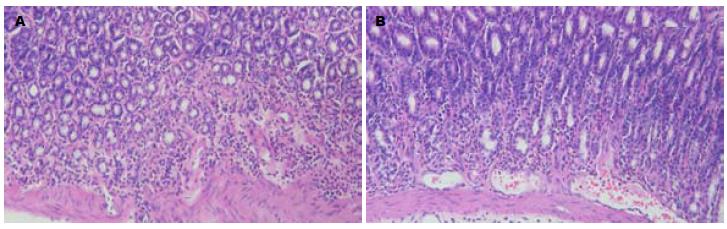
大鼠胃组织分前胃和腺胃, 经组织学观察证实大鼠胃黏膜癌前病变的发生主要在腺胃(图1). P组无癌前病变的发生(0/12). M1组癌前病变的发生率为25%(3/12), M2组为83.3%(10/12), M3组为100%(12/12); NL1组为25%(3/12), NL2组为41.7%(5/12); NH1组为33.3%(4/12), NH2组为41.7%(5/12). 统计结果表明, 用药至26 wk的NL1组和NH1组癌前病变发生率均显著低于对照的M2组(P<0.05); 用药至38 wk的NL2组和NH2 组癌前病变发生率均显著低于对照的M3组(P<0.05); NL1、NL2组和NH1、NL2 组之间癌前病变发生率无显著差异(P>0.05)并且与14 wk处理的M1组癌前病变发生率也没有显著差异(P>0.05, 表1).
| P | M1 | M2 | M3 | NL1 | NL2 | NH1 | NH2 | |
| 萎缩 | 0/12 | 0/12 | 1/12 | 2/12 | 0/12 | 1/12 | 1/12 | 1/12 |
| 肠化 | 0/12 | 1/12 | 2/12 | 2/12 | 0/12 | 0/12 | 1/12 | 1/12 |
| 异形增生 | 0/12 | 2/12 | 7/12 | 8/12 | 3/12 | 4/12 | 2/12 | 3/12 |
| 癌前病变率(%) | 0(0/12) | 25.0(3/12) | 83.3(10/12) | 100(12/12) | 25.0(3/12) | 41.7(5/12) | 33.3(4/12) | 41.7(5/12) |
将M1、M2和M3组的癌前病变组织(n = 25)作为非用药组; NL1、NL2、NH1 和NH2的癌前病变组织(n = 17)作为干预组. COX-2蛋白在非用药组的阳性率是60%(15/25), 在干预组的阳性率是17.6%(3/17), 两者之间存在显著差异(P<0.05). Bcl-2蛋白在非用药组的阳性率是84%(21/25), 与干预组的35.3%(6/17)比较存在显著差异(P<0.05). 非用药组的胃黏膜上皮细胞增殖指数(PI)为49.43±7.92, 干预组为18.9±4.57, 两组间存在显著差异(P<0.05). COX-2蛋白表达(r = 0.786, P = 0.0001)和Bcl-2蛋白的表达(r = 0.899, P = 0.0001)与PI呈正相关. AI值非用药组的为2.12±0.53, 干预组为13.6±1.82, 两组间存在显著差异(P<0.05). COX-2蛋白的表达(r = -0.824, P = 0.0001)和Bcl-2蛋白的表达(r = -0.892, P = 0.0001)与AI呈负相关(表2).
| 癌前病变胃黏膜 | COX-2表达 | Bcl-2表达 | 增殖指数 | 凋亡指数 |
| 非用药组(n = 25) | 60(15/25) | 84(21/25) | 49.43±7.92 | 2.12±0.53 |
| 干预组(n = 17) | 17.6(3/17) | 35.3(6/17) | 18.9±4.57 | 13.6±1.82 |
| P值 | 0.037 | 0.025 | <0.001 | <0.001 |
目前COX-2抑制剂在不同肿瘤及其癌前病变中的作用和机制得到了广泛的研究, 对胃癌及其癌前病变的大多数研究都集中在体外实验[1-5]. 基于体外实验的研究结果, 本实验通过对大鼠胃黏膜癌前病变发展过程中选择性COX-2抑制剂作用的体内实验研究, 进一步了解选择性COX-2抑制剂在胃癌癌前病变发生、发展各阶段的作用及其可能的作用机制.
本实验研究结果表明, 选择性COX-2抑制剂尼美舒利可以抑制大鼠胃癌前病变的发展过程, 降低癌前病变的发生率并具有化学预防作用. 本实验中使用尼美舒利干预至26 wk的NL1组和NH1组癌前病变的发生率分别为25%和33.3%, 明显低于不用尼美舒利干预M2组的83.3%(P<0.05); 使用尼美舒利干预至38 wk的NL2组和NH2组癌前病变的发生率均为41.7%, 也显著低于相应不用尼美舒利干预M3组的100%(P<0.05). 此外, 药物干预组与14 wk处理的M1组癌前病变的发生率比较无显著差异(P>0.05), 提示选择性COX-2抑制剂尼美舒利可以抑制大鼠胃癌前病变的发生、发展过程. 本研究中采用了2种不同剂量的尼美舒利进行不同时间段的干预, 结果显示, 2种剂量的尼美舒利在不同时间段对癌前病变的抑制作用无显著差别, 提示较低剂量的药物在预防大鼠胃癌前病变中就可以取得较好的效果. 这与不同剂量阿司匹林对大肠癌预防作用的流行病学的研究结果一致[6-9].
研究表明, COX-2和Bcl-2蛋白的高表达和凋亡发生率的降低是肿瘤发生、发展过程中的重要因素, 并且Bcl-2蛋白的高表达与COX-2蛋白的高表达在肿瘤的发生过程具有相关性. 选择性COX-2抑制剂可以通过抑制COX-2、Bcl-2的表达, 诱导凋亡的发生来抑制肿瘤细胞的生长[10-15]. 我们的研究结果表明, 尼美舒利可以通过抑制COX-2和Bcl-2的表达, 抑制胃黏膜上皮细胞增殖; 诱导其凋亡, 从而抑制ENNG所诱导的大鼠胃黏膜癌前病变的发展. 尼美舒利干预组的COX-2和Bcl-2蛋白的表达率分别为17.6%和35.3%, 明显低于非用药组的60%和84%(P<0.05). 干预组的PI值为18.9±4.57, 显著低于非用药组的49.43±7.92(P<0.05). COX-2蛋白的表达与PI正相关(r = 0.786, P = 0.0001), Bcl-2蛋白的表达和PI正相关(r = 0.899, P = 0.0001); 即COX-2和Bcl-2蛋白高表达时PI值高, COX-2和Bcl-2蛋白低表达时PI值低; 尼美舒利通过抑制COX-2和Bcl-2蛋白的表达来抑制大鼠病变胃黏膜细胞的增殖. 尼美舒利干预组的AI值为13.6±1.82显著高于非用药组的2.12±0.53(P<0.05); COX-2蛋白的表达和AI负相关(r = -0.824, P = 0.0001), Bcl-2蛋白的表达和PI负相关(r = -0.892, P = 0.0001); 即COX-2和Bcl-2蛋白低表达时AI值高, 尼美舒利可以通过抑制COX-2和Bcl-2蛋白的表达来诱导大鼠病变胃黏膜细胞的凋亡.
总之, 选择性COX-2抑制剂尼美舒利可以通过抑制COX-2和Bcl-2的表达, 抑制胃黏膜上皮细胞增殖; 诱导其凋亡, 从而有效抑制ENNG所诱导的大鼠胃黏膜癌前病变的发展, 降低其癌前病变的发生率. 虽然这仅是动物模型的研究, 但这为选择性COX-2抑制剂应用于胃癌癌前病变的预防和治疗提供了有力的依据; 并进一步证实了COX-2在肿瘤发生的早期具有重要的作用.
胃黏膜萎缩、肠化和不典型增生是胃癌的癌前病变, 与胃癌的发生关系密切, 对此类病变的预防和逆转是抑制胃癌发生的关键.
邹小明, 教授, 哈尔滨医科大学附属第二医院普外二科
研究表明, COX-2和Bcl-2蛋白的高表达和凋亡发生率的降低是肿瘤发生、发展过程中的重要因素, 并且Bcl-2蛋白的高表达与COX-2蛋白的高表达在肿瘤的发生过程具有相关性. 选择性COX-2抑制剂可以通过抑制COX-2、Bcl-2的表达, 诱导凋亡的发生来抑制肿瘤细胞的生长.
选择性COX-2抑制剂尼美舒利可以通过抑制COX-2和Bcl-2的表达, 抑制胃黏膜上皮细胞增殖; 诱导其凋亡, 从而有效抑制ENNG所诱导的大鼠胃黏膜癌前病变的发展, 降低其癌前病变的发生率.
文章有一定的科学性和创新性, 能够反映当前胃肠病学的研究水平.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Hu KQ. Rationale and feasibility of chemoprovention of hepatocellular carcinoma by cyclooxygenase-2 inhibitors. J Lab Clin Med. 2002;139:234-243. [PubMed] [DOI] |
| 2. | Yamazaki R, Kusunoki N, Matsuzaki T, Hashimoto S, Kawai S. Selective cyclooxygenase-2 inhibitors show a differential ability to inhibit proliferation and induce apoptosis of colon adenocarcinoma cells. FEBS Lett. 2002;531:278-284. [PubMed] [DOI] |
| 3. | Sugiura T, Saikawa Y, Kubota T, Suganuma K, Otani Y, Watanabe M, Kumai K, Kitajima M. Combination chemotherapy with JTE-522, a novel selective cyclooxygenase-2 inhibitor, and cisplatin against gastric cancer cell lines in vitro and in vivo. In Vivo. 2003;17:229-233. [PubMed] |
| 4. | Sitarz R, Leguit RJ, de Leng WW, Morsink FH, Polkowski WP, Maciejewski R, Offerhaus GJ, Milne AN. Cyclooxygenase-2 mediated regulation of E-cadherin occurs in conventional but not early-onset gastric cancer cell lines. Cell Oncol. 2009;31:475-485. [PubMed] |
| 5. | Fife RS, Stott B, Carr RE. Effects of a selective cyclooxygenase-2 inhibitor on cancer cells in vitro. Cancer Biol Ther. 2004;3:228-232. [PubMed] [DOI] |
| 6. | Kim S, Baron JA, Mott LA, Burke CA, Church TR, McKeown-Eyssen GE, Cole BF, Haile RW, Sandler RS. Aspirin may be more effective in preventing colorectal adenomas in patients with higher BMI (United States). Cancer Causes Control. 2006;17:1299-1304. [PubMed] [DOI] |
| 7. | Iwama T. NSAIDs and colorectal cancer prevention. J Gastroenterol. 2009;44 Suppl 19:72-76. [PubMed] [DOI] |
| 8. | Watson AJ. An overview of apoptosis and the prevention of colorectal cancer. Crit Rev Oncol Hematol. 2006;57:107-121. [PubMed] [DOI] |
| 10. | Ushio A, Takikawa Y, Lin SD, Miyamoto Y, Suzuki K. Induction of Bcl-xL is a possible mechanism of anti-apoptotic effect by prostaglandin E2 EP4-receptor agonist in human hepatocellular carcinoma HepG2 cells. Hepatol Res. 2004;29:173-179. [PubMed] [DOI] |
| 11. | Konturek PC, Brzozowski T, Duda A, Kwiecien S, Löber S, Dembinski A, Hahn EG, Konturek SJ. Epidermal growth factor and prostaglandin E(2) accelerate mucosal recovery from stress-induced gastric lesions via inhibition of apoptosis. J Physiol Paris. 2001;95:361-367. [PubMed] [DOI] |
| 12. | Fosslien E. Review: molecular pathology of cyclooxygenase-2 in cancer-induced angiogenesis. Ann Clin Lab Sci. 2001;31:325-348. [PubMed] |
| 13. | Toller IM, Hitzler I, Sayi A, Mueller A. Prostaglandin E2 prevents Helicobacter-induced gastric preneoplasia and facilitates persistent infection in a mouse model. Gastroenterology. 2010;138:1455-1467, 1467. e1-e4. [PubMed] |