修回日期: 2012-12-19
接受日期: 2012-12-25
在线出版日期: 2012-12-28
目的: 研究磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase, P13K)/丝/苏氨酸激酶(ser-ine threonine kinase, Akt)信号通路抑制剂渥曼青霉素(wortmannin)对重症急性胰腺炎(severe acute pancreatitis, SAP)大鼠细胞因子[肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-1β(interleukin-1β, IL-1β)、IL-6]转录和表达以及胰腺组织病理评分的影响, 探讨其对SAP大鼠的保护作用.
方法: 将60只SD大鼠随机分为重症急性胰腺炎组(S组)、假手术组(C组)、生理盐水组(NS组)、溶剂(DMSO)对照组(R组)、PI3K/Akt抑制剂wortmannin组(W组). 采用改良的Aho法制作SAP模型, 分别在造模3、6 h后抽血并处死大鼠, 收集胰腺组织. 采用酶联免疫吸附试验(ELISA)检测血清细胞因子(TNF-α、IL-1β、IL-6)表达. Real-time PCR方法检测胰腺组织细胞因子(TNF-α、IL-1β、IL-6)mRNA转录水平变化, 并常规HE染色进行胰腺组织病理评分, 同时观察各组腹水量、血清及腹水淀粉酶的变化.
结果: S组和R组大鼠术后3、6 h的腹水量、血清及腹水淀粉酶水平、胰腺组织病理评分较C组和NS组差异有统计学意义(P<0.05); W组的腹水量、血清及腹水淀粉酶水平、胰腺组织病理评分较同时段的S组和R组有所降低, 差异有统计学意义(P<0.05). 与C组和NS组相比, S组和R组大鼠术后3、6 h的血清细胞因子TNF-α、IL-1β、IL-6表达水平和胰腺组织内TNF-α、IL-1β、IL-6 mRNA转录水平差异有统计学意义(P<0.05); W组的上述指标均低于S组和R组, 差异有统计学意义(P<0.05).
结论: PI3K抑制剂wortmanin通过抑制PI3K/Akt信号转导通路下调SAP大鼠细胞因子(TNF-α、IL-1β、IL-6)的转录和表达水平, 减轻胰腺组织的病理损伤, 对SAP大鼠具有保护作用.
引文著录: 陈诚, 徐萍, 王静, 娄晓丽. PI3K抑制剂对急性胰腺炎细胞因子和组织病理学评分的影响. 世界华人消化杂志 2012; 20(36): 3663-3669
Revised: December 19, 2012
Accepted: December 25, 2012
Published online: December 28, 2012
AIM: To investigate the effect of the PI3K/Akt signaling transduction pathway inhibitor wortmannin on the levels of cytokines [tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β) and IL-6] and pancreatic histopathological changes in rats with severe acute pancreatitis (SAP).
METHODS: Sixty male Sprague-Dawley (SD) rats were randomly divided into five groups, including SAP group, sham operation group, normal saline group, DMSO control group, and wortmannin group. The modified Aho's method was used to reproduce the SAP model. The rats were sacrificed 3 and 6 h after treatment. The levels of inflammatory cytokines TNF-α, IL-1β and IL-6 in serum were determined by ELISA. Transcription levels of these inflammatory cytokines in pancreatic tissue were determined by real-time PCR. In addition, the amount of ascites, the activities of serum amylase and ascites amylase, and the pathological scores of pancreatic tissue were also measured.
RESULTS: At 3 and 6 h after treatment, all parameters tested, including the amount of ascites, the levels of serum and ascites amylase, the pathological scores of pancreatic tissue, serum levels of TNF-α, IL-1β and IL-6, and the transcription levels of TNF-α, IL-1β and IL-6 mRNAs in the pancreatic tissue, in the SAP group and DMSO group were significantly higher than those in the normal saline group and sham operation group (all P < 0.05). Compared to the SAP group and DMSO group, the above parameters decreased significantly in the wortmannin group (all P < 0.05).
CONCLUSION: Wortmannin exerts a protective effect against SAP possibly by down-regulating the levels of TNF-α, IL-1β and IL-6 and reducing pathological injury of pancreatic tissue in rats.
- Citation: Chen C, Xu P, Wang J, Lou XL. Effect of PI3K inhibitor wortmannin on cytokine levels and pancreatic histopathological scores in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2012; 20(36): 3663-3669
- URL: https://www.wjgnet.com/1009-3079/full/v20/i36/3663.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i36.3663
重症急性胰腺炎(severe acute pancreatitis, SAP)发病早期, 在各种损伤因子的刺激下单核/巨噬细胞等被激活. 释放出大量的促炎细胞因子. 多种促炎细胞因子[肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-1β(interleukin-1β, IL-1β)、IL-6等]在SAP的病情演变过程中起着至关重要的作用[1,2]. 近年来, 磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase, P13K)/丝/苏氨酸激酶(ser-ine threonine kinase, Akt)信号转导通路在介导炎症、应激等细胞反应过程中发挥的重要调节作用引人注目[3,4]. wortmannin(渥曼青霉素)是一种常用的PI3K特异性抑制剂, 可以通过细胞膜与胞内PI3K的110 kD催化亚基相结合, 抑制其信号向下游传导而降低其下游Akt磷酸化水平, 从而阻断Akt下游的信号级联反应而发挥生物学效应[5,6]. 本研究旨在探讨wortmannin在重症急性胰腺炎大鼠发病早期对SAP大鼠细胞因子(TNF-α、IL-1β、IL-6)转录和表达的干预作用, 以及对重症急性胰腺炎大鼠的保护作用.
健康♂SD大鼠, 清洁级, 鼠龄2-2.5 mo, 体质量160-200 g, 由上海交通大学附属第一人民医院动物实验中心提供; 牛磺胆酸钠、二甲基亚砜(DMSO)(上海生工生物工程技术服务有限公司); PI3K抑制剂wortmannin(Sigma, 美国); TRIzol(Invitrogen, 美国); 大鼠血清TNF-α、IL-1β、IL-6的ELISA检测试剂盒(欣博盛生物科技有限公司, 中国); TNF-α引物序列: 上游5'-AGGCTCCTCTCCGCCATCAAGA-3', 下游5'-TGGGCTCATACCAGGGCTT-3', 扩增片段148 bp; IL-1β引物序列: 上游5'-GATGGCTGCACTATTCCTAATGC-3', 下游5'-AGACTGCCCATTCTCGACAAG-3', 扩增片段207 bp; IL-6引物序列: 上游5'-TAGTCCTTCCTACCCCAACTTCC-3', 下游5'-TTGGTCCTTAGCCACTCCTTC-3', 扩增片段165 bp; β-actin引物序列: 上游5'-CCTGGCACCCAGCACAAT-3', 下游5'-GGGCCGGACTCGTCATAC-3', 扩增片段105 bp; 第一链cDNA合成试剂盒(Fermentas, 美国); RNA提取试剂盒(TaKaRa, 大连宝生); PCR扩增仪(Bio-Rad, 美国); ABI 7500型定量PCR仪(Applied Biosystems); 倒置显微镜(Olympus, 日本).
1.2.1 模型建立: 60只SD大鼠随机分为重症急性胰腺炎组(S组)、假手术组(C组)、生理盐水组(NS组)、溶剂(DMSO)对照组(R组)、PI3K/Akt抑制剂wortmannin组(W组), 分别于术后3 h、6 h 2个时间点处死并取材, 每组各6只. SAP模型采用改良的Aho法制作. 实验前12 h禁食, 自由饮水. S组: 术前15 min 0.2%戊巴比妥钠腹腔内注射麻醉, 取上腹正中切口, 切开4 cm, 开腹后沿十二指肠内侧找到胆胰管开口, 以2枚血管夹分别夹住肝门部胆管和十二指肠乳头部位, 用5.5号穿刺针逆行刺入胰管, 以0.1 mL/min速度向胰管内匀速注射50 g/L牛磺胆酸钠(1 mL/kg), 注射后观察胰腺变化8-10 min, 松开血管夹, 确认腹腔无活动性出血后, 连续缝合关闭腹腔. C组: 开腹后不注射牛磺胆酸钠溶液, 只翻动胰腺并以钝器轻划胰腺3次. NS组: 开腹后注射等量的生理盐水(1 μL/g)代替牛磺胆酸钠. W组: 建模前30 min腹腔注射wortmannin(溶于DMSO) 1.0 mg/kg, 再复制SAP模型. R组: 建模前30min腹腔注射同等量的DMSO液, 再复制大鼠SAP模型. 各组大鼠术后自由饮水, 仍禁食.
1.2.2 标本采集: 分别于术后3 h、6 h 2个时段用七氟烷麻醉大鼠, 用10 mL注射器收集腹水标本, 记录腹水量, 同时送检腹水淀粉酶; 经心脏采血收集血标本, 4 ℃冰箱静置3 h后以3 000 r/min离心10 min取血清分为两部分, 血清一部分保存在-80 ℃冰箱中待行ELISA检测, 另一部分送检血清淀粉酶. 观察胰腺大体病理改变, 并取胰头部组织分为两部分: 第一部分用10%中性缓冲甲醛固定24 h, 石蜡包埋, 用于进行常规HE染色, 第二部分放入冻存管立即置于液氮罐内保存.
1.2.3 指标检测: (1)胰腺组织病理评分: 胰头部组织常规制作石蜡切片, HE染色, 在光镜下阅片观察胰腺组织损伤程度, 每片随机选取8-10个高倍视野, 采用Schimidt等[6]标准对胰腺组织的4个单项(水肿、炎症细胞浸润、出血、坏死程度)进行单独评分; (2)血清、腹水指标检测: 血清稀释40倍, 腹水稀释60-100倍, 经全自动干化学分析仪(Roche, 美国)检测血清和腹水中淀粉酶的含量; (3)采用双抗体夹心ELISA法检测血清细胞因子(TNF-α、IL-1β、IL-6)的表达水平, 严格按照说明书操作. (4)胰腺组织促炎因子(TNF-α、IL-1β、IL-6)mRNA转录水平变化的检测: 取冻存的胰腺组织100 μg, 采用TRIzol一步法提取总蛋白, 实验步骤严格按照试剂说明书进行, 紫外分光光度仪测总RNA在260 nm和280 nm波长下的吸光度(A)值, A260/280稳定于1.8-2.0, 此时RNA的纯度较高. 按第一链cDNA合成试剂盒操作步骤将mRNA反转录成cDNA, 运用ABI7500型定量PCR仪采用两步法PCR反应程序检测胰腺组织中细胞因子(TNF-α、IL-1β、IL-6)mRNA的表达. 反应按以下条件循环: 95 ℃预变性30 s; 95 ℃变性5 s, 60 ℃退火并延伸34 s, 进行40个循环. 收集每个PCR延伸期的荧光. 实验重复3次取平均值, 计算mRNA相对β-action表达量的比值, 用2-∆∆t值表示.
统计学处理 数据均以均数±标准差(mean±SD)表示. 应用SPSS13.0统计分析软件采用单因素方差分析(LSD)和相关性分析处理数据, P<0.05为差异有统计学意义.
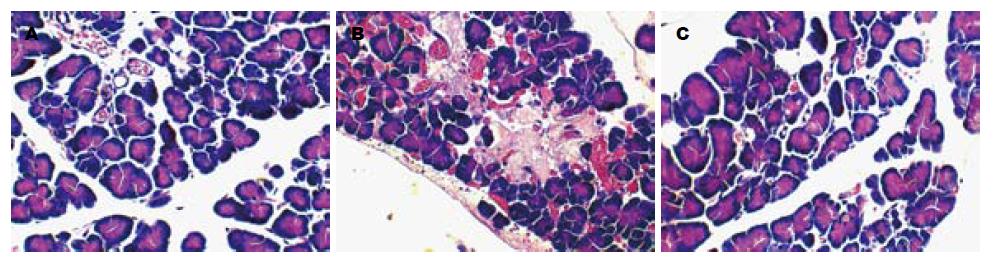
重症急性胰腺炎组(S组)和溶剂对照组(R组)大鼠术后3、6 h的腹水量、血清及腹水淀粉酶水平较假手术组(C组)和生理盐水组(NS组)明显增高(P<0.05); 注射PI3K/Akt抑制剂wortmannin后的W组同时段的腹水量、血清及腹水淀粉酶水平较S组和R组明显降低(P<0.05, 表1). S组和R组大鼠同时间段的病理评分明显高于C组和NS组(P<0.05), 同时间段的W组大鼠胰腺组织病理损害程度较S组和R组明显减轻(P<0.05). C组较同时段NS组、S组较同时段R组的腹水量、血清及腹水淀粉酶水平以及胰腺组织病理学评分差异无统计学意义(P>0.05). 各组大鼠代表性胰腺组织病理形态学改变见图1. 生理盐水组(NS组)大鼠胰腺组织结构清晰, 大部分腺泡小叶完整, 偶见炎性细胞浸润, 未见间质充血、出血和腺泡细胞坏死(图1A). 牛磺胆酸钠组(S组)胰腺组织可见明显腺泡小叶结构破坏, 小叶间水肿, 片状出血, 炎性细胞浸润, 腺泡细胞变性坏死(图1B). PI3K/Akt抑制剂wortmannin组(W组)大鼠胰腺组织小叶结构存在, 部分间质水肿, 少量的炎性细胞浸润, 偶见点状出血, 未见腺泡细胞坏死(图1C). 各组胰腺组织病理评分比较见表1.
| 分组 | 3 h | 6 h | ||||||
| 腹水量(mL) | AMS(IU/L) | 腹水淀粉酶(IU/L) | 胰腺病理评分 | 腹水量(mL) | AMS(IU/L) | 腹水淀粉酶(IU/L) | 胰腺病理评分 | |
| C组 | 0±0 | 6675.00± 576.63 | 7200.00± 572.36 | 0.94± 1.52 | 0±0 | 3205.00± 520.48 | 11100.00± 783.58 | 1.36± 0.95 |
| NS 组 | 0.87± 0.49 | 9916.60± 254.89 | 15900.00± 694.25 | 1.48± 1.73 | 0.88±0.56 | 5488.30± 742.17 | 29800.00± 1087.43 | 2.77± 1.43 |
| S组 | 6.67± 2.07a | 23925.00± 590.90a | 58624.00± 8423.86a | 10.89± 2.43a | 7.57±1.84a | 26087.50± 645.78a | 65650.00± 5292.79a | 12.00± 1.58a |
| R组 | 7.75± 1.05a | 27425.00± 472.66a | 104900.00± 2354.62a | 11.26± 1.38a | 8.28±1.41a | 34450.00± 384.78a | 104250.00± 2273.86a | 13.72± 1.25a |
| W组 | 4.67± 0.57c | 12583.33± 770.39c | 23640.00± 1079.25c | 7.82± 2.06c | 5.52±1.25c | 13116.60± 529.94c | 54990.00± 2927.42c | 6.42± 0.83c |
与C组和NS组相比, S组和R组大鼠术后3、6 h的血清细胞因子(TNF-α、IL-1β、IL-6)表达水平明显增高(P<0.05), 注射PI3K/Akt抑制剂wortmannin后(W组)血清细胞因子(TNF-α、IL-1β、IL-6)表达水平显著低于S组和R组(P<0.05). C组较同时段NS组、S组较同时段R组血清中的细胞因子(TNF-α、IL-1β、IL-6)的表达无统计学意义(P>0.05). 与同组3 h相比, 6 h的S组、R组和W组TNF-α mRNA, IL-6 mRNA转录水平有所下降, 而IL-1β mRNA转录水平呈上升趋势, 差异存在统计学意义(P<0.05). C组和NS组3h的血清细胞因子(TNF-α、IL-1β、IL-6)的表达与同组6 h相比, 差异无统计学意义(P>0.05, 表2). 胰腺组织病理评分与血清中细胞因子(TNF-α、IL-1β、IL-6)的表达均呈正相关(r值分别为0.730、0.863和0.731, P值均<0.01).
| 分组 | 3 h | 6 h | ||||
| TNF-α | IL-1β | IL-6 | TNF-α | IL-1β | IL-6 | |
| C组 | 6.54±3.22 | 37.94±1.79 | 1.25±0.72 | 11.41±5.06 | 29.67±23.52 | 6.36±4.56 |
| NS组 | 7.36±5.71 | 43.31±13.59 | 7.25±1.33 | 6.92±4.74 | 47.79±24.50 | 2.57±3.43 |
| S组 | 88.42±4.05a | 160.24±38.18a | 373.82±28.73a | 39.29±11.23ae | 301.40±27.53ae | 135.94±36.10ae |
| R组 | 87.06±12.56a | 149.42±16.18a | 290.96±17.14a | 47.67±4.43ae | 278.57±32.24ae | 114.33±20.90ae |
| W组 | 46.77±10.45c | 75.42±15.08c | 183.44±11.23c | 21.39±3.56ce | 160.67±22.71ce | 57.85±31.61ce |
与C组和NS组相比, S组和R组大鼠术后3、6 h的胰腺组织内TNF-α、IL-1β、IL-6 mRNA转录水平明显增高(P<0.05); W组的上述指标低于S组和R组, 差异存在统计学意义P<0.05). C组较同时段NS组、S组较同时段R组的胰腺组织细胞因子(TNF-α、IL-1β、IL-6)mRNA转录水平差异无统计学意义(P>0.05). 与同组3 h相比, 6 h的S组, R组和W组IL-1β mRNA转录水平有所上升, 而TNF-α mRNA转录水平呈下降趋势, 差异存在统计学意义(P<0.05). IL-6 mRNA转录水平呈下降趋势, 差异无统计学意义(P>0.05). C组和NS组3h的胰腺组织细胞因子(TNF-α, IL-1β, IL-6)mRNA转录水平变化与同组6 h相比, 差异无统计学意义(P>0.05, 表3). 胰腺组织病理评分与胰腺组织细胞因子(TNF-α、IL-1β、IL-6)mRNA转录水平均呈正相关(r值分别为0.569、0.900和0.884, P值均<0.01).
| 分组 | 3 h | 6 h | ||||
| TNF-α mRNA | IL-1β mRNA | IL-6 mRNA | TNF-α mRNA | IL-1β mRNA | IL-6 mRNA | |
| C组 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 |
| NS组 | 1.22±0.25 | 1.51±0.68 | 0.79±0.36 | 1.46±0.15 | 0.77±0.53 | 0.84±0.21 |
| S组 | 757.97±56.81a | 18.06±1.23a | 51.02±10.21a | 117.78±14.22ae | 37.19±3.65ae | 42.14±6.26a |
| R组 | 801.20±54.47a | 19.02±1.12a | 55.24±12.30a | 139.87±12.36ae | 31.15±1.32ae | 41.38±8.36a |
| W组 | 458.39±20.23c | 10.61±2.34c | 14.41±5.38c | 57.52±10.36ce | 18.43±2.36ce | 7.67±1.02c |
SAP发病早期, 胰腺组织常出现明显的出血坏死及炎症细胞浸润. 过度激活的白细胞释放出大量的细胞因子, 形成复杂的炎症级联反应[7]. 研究表明, 胰腺组织和血液中的细胞因子在SAP发生和发展过程中呈现动态变化, 其中促炎细胞因子(TNF-α、IL-1β、IL-6等)的释放与SAP的严重程度呈正相关[8], 在SAP的发生、发展、和转归中发挥着重要的作用[9,10]. 在急性胰腺炎早期, TNF-α低浓度时能结合胰腺腺泡膜上的TNFR受体, 诱导腺泡凋亡, 高浓度时促使IL-1β, IL-6等细胞因子过表达, 进一步加重炎症反应[11]. IL-1β的作用主要是诱导和调控TNF-α、IL-6、iNOS、COX-2黏附分子的产生, 激活中性粒细胞, 与急性胰腺炎严重程度呈正相关. IL-6是由内皮细胞、单核巨噬细胞和成纤维细胞等产生的多功能因子, 同时作用于多种靶细胞, 引起全身炎症反应, 与炎性疾病的进展密切相关[12]. 血清中IL-6的水平在实验和临床上可作为衡量急性胰腺炎的严重程度和预后的较为敏感和特异度的指标之一[13,14]. 因此我们选择TNF-α、IL-1β、IL-6探讨SAP大鼠细胞因子的转录与表达. 我们的实验发现SAP大鼠的胰腺组织细胞因子(TNF-α、IL-1β、IL-6)mRNA和血清中细胞因子(TNF-α、IL-1β、IL-6)的表达明显增高, 在SAP大鼠发病早期, IL-1β的胰腺组织中mRNA和血清中的表达持续上升, 而TNF-α, IL-6呈现出先升后降趋势, 但是仍明显高于假手术组和生理盐水组. 用wortmanin预先干预的SAP大鼠在发病早期TNF-α、IL-1β、IL-6的转录和表达具有相同的时间依赖性, 但明显低于急性胰腺炎组.
P13K/Akt信号通路是胰岛素信号转导通路中一条经典的、具有广泛生物学效应的途径[15-17]. P13K家族是一类特异性催化磷脂酰肌醇3-位羟基磷酸化, 产生具有第二信使作用的肌醇脂物质的激酶[18]. Akt通路位于P13K的下游, 处于该通路的中心环节, 主要负责由PI3K始动的生物信息的传导. 细胞受到生长因子、细胞因子等刺激后会激活细胞内的PI3K, 活化的PI3K使其底物3,4-二磷酸磷脂酰肌醇(PIP2)磷酸化成3,4,5-三磷酸磷脂酰肌醇(PIP3)[19], 下游的Akt通过血小板-白细胞C激酶同源区与PI3K的磷酸化底物PIP3结合, 并通过磷脂酰肌醇依赖性激酶-1(PDK-1)磷酸化Akt的第308位苏氨酸位点(Thr308)而被激活,在酰肌醇依赖性激酶-2(PDK-2)的存在下, Akt第473位上的丝氨酸位点(Ser473)也发生磷酸化, 使Akt处于充分活化状态[20], 激活的Akt进一步引起下游靶基因的变化[21].
近期研究发现, PI3K/Akt信号转导通路在炎症反应过程中发挥着重要的调节作用. PI3K/Akt信号通路的激活可以上调炎性介质基因的转录活性, 促使细胞产生大量细胞因子[22]. 研究者发现细菌内毒素、过敏毒素C5a等可以使PI3K/Akt通路活化, 进而激活了其他信号通路, 信号通路的异常活化可促进细胞因子TNF-α等的基因转录[23]. 由于PI3K/Akt信号通路反应迅速, 使细胞在致病因子的刺激下能及时反应, 因而此过程在机体炎症反应的过程中发挥了关键性的调节作用. 研究显示抑制P13K/Akt信号转导通路的激活可以明显降低急性胰腺炎的严重程度[24,25]. 我们的实验中亦发现用wortmanin预先干预的SAP大鼠腹水量、血清及腹水淀粉酶水平显著下降, 胰腺组织的病理损伤也得到明显的改善, wortmanin抑制PI3K/Akt信号通路有效地控制了SAP大鼠的早期炎症反应.
PI3K活性的特异性抑制剂wortmannin在重症急性胰腺炎发病早期显示出的独特抗炎作用近年来引起人们的广泛关注[26]. 研究显示PI3K信号转导通路抑制剂wortmannin可明显抑制SAP中性粒细胞内Akt的活性[27]并且对SAP大鼠肺损伤具有一定的保护作用[28,29]. 本实验的结果表明PI3K抑制剂wortmanin通过抑制PI3K/Akt信号转导通路可以减少SAP大鼠胰腺组织中细胞因子(TNF-α、 IL-1β、IL-6)mRNA表达, 同时降低了上述细胞因子在血清中的表达. SAP大鼠用wortmanin预先干预后, 细胞因子(TNF-α、IL-1β、IL-6)的胰腺组织mRNA转录水平和血清中的表达下调程度相近, 由此推测PI3K抑制剂wortmanin对细胞因子TNF-α、IL-1β、IL-6的转录与表达有着相似的抑制作用. 我们在实验中还发现, SAP大鼠的细胞因子(TNF-α、IL-1β、IL-6)的胰腺组织mRNA转录水平和血清中的表达与胰腺组织病理组织学改变均呈正相关性, 提示PI3K抑制剂wortmannin可通过抑制胰腺组织中细胞因子TNF-α、IL-1β、IL-6等的转录, 降低心清中细胞因子TNF-α、IL-1β、IL-6等的表达, 明显减轻SAP发病早期胰腺组织的病理损伤.
目前, 虽然SAP的治疗策略有指南不断更新, 但临床效果都不甚满意, SAP尚无明确的治疗方案[30,31]. 近两年来, 在SAP发病早期抑制细胞因子等炎症介质的释放从而有效控制炎症反应成为研究SAP发病机制和治疗SAP的切入点. 我们的实验显示PI3K/Akt信号传导通路抑制剂wortmannin通过抑制PI3K/Akt信号通路, 下调下游的细胞因子在胰腺组织中的转录水平, 引起心清中TNF-α、IL-1β、IL-6等细胞因子的表达下降, 从而减轻急性胰腺炎的严重程度, 对重症急性胰腺炎大鼠产生抗炎作用, 为SAP的治疗提供新的思路. 但wortmannin对SAP的具体抗炎机制以及PI3K/Akt信号通路与其他炎症信号通路的相互关系还需要我们今后的实验来进一步探讨.
由于发病机制尚不清楚, 临床上重症急性胰腺炎(SAP)的治疗仍然是一个棘手的问题. 近两年来, 如何在SAP发病早期抑制细胞因子等炎症介质的释放从而有效控制炎症反应成为研究SAP发病机制和治疗SAP的切入点. PI3K/Akt信号转导通路是机体的一条重要通路, 参与脓毒症、SAP并发肺损伤等疾病炎症反应的调控. SAP早期产生和释放的TNF-α, IL-1β, IL-6等促炎细胞因子是SAP发生和发展链上的始动环节. 因此通过抑制PI3K/Akt信号通路减少促炎细胞因子的释放为寻找有效控制SAP发病早期的炎症反应的方法提供了新的思路.
崔云甫, 教授, 哈尔滨医科大学第二附属医院普外一科
近年来大量研究表明SAP早期促炎细胞因子的产生及炎症的级联瀑布反应与PI3K/Akt、p38MAPK、NF-κB等细胞内信号转导通路有关. 但目前有关PI3K/Akt信号通路与SAP的研究主要是从SAP的发病机制的角度切入, 更多的是探讨PI3K/Akt信号通路对SAP并发症急性肺损伤的影响. 而PI3K特异性抑制剂wortmannin在急性胰腺炎发病早期通过抑制细胞因子胰腺组织内的转录和血清中的表达来减轻胰腺组织损伤的治疗作用至今未见报道.
目前的研究显示, 胰腺细胞内胰蛋白酶原的异位激活、钙离子的异常内流及核因子NF-κB的过度活化是SAP早期的特征性病理改变. 同时这些变化均与PI3K/Akt信号通路密切相关. 现已发现, 使用PI3K特异性抑制剂或者敲除PI3K基因可以抑制雨蛙肽诱导的和胰管内注射牛磺胆酸钠引起的SAP大鼠的胰蛋白酶原的激活, 降低NF-κB的活性水平, 而减轻SAP的严重性.
本文的创新之处在于首次探讨PI3K特异性抑制剂wortmannin对SAP发病早期的细胞因子TNF-α、IL-1β、IL-6在胰腺组织中的转录水平和血清中表达水平的改变与胰腺组织病理学改变之间的关系, 从SAP治疗的角度显示了wortmannin对SAP大鼠, 尤其是大鼠胰腺组织的保护作用, 并且阐明了SAP大鼠细胞因子TNF-α、IL-1β、IL-6的转录和表达在发病早期的动态变化.
本研究用PI3K特异性抑制剂wortmannin对SAP大鼠进行干预治疗, 明显减轻SAP大鼠的炎症程度, 改善大鼠胰腺组织的病理损伤, 为PI3K特异性抑制剂用于临床治疗SAP提供了实验依据, 同时本研究也为临床应用药物如吡格列酮、白藜芦醇等治疗SAP的理论研究提供一些新的思路.
wortmannin(渥曼青霉素): 是一种常用的PI3K特异性抑制剂, 可以通过细胞膜与胞内PI3K的110 kD催化亚基相结合, 抑制其信号向下游传导而降低其下游Akt磷酸化水平, 从而阻断Akt下游的信号级联反应而发挥生物学效应.
本研究采用经典方法制备模型, 设计分组合理, 同时从细胞因子和组织病理学等多方面评估PI3K处理对SAP的效果, 方法部分充分. 研究采用2个早期时间点进行取材并比较, 探讨了实验性SAP大鼠发病早期细胞因子的动态变化. 文章有一定创新性.
编辑: 田滢 电编:鲁亚静
| 1. | Zhang XP, Zhang J, Ma ML, Cai Y, Xu RJ, Xie Q, Jiang XG, Ye Q. Pathological changes at early stage of multiple organ injury in a rat model of severe acute pancreatitis. Hepatobiliary Pancreat Dis Int. 2010;9:83-87. [PubMed] |
| 2. | Xu P, Zhou XJ, Chen LQ, Chen J, Xie Y, Lv LH, Hou XH. Pioglitazone attenuates the severity of sodium taurocholate-induced severe acute pancreatitis. World J Gastroenterol. 2007;13:1983-1988. [PubMed] |
| 3. | Rajaram MV, Ganesan LP, Parsa KV, Butchar JP, Gunn JS, Tridandapani S. Akt/Protein kinase B modulates macrophage inflammatory response to Francisella infection and confers a survival advantage in mice. J Immunol. 2006;177:6317-6324. [PubMed] |
| 4. | Zong Y, Sun L, Liu B, Deng YS, Zhan D, Chen YL, He Y, Liu J, Zhang ZJ, Sun J. Resveratrol inhibits LPS-induced MAPKs activation via activation of the phosphatidylinositol 3-kinase pathway in murine RAW 264.7 macrophage cells. PLoS One. 2012;7:e44107. [PubMed] [DOI] |
| 5. | Zhang F, Zhang T, Jiang T, Zhang R, Teng ZH, Li C, Gu ZP, Mei Q. Wortmannin potentiates roscovitine-induced growth inhibition in human solid tumor cells by repressing PI3K/Akt pathway. Cancer Lett. 2009;286:232-239. [PubMed] [DOI] |
| 6. | Schmidt J, Rattner DW, Lewandrowski K, Compton CC, Mandavilli U, Knoefel WT, Warshaw AL. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 1992;215:44-56. [PubMed] [DOI] |
| 7. | Dios ID. Inflammatory role of the acinar cells during acute pancreatitis. World J Gastrointest Pharmacol Ther. 2010;1:15-20. [PubMed] [DOI] |
| 8. | Novovic S, Andersen AM, Ersbøll AK, Nielsen OH, Jorgensen LN, Hansen MB. Proinflammatory cytokines in alcohol or gallstone induced acute pancreatitis. A prospective study. JOP. 2009;10:256-262. [PubMed] |
| 9. | Bhatia M, Wong FL, Cao Y, Lau HY, Huang J, Puneet P, Chevali L. Pathophysiology of acute pancreatitis. Pancreatology. 2005;5:132-144. [PubMed] [DOI] |
| 10. | Bhatia M. Acute pancreatitis as a model of SIRS. Front Biosci. 2009;14:2042-2050. [PubMed] [DOI] |
| 11. | Xue DB, Zhang WH, Yun XG, Song C, Zheng B, Shi XY, Wang HY. Regulating effects of arsenic trioxide on cell death pathways and inflammatory reactions of pancreatic acinar cells in rats. Chin Med J (Engl). 2007;120:690-695. [PubMed] |
| 12. | Aoun E, Chen J, Reighard D, Gleeson FC, Whitcomb DC, Papachristou GI. Diagnostic accuracy of interleukin-6 and interleukin-8 in predicting severe acute pancreatitis: a meta-analysis. Pancreatology. 2009;9:777-785. [PubMed] [DOI] |
| 13. | Jun G, Zhi-jun T, Bao-liang Q, Fei L, Jia-bang S. Significance of trypsinogen activation peptides and interleukin-6 in experimental acute pancreatitis. Zhongguo Yixuekexueyuan Xuebao. 2011;33:205-209. [PubMed] |
| 14. | Sathyanarayan G, Garg PK, Prasad H, Tandon RK. Elevated level of interleukin-6 predicts organ failure and severe disease in patients with acute pancreatitis. J Gastroenterol Hepatol. 2007;22:550-554. [PubMed] [DOI] |
| 15. | Lackner MR. Prospects for personalized medicine with inhibitors targeting the RAS and PI3K pathways. Expert Rev Mol Diagn. 2010;10:75-87. [PubMed] [DOI] |
| 16. | Kuijk LM, Beekman JM, Koster J, Waterham HR, Frenkel J, Coffer PJ. HMG-CoA reductase inhibition induces IL-1beta release through Rac1/PI3K/PKB-dependent caspase-1 activation. Blood. 2008;112:3563-3573. [PubMed] [DOI] |
| 17. | Steinbrunn T, Stühmer T, Sayehli C, Chatterjee M, Einsele H, Bargou RC. Combined targeting of MEK/MAPK and PI3K/Akt signalling in multiple myeloma. Br J Haematol. 2012;159:430-440. [PubMed] [DOI] |
| 18. | Cantrell DA. Phosphoinositide 3-kinase signalling pathways. J Cell Sci. 2001;114:1439-1445. [PubMed] |
| 19. | Pene F, Claessens YE, Muller O, Viguié F, Mayeux P, Dreyfus F, Lacombe C, Bouscary D. Role of the phosphatidylinositol 3-kinase/Akt and mTOR/P70S6-kinase pathways in the proliferation and apoptosis in multiple myeloma. Oncogene. 2002;21:6587-6597. [PubMed] [DOI] |
| 20. | Solit DB, Basso AD, Olshen AB, Scher HI, Rosen N. Inhibition of heat shock protein 90 function down-regulates Akt kinase and sensitizes tumors to Taxol. Cancer Res. 2003;63:2139-2144. [PubMed] |
| 21. | Madrid LV, Mayo MW, Reuther JY, Baldwin AS. Akt stimulates the transactivation potential of the RelA/p65 Subunit of NF-kappa B through utilization of the Ikappa B kinase and activation of the mitogen-activated protein kinase p38. J Biol Chem. 2001;276:18934-18940. [PubMed] [DOI] |
| 22. | Luyendyk JP, Schabbauer GA, Tencati M, Holscher T, Pawlinski R, Mackman N. Genetic analysis of the role of the PI3K-Akt pathway in lipopolysaccharide-induced cytokine and tissue factor gene expression in monocytes/macrophages. J Immunol. 2008;180:4218-4226. [PubMed] |
| 23. | Konrad S, Ali SR, Wiege K, Syed SN, Engling L, Piekorz RP, Hirsch E, Nürnberg B, Schmidt RE, Gessner JE. Phosphoinositide 3-kinases gamma and delta, linkers of coordinate C5a receptor-Fcgamma receptor activation and immune complex-induced inflammation. J Biol Chem. 2008;283:33296-33303. [PubMed] [DOI] |
| 24. | Wang K, Scheel-Toellner D, Wong SH, Craddock R, Caamano J, Akbar AN, Salmon M, Lord JM. Inhibition of neutrophil apoptosis by type 1 IFN depends on cross-talk between phosphoinositol 3-kinase, protein kinase C-delta, and NF-kappa B signaling pathways. J Immunol. 2003;171:1035-1041. [PubMed] |
| 25. | Singh VP, Saluja AK, Bhagat L, van Acker GJ, Song AM, Soltoff SP, Cantley LC, Steer ML. Phosphatidylinositol 3-kinase-dependent activation of trypsinogen modulates the severity of acute pancreatitis. J Clin Invest. 2001;108:1387-1395. [PubMed] |
| 26. | Yang SJ, Chen HM, Hsieh CH, Hsu JT, Yeh CN, Yeh TS, Hwang TL, Jan YY, Chen MF. Akt pathway is required for oestrogen-mediated attenuation of lung injury in a rodent model of cerulein-induced acute pancreatitis. Injury. 2011;42:638-642. [PubMed] [DOI] |
| 27. | 张 成, 栾 正刚, 葛 春林, 郭 仁宣. 磷脂酰肌醇3激酶/蛋白激酶B信号转导通路在重症急性胰腺炎中性粒细胞活化中的作用. 世界华人消化杂志. 2006;14:1987-1991. [DOI] |
| 29. | Kang X, Wang LZ, Wang YG, Liu L, Fan ZW, Bai LZ, Lu XG. [Expression and significance of phosphatidylinositol 3-kinase/protein kinase B signal transduction pathway in severe acute pancreatitis-associated lung injury]. Zhonghua Yixue Zazhi. 2010;90:732-737. [PubMed] |
| 30. | Lankisch PG. Treatment of acute pancreatitis: an attempted historical review. Pancreatology. 2010;10:134-141. [PubMed] [DOI] |
| 31. | Wu BU, Conwell DL. Update in acute pancreatitis. Curr Gastroenterol Rep. 2010;12:83-90. [PubMed] [DOI] |