修回日期: 2012-12-15
接受日期: 2012-12-20
在线出版日期: 2012-12-28
目的: 研究二苯乙烯苷(tetrahydroxystilbene glucoside, TSG)对急性酒精性肝损伤小鼠炎症相关因子的影响.
方法: 将昆明种小鼠随机分为正常对照组、模型组、TSG低剂量组(30 mg/kg)、TSG高剂量组(60 mg/kg)、水飞蓟宾组(50 mg/kg); 采用白酒灌胃的方式建立小鼠急性酒精性肝损伤模型. 光学显微镜观察小鼠肝脏病理变化, 采用ELISA法检测各组小鼠血清肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素1β(interleukin 1β, IL-1β)、IL-6的含量, 鲎试剂终点显色法检测小鼠血浆内毒素水平, Real-time PCR法检测肝脏组织TNF-α和iNOS基因表达, Western blot法检测肝脏组织IκB-α磷酸化水平和NF-κB核移位程度.
结果: 与正常对照组比较, 模型组小鼠肝索排列紊乱, 肝脏出现明显的脂肪变性, 血清TNF-α、IL-1β、IL-6的含量和血浆内毒素水平均显著升高, TNF-α和iNOS基因表达上调, IκB-α磷酸化水平升高和NF-κB核移位增多, 差异具有统计学意义[TNF-α: 128.5 pg/mL±20.7 pg/mL vs 45.2 pg/mL±14.2 pg/mL; IL-1β: 71.8 pg/mL±9.1 pg/mL vs 33.1 pg/mL±9.5 pg/mL; IL-6: 59.8 pg/mL±13.1 pg/mL vs 23.7 pg/mL±5.9 pg/mL; endotoxin: 0.35 EU/mL±0.09 EU/mL vs 0.11 EU/mL±0.03 EU/mL. TNF-α mRNA: 1.33±0.11 vs 0.63±0.10; iNOS mRNA: 0.85±0.09 vs 0.40±0.07; phospho-IκB-α: 2.02±0.14 vs 0.92±0.19; NF-κB P65: 1.10±0.14 vs 0.44±0.13, P<0.05或P<0.01]; 给予TSG后, 小鼠肝脏组织脂肪变性减少, 各组小鼠血清TNF-α、IL-1β、IL-6的含量和血浆内毒素水平均明显降低; 肝脏组织TNF-α和iNOS基因表达下调, 同时IκB-α磷酸化水平和NF-κB核移位减少, 差异具有统计学意义[TSG 60 mg/kg group: TNF-α: 65.9 pg/mL±13.9 pg/mL vs 128.5 pg/mL±20.7 pg/mL; IL-1β: 43.0 pg/mL±7.1 pg/mL vs 71.8 pg/mL±9.1 pg/mL; IL-6: 36.3 pg/mL±10.1 pg/mL vs 59.8 pg/mL±13.1 pg/mL; endotoxin: 0.20 EU/mL±0.05 EU/mL vs 0.35 EU/mL±0.09 EU/mL; TNF-α mRNA: 0.79±0.09 vs 1.33±0.11; iNOS mRNA: 0.53±0.10 vs 0.85±0.09; phospho-IκB-α: 1.35±0.32 vs 2.02±0.14; NF-κB P65: 0.62±0.05 vs 1.10±0.14, P<0.05或P<0.01].
结论: TSG对小鼠急性酒精性肝损伤有良好的保护作用, 其机制可能是通过抑制内毒素引起的Kupffer细胞激活, 进而抑制下游核因子NF-κB的激活, 减少炎性反应级联放大的触发机制, 从而产生肝功能保护作用.
引文著录: 熊章鄂, 仝巧云, 郑世华, 李中艳, 王婷. 二苯乙烯苷对急性酒精性肝损伤小鼠炎症相关因子的影响. 世界华人消化杂志 2012; 20(36): 3649-3655
Revised: December 15, 2012
Accepted: December 20, 2012
Published online: December 28, 2012
AIM: To investigate the protective effects of tetrahydroxystilbene glucoside (TSG) against acute ethanol-induced liver injury in mice and to explore the possible mechanisms involved.
METHODS: Kunming mice were randomly divided into five groups: normal control group, liver injury model group, low-(30 mg/kg) and high-dose (60 mg/kg) TSG groups, and Silibinin (50 mg/kg) group. Liver histopathology was measured by light microscopy. The contents of serum tumor necrosis factor-α (TNF-α), interleukin 1β (IL-1β), and IL-6 were assayed by ELSIA, and plasma endotoxin level was measured by LAL chromogenic endpoint assay. The mRNA expression of TNF-α and iNOS in liver tissue was detected by real-time PCR. The phospho-IκBα level and NF-κB nuclear translocation in hepatic tissue were measured by Western blot.
RESULTS: Compared to the control group, the model group showed significant hydropic degeneration and steatosis of hepatocytes, increased contents of serum TNF-α, IL-1β and IL-6 and plasma level of endotoxin (all P < 0.01), up-regulated mRNA expression of TNF-α and iNOS in liver tissue (TNF-α: 128.5 pg/mL ± 20.7 pg/mL vs 45.2 pg/mL ± 14.2 pg/mL; IL-1β: 71.8 pg/mL ± 9.1 pg/mL vs 33.1 pg/mL ± 9.5 pg/mL; IL-6: 59.8 pg/mL ± 13.1 pg/mL vs 23.7 pg/mL ± 5.9 pg/mL; endotoxin: 0.35 EU/mL ± 0.09 EU/mL vs 0.11 EU/mL ± 0.03 EU/mL. TNF-α mRNA: 1.33 ± 0.11 vs 0.63 ± 0.10; iNOS mRNA: 0.85 ± 0.09 vs 0.40 ± 0.07; phospho-IκB-α: 2.02 ± 0.14 vs 0.92 ± 0.19; NF-κB P65: 1.10 ± 0.14 vs 0.44 ± 0.13, P < 0.05, P < 0.01), and significantly increased phospho-IκBα level and NF-κB nuclear translocation in hepatic tissue (both P < 0.01). Compared to the model group, serum levels of TNF-α, IL-1β and IL-6 and plasma endotoxin level significantly decreased (all P < 0.05 or 0.01), the mRNA expression of TNF-α and iNOS was down-regulated, and phospho-IκBα level and NF-κB nuclear translocation in hepatic tissue were significantly inhibited in the TSG groups (TSG 60 mg/kg group: TNF-α: 65.9 pg/mL ± 13.9 pg/mL vs 128.5 pg/mL ± 20.7 pg/mL; IL-1β: 43.0 pg/mL ± 7.1 pg/mL vs 71.8 pg/mL ± 9.1 pg/mL; IL-6: 36.3 pg/mL ± 10.1 pg/mL vs 59.8 pg/mL ± 13.1 pg/mL; endotoxin: 0.20 EU/mL ± 0.05 EU/mL vs 0.35 EU/mL ± 0.09 EU/mL; TNF-α mRNA: 0.79 ± 0.09 vs 1.33 ± 0.11; iNOS mRNA: 0.53 ± 0.10 vs 0.85 ± 0.09; phospho-IκB-α: 1.35 ± 0.32 vs 2.02 ± 0.14; NF-κB P65: 0.62 ± 0.05 vs 1.10 ± 0.14, all P < 0.05 or 0.01).
CONCLUSION: TSG has a protective effect on acute alcoholic liver injury in mice possibly by decreasing endotoxin level and NF-κB nuclear translocation and attenuating the trigger of inflammation-related cascade amplification.
- Citation: Xiong ZE, Tong QY, Zheng SH, Li ZY, Wang T. Tetrahydroxystilbene glucoside protects against ethanol-induced liver injury in mice by inhibition of expression of inflammation-related factors. Shijie Huaren Xiaohua Zazhi 2012; 20(36): 3649-3655
- URL: https://www.wjgnet.com/1009-3079/full/v20/i36/3649.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i36.3649
酒精性肝病(alcoholic liver disease, ALD)是由于长期大量饮用含乙醇的饮料导致肝脏的损害性病变, 其病理组织学变化主要表现为5种形式: 酒精性脂肪肝(alcoholic fatty liver, AFL)、酒精性肝炎(alcoholic hepatitis, AH)、酒精性肝纤维化(alcoholic hepatic fibrosis, AHF)、肝硬化(hepatic cirrhosis, HC)和肝细胞癌(hepatocellular carcinoma, HCC). 这几种病变往往可部分重叠, 可单独也可同时混存于病变的肝脏中[1,2]. 世界范围内, ALD是肝病及其相关疾病的主要死因之一[3-5]. 在我国嗜酒者逐年增多, 由酒精所致肝损伤的发病率呈逐渐上升的趋势[6,7], 酒精已成为继病毒性肝炎之后导致肝损害的第2大病因[8]. 许多实验研究证实, 由内毒素介导的炎症反应是ALD的重要发病机制之一[9]. 二苯乙烯苷(tetrahydroxystilbene glucoside, TSG)是从何首乌中提取分离得到的一种多酚结构的主要成分, 具有广泛的生物学活性. 现代药理研究显示, TSG具有抗氧化、清除自由基、抗炎、抗肿瘤、降血脂、抑制动脉粥样硬化、保护肝脏等多种药理作用[10,11]. 我们前期的研究表明, TSG对急性酒精性肝损伤小鼠的氧化应激及其脂质过氧化作用有很好的改善作用, 本研究进一步探讨TSG对急性酒精性肝损伤小鼠炎症相关因子的影响.
SPF级♂昆明种小鼠, 体质量18-22 g, 由湖北省疾病预防实验动物中心提供, 动物合格证号: SCXK2011-0005. 动物饲养温度23 ℃±2 ℃, 相对湿度: 50%±5%, 自由进食和饮水. 二苯乙烯苷(TSG, C20H22O9, 分子量: 406, 纯度大于98%), 购自中国药品生物制品检定所; 北京红星二锅头为市售(北京红星股份有限公司); 肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-6(interleukin-6, IL-6)和IL-1β的ELISA检测试剂盒购自南京建成生物工程研究所; 内毒素定量检测试剂盒购自上海伊华临床医学科技公司; RNA提取试剂盒购自Omega Bio-Tek公司(Omega Bio-tek.Inc., USA); RNA逆转录聚合酶链反应试剂盒和实时定量PCR(real-time PCR)试剂盒购自宝生物工程(大连)有限公司; TNF-α、iNOS和GAPDH引物由上海生工生物工程技术服务有限公司合成, 具体引物序列见下表1; NF-κB P65抗体和p-IκB-α抗体购自Cell Signaling Technology公司(Boston, MA, USA); β-actin购自Santa cruz公司(Santa Cruz, CA, USA); 其他试剂为市售分析纯.
| 基因 | 上游引物(5'-3') | 下游引物(5'-3') | 产物长度(bp) |
| TNF-α | AGGCAACCTGACCACTCTCC | CACCACCATCAAGGACTCAA | 292 |
| iNOS | GACAGCACAGAATGTTCCAG | TGGCCAGATGTTCCTCTATT | 305 |
| GAPDH | CGGATTTGGTCGTATTGGG | CTCGCTCCTGGAAGATGG | 100 |
1.2.1 动物分组及模型制备: 适应性饲养1 wk后, 将小鼠随机分为正常对照组、模型组、TSG低剂量组(30 mg/kg)、TSG高剂量组(60 mg/kg)和水飞蓟宾组(50 mg/kg), 每组8只. TSG组和水飞蓟宾组分别灌胃给予相应剂量的药物, 正常对照组和模型组给予等容量的生理盐水, 1次/d, 给予3 d后, 模型组给予12 mL/kg的56度白酒灌胃, 给药组给予等剂量的白酒和相应剂量的药物灌胃, 1次/d, 连续3 d. 于第6天末次灌胃给药后, 动物禁食不禁水12 h, 各组动物经眼球后静脉丛取血, 分离血清和血浆备用; 取肝脏相同部位用滤纸吸净肝脏表面水分和血液后快速冷冻于液氮中备用.
1.2.2 小鼠肝脏HE染色, 镜下观察组织病理学变化: 取小鼠肝脏组织用10%福尔马林固定, 24 h后转移到75%的乙醇中, 常规脱水, 石蜡包埋, 切片, HE染色后进行病理学观察.
1.2.3 小鼠肝脏指数和肝功能的检测: 末次给药后, 动物禁食不禁水. 12 h后各组小鼠经眼球后静脉丛取血, 3 000 r/min离心10 min分离血清, 全自动生化分析仪测定各组血清中谷丙转氨酶(alanine aminotransferase, ALT)和天冬氨酸转氨酶(aspartate aminotransferase, AST)水平; 取肝脏, 用4 ℃生理盐水冲洗, 滤纸吸干, 称质量, 计算肝脏指数. 肝脏指数(%) = 肝脏质量(g)/体质量(g)×100%.
1.2.4 血浆内毒素水平的测定: 用肝素抗凝的无菌试管收集血液, 1 000 r/min离心5 min后收集血浆, 加入无热原生理盐水0.2 mL、Tris-HCl缓冲液0.2 mL混匀, 置于100 ℃水浴加热10 min去除潜在内毒素抑制剂, 然后3 000 r/min离心10 min, 取上清液检测. 具体操作参照试剂盒说明书进行, 于545 nm波长处测吸光度(A)值, 建立回归方程求标本中内毒素浓度.
1.2.5 ELISA法检测小鼠血清中TNF-α、IL-1β、IL-6的水平: 应用南京建成生物工程研究所提供的ELISA检测试剂盒检测血清TNF-α、IL-1β和IL-6的含量, 严格按照试剂盒说明书进行操作.
1.2.6 Real-time PCR检测肝脏组织TNF-α和iNOS基因的表达: 取50 mg肝脏组织, 加入1 mL的TRIzol冰上进行充分匀浆后按照试剂盒的说明书提取RNA. 紫外分光光度计测RNA浓度及纯度后, 按照反转录试剂盒说明书将提取的RNA反转录为cDNA后进行Real-time PCR反应, 引物序列见表1, 反应体系为: SYBR Premix Ex TaqTM Ⅱ (2×) 12.5 μL, PCR Forward Primer (10 μmol/L) 1 μL, PCR Reverse Primer (10 μmol/L) 1 μL, cDNA 2 μL, Rnase Free dH2O 8.5 μL. 将样品放入实时定量PCR扩增仪中按95 ℃预变性10 s、95 ℃变性5 s、59 ℃退火30 s、72 ℃延伸15 s条件扩增40个循环. 根据各样品Ct值以及GAPDH为内对照, 按照公式2-△△CT法分析TNF-α和iNOS基因的表达水平.
1.2.7 Western Blot检测肝脏组织NF-κB P65和p-IκB-α表达: 取100 mg肝脏组织, 按照蛋白提取试剂盒说明书提取肝脏细胞核蛋白和总蛋白, 然后用BCA法定蛋白后制备组织蛋白用于后续的Western blot检测. 配制10%的分离胶, 每泳道加入50 μg的等量蛋白, 经SDS-聚丙烯酰胺凝胶电泳分离后用湿转法将蛋白从胶转移至PVDF膜上. 取出NC膜后用封闭液(5%脱脂奶粉溶于TBST)封闭1 h. 根据抗体的效价要求, 稀释适当浓度的一抗(1%脱脂奶粉溶于TBST)于4 ℃孵育过夜. NF-κB P65和β-actin抗体效价均为1:1 000, p-IκB-α效价为1:500. 用TBST洗膜后加入HRP标记的羊抗鼠IgG二抗, 室温条件下孵育1 h. 再次洗膜后, 加ECL荧光剂, 压片显影, GTS凝胶图像处理系统软件扫描显影的密度.
统计学处理 数据经SPSS13.0软件处理, 所有的数据用均数±标准差表(mean±SD). 多组间显著性比较用单因素方差分析(ANOVA)结合Duncan's检验法. P<0.05有显著性差异.
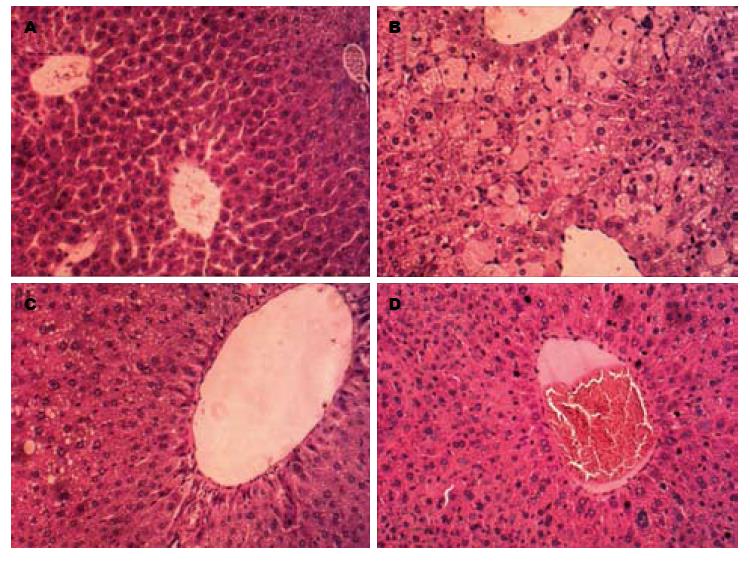
如图1所示, 正常对照组小鼠肝索排列整齐, 肝细胞形态正常, 肝细胞无水肿及脂肪变性; 模型组肝索排列紊乱, 肝细胞出现严重水肿和脂肪变性; TSG高剂量组肝索排列较模型组有所恢复, 肝细胞水肿及脂肪变性显著减少; 水飞蓟宾组肝组织细胞脂肪变轻微, 主要以肝细胞水肿为主.
实验结果见表2, 与正常对照组相比, 模型组小鼠肝脏指数升高; 同时, 反应肝脏功能的指标ALT和AST的水平也明显升高, 分别升高到正常对照组的1.8倍和1.7倍, 提示小鼠经酒精暴露后肝细胞和肝脏功能受损. 灌胃给予TSG后, 各组小鼠肝脏指数明显下降, ALT和AST水平也显著降低, 与模型组比较差异具有统计学意义(P<0.05, P<0.01).
实验结果见表3, 正常对照组小鼠血清TNF-α、IL-1β和IL-6水平分别为45.2 pg/mL±14.2 pg/mL、33.1 pg/mL±9.5 pg/mL和23.7 pg/mL±5.9 pg/mL, 模型组小鼠血清TNF-α、IL-1β和IL-6水平较正常对照组显著升高, 分别为128.5 pg/mL±20.7 pg/mL、71.8 pg/mL±9.1 pg/mL和59.8 pg/mL±13.1 pg/mL. TSG低、高剂量可使小鼠血清TNF-α、IL-1β和IL-6水平呈剂量依赖性的显著降低, 与模型组相比具有显著性差异(P<0.05或P<0.01).
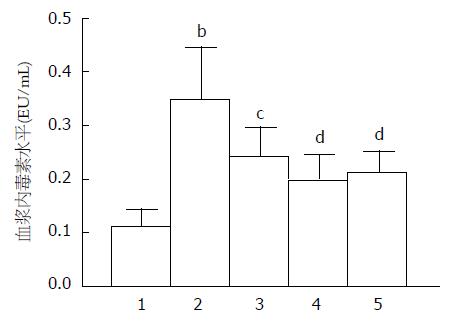
实验结果见图2, 正常对照组小鼠血浆内毒素水平为0.11 EU/mL±0.03 EU/mL, 急性酒精暴露后模型组小鼠血浆内毒素水平显著升高为0.35 EU/mL±0.09 EU/mL, 差异具有统计学意义(P<0.01). 给予TSG后, 各组小鼠血浆内毒素水平与模型组相比明显下降(P<0.05或P<0.01).
2.5 TSG对小鼠肝脏TNF-α和iNOS基因表达的影响 实验结果见表4, 模型组小鼠肝脏组织TNF-α和iNOS基因表达较正常对照组显著升高, 分别升高到正常对照组的2.11倍和2.13倍, TSG低、高剂量组可使小鼠肝脏组织TNF-α和iNOS基因表达显著降低, 且具有剂量依赖性(P<0.05或P<0.01).
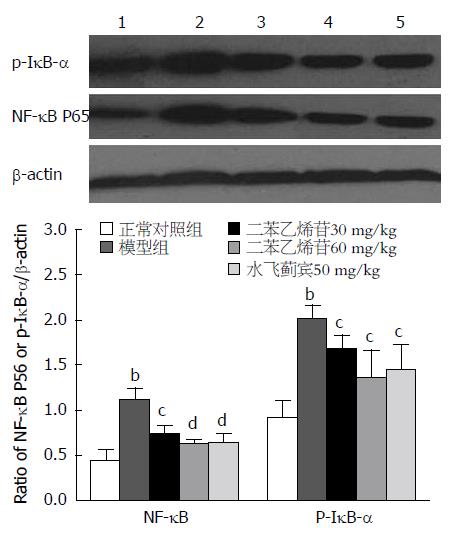
2.6 TSG对肝脏组织IκB-α磷酸化和胞核NF-κB P65表达的影响 实验结果见图3, 与正常对照组比较(p-IκB-α: 0.92±0.19; NF-κB P65: 0.44±0.13), 模型组大鼠肝脏组织IκB-α磷酸化水平和胞核中NF-κB P65表达显著升高, 其表达量p-IκB-α为2.02±0.14, 胞核NF-κB P65为1.10±0.14(P<0.01); TSG低、高剂量组明显降低肝脏组织IκB-α磷酸化水平和胞核中NF-κB p65的表达, 与模型组相比, 差异具有统计学意义(P<0.05或P<0.01).
ALD的发生是一个复杂的病理生理过程, 涉及多种细胞如Kupffer细胞、中性粒细胞、上皮细胞和许多有害因素如内毒素、氧化应激、细胞因子等[12,13]. 研究表明, 肠源性内毒素及其对Kupffer细胞的激活介导的肝细胞损害在急性酒精性肝损害的发病机理中发挥了关键性作用[14]. 正常生理情况下因为肠道的屏障作用以及Kupffer细胞对内毒素的清除作用, 脂多糖(lipopolysaccharide, LPS)维持在很低的水平, 但在ALD患者及ALD动物模型中其内毒素水平均显著升高[15]. 内毒素是肠道革兰阴性杆菌细胞壁的LPS, 具有多种生物活性, 其核心致病成分是LPS, 当过多的LPS进入血液或组织时可引起发热、寒战、休克甚至肠源性内毒素血症或成人呼吸窘迫综合征. ALD时, 肠细菌会过度生长、肠黏膜通透性增加、肠细菌移位以及正常的免疫功能受抑制等, 导致肠源性内毒素血症[16,17]. 异常升高的LPS与Kupffer细胞表面的CD14和Toll样受体4共同结合后引起Kupffer细胞的活化, 从而激活NF-κB等相关炎症信号通路, 诱导TNF-a和IL-1β、IL-6等细胞因子和介质的产生[18], 这些细胞因子和介质被认为是早期肝脏损害的关键因素, 他们激发了肝脏的炎症过程和破坏了肝实质细胞的内环境稳态[9,19]. TNF-a一方面具有直接的细胞毒作用, 引起肝细胞坏死, 另一方面又可引起微循环障碍导致肝细胞坏死, 同时, 还与其他炎性因子如IL-6、IL-1β相互激发, 引起级联放大反应, 进一步加重肝损伤[20,21]. 本实验结果表明, 急性酒精暴露后, 小鼠血清TNF-a、IL-1β和IL-6水平均显著升高, 而给予TSG后可抑制炎性因子的水平, 提示TSG对肝损伤的保护作用与降低炎性因子水平有关.
NF-κB为核转录因子, 存在于多种细胞中, 是细胞内多种信号转导通路的汇聚点, 参与包括免疫反应、急性期反应蛋白、炎症反应等基因表达的调控, 通过影响炎性因子如TNF-a以及iNOS等基因表达在炎症反应和细胞凋亡等病理过程中起着关键作用[22,23]. 在TNF-a启动子上存在着NF-κB的结合位点, NF-κB被外源性因素如酒精刺激激活后即启动TNF-a的表达和分泌, 并促进其他炎性因子的调控, 参与肝损伤的发生发展. 静息状态下NF-κB与抑制蛋白IκB-a结合成复合物存在于细胞浆中, 当IκB-a磷酸化发生后, NF-κB和IκB-a解离, NF-κB游离后进入核内并与DNA上相应位点结合, 激活转录和翻译过程, 诱导iNOS以及炎性因子的合成、释放[24]. 本实验结果表明, 酒精性肝损伤时小鼠肝脏组织IκB-a磷酸化水平和胞核中NF-κB蛋白表达显著增强, 提示酒精刺激后NF-κB进入核内增多, 导致核内相关基因转录增强. 我们采用Real-time PCR检测了TNF-a和iNOS基因的表达. 实验结果表明, 酒精刺激后TNF-a和iNOS的表达也显著增强. 给予TSG后, 肝脏组织IκB-a磷酸化和NF-κB的蛋白表达水平与模型组相比显著降低. 同时, TNF-a和iNOS基因的表达也显著降低, 提示TSG可通过对NF-κB的调控, 从而抑制炎性相关因子的合成, 保护肝脏组织免遭炎性相关因子的侵害.
水飞蓟宾等一些中草药提取物对ALD有较好的治疗作用, 其机制是通过抗氧化及减少TNF-a的产生等途径发挥肝脏保护作
用[25-27]. TSG是中药何首乌特有的生物活性成分, 在许多研究中表明其通过激活沉默信息调节因子-1(SIRT1)从而抑制NF-κB的活化发挥抗炎作用[28,29]. 我们的研究结果表明在急性酒精性肝损伤模型中, TSG明显减少血内毒素水平, 减少TNF-a的表达, 可能是通过抑制Kupffer细胞的激活, 抑制NF-κB的活化而减少炎症介质的释放, 从而产生肝功能保护作用. 由于TSG具有多种药理学活性[30,31], 有可能比其他中药单体具有更好的药物保护作用, 深入研究其在ALD中的作用机理, 对于ALD的防治及开发祖国宝贵的中草药资源具有重要意义.
随着我国嗜酒者逐年增多, 由酒精所致肝损伤的发病率呈逐渐上升的趋势. 大量研究证实由内毒素介导的炎症反应是酒精性肝病的重要发病机制.
黎乐群, 教授, 广西医科大学附属肿瘤医院
肠源性内毒素及其对Kupffer细胞激活介导的肝细胞损害在酒精性肝病的发病机理中发挥着关键性作用, 针对这些环节找寻和开发治疗酒精性肝病的药物是科学界关注的热点.
二苯乙烯苷能降低肝中醋酸可的松所致的甘油三酯(TG)积累, 减轻四氯化碳(CCl4)导致的肝损伤, 抑制CCl4、醋酸可的松和硫代乙酰胺导致的小鼠肝脏微粒体中的脂质过氧化.
以往的研究报道二苯乙烯苷具有良好的抗氧化和抗炎效应, 但通过复制急性酒精性肝损伤模型, 从炎症角度来探讨二苯乙烯苷的保护效应尚属首次.
二苯乙烯苷是从何首乌中提取分离的一种多酚类的有效成分, 本研究为开发和利用二苯乙烯苷类多酚化合物防治酒精性肝病提供了重要的实验室依据, 为开发祖国宝贵的中草药资源提供了方向.
本文实验设计较严谨, 数据可靠, 有一定的创新性, 为二苯乙烯苷治疗酒精性肝病提供了实验室依据.
编辑: 田滢 电编:鲁亚静
| 1. | Purohit V, Gao B, Song BJ. Molecular mechanisms of alcoholic fatty liver. Alcohol Clin Exp Res. 2009;33:191-205. [PubMed] [DOI] |
| 3. | Yu CH, Xu CF, Ye H, Li L, Li YM. Early mortality of alcoholic hepatitis: a review of data from placebo-controlled clinical trials. World J Gastroenterol. 2010;16:2435-2439. [PubMed] [DOI] |
| 4. | Grewal P, Viswanathen VA. Liver cancer and alcohol. Clin Liver Dis. 2012;16:839-850. [PubMed] [DOI] |
| 5. | Bruha R, Dvorak K, Petrtyl J. Alcoholic liver disease. World J Hepatol. 2012;4:81-90. [PubMed] [DOI] |
| 9. | Ambade A, Mandrekar P. Oxidative stress and inflammation: essential partners in alcoholic liver disease. Int J Hepatol. 2012;2012:853175. |
| 11. | Ryu G, Ju JH, Park YJ, Ryu SY, Choi BW, Lee BH. The radical scavenging effects of stilbene glucosides from Polygonum multiflorum. Arch Pharm Res. 2002;25:636-639. [PubMed] [DOI] |
| 12. | Bode C, Bode JC. Effect of alcohol consumption on the gut. Best Pract Res Clin Gastroenterol. 2003;17:575-592. [DOI] |
| 13. | Hartmann P, Chen WC, Schnabl B. The intestinal microbiome and the leaky gut as therapeutic targets in alcoholic liver disease. Front Physiol. 2012;3:402. [PubMed] [DOI] |
| 14. | Massey VL, Arteel GE. Acute alcohol-induced liver injury. Front Physiol. 2012;3:193. [PubMed] [DOI] |
| 15. | Rao RK, Seth A, Sheth P. Recent Advances in Alcoholic Liver Disease I. Role of intestinal permeability and endotoxemia in alcoholic liver disease. Am J Physiol Gastrointest Liver Physiol. 2004;286:G881-G884. [PubMed] [DOI] |
| 16. | Szabo G, Bala S. Alcoholic liver disease and the gut-liver axis. World J Gastroenterol. 2010;16:1321-1329. [PubMed] [DOI] |
| 17. | Yan AW, Schnabl B. Bacterial translocation and changes in the intestinal microbiome associated with alcoholic liver disease. World J Hepatol. 2012;4:110-118. [PubMed] [DOI] |
| 18. | Zimmermann HW, Trautwein C, Tacke F. Functional role of monocytes and macrophages for the inflammatory response in acute liver injury. Front Physiol. 2012;3:56. [PubMed] [DOI] |
| 19. | Ajakaiye M, Jacob A, Wu R, Nicastro JM, Coppa GF, Wang P. Alcohol and hepatocyte-Kupffer cell interaction (review). Mol Med Report. 2011;4:597-602. [PubMed] |
| 20. | Wang HJ, Gao B, Zakhari S, Nagy LE. Inflammation in alcoholic liver disease. Annu Rev Nutr. 2012;32:343-368. [PubMed] [DOI] |
| 21. | An L, Wang X, Cederbaum AI. Cytokines in alcoholic liver disease. Arch Toxicol. 2012;86:1337-1348. [PubMed] [DOI] |
| 22. | Mandrekar P, Jeliazkova V, Catalano D, Szabo G. Acute alcohol exposure exerts anti-inflammatory effects by inhibiting IkappaB kinase activity and p65 phosphorylation in human monocytes. J Immunol. 2007;178:7686-7693. [PubMed] |
| 23. | Gasparini C, Feldmann M. NF-κB as a Target for Modulating Inflammatory Responses. Curr Pharm Des. 2012;18:5735-5745. [PubMed] [DOI] |
| 24. | Novitskiy G, Ravi R, Potter JJ, Rennie-Tankersley L, Wang L, Mezey E. Effects of acetaldehyde and TNF alpha on the inhibitory kappa B-alpha protein and nuclear factor kappa B activation in hepatic stellate cells. Alcohol Alcohol. 2005;40:96-101. [PubMed] [DOI] |
| 25. | Pradhan SC, Girish C. Hepatoprotective herbal drug, silymarin from experimental pharmacology to clinical medicine. Indian J Med Res. 2006;124:491-504. [PubMed] |
| 26. | Trappoliere M, Caligiuri A, Schmid M, Bertolani C, Failli P, Vizzutti F, Novo E, di Manzano C, Marra F, Loguercio C. Silybin, a component of sylimarin, exerts anti-inflammatory and anti-fibrogenic effects on human hepatic stellate cells. J Hepatol. 2009;50:1102-1111. [PubMed] [DOI] |
| 27. | Del Prete A, Scalera A, Iadevaia MD, Miranda A, Zulli C, Gaeta L, Tuccillo C, Federico A, Loguercio C. Herbal products: benefits, limits, and applications in chronic liver disease. Evid Based Complement Alternat Med. 2012;2012:837939. [PubMed] |
| 28. | Wang T, Gu J, Wu PF, Wang F, Xiong Z, Yang YJ, Wu WN, Dong LD, Chen JG. Protection by tetrahydroxystilbene glucoside against cerebral ischemia: involvement of JNK, SIRT1, and NF-kappaB pathways and inhibition of intracellular ROS/RNS generation. Free Radic Biol Med. 2009;47:229-240. [PubMed] [DOI] |
| 29. | Shen Z, Ajmo JM, Rogers CQ, Liang X, Le L, Murr MM, Peng Y, You M. Role of SIRT1 in regulation of LPS- or two ethanol metabolites-induced TNF-alpha production in cultured macrophage cell lines. Am J Physiol Gastrointest Liver Physiol. 2009;296:G1047-G1053. [PubMed] [DOI] |
| 30. | Zhang YZ, Shen JF, Xu JY, Xiao JH, Wang JL. Inhibitory effects of 2,3,5,4'-tetrahydroxystilbene-2-O-beta-D-glucoside on experimental inflammation and cyclooxygenase 2 activity. J Asian Nat Prod Res. 2007;9:355-363. [PubMed] [DOI] |