修回日期: 2012-12-10
接受日期: 2012-12-17
在线出版日期: 2012-12-18
目的: 观察甘草酸二铵(diammonium glycyrrhizinate, DG)对2, 4, 6-三硝基苯磺酸(2, 4, 6-trinitrobenzene sulfonic acid, TNBS)诱导的大鼠溃疡性结肠炎(ulcerative colitis, UC)的疗效及其对大鼠结肠组织M30及Fas/FasL蛋白表达的影响, 继而从细胞凋亡方面探讨DG治疗大鼠UC可能的作用机制.
方法: ♀Wistar大鼠30只, 随机分为正常对照组、模型组和DG组, 每组10只. 用TNBS/乙醇灌肠法复制大鼠UC模型, 10 d后收集结肠标本, 观察大鼠疾病活动指数(disease activity index, DAI)、结肠大体形态损伤评分和组织学改变, 用免疫组织化学法观察大鼠结肠黏膜中M30及Fas/FasL蛋白的表达.
结果: 与正常对照组相比, DG组、模型组DAI评分、结肠大体形态损伤评分和组织学损伤评分均显著增高(7.06±0.80 vs 0.32±0.14; 6.03±0.61 vs 0.19±0.16; 5.84±0.53 vs 0.22±0.11, P<0.01); 而与模型组相比, DG治疗组能显著改善UC症状(3.33±0.27 vs 7.06±0.80; 3.29±0.36 vs 6.03±0.61; 2.98±0.24 vs 5.84±0.53, P<0.05). 模型组大鼠M30及Fas/FasL蛋白表达水平明显高于正常组(5.76±0.66 vs 0.42±0.18; 26.62±4.20 vs 10.81±2.20; 17.11±3.12 vs 6.02±1.02, P<0.01); 与模型组相比, DG治疗组M30及Fas/FasL蛋白表达显著降低(2.24±0.48 vs 5.76±0.66; 17.23±3.20 vs 26.62±4.20; 11.02±2.12 vs 17.11±3.12, P<0.05).
结论: DG对TNBS诱导的大鼠UC有较好的疗效, DG通过下调Fas/FasL的表达抑制结肠上皮细胞的凋亡, 这可能是其减轻结肠黏膜损伤的机制之一.
引文著录: 原皓, 王鹤鸣, 赵雪曼. 甘草酸二铵对溃疡性结肠炎大鼠M30表达的影响. 世界华人消化杂志 2012; 20(35): 3439-3444
Revised: December 10, 2012
Accepted: December 17, 2012
Published online: December 18, 2012
AIM: To assess the therapeutic effect of diammonium glycyrrhizinate (DG) on 2,4,6-trinitrobenzene sulfonic acid (TNBS)-induced ulcerative colitis in rats and to explore the underlying mechanisms by detecting the expression of M30 and Fas/FasL.
METHODS: Thirty Wistar rats were equally randomized into a normal control group, a model group and a DG group. Ulcerative colitis was induced in the DG group and model group with TNBS by enema. After ten days, all rats were killed. Disease activity index (DAI), colon macroscopic damage score (CMDS) and histological damage score were calculated, and the expression of M30 and Fas/FasL in the colonic mucosa was detected by immunohistochemistry.
RESULTS: Compared to normal controls, the DAI, CMDS and histological damage score significantly increased in model rats (7.06 ± 0.80 vs 0.32 ± 0.14; 6.03 ± 0.61 vs 0.19 ± 0.16; 5.84 ± 0.53 vs 0.22 ± 0.11, P < 0.01). Compared to the model group, the above parameters were significantly improved in the DG group (3.33 ± 0.27 vs 7.06 ± 0.80; 3.29 ± 0.36 vs 6.03 ± 0.61; 2.98 ± 0.24 vs 5.84 ± 0.53, P < 0.05). Compared to the normal control group, the expression of M30 and Fas/FasL was up-regulated in the model group and DG group (5.76 ± 0.66 vs 0.42 ± 0.18; 26.62 ± 4.20 vs 10.81 ± 2.20; 17.11 ± 3.12 vs 6.02 ± 1.02, P < 0.01). Compared to the model group, the expression of M30 and Fas/FasL was remarkably decreased in the DG group (2.24 ± 0.48 vs 5.76 ± 0.66; 17.23 ± 3.20 vs 26.62 ± 4.20; 11.02 ± 2.12 vs 17.11 ± 3.12, P < 0.05).
CONCLUSION: Treatment with DG could reduce inflammatory injury in rats with experimental ulcerative colitis possibly by reducing the expression Fas/FasL and inhibiting apoptosis of cells in the colonic mucosa.
- Citation: Yuan H, Wang HM, Zhao XM. Treatment with diammonium glycyrrhizinate down-regulates M30 expression in ulcerative colitis in rats. Shijie Huaren Xiaohua Zazhi 2012; 20(35): 3439-3444
- URL: https://www.wjgnet.com/1009-3079/full/v20/i35/3439.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i35.3439
溃疡性结肠炎(ulcerative colitis, UC)是一种由免疫介导的结肠慢性炎症性疾病, 以腹痛、腹泻及黏液脓血便为临床特点, 多表现为发作期与缓解期交替. 肠道免疫系统功能障碍是UC炎症反应的主要机制[1,2]. 已有研究表明, 结肠上皮细胞异常凋亡参与UC的发生[3-6]. 上皮细胞过度凋亡导致黏膜脱落缺失, 在UC病理过程中起重要的作用. 尽管针对UC病理过程中免疫途径及炎症反应的治疗已取得了实质性的进展, 但尚无有效的治愈UC且不良作用小的特效药物[7,8]. 传统的治疗药物, 包括5-氨基水杨酸、糖皮质激素及免疫抑制剂等已出现了令人不满的效果, UC的复发率正逐渐上升[9]. 因此, 寻找新的、更有效的治疗方法一直是近几年研究的热点. 我们之前的研究已经证实, 甘草酸二铵(diammonium glycyrrhizinate, DG)对大鼠UC有较好的治疗作用, 能够显著抑制炎症反应, 减轻结肠黏膜损伤[10,11]. 进一步的研究表明, 其抗炎机制与降低炎症因子的表达, 影响炎症反应信号通路等因素有关[12-14]. 本研究旨在进一步证实DG对UC疗效的基础上, 通过观察DG对结肠黏膜M30及Fas/FasL蛋白表达的影响, 从影响上皮细胞凋亡的角度来探讨其减轻结肠黏膜损伤的作用机制.
健康♀Wistar大鼠30只, 体质量200 g±10 g, 由山东中医药大学动物中心提供; 2, 4, 6-三硝基苯磺酸(2, 4, 6-trinitrobenzene sulfonic acid, TNBS, 美国Sigma公司); DG注射液(商品名: 甘利欣, 江苏正大天晴药业股份有限公司); 兔抗大鼠Fas、FasL多克隆抗体(北京博奥森生物技术有限公司); M30单克隆抗体(瑞士PEVIVA公司); 免疫组织化学SP试剂盒、浓缩型DAB显色剂(北京中杉金桥生物有限公司).
1.2.1 造模与分组: 30只健康♀Wistar大鼠适应性喂养1 wk后随机分为正常对照组、模型组和DG组, 每组10只, 常规禁食24 h, 10%水合氯醛4.5 mL/kg腹腔麻醉后, 按照文献所述[15], 将TNBS与无水乙醇等比例混匀, DG组和模型组大鼠用聚乙烯导管由肛门缓慢插入结肠约8 cm, 然后将混合药液2 mL(以50 mg/kg计算)缓慢注入, 正常组大鼠灌注等量生理盐水. 根据人与大鼠的药物剂量折算系数算出DG的应用剂量40 mg/(kg·d), 用生理盐水稀释至2 mL, 缓慢腹腔注入; 造模当天作为第1天, DG组第1-10天腹腔注射DG; 正常对照组及模型组第1-10天腹腔注射2 mL生理盐水.
1.2.2 标本制备: 造模10 d后, 10%水合氯醛麻醉大鼠, 称质量后处死动物, 迅速剖取距肛门8 cm结肠组织, 沿肠系膜纵轴切开, 于冷生理盐水中冲洗干净, 分别在距肛门3、5和8 cm处留取结肠组织, 另于溃疡或炎症严重处留取组织, 用4%多聚甲醛固定, 常规石蜡包埋、切片, 行HE染色及免疫组织化学检测.
1.2.3 结肠炎症评价: 采用疾病活动指数(disease activity index, DAI)、大体形态损伤评分及组织学损伤评分来评价结肠炎症. (1)DAI评分: 造模后10 d, 综合大鼠体质量下降百分率、大便性状和大便出血情况, 根据Maines等[16]提出的评分标准进行积分(表1); (2)大体形态损伤评分参考Wallace等提出的评分标准, 并稍作修改[17,18]: 0分, 无炎症; 1分, 局部充血, 无溃疡; 2分, 溃疡不伴充血; 3分, 1处溃疡伴黏连; 4分, 2处或多处溃疡伴炎症; 5分, >2处溃疡和/或溃疡>1 cm; 6-8分, 溃疡>2 cm, 病变范围每增加1 cm, 增加1分; (3)组织学损伤评分[19]: 选10个视野(×100)平均评分. 评分标准: 0分, 正常结肠黏膜; 1分, 隐窝缺损1/3时; 2分, 隐窝缺损2/3; 3分, 固有层覆盖单层上皮伴轻度炎性细胞浸润; 4分, 黏膜糜烂、溃疡伴显著炎性细胞浸润.
| 得分 | 体质量下降百分率(%) | 大便性状 | 大便出血 |
| 0 | 0 | 正常 | 阴性 |
| 1 | 1-5 | ||
| 2 | 6-10 | 松散大便 | 阳性 |
| 3 | 11-15 | ||
| 4 | >15 | 腹泻 | 显性出血 |
1.2.4 M30及Fas/FasL蛋白的检测: 采用免疫组织化学SP法检测M30及Fas/FasL蛋白的表达. 按照试剂盒操作步骤进行. 结果判断: 封片后, 每张切片随机选取5个高倍视野, 计数1 000个细胞, 计算阳性细胞百分比.
统计学处理 数据用mean±SD表示, 用SPSS17.0软件进行统计分析, 对数据行单因素方差分析(one-way analysis of variance, one-way ANOVA), 再用SNK-q检验进行组间比较. P<0.05为差异有统计学意义.
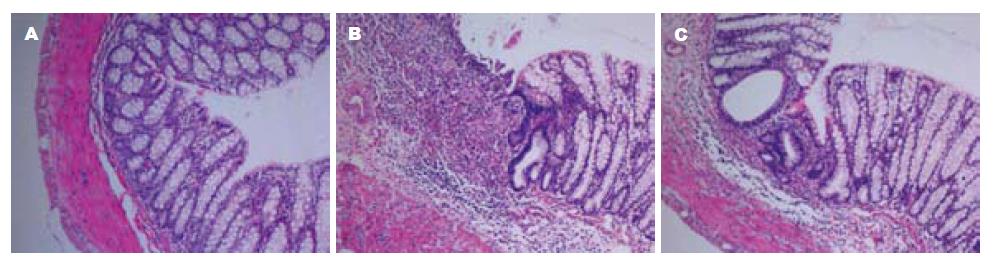
TNBS组大鼠造模后出现进食及活动明显减少, 体质量下降, 伴有稀便、黏液脓血便, 肛周污秽. 肉眼可见结肠肠腔扩张, 肠壁增厚, 充血水肿明显, 有溃疡形成, 病变严重处肠段呈黑褐色. 光镜下见上皮缺损, 隐窝脓肿, 腺体破坏, 杯状细胞减少, 大量炎性细胞浸润, 病变符合UC病理改变, 说明造模成功. 治疗10 d后, DG组体质量增加, 大便性状明显改善, 肉眼见肠壁充血水肿明显减轻, 光镜见下上皮及溃疡得到不同程度修复, 炎症细胞浸润减轻. 与正常对照组相比, DG组、模型组大鼠DAI评分、结肠大体形态损伤评分及组织学损伤评分显著升高(P<0.01), 而与模型组相比, DG组显著改善(P<0.05, 表2, 图1).
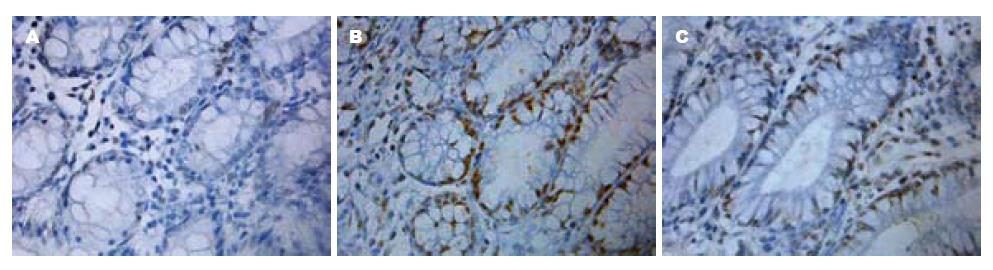
M30阳性表现为细胞浆染色. 在正常结肠黏膜偶见M30阳性凋亡细胞出现在肠腔黏膜表面, 而在溃疡黏膜及其周围可见较多M30阳性凋亡细胞呈小灶性聚集出现, 肠腔表面及整个结肠隐窝的上皮细胞都可见到凋亡细胞. DG干预治疗后, 凋亡细胞明显减少, 且主要分布于肠腔表面, 与模型组相比, M30阳性细胞率显著降低(P<0.05). 结果说明DG能明显抑制结肠上皮细胞早期的凋亡(表3, 图2).
Fas阳性在上皮细胞表现为胞浆染色, 在炎性细胞表现为细胞膜染色. 正常组和造模组, 结肠黏膜肠腔表面上皮细胞Fas均有表达, 呈连续性分布. 模型组Fas在整个结肠隐窝底部、隐窝两侧的上皮细胞都有表达, 且炎性细胞(淋巴细胞、单核细胞等)表达Fas也明显增多. DG组中, 无论是上皮细胞还是固有层炎症细胞Fas阳性表达显著减少, Fas阳性细胞率较模型组均明显降低(P<0.05, 表3), 提示DG抑制了Fas表达.
FasL阳性表现为细胞浆染色. 正常对照组中, 仅在固有层内的少许单核细胞中表达. 模型组中, FasL在固有层内淋巴细胞、浆细胞、单核细胞及上皮细胞表达明显增加. DG组中, FasL的阳性表达较模型组明显减轻, 主要见于淋巴细胞, 与模型组相比, FasL阳性细胞率显著降低(P<0.05, 表3), 说明DG能抑制FasL表达.
模型组结肠黏膜M30、Fas及FasL的表达程度与组织损伤评分, 均有一定的相关性(r = 0.38, 0.42, 0.40, P<0.05). 造模后大鼠结肠黏膜Fas表达与上皮细胞M30表达具有相关性(r = 0.38, P<0.05).
本实验通过对各组大鼠结肠炎症评分进行比较, 显示DG对UC大鼠的DAI、结肠大体形态损伤和组织学损伤评有明显的改善作用, 说明DG对TNBS诱导的大鼠UC有良好的治疗作用.
细胞凋亡是一种由基因控制的细胞程序性死亡的过程[20], 能调控机体发育, 维护内环境稳定. 虽然UC的发病机制尚不明确, 但大量的研究表明, 在UC病理过程中, 细胞凋亡参与了UC结肠黏膜的损伤, 大量的炎性细胞因子, 如肿瘤坏死因子、白细胞介素和干扰素家族等, 能够诱发结肠上皮细胞异常凋亡[16,21]. UC结肠黏膜的凋亡主要见于肠腔上皮细胞, 在活动期UC急性炎症部位及临近的隐窝上皮细胞凋亡明显增加[22,23], 过度的上皮细胞凋亡可以破坏肠黏膜的完整性和屏障功能导致结肠黏膜的损伤和溃疡形成[24,25]. 因此, 抑制UC肠黏膜细胞的凋亡, 将会起到对UC结肠黏膜的保护作用.
在上皮细胞凋亡早期, 半胱天冬蛋白酶Caspase能够特异性裂解细胞角蛋白l8(CK18), 引导凋亡发生, Caspase裂解的CK18暴露出新的抗原表位(M30蛋白), 能够被M30单克隆抗体特异性的识别, 而M30抗体不会与正常细胞或坏死细胞上未断裂的CK18结合[26]. 因此, M30抗体能够特异性检测上皮细胞早期凋亡, M30阳性细胞百分率可作为凋亡指数[27]. 用M30抗体检测细胞凋亡较传统的终端脱氧核糖核苷酸转移酶酶介导的缺口末端标记法和原位末端标记法操作简便、灵敏, 因此本实验采用M30蛋白作为检测指标, 来观察DG对UC大鼠结肠上皮细胞凋亡的影响. 结果显示DG能显著降低M30蛋白的产生, 说明DG对UC大鼠结肠上皮细胞的凋亡有显著的抑制作用.
Fas/FasL是一种死亡受体介导的细胞凋亡途径, 正常结肠上皮细胞表达Fas, 其配体FasL与Fas结合形成死亡诱导信号复合物诱导细胞凋亡, 这一机制在维持肠上皮细胞增殖和凋亡平衡过程中起重要作用[28]. Fas/FasL在肠上皮细胞主要是通过caspase介导细胞凋亡信号的转导[29]. 而且研究发现, Fas/FasL系统也是UC上皮细胞异常凋亡的重要途径之一, 在UC病变组织中, FasL阳性细胞数量明显增加, 从而导致表达Fas的结肠上皮细胞凋亡增加[30]. 本研究结果显示, DG能显著抑制Fas及FasL的表达, 提示DG对这一凋亡途径有抑制作用.
本研究结果还显示, UC结肠黏膜M30、Fas及FasL的表达程度与组织损伤评分均有一定的相关性, 进一步证明了细胞凋亡参与了UC结肠黏膜的病理变化过程, 抑制细胞凋亡就能够减小UC对黏膜的损伤; 结果还显示结肠黏膜Fas表达与上皮细胞M30表达也具有相关性, 而且M30与Fas的阳性表达部位一致, 提示UC时结肠上皮细胞的早期凋亡也是通过Fas/FasL途径介导, 这也与已有的研究结果相符[31]. 而且这也提示, DG对UC结肠黏膜上皮细胞凋亡的抑制作用是通过对Fas/FasL表达的抑制实现的.
总之, DG对TNBS诱导的大鼠UC具有良好的治疗作用, 通过抑制Fas/FasL途径介导的结肠上皮细胞的早期凋亡, 减少肠上皮细胞缺失、损伤, 增强肠黏膜屏障作用, 可能是其治疗机制之一.
甘草酸二铵(DG)对大鼠溃疡性结肠炎(UC)有较好的治疗作用, 能够降低炎症因子的表达, 显著抑制炎症反应, 减轻结肠黏膜损伤.
任粉玉, 教授, 延边大学附属医院消化内科
UC的发病率及复发率有升高的趋势, 其传统治疗的不良反应逐渐显现, 寻找新的、更有效的治疗方法一直是近几年的研究热点.
研究表明, 肠上皮细胞异常凋亡在UC病理过程中起重要作用, Fas/FasL系统是诱导其细胞凋亡的重要途径之一.
研究表明, 肠上皮细胞异常凋亡在UC病理过程中起重要作用, Fas/FasL系统是诱导其细胞凋亡的重要途径之一.
DG能够抑制大鼠UC肠上皮细胞的过度凋亡, 保护肠黏膜屏障功能, 对大鼠UC有良好的治疗作用, 可进一步扩展其临床应用.
本研究观察了甘草酸二铵对溃疡性结肠炎大鼠M30表达的影响, 课题设计合理, 研究结果具有一定的学术意义和价值.
编辑: 翟欢欢 电编:闫晋利
| 1. | Jin Y, Hofseth AB, Cui X, Windust AJ, Poudyal D, Chumanevich AA, Matesic LE, Singh NP, Nagarkatti M, Nagarkatti PS. American ginseng suppresses colitis through p53-mediated apoptosis of inflammatory cells. Cancer Prev Res (Phila). 2010;3:339-347. [PubMed] [DOI] |
| 3. | Yu QT, Saruta M, Papadakis KA. Visilizumab induces apoptosis of mucosal T lymphocytes in ulcerative colitis through activation of caspase 3 and 8 dependent pathways. Clin Immunol. 2008;127:322-329. [PubMed] [DOI] |
| 4. | Salim SY, Söderholm JD. Importance of disrupted intestinal barrier in inflammatory bowel diseases. Inflamm Bowel Dis. 2011;17:362-381. [PubMed] [DOI] |
| 5. | Günther C, Neumann H, Neurath MF, Becker C. Apoptosis, necrosis and necroptosis: cell death regulation in the intestinal epithelium. Gut. 2012; Jun 27. [Epub ahead of print]. [PubMed] [DOI] |
| 6. | Buczyński J, Spychalski M, Ławska-Wierzchniewska A, Dziki A. Higher apoptosis index and proliferation index in colonocytes of patients with ulcerative colitis in remission. Pol Przegl Chir. 2012;84:271-275. [PubMed] [DOI] |
| 7. | Jun CD, Kim Y, Choi EY, Kim M, Park B, Youn B, Yu K, Choi KS, Yoon KH, Choi SC. Gliotoxin reduces the severity of trinitrobenzene sulfonic acid-induced colitis in mice: evidence of the connection between heme oxygenase-1 and the nuclear factor-kappaB pathway in vitro and in vivo. Inflamm Bowel Dis. 2006;12:619-629. [PubMed] [DOI] |
| 8. | Cheon JH, Kim JS, Kim JM, Kim N, Jung HC, Song IS. Plant sterol guggulsterone inhibits nuclear factor-kappaB signaling in intestinal epithelial cells by blocking IkappaB kinase and ameliorates acute murine colitis. Inflamm Bowel Dis. 2006;12:1152-1161. [PubMed] [DOI] |
| 9. | Liu X, Wang JM. Iridoid glycosides fraction of Folium syringae leaves modulates NF-κB signal pathway and intestinal epithelial cells apoptosis in experimental colitis. PLoS One. 2011;6:e24740. [PubMed] [DOI] |
| 10. | Yuan H, Ji WS, Wu KX, Jiao JX, Sun LH, Feng YT. Anti-inflammatory effect of Diammonium Glycyrrhizinate in a rat model of ulcerative colitis. World J Gastroenterol. 2006;12:4578-4581. [PubMed] |
| 15. | Li XL, Cai YQ, Qin H, Wu YJ. Therapeutic effect and mechanism of proanthocyanidins from grape seeds in rats with TNBS-induced ulcerative colitis. Can J Physiol Pharmacol. 2008;86:841-849. [PubMed] [DOI] |
| 16. | Maines LW, Fitzpatrick LR, French KJ, Zhuang Y, Xia Z, Keller SN, Upson JJ, Smith CD. Suppression of ulcerative colitis in mice by orally available inhibitors of sphingosine kinase. Dig Dis Sci. 2008;53:997-1012. [PubMed] [DOI] |
| 17. | Wallace JL, Keenan CM, Gale D, Shoupe TS. Exacerbation of experimental colitis by nonsteroidal anti-inflammatory drugs is not related to elevated leukotriene B4 synthesis. Gastroenterology. 1992;102:18-27. [PubMed] |
| 18. | Bobin-Dubigeon C, Collin X, Grimaud N, Robert JM, Le Baut G, Petit JY. Effects of tumour necrosis factor-alpha synthesis inhibitors on rat trinitrobenzene sulphonic acid-induced chronic colitis. Eur J Pharmacol. 2001;431:103-110. [PubMed] [DOI] |
| 19. | Krieglstein CF, Cerwinka WH, Laroux FS, Grisham MB, Schürmann G, Brüwer M, Granger DN. Role of appendix and spleen in experimental colitis. J Surg Res. 2001;101:166-175. [PubMed] [DOI] |
| 21. | Qiu W, Wu B, Wang X, Buchanan ME, Regueiro MD, Hartman DJ, Schoen RE, Yu J, Zhang L. PUMA-mediated intestinal epithelial apoptosis contributes to ulcerative colitis in humans and mice. J Clin Invest. 2011;121:1722-1732. [PubMed] [DOI] |
| 22. | Iwamoto M, Koji T, Makiyama K, Kobayashi N, Nakane PK. Apoptosis of crypt epithelial cells in ulcerative colitis. J Pathol. 1996;180:152-159. [PubMed] [DOI] |
| 23. | Hagiwara C, Tanaka M, Kudo H. Increase in colorectal epithelial apoptotic cells in patients with ulcerative colitis ultimately requiring surgery. J Gastroenterol Hepatol. 2002;17:758-764. [PubMed] [DOI] |
| 24. | Schulzke JD, Bojarski C, Zeissig S, Heller F, Gitter AH, Fromm M. Disrupted barrier function through epithelial cell apoptosis. Ann N Y Acad Sci. 2006;1072:288-299. [PubMed] [DOI] |
| 25. | Han X, Ren X, Jurickova I, Groschwitz K, Pasternak BA, Xu H, Wilson TA, Hogan SP, Denson LA. Regulation of intestinal barrier function by signal transducer and activator of transcription 5b. Gut. 2009;58:49-58. [PubMed] [DOI] |
| 26. | West NJ, Courtney ED, Poullis AP, Leicester RJ. Apoptosis in the colonic crypt, colorectal adenomata, and manipulation by chemoprevention. Cancer Epidemiol Biomarkers Prev. 2009;18:1680-1687. [PubMed] [DOI] |
| 28. | Souza HS, Tortori CJ, Castelo-Branco MT, Carvalho AT, Margallo VS, Delgado CF, Dines I, Elia CC. Apoptosis in the intestinal mucosa of patients with inflammatory bowel disease: evidence of altered expression of FasL and perforin cytotoxic pathways. Int J Colorectal Dis. 2005;20:277-286. [PubMed] [DOI] |
| 29. | Liu D, Huang X, Cheng S, Tong W, Wan P, Guan Y, Zhao H. [Regulation of sishen wan on Bax/Bcl-2 mRNA, Fas/FasL in colonic tissue from rats with colitis]. Zhongguo Zhongyao Zazhi. 2011;36:3484-3488. [PubMed] |
| 30. | Hofseth LJ, Hussain SP, Harris CC. p53: 25 years after its discovery. Trends Pharmacol Sci. 2004;25:177-181. [PubMed] [DOI] |