修回日期: 2012-09-05
接受日期: 2012-09-25
在线出版日期: 2012-10-28
目的: 观察siRNA沉默核糖体蛋白L31(ribosomal protein L31, RPL31)基因表达对人胰腺癌PANC-1细胞的影响.
方法: 针对RPL31基因设计了3条siRNA, 使用脂质体LipofectamineTM2000转染人胰腺癌PANC-1细胞, 同时设立空白对照组和阴性对照组, 转染成功后通过实时定量PCR及Western blot分别从mRNA和蛋白水平检测RNA干扰沉默RPL31基因的效果, 四氮唑盐比色法(MTT)检测细胞增殖, 流式细胞术检测细胞周期分布, Transwell小室检测细胞迁移, ELISA检测血管内皮生长因子(vascular endothelial growth factor, VEGF)的表达.
结果: 转染48 h后, 3条siRNA能显著抑制RPL31基因mRNA和蛋白的表达; MTT结果显示, PANC-1细胞增殖明显受到抑制; 细胞周期分布中G0/G1期明显增加、S期减少(G0/G1: 59.85%±5.47% vs 45.71%±3.44%; S: 28.63%±4.52% vs 45.13%±2.64%, 均P<0.05); 转染后细胞迁移数目(178.6个±30.3个)较空白对照组(470.5个±22.8个)与阴性对照组(474.2个±20.4个)明显减少, 差异显著(P<0.05); 转染后PANC-1细胞的VEGF表达量也明显减少[1563.45 pg/(106 cell • 24 h)±24.95 pg/(106 cell • 24 h) vs 2804.6 pg/(106 cell • 24 h)±40.46 pg/(106 cell•24 h), 2791.5 pg/(106 cell • 24 h)±44.77 pg/(106 cell•24 h)].
结论: RPL31 siRNA能明显抑制PANC-1细胞RPL31的表达, 抑制细胞增殖, 降低细胞迁移及VEGF表达, RPL31基因有可能成为胰腺癌基因治疗的新靶点.
引文著录: 李朝东, 戈梅, 罗敏玉, 陈代杰. siRNA沉默RPL31表达对胰腺癌PANC-1细胞增殖的抑制作用. 世界华人消化杂志 2012; 20(30): 2895-2901
Revised: September 5, 2012
Accepted: September 25, 2012
Published online: October 28, 2012
AIM: To investigate the impact of small interfering RNA (siRNA)-mediated RPL31 gene silencing on biological behavior of human pancreatic cancer PANC-1 cells, and to explore the feasibility of using the human RPL31 gene as a therapeutic target for pancreatic cancer.
METHODS: Three RPL31-specific siRNAs were designed and transfected into PANC-1 cells using LipofectamineTM 2000. Blank control and negative control groups were run at the same time. After PANC-1 cells were transfected with RPL31-specific siRNA, the levels of RPL31 mRNA and protein were detected by quantitative real-time PCR (qRT-PCR) and Western blot, respectively. Cell proliferation was detected by MTT assay. Cell cycle progression was determined by flow cytometry. Cell migration was determined by Transwell chamber assay. Vascular endothelial growth factor (VEGF) expression in cells was detected by ELISA.
RESULTS: All three RPL31-specific siRNAs could silence the expression of RPL31 at the mRNA and protein levels 48 hours after transfection. MTT assay showed that cell proliferation was significantly inhibited. Flow cytometry analysis revealed that PANC-1 cells transfected with RPL31 siRNA had a more significant cell cycle arrest (G0/G1 phase: 59.85% ± 5.47% vs 45.71% ± 3.44%; S phase: 28.63% ± 4.52% vs 45.13% ± 2.64%, both P < 0.05). RPL31 knockdown significantly suppressed VEGF expression (1563.45 ± 24.95 pg/106 cells/24 h vs 2804.6 ± 40.46 pg/106 cells/24 h, 2791.5 ± 44.77 pg/106 cells/24 h, both P < 0.05) and the migration of PANC-1 cells (178.6 ± 30.3 vs 470.5 ± 22.8, 474.2 ± 20.4, both P < 0.05) compared to the blank control and negative control groups.
CONCLUSION: Transfection of RPL31-specific siRNAs could effectively inhibit RPL31 expression, significantly suppress cell proliferation, and reduce cell migration and VEGF expression. RPL31 might serve as a target for gene therapy of pancreatic cancer.
- Citation: Li CD, Ge M, Luo MY, Chen DJ. SiRNA-mediated silencing of the RPL31 gene inhibits proliferation of human pancreatic cancer PANC-1 cells. Shijie Huaren Xiaohua Zazhi 2012; 20(30): 2895-2901
- URL: https://www.wjgnet.com/1009-3079/full/v20/i30/2895.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i30.2895
胰腺癌是常见的消化系恶性肿瘤, 其恶性程度极高, 早期缺乏特异症状, 进展迅速, 在发现时多是晚期, 死亡率在所有癌症死亡中排名第4位, 总体5年生存率低于3%[1,2]. 胰腺癌的发生是多个基因突变连续性积累的结果[3,4]. RNA干扰(RNA interference, RNAi)可以特异性关闭某个基因的表达, 在肿瘤治疗及发病机制研究方面有着独特的优势. KRAS基因是与胰腺癌关系最为密切的原癌基因之一, 是胰腺癌治疗的重要靶点[5,6]. 利用RNA干扰技术特异性的抑制KRAS基因可能会导致细胞内其他基因的表达发生变化对其进行补偿[7]. 我们之前的研究证实, 通过慢病毒介导的RNAi长期抑制胰腺癌PANC-1细胞KRAS基因的表达, 可以导致糖体蛋白L31(ribosomal protein L31, RPL31)基因的表达上调[8], 推测RPL31基因可能参与KRAS沉默的补偿, 可能是胰腺癌细胞中的一个重要的基因. 因此, 本文设计特异性针对RPL31基因的小干扰RNA(siRNA), 分析RPL31基因沉默后对胰腺癌细胞PANC-1生物学特性的影响.
人胰腺癌细胞株PANC-1(中国科学院典型培养物保藏委员会细胞库), DMEM培养基(美国Gibco), 胎牛血清(HyClone), LipofectamineTM2000(Invitrogen), TRNzolTM(TIANGEN), cDNA反转录试剂盒、SYBR Green qPCR Master Mix(Fermentas), RPL31兔抗人单克隆抗体(Abgent), β-actin兔抗人单克隆抗体(Cell Signaling), HRP标记的山羊抗兔二抗(北京中杉金桥), ECL发光试剂盒(Thermo Scientific), 细胞周期检测试剂盒、BCA蛋白浓度检测试剂盒、RIPA裂解液(碧云天), Transwell小室、各种规格培养皿(corning costar), DAPI荧光染料、MTT(sigma), 血管内皮生长因子(vascular endothelial growth factor, VEGF)ELISA检测试剂盒(深圳晶美).
1.2.1 siRNA的设计及合成: 通过Ambion网站, 根据人RPL31基因(Genbank NM_000993.4)的编码序列设计3条不同的siRNA序列, siRNA-1: 5'-UCAAUGCGCACAUCUGGAGTT-3', 5'-CUCCAGAUGUGCGCAUUGATT-3'; siRNA-2: 5'-AUUCGGUAUGGCACAUUCCTT-3', 5'-GGAAUGUGCCAUACCGAAUTT-3'; siRNA-3: 5'-CACAUUGACUGUCUGUAGATT-3', 5'-UCUACAGACAGUCAAUGUGTT-3'. 同时设计阴性对照siRNA, 序列为: 5'-UUCUCCGAACGUGUCACGUTT-3', 5'-ACGUGACACGUUCGGAGAATT-3'. 所有siRNA由上海吉玛制药由限公司合成提供.
1.2.2 细胞培养及转染: PANC-1细胞培养于100 mL/L胎牛血清的高糖DMEM培养液中, 置于37 ℃、含50 mL/L CO2、饱和湿度的培养箱中. 培养48-72 h时使用2.5 g/L的胰酶+0.02%的EDTA按1∶3进行传代. 取对数生长期的细胞用于实验. 转染前24 h将细胞计数, 约1.5×105/孔接种至6孔板, 转染时细胞融合达到50%. 转染完全按照Invitrogen的LipofectamineTM2000产品使用说明书操作, 每孔siRNA浓度40 nmol/L, 转染6 h后换液. 实验分为空白对照组、阴性对照组及干预组.
1.2.3 实时定量PCR: 收集转染48 h后的细胞, 使用TRNzolTM试剂提取细胞总RNA, 具体操作按照TIANGEN公司的TRNzolTM操作说明进行. 紫外分光光度计检测样品纯度和浓度, A260/280 = 1.8-2.0. 按照Fermentas公司的First Strand cDNA Synthesis Kit说明书进行逆转录合成cDNA, 逆转录2 µg RNA, 体系为20 µL, 反转录程序为: 65 ℃ 5 min, 42 ℃ 60 min, 70 ℃ 5 min灭活反转录酶. 分别设计RPL31及GAPDH的检测引物, 序列如下: RPL31-F: 5'-CGACCCGGAAGTTGTACTTG-3'; RPL31-R: 5'-TCTCGCCACCCTTCTTTG-3'; GAPDH-F: 5'-GCACCGTCAAGGCTGAGAAC-3'; GAPDH-R: 5'-GCCTTCTCCATGGTGGTGAA-3'. 实时定量PCR反应体系为20 μL, 其中SYBR Green/ROX qPCR Master Mix为12.5 μL, 10 μmol/L的上下游引物各1 μL, cDNA为1 μL, ddH2O为9.5 μL. 反应程序为: (1)94 ℃ 10 min, (2)94 ℃ 30 s, (3)60 ℃ 30 s, (4)72 ℃ 30 s. (2)-(4)40个循环, 用2-△△Ct分析法进行数值分析[9].
1.2.4 Western blot检测RPL31蛋白的表达: 细胞转染siRNA 48 h后, 用预冷的PBS(0.01 mol/L, pH 7.4)洗涤细胞3次, 加入RIPA裂解液, 置冰浴中作用30 min, 4 ℃、12 000 g×15 min, 提取细胞总蛋白, 取上清进行BCA法蛋白定量. 制备10%的SDS-PAGE分离胶, 5%的SDS-PAGE浓缩胶, 取等量蛋白30 μg进行电泳, 将蛋白于200 mA恒电流下转膜1 h至PVDF膜上, 5%脱脂奶粉的TBST封闭1 h, 4 ℃孵育RPL31抗体及β-Actin抗体过夜, 二抗室温震荡孵育1 h, TBST洗膜后用ECL试剂盒暗室显影.
1.2.5 MTT法[10]检测细胞增殖: 细胞转染24 h后, 胰酶消化, 2 000/孔接种96孔板(200 μL培养液), 连续培养5 d, 每天进行MTT检测: 用PBS配制5 g/L的MTT溶液, 每孔加入20 μL, 37 ℃孵育4 h, 小心弃上清, 每孔加入200 μL DMSO, 震荡溶解, 使用酶标仪(美国Bio-Rad公司)测定490 nm下的A值. 分别以转染时间为横坐标、A值为纵坐标, 绘制细胞生长曲线.
1.2.6 流式细胞仪检测细胞周期[11]: 收集转染48 h后的各组细胞, 用预冷的PBS洗涤细胞一次, 加入预冷的700 mL/L乙醇4 ℃固定过夜, 按照细胞周期检测试剂盒(碧云天)说明进行PI染色液, 37 ℃避光孵育30 min, 用流式细胞仪检测各个细胞周期的分布.
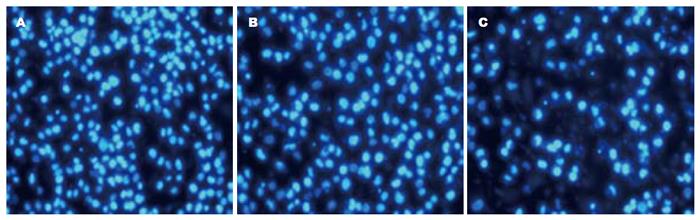
1.2.7 细胞迁移实验[12]: 收集转染48 h后的细胞2×104个, 用100 μL无血清培养液稀释后接种到Transwell小室的上室中, 24孔板每孔加入600 μL含100 mL/L胎牛血清DMEM培养液, 将小室置于24孔板内, 放入37 ℃、50 mL/L CO2的培养箱孵育12 h. 小心擦掉上室细胞, PBS洗3次, 5%多聚甲醛固定10 min, 10 μg/mL的DAPI溶液染色5 min, 荧光显微镜下拍照计数5个视野穿过微孔的细胞数. 每组3个小室, 实验重复3次.
1.2.8 ELISA检测血管内皮生长因子表达[13]: 在6孔板中进行转染, 转染24 h后, 吸弃上清, 用无血清的DMEM培养液洗涤细胞3次, 再加入2 mL无血清的DMEM培养液培养24 h. 吸取培养液上清, 离心后-80 ℃冻存备测. 细胞用胰酶消化进行计数. 采用人VEGF ELISA检测试剂盒, 严格按照说明书进行操作. 最后用酶标仪测定450 nm下的A值, 通过标准曲线计算细胞每106个细胞、每24 h的VEGF表达量.
统计学处理 数据计量采用均数±标准差(mean±SD)表示. 用SPSS12.0软件进行数据统计分析, 两组数据之间进行t检验, 多组均数间的显著性检验用方差分析, P<0.05代表差异具有显著性.
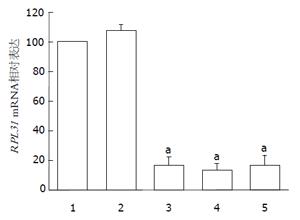
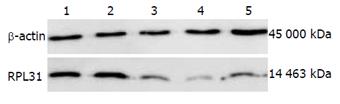
与空白对照组和阴性对照组相比, 3个干预组siRNA转染PANC-1细胞后都能使RPL31基因在mRNA和蛋白水平表达明显下调(P<0.05). 实时定量PCR分析得出, RPL31-1、RPL31-2、RPL31-3 3个干预组处理后RPL31的mRNA分别下降83.16%±5.53%、86.10%±3.78%、83.04%±6.27%, 空白对照组及阴性对照组并未明显改变(图1). Western blot实验分析得出, 3个干预组都能降低RPL31蛋白的表达(图2). 选择干扰效果最好的RPL31-2进行后续实验.
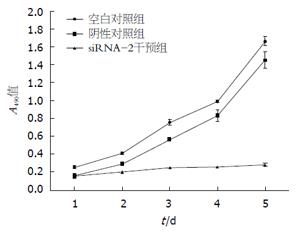
MTT检测结果显示, 转染RPL31 siRNA-2的细胞生长速度较空白对照组及阴性对照组明显减慢, 差异有统计学意义(P<0.05). 转染后48 h为测定的1 d, 从1 d到5 d干预组的抑制率分别为35.90%、51.21%、67.43%、74.25%和83.22%(图3).
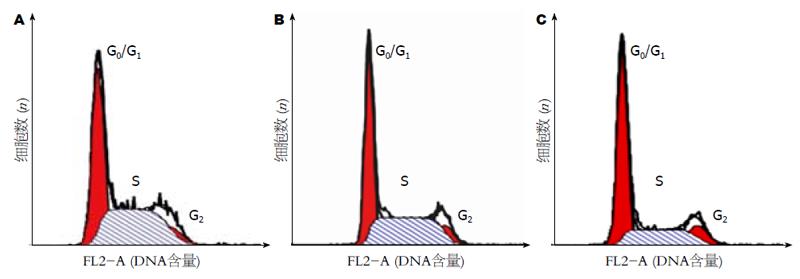
流式细胞仪分析显示, 转染siRNA-2 48 h后, PANC-1细胞周期发生明显改变, G0/G1期细胞明显增加(由45.71%±3.44%增至59.85%±5.47%), S期细胞明显减少(由45.13%±2.64%降至28.63%±4.52%), G2期细胞无明显改变, 与空白对照组和阴性对照组相比有显著性统计学差异(P<0.05, 图4, 表1).
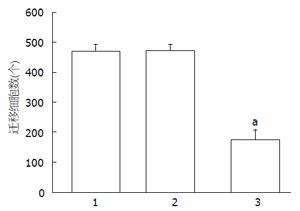
空白对照组迁移细胞数目为470.5个±22.8个, 转染阴性对照组为474.2个±20.4个, 而转染RPL31 siRNA-2组迁移的数目为178.6个±30.3个, 与空白对照组和阴性对照组比较差异均有统计学意义(P<0.05, 图5, 6).
2.5 RPL31 siRNA对胰腺癌PANC-1细胞血管内皮生长因子表达的影响
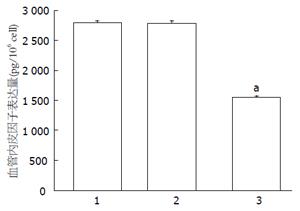
VEGF是促血管生长因子, 癌细胞的增殖、转移依赖于新生血管的生成. ELISA实验结果显示, 培养24 h, 空白对照组培养液上清中VEGF的表达量是2804.6 pg/106 cell±40.46 pg/106 cell, 转染阴性对照组为2791.5 pg/106 cell±44.77 pg/106 cell, 而转染RPL31 siRNA-2组培养液上清中VEGF的表达量是1563.45 pg/106 cell±24.95 pg/106 cell, 与空白对照组和阴性对照组比较差异均有统计学意义(P<0.05, 图7).
胰腺癌是威胁人类健康的主要致死疾病之一. 手术是目前唯一可能治愈胰腺癌的方法, 然而仅10%-15%的胰腺癌患者有手术治疗机会, 患者术后5年生存率仅为15%-25%[14]. KRAS基因与胰腺癌关系极为密切, 其编码的P21蛋白一旦发生突变, 可诱导胰腺导管上皮细胞发生化生及瘤变[15]. KRAS基因在胰腺癌中突变频率几乎达到100%, 他在胰腺癌的发生、持续生长、浸润转移的各个阶段都有非常重要的作用[16], 已经成为公认的治疗靶点. 分子靶向治疗是目前胰腺癌内科治疗发展的方向[17]. 然而, 不管是针对KRAS基因的基因治疗还是针对P21蛋白的分子靶向治疗, 最终的治疗效果都不显著[18,19]. 这提示我们, 需要深层次的理解胰腺癌致病的分子机制, 并且开发一些更加有效的治疗靶点.
RNAi是指通过内源性或外源性双链RNA的介导, 特异性降解相应序列的mRNA, 导致靶基因的表达沉默, 产生相应的功能型缺失的现象[20]. 利用RNA干扰技术针对KRAS基因治疗是一种有效的胰腺癌治疗策略, 国内外也进行了许多研究[21,22]. 然而, 特异性的抑制某一基因可能会导致细胞内其他基因的表达发生变化对其进行补偿. 例如, Zhao等[7]发现利用siRNA沉默肝癌细胞中原癌基因NRAS的表达后, epiregulin基因对NRAS沉默后产生了补偿现象, 因此epiregulin基因是一个潜在的治疗靶点. 我们前期的研究利用了慢病毒介导的RNAi这一策略在胰腺癌PANC-1细胞中关闭KRAS基因的表达, 之后通过基因芯片研究胞内其他基因的表达变化. 值得一提的是, 若干个核糖体蛋白基因在KRAS沉默后表达上调, 本研究中的RPL31就是其中显著上调的一个基因[8].
RPL31基因属于核糖体蛋白L31E家族, 其编码的蛋白质是构成核糖体60S亚基的成员之一. 越来越多的研究表明, 许多核糖体蛋白还有独立于蛋白质生物合成作用之外的功能, 比如参与调控基因的转录翻译、参与DNA修复、调控细胞的增殖分化凋亡等, 另外, 核糖体蛋白在肿瘤的发生、发展、转移和肿瘤抑制中可能发挥重要的作用[23-25]. 目前RPL31的研究主要是探讨其与结直肠癌(colorectal carcinomas, CRC)的关系. 研究表明, RPL31在结直肠癌的发生、发展中具有促增殖及致癌性的作用[26,27]. 另外, 在转移性的结直肠癌肿瘤内, RPL31的表达是下调的[28]. RPL31基因与胰腺癌的关系目前未见国内外报道.
本研究中, 我们利用siRNA考察了中关闭RPL31表达后胰腺癌PANC-1细胞生物学特性的变化: 增殖特性、周期变化、迁移特性和血管生成. 胰腺癌细胞的显著特是具有恶性增生能力点, 因此在治疗时一个重要的措施就是抑制胰腺癌细胞的恶性增殖能力[29]; 从另外一个角度来, 肿瘤的发生是由于细胞周期的调节失控引起的周期性疾病, 胰腺癌也不例外; 此外, 细胞的迁移运动是肿瘤病理过程中的重要步骤和关键环节, 胰腺癌的另一个显著的特点是具有很强的转移性, 控制胰腺癌的恶性转移是治疗的一个重要的方向[30]; 最后, 癌细胞的增殖、转移依赖于新生血管的生成, 胰腺癌的发生、发展及转移的整个过程中, VEGF发挥了重要的作用[31]. 如果能改变胰腺癌细胞的上述生物学特性, 就能对胰腺癌的治疗产生积极的作用. 在实验中我们通过转染siRNA关闭胰腺癌PANC-1细胞中RPL31的表达, 发现细胞的增殖受到抑制, 细胞周期阻遏于G0/G1期, 除此之外, RPL31被沉默后PANC-1细胞的迁移能力及VEGF表达都降低. 这些研究结果显示了RPL31基因在维持PANC-1细胞生物学特性方面的重要性. 因此, RPL31基因是否可能成为一个新的治疗靶点值得进一步研究. 本研究为将RPL31基因作为胰腺癌治疗靶点的基因治疗提供了新的思路.
感谢北京大学席建忠教授在RNAi方面的指导, 感谢毛文伟、殷瑜及杨天同志在实验中给予的大力帮助.
胰腺癌与其他恶性肿瘤一样是一种基因疾病, KRAS基因与胰腺癌关系密切, 是重要的胰腺癌治疗靶点, 然而利用RNA干扰技术特异性的抑制KRAS基因可能会导致细胞内其他基因的表达发生变化对其进行补偿. 研究这些补偿机制有可能会发现新的治疗靶点.
江建新, 副主任医师, 贵阳医学院附属医院肝胆外科; 高英堂, 研究员, 天津市第三中心医院
目前关于核糖体蛋白与肿瘤关系的研究成为肿瘤发病机制及治疗研究的新热点, RNA干扰(RNAi)可以特异性关闭某个基因的表达, 在肿瘤治疗及发病机制研究方面具有独特的优势.
核糖体蛋白L31(RPL31)在结直肠癌的发生、发展中具有促增殖及致癌性的作用, 我们前期的研究发现, 利用慢病毒介导的RNAi在胰腺癌PANC-1细胞中长期关闭KRAS基因的表达可以导致RPL31的显著上调, 推测RPL31可能是胰腺癌中一个重要的基因.
目前国内外关于RPL31基因在胰腺癌中功能的研究报道很少, 本研究设计特异性针对RPL31基因的siRNA, 分析了RPL31基因沉默后对胰腺癌PANC-1细胞生物学特性的影响, 国内外未见报道.
使用siRNA关闭胰腺癌PANC-1细胞的RPL31表达, 发现细胞的增殖受到抑制, 周期阻遏于G0/G1期, 迁移能力及VEGF表达都降低. 这些研究结果显示了RPL31基因在维持PANC-1细胞生物学特性方面的重要性. 因此, 该基因是否能够成为一个新的治疗靶点值得进一步研究.
本文选题较为新颖, 研究方法合理, 对胰腺癌的发生和治疗靶点的探讨具有一定的意义.
编辑: 田滢 电编:鲁亚静
| 1. | Hidalgo M. Pancreatic cancer. N Engl J Med. 2010;362:1605-1617. [PubMed] [DOI] |
| 2. | Siegel R, Ward E, Brawley O, Jemal A. Cancer statistics, 2011: the impact of eliminating socioeconomic and racial disparities on premature cancer deaths. CA Cancer J Clin. 2011;61:212-236. [PubMed] [DOI] |
| 3. | Matthaios D, Zarogoulidis P, Balgouranidou I, Chatzaki E, Kakolyris S. Molecular pathogenesis of pancreatic cancer and clinical perspectives. Oncology. 2011;81:259-272. [PubMed] [DOI] |
| 4. | Sakorafas GH, Smyrniotis V. Molecular biology of pancreatic cancer: how useful is it in clinical practice? JOP. 2012;13:332-337. [PubMed] |
| 5. | Rajalingam K, Schreck R, Rapp UR, Albert S. Ras oncogenes and their downstream targets. Biochim Biophys Acta. 2007;1773:1177-1195. [PubMed] |
| 6. | Wong HH, Lemoine NR. Pancreatic cancer: molecular pathogenesis and new therapeutic targets. Nat Rev Gastroenterol Hepatol. 2009;6:412-422. [PubMed] [DOI] |
| 7. | Zhao M, He HW, Sun HX, Ren KH, Shao RG. Dual knockdown of N-ras and epiregulin synergistically suppressed the growth of human hepatoma cells. Biochem Biophys Res Commun. 2009;387:239-244. [PubMed] [DOI] |
| 8. | Li C, Ge M, Yin Y, Luo M, Chen D. Silencing expression of ribosomal protein L26 and L29 by RNA interfering inhibits proliferation of human pancreatic cancer PANC-1 cells. Mol Cell Biochem. 2012; Aug 7. [Epub ahead of print]. [PubMed] [DOI] |
| 9. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] [DOI] |
| 10. | Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods. 1983;65:55-63. [PubMed] [DOI] |
| 11. | Chen HY, Tang NH, Lin N, Chen ZX, Wang XZ. Hepatitis B virus X protein induces apoptosis and cell cycle deregulation through interfering with DNA repair and checkpoint responses. Hepatol Res. 2008;38:174-182. [PubMed] |
| 12. | Luftman K, Hasan N, Day P, Hardee D, Hu C. Silencing of VAMP3 inhibits cell migration and integrin-mediated adhesion. Biochem Biophys Res Commun. 2009;380:65-70. [PubMed] [DOI] |
| 13. | Gray MJ, Zhang J, Ellis LM, Semenza GL, Evans DB, Watowich SS, Gallick GE. HIF-1alpha, STAT3, CBP/p300 and Ref-1/APE are components of a transcriptional complex that regulates Src-dependent hypoxia-induced expression of VEGF in pancreatic and prostate carcinomas. Oncogene. 2005;24:3110-3120. [PubMed] [DOI] |
| 14. | Gudjonsson B. Pancreatic cancer: survival, errors and evidence. Eur J Gastroenterol Hepatol. 2009;21:1379-1382. [PubMed] [DOI] |
| 15. | Ji B, Tsou L, Wang H, Gaiser S, Chang DZ, Daniluk J, Bi Y, Grote T, Longnecker DS, Logsdon CD. Ras activity levels control the development of pancreatic diseases. Gastroenterology. 2009;137:1072-1082, 1082. e1-e6. [PubMed] |
| 16. | Collins MA, Bednar F, Zhang Y, Brisset JC, Galbán S, Galbán CJ, Rakshit S, Flannagan KS, Adsay NV, Pasca di Magliano M. Oncogenic Kras is required for both the initiation and maintenance of pancreatic cancer in mice. J Clin Invest. 2012;122:639-653. [PubMed] [DOI] |
| 17. | Rivera F, López-Tarruella S, Vega-Villegas ME, Salcedo M. Treatment of advanced pancreatic cancer: from gemcitabine single agent to combinations and targeted therapy. Cancer Treat Rev. 2009;35:335-339. [PubMed] [DOI] |
| 18. | Van Cutsem E, van de Velde H, Karasek P, Oettle H, Vervenne WL, Szawlowski A, Schoffski P, Post S, Verslype C, Neumann H. Phase III trial of gemcitabine plus tipifarnib compared with gemcitabine plus placebo in advanced pancreatic cancer. J Clin Oncol. 2004;22:1430-1438. [PubMed] [DOI] |
| 19. | Macdonald JS, McCoy S, Whitehead RP, Iqbal S, Wade JL, Giguere JK, Abbruzzese JL. A phase II study of farnesyl transferase inhibitor R115777 in pancreatic cancer: a Southwest oncology group (SWOG 9924) study. Invest New Drugs. 2005;23:485-487. [PubMed] [DOI] |
| 20. | Hammond SM, Bernstein E, Beach D, Hannon GJ. An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells. Nature. 2000;404:293-296. [PubMed] [DOI] |
| 21. | Réjiba S, Wack S, Aprahamian M, Hajri A. K-ras oncogene silencing strategy reduces tumor growth and enhances gemcitabine chemotherapy efficacy for pancreatic cancer treatment. Cancer Sci. 2007;98:1128-1136. [PubMed] [DOI] |
| 22. | 李 冬斌, 郑 志刚, 许 香梅, 郭 华, 赵 雪莲, 黄 林凤, 蔡 建辉. 短发夹RNA对胰腺癌细胞PANC-1突变型K-ras基因表达的影响. 世界华人消化杂志. 2008;16:3941-3945. [DOI] |
| 23. | Warner JR, McIntosh KB. How common are extraribosomal functions of ribosomal proteins? Mol Cell. 2009;34:3-11. [PubMed] [DOI] |
| 24. | Ogle JM, Carter AP, Ramakrishnan V. Insights into the decoding mechanism from recent ribosome structures. Trends Biochem Sci. 2003;28:259-266. [PubMed] [DOI] |
| 25. | Stoneley M, Willis AE. Cellular internal ribosome entry segments: structures, trans-acting factors and regulation of gene expression. Oncogene. 2004;23:3200-3207. [PubMed] [DOI] |
| 26. | Lai MD, Xu J. Ribosomal proteins and colorectal cancer. Curr Genomics. 2007;8:43-49. [PubMed] [DOI] |
| 27. | Chester KA, Robson L, Begent RH, Talbot IC, Pringle JH, Primrose L, Macpherson AJ, Boxer G, Southall P, Malcolm AD. Identification of a human ribosomal protein mRNA with increased expression in colorectal tumours. Biochim Biophys Acta. 1989;1009:297-300. [PubMed] [DOI] |
| 28. | Bertucci F, Salas S, Eysteries S, Nasser V, Finetti P, Ginestier C, Charafe-Jauffret E, Loriod B, Bachelart L, Montfort J. Gene expression profiling of colon cancer by DNA microarrays and correlation with histoclinical parameters. Oncogene. 2004;23:1377-1391. [PubMed] [DOI] |
| 29. | Kunnumakkara AB, Guha S, Krishnan S, Diagaradjane P, Gelovani J, Aggarwal BB. Curcumin potentiates antitumor activity of gemcitabine in an orthotopic model of pancreatic cancer through suppression of proliferation, angiogenesis, and inhibition of nuclear factor-kappaB-regulated gene products. Cancer Res. 2007;67:3853-3861. [PubMed] [DOI] |
| 30. | Garcea G, Neal CP, Pattenden CJ, Steward WP, Berry DP. Molecular prognostic markers in pancreatic cancer: a systematic review. Eur J Cancer. 2005;41:2213-2236. [PubMed] [DOI] |
| 31. | Korc M. Pathways for aberrant angiogenesis in pancreatic cancer. Mol Cancer. 2003;2:8. [PubMed] [DOI] |