修回日期: 2012-08-09
接受日期: 2012-09-03
在线出版日期: 2012-09-18
目的: 探讨患者外周血清白介素-17A(serum Interleukin-17A, IL-17A)对肝癌细胞可溶性MICA(soluble major histocompatibility complex class I chain-related gene A, sMICA)的调控作用及可能机制.
方法: 收集慢性肝炎(chronic hepatitis, CH)、肝硬化(liver cirrhosis, LC)、HCC、健康对照者(health control, HC)各30例, 采用ELISA方法分别检测血清sMICA及IL-17A的表达水平; HepG2和PLC/PRF/5细胞加入0、10、50 ng/mL的重组人IL-17A(RhIL-17A)作用24 h后, 分别采用ELISA检测sMICA的表达; 并在50 ng/mL的RhIL-17A作用24 h后, 采用流式细胞术(flow cytometry, FCM)检测膜型MICA的表达、荧光定量RT-PCR检测MICA mRNA的表达、Western blot检测ADAM 9, p65和磷酸化p65(P-p65)的表达.
结果: HCC组血清IL-17A与sMICA水平明显高于CH、LC、HC组(IL-17AF = 46.321, sMICAF = 24.144, P<0.01), 且二者呈正相关(r = 0.28, P<0.01); RhIL-17A显著增加HCC细胞sMICA、膜MICA mRNA的表达(P<0.05), 且可增加HCC细胞ADAM 9和P-p65蛋白的表达.
结论: IL-17A能上调肝癌细胞MICA mRNA表达, 可能与其活化NF-κB-ADAM 9信号通路, 从而增加HCC sMICA的表达有关.
引文著录: 刘丹, 向晓星, 顾学文, 李国青, 刘延庆. IL-17A对肝细胞癌可溶性MICA表达的影响. 世界华人消化杂志 2012; 20(26): 2460-2466
Revised: August 9, 2012
Accepted: September 3, 2012
Published online: September 18, 2012
AIM: To investigate the correlation between serum interleukin-17A (IL-17A) levels and soluble major histocompatibility complex class I chain-related gene A (sMICA) in patients with chronic hepatitis (CH), liver cirrhosis (LC), or hepatocellular carcinoma (HCC), and to discuss the role of IL-17A in regulating the production of sMICA.
METHODS: Serum samples were collected from healthy controls (HC) and patients with CH, LC, or HCC (n = 30 for each group), and sMICA and IL-17A were assayed by enzyme-linked immunosorbent assay (ELISA). PLC/PRF/5 and HepG2 cells were cultured with 0, 10 and 50 ng/mL of recombinant human IL-17A (RhIL-17A) for 24 h, and the expression of sMICA was detected by ELISA. Flow cytometry (FCM) and real-time quantitative polymerase chain reaction (qRT-PCR) were used to detect the expression of membrane MICA after HCC cells were incubated with 50 ng/mL RhIL-17A for 24 h. Western blot was used to detect the expression of ADAM9, p65 and phosphorylation-p65 (P-p65).
RESULTS: Serum IL-17A and sMICA levels were significantly higher in HCC patients than in those with HC, LC or HC (IL-17AF = 46.321, sMICAF = 24.144, P < 0.01). IL-17A levels were positively associated with soluble MICA levels in hepatopathy patients (r = 0.28, P < 0.01). Addition of RhIL-17A resulted in a significant increase in the production of sMICA and membrane MICA mRNAs in HepG2 and PLC/PRF/5 cells (all P < 0.05), and RhIL-17A also increased the ADAM9 and P-p65 protein levels.
CONCLUSION: IL-17A may up-regulate membrane MICA mRNA expression by activating the nuclear factor-kappa B (NF-κB)-ADAM 9 signal pathway and thus enhance the production of sMICA by human HCC cells.
- Citation: Liu D, Xiang XX, Gu XW, Li GQ, Liu YQ. Interleukin-17A enhances the production of soluble MICA by human hepatocellular carcinoma cells. Shijie Huaren Xiaohua Zazhi 2012; 20(26): 2460-2466
- URL: https://www.wjgnet.com/1009-3079/full/v20/i26/2460.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i26.2460
原发性肝癌是全球范围内高发的癌症, 已经成为我国第2位的肿瘤死亡原因, 对我国人民的健康构成了严重的威胁[1,2]. 肝细胞癌(hepatocellular carcinoma, HCC)是其主要组织学类型, 大部分由慢性病毒性肝炎及肝炎性肝硬化发展而来[3]. 近年来, 炎症与肿瘤之间的关系日益受到关注, 白介素-17A(interleukin-17A, IL-17A)作为炎症反应中重要的调控因子, 其在肿瘤的发生、发展中可能发挥双重作用. 研究发现, IL-17A在肝炎、肝硬化、肝癌患者的血清及组织中表达明显升高, 与肝癌的转移密切相关[4-6]. MHC-Ⅰ链相关基因A(major histocompatibility complex classⅠchain-related gene A, MICA)主要表达于肿瘤细胞、炎症细胞、病毒感染细胞等, 其脱落形成的可溶性MICA(soluable MICA, sMICA)是肿瘤细胞发生免疫逃逸的重要因素之一, 研究发现sMICA表达水平随着肝炎、肝硬化和HCC病程的进展逐渐升高, 与HCC的预后呈负相关[7-9]. 本研究中, 通过观察慢性肝病及肝细胞癌患者外周血清IL-17A与sMICA表达水平的相关性, 进一步探讨IL-17A对肝癌细胞sMICA的调控作用及可能机制.
随机收集2009-/2011就诊于扬州大学临床医学院的慢性肝炎患者血清30例, 其中男17例, 女13例, 平均年龄57岁±13岁; 肝硬化患者血清30例(按Child-Pugh分级: A级12例, B级8例, C级10例), 其中男16例, 女14例, 平均年龄61岁±12岁, 均为临床确诊的肝炎后肝硬化患者, 入选病例除肝炎外无其他伴发疾病; 肝细胞癌患者血清30例(按Child-Pugh分级: A级15例, B级10例, C级5例), 其中男23例, 女7例, 平均年龄69岁±10岁, TNM分期: 其中Ⅰ期7例, Ⅱ期9例, Ⅲ期8例, Ⅳ期6例, 临床检查证实患者除肝炎肝硬化外无其他伴发病, 30例均为根治性切除, 并经病理证实; 正常对照组为我院体检健康者30例, 其中男15例, 女15例, 平均年龄60岁±14岁, 均为排除肝炎、肝硬化及肝癌的健康成年人, 所有病例血清-20 ℃冻存, 所有手术病例均有完整病理诊断和随访资料, 肝炎、肝癌分别按全国肝炎和肝癌防治协作组制定的标准核实诊断.
1.2.1 肝癌细胞的培养: 人肝癌细胞株HepG2和PLC/PRF/5均购自中科院上海细胞库, 培养于DMEM(GIBCO公司)培养液, 培养液含100 mL/L 胎牛血清(GIBCO公司)、100 U/mL青霉素、100 mg/mL链霉素, 于37 ℃、50 mL/L CO2、饱和湿度培养箱常规培养, 取对数生长期的细胞进行试验. 2×105 HepG2和PLC/PRF/5细胞分别接种于6孔培养板, 并加入0、10、50 ng/mL的重组人IL-17A(Recombinant human IL-17A, RhIL-17A, R&D公司)培养24 h 进行实验.
1.2.2 ELISA: 收集病例血清和肝癌细胞上清, 分别采用人IL-17A ELISA试剂盒(百赛生物公司)和sMICA ELISA试剂盒(R&D公司)进行检测, 按试剂盒说明书进行操作.
1.2.3 FCM: BD公司流式细胞仪(flow cytometry, FCM)检测HepG2和PLC/PRF/5膜固有MICA表达, 含100 mL/L胎牛血清DMEM调整细胞密度约为1×106/mL. 检测管加入鼠抗人MICA单抗(R&D公司), 同型对照管加入同型对照单抗. 孵育后分别加入PE标记的羊抗鼠IgG单抗(R&D公司), 孵育30 min后上机检测, WinMDI软件获取和分析数据. 以平均荧光强度代表细胞膜MICA表达水平.
1.2.4 Western blot: 细胞培养至预定时间点后, 收集细胞, 分别按蛋白抽提试剂盒说明(碧云天公司)抽提细胞总蛋白及细胞核蛋白. 取蛋白40 μg/20 μL每孔上样, 在12%分离胶行SDS-PAGE电泳(150 V, 1.5 h), 350 mA电转90 min至PVDF膜(Millipore公司). 3% BSA室温封闭2 h后小鼠抗人ADAM 9、p65、磷酸化p65(P-p65)、β-actin单克隆抗体、山羊抗人Histone H3多克隆抗体(Santa Cruz公司), 4 ℃孵育过夜, 再加HRP标记的山羊抗小鼠、兔抗山羊二抗室温孵育2 h, ECL法显色, 每个样本重复3遍.
1.2.5 荧光定量RT-PCR检测(qRT-PCR): (1)总RNA提取和cDNA合成, 收获各组细胞, 按 Trizol RNA提取试剂盒(Invitrogen公司)的说明书提取RNA. RNA沉淀用DEPC水溶解, 在紫外分光光度计下测A260/A280的吸光度比值, 比值1.8-2.0为合格样本, 琼脂糖凝胶电泳鉴定RNA完整性, 按比例稀释RNA浓度至0.5 g/L. cDNA合成: 取2 μL RNA、2倍逆转录缓冲液10 μL、逆转录酶2 μL(ABI公司), 补加DEPC处理的双蒸水至20 μL, ABI 2720 PCR仪按25 ℃ 10 min、50 ℃ 30 min、85 ℃ 5 min孵育, 最后置于冰上终止反应; (2)定量PCR测定肝癌细胞MICA、ADAM 9 mRNA表达水平, 在ABI Prism 7000荧光定量RT-PCR仪上进行实时定量扩增, 定量PCR采用SYBR Green 2步法RT-PCR试剂盒(ABI公司), 根据说明书进行操作. 遵循引物设计原则, 使用Primer Express 3.0软件设计MICA及GAPDH引物(表1), 并由上海生工生物技术有限公司合成. PCR反应体系: SYBR Green qPCR混合液25 μL, 正义及反义引物各1 μL(200 nmol/L), cDNA 5 μL补充DEPC处理双蒸水至总反应体积为50 μL. PCR扩增反应条件: 50 ℃ 2 min, 95 ℃ 10 min. 95 ℃ 15 s, 60 ℃ 1 min, 共40个循环. 并选取1份cDNA样本进行目的基因和参照基因扩增效率检测, 梯度稀释样本(0.1和0.01倍), 分别扩增目的基因和参照基因, 观察所得直线的斜率, 绝对值接近0则说明扩增效率相同, 可以2-△△CT法表示基因相对表达量的变化: △△CT = (CTTarget-CTGAPDH)-(CTControl-CTGAPDH). 实验重复3次, 取平均值.
| 探针 | 序列 |
| MICA | F: 5'-CTTGGCCATGAACGTCAGG-3' |
| R: 5'-CCTCTGAGGCCTCGCTGCG-3' | |
| GAPDH | F: 5'-ATCCCGCTAACATCAAATGG-3' |
| R: 5'-GTGGTTCACACCCATCACAA-3' |
统计学处理 灰度分析数据用mean±SD表示, 组间比较用t检验和方差分析, P<0.05为统计学有意义. 所有统计学处理在SPSS11.0及Excel 2010软件中完成.
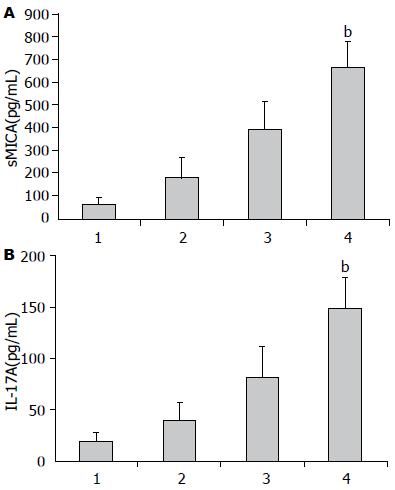
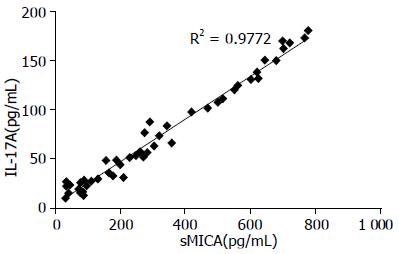
肝癌患者血清IL-17A和sMICA水平明显高于慢性肝炎、肝硬化患者及健康对照组(IL-17AF = 46.321, sMICAF = 24.144, P<0.01), 从肝炎到肝硬化、肝癌, 血清IL-17A及sMICA水平逐渐上升(图1). 良性肝病及肝癌患者, 血清sMICA与IL-17A水平呈显著正相关(r = 0.28, P<0.01, 图2). 且在肝癌的不同分期中, IL-17A与sMICA的表达也存在差异, 分析Ⅰ、Ⅱ期与Ⅲ、Ⅳ期肝癌患者血清中IL-17A与sMICA的表达, 发现伴有转移的Ⅲ、Ⅳ期肝癌患者血清中IL-17A及sMICA的含量较Ⅰ、Ⅱ期患者血清中的含量明显增加(P<0.01).
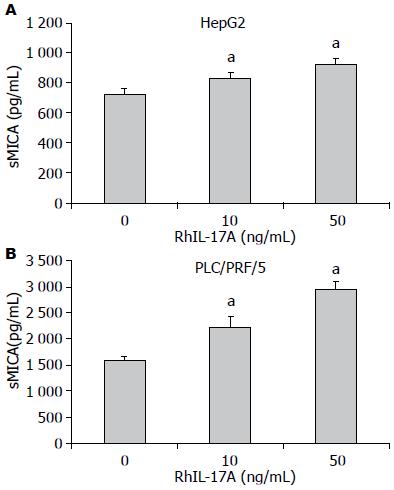
分别在HepG2和PLC/PRF/5细胞培养液中加入不同浓度的RhIL-17A作用24 h, ELISA检测细胞上清, 发现RhIL-17A呈浓度依赖性的显著增加HepG2和PLC/PRF/5细胞上清中sMICA的表达(HepG2F = 44.243, PLC/PRF/5F = 54.112, P<0.05, 图3).
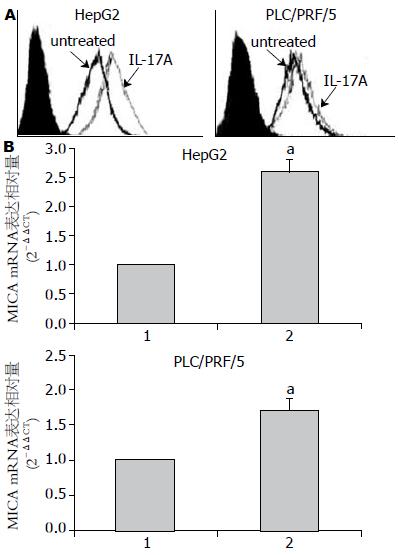
分别在HepG2和PLC/PRF/5细胞培养液中加入50 ng/mL的RhIL-17A作用24 h后, 收获细胞分别采用FCM检测膜型MICA蛋白表达、实时定量PCR检测MICA mRNA表达, 结果发现RhIL-17A可以增加HepG2细胞膜固有MICA mRNA(t = 7.033, P<0.05)及蛋白(t = 4.121, P<0.05)表达, 而对PLC/PRF/5细胞膜固有MICA蛋白表达无明显影响(P>0.05), 但可增加MICA mRNA的表达水平(t = 6.424, P<0.05, 图4).
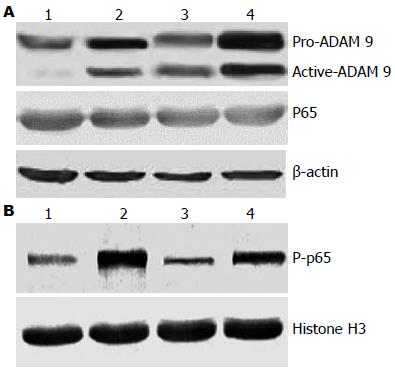
50 ng/mL的RhIL-17A作用HepG2和PLC/PRF/5细胞24 h后, Western blot分别检测总蛋白ADAM 9, p65及核蛋白P-p65的表达, 结果发现RhIL-17A可以增加HepG2和PLC/PRF/5细胞ADAM 9及P-p65的蛋白表达水平, 而对p65蛋白表达无明显影响(图5).
HCC由于其易复发、缺少有效的治疗手段及早期诊断的生物学标志物, 已成为高死亡率的肿瘤之一[10]. HCC主要从慢性病毒性肝炎发展而来, 炎症因子在其发生、发展中可能起重要的调控作用[11-15]. 近年来, 炎症反应与肿瘤之间的关系日益受到关注. 研究发现, 慢性炎症与肿瘤的关系密切, 许多慢性炎症都是癌前病变, 由肝炎到肝硬化再到肝癌是一个渐进的由量变到质变的过程, 但具体机制尚未明确[16-18]. 最近研究发现, HCC微环境中表达Th17和IL-17A的CD8+ T细胞数量增加, 且与HCC的预后差密切相关[12]. 但目前IL-17A在肿瘤发生、发展中的作用仍有争议, 有研究认为IL-17A可以通过激活细胞毒性T细胞和增加INF-γ的表达抑制肿瘤的生长和转移[19,20]; 另一方面其他研究证实IL-17A可以通过改变肿瘤的微环境及影响其他细胞因子的表达促进肿瘤的生长和转移[9,21]. 本研究也证实了IL-17A在慢性肝病病程发展中的促进作用, 其表达水平随着肝炎、肝硬化、肝癌的病程发展逐渐升高, 且其表达与肝癌的分期及转移高度相关, 也支持了后者的结论.
免疫治疗已成为肝癌治疗研究的热点, 但是肝癌如何逃避机体免疫的机制仍不清楚. 肿瘤的发生是由化学因素、物理因素、感染或者自身免疫性疾病的慢性刺激通过不同的机制引起肿瘤微环境的改变, 触发并招募骨髓和淋巴免疫细胞进入肿瘤微环境中, 随后各种宿主细胞释放多种细胞因子, 促进或者抑制肿瘤的发生、发展. 在这个过程中有哪些细胞因子参与了精细调节促进肿瘤和抗肿瘤之间的平衡目前还不清楚. MICA位于人第6号染色体的MHC-I类区域中, 属于MIC基因家族, 在消化系统肿瘤、肺癌、乳腺癌、卵巢癌等肿瘤细胞中表达上调, 被认为是一种肿瘤相关性抗原(tumor associated antigen, TAA)[22]. MICA不仅表达于绝大多数肿瘤细胞, 而且一些病毒感染细胞、受诱导分化药物处理的细胞及射线照射引起DNA损伤的细胞均有表达, 这表明他代表着机体的一种应激反应[23]. sMICA是肿瘤细胞削弱MICA-NKG2D系统监视的重要途径, 我们既往在结肠癌中研究发现sMICA分子能使NKG2D内化或降解, 显著下调NKG2D的表达, 降低特异性T细胞、NK细胞对靶细胞的攻击和杀伤, 最终导致肿瘤的免疫逃逸[24]. 目前已发现的可引起肝癌细胞MICA脱落的基质金属蛋白酶包括MMP 2、ADAM 9、AMAM 10等, 我们在结肠癌组织中也证实了AMAM 10与MICA的表达呈负相关[25,26].
我们的研究证实, HCC患者sMICA的含量明显高于肝硬化组、慢性肝炎组及健康人群, 且Ⅲ、Ⅳ期肝癌患者又显著高于Ⅰ、Ⅱ期; 肝硬化组血清中sMICA含量明显高于慢性肝炎组. sMICA水平的升高与IL-17A呈正相关, 推测在肝炎发生、发展及纤维化的过程中, 细胞发生变性、坏死与再生, 肝组织呈炎性改变, IL-17A表达升高, 进而可诱导其他细胞因子表达增加, 进而使MICA的表达及脱落增加, 提示IL-17A除了引起多种细胞因子表达改变外, 可能通过增加sMICA的表达进而使肿瘤细胞逃脱免疫监视, 促进肿瘤的发展.
为了进一步明确IL-17A对肝癌细胞sMICA的作用及可能机制, 我们在体外细胞水平同时选取乙肝表面抗原阳性和阴性的HCC细胞株HepG2和PLC/PRF/5细胞为研究对象, 发现RhIL-17A可呈浓度依赖性的增加HCC细胞sMICA的表达, 进一步验证了上述结论. 由于sMICA的形成与肿瘤细胞膜MICA mRNA表达及基质金属蛋白酶所致的sMICA脱落二方面相关. 为进一步探讨IL-17A引起sMICA升高的机制, 我们检测加入一定浓度的RhIL-17A后, HepG2和PLC/PRF/5细胞膜固有MICA表达的变化, 证实RhIL-17A可以增加HCC细胞MICA mRNA的表达; 同时发现RhIL-17A也可以增加HCC细胞ADAM 9和P-p65蛋白的表达, 提示IL-17A可能通过双重作用增加sMICA的表达. 有报道ADAM 9可能是造成HCC细胞sMICA脱落的主要因素[27], 本研究也证实IL-17A可通过增加ADAM 9的表达进而引起sMICA的脱落增加, 但这种作用可能并非直接作用. 由于IL-17A可以调控许多重要的细胞因子通路[28-30], 如IL-17A-NF-κB信号通路, 而基质金属蛋白酶如MMP 2、ADAM 9等是NF-κB信号通路的下游靶基因, 本研究中P-p65作为NF-κB的活化形式, 加入RhIL-17A后其表达增加进一步证实了IL-17A对NF-κB信号通路的激活, 我们猜测IL-17A可能上调MICA mRNA表达并通过NF-κB-ADAM 9信号通路增加sMICA的脱落, 增加HCC sMICA的表达, 使细胞逃脱机体固有免疫细胞的免疫监视, 促进肿瘤的发生、发展. 但本实验亦存在许多不足之处, 如IL-17A对于sMICA的作用是否主要通过ADAM 9实现, 需要更加直接的证据支持, 如通过siRNA干扰直接阻断ADAM 9的表达后, 观察RhIL-17A对肝癌细胞sMICA表达的影响等.
IL-17A及sMICA与肝癌的发生、发展、分期、转移密切相关, IL-17A可能通过对sMICA及其他细胞因子网络的调控, 改变肿瘤微环境, 使肿瘤细胞发生免疫逃逸. 本研究为进一步明确慢性肝脏炎症到肝癌的发生机制、寻找有效的肝癌诊断、治疗监测指标提供线索.
原发性肝癌是全球范围内高发的癌症, 已经成为我国第2位的肿瘤死亡原因, 对我国人民的健康构成了严重威胁. 肝细胞癌(HCC)是其主要组织学类型, 大部分由慢性病毒性肝炎及肝炎性肝硬化发展而来. 近年来, 炎症与肿瘤之间的关系日益受到关注.
代智, 副研究员, 复旦大学附属中山医院肝癌研究所
近年来, 炎症反应与肿瘤之间的关系日益受到关注. 研究发现, 慢性炎症与肿瘤的关系密切, 许多慢性炎症都是癌前病变, 由肝炎到肝硬化再到肝癌是一个渐进的由量变到质变的过程, 但其具体机制尚未明确.
最近研究发现, HCC微环境中表达Th17和IL-17A的CD8+ T细胞数量增多, 且与HCC的预后差密切相关.
本研究内容很重要, 设计合理, 研究结果可信, 具有很好的临床价值.
编辑: 李军亮 电编:闫晋利
| 1. | Semela D, Dufour JF. Angiogenesis and hepatocellular carcinoma. J Hepatol. 2004;41:864-880. [PubMed] [DOI] |
| 3. | Utsunomiya T, Shimada M, Imura S, Morine Y, Ikemoto T, Mori M. Molecular signatures of noncancerous liver tissue can predict the risk for late recurrence of hepatocellular carcinoma. J Gastroenterol. 2010;45:146-152. [PubMed] [DOI] |
| 4. | Li J, Lau GK, Chen L, Dong SS, Lan HY, Huang XR, Li Y, Luk JM, Yuan YF, Guan XY. Interleukin 17A promotes hepatocellular carcinoma metastasis via NF-kB induced matrix metalloproteinases 2 and 9 expression. PLoS One. 2011;6:e21816. [PubMed] [DOI] |
| 5. | 王 平, 武 传星, 吕 凌, 张 峰. IL-17 在原发性肝癌组织中的表达及其临床意义. 中国肿瘤生物治疗杂志. 2011;18:216-219. |
| 7. | Kohga K, Takehara T, Tatsumi T, Ohkawa K, Miyagi T, Hiramatsu N, Kanto T, Kasugai T, Katayama K, Kato M. Serum levels of soluble major histocompatibility complex (MHC) class I-related chain A in patients with chronic liver diseases and changes during transcatheter arterial embolization for hepatocellular carcinoma. Cancer Sci. 2008;99:1643-1649. [PubMed] [DOI] |
| 8. | Morisaki T, Onishi H, Koya N, Kiyota A, Tanaka H, Umebayashi M, Ogino T, Nagamatsu I, Katano M. Combinatorial cytotoxicity of gemcitabine and cytokine-activated killer cells in hepatocellular carcinoma via the NKG2D-MICA/B system. Anticancer Res. 2011;31:2505-2510. [PubMed] |
| 9. | He D, Li H, Yusuf N, Elmets CA, Li J, Mountz JD, Xu H. IL-17 promotes tumor development through the induction of tumor promoting microenvironments at tumor sites and myeloid-derived suppressor cells. J Immunol. 2010;184:2281-2288. [PubMed] [DOI] |
| 11. | Zhang JP, Yan J, Xu J, Pang XH, Chen MS, Li L, Wu C, Li SP, Zheng L. Increased intratumoral IL-17-producing cells correlate with poor survival in hepatocellular carcinoma patients. J Hepatol. 2009;50:980-989. [PubMed] [DOI] |
| 12. | Kuang DM, Peng C, Zhao Q, Wu Y, Zhu LY, Wang J, Yin XY, Li L, Zheng L. Tumor-activated monocytes promote expansion of IL-17-producing CD8+ T cells in hepatocellular carcinoma patients. J Immunol. 2010;185:1544-1549. [PubMed] [DOI] |
| 13. | Kohga K, Tatsumi T, Tsunematsu H, Aono S, Shimizu S, Kodama T, Hikita H, Yamamoto M, Oze T, Aketa H. Interleukin-1β enhances the production of soluble MICA in human hepatocellular carcinoma. Cancer Immunol Immunother. 2012;61:1425-1432. [PubMed] [DOI] |
| 14. | Tsunematsu H, Tatsumi T, Kohga K, Yamamoto M, Aketa H, Miyagi T, Hosui A, Hiramatsu N, Kanto T, Hayashi N. Fibroblast growth factor-2 enhances NK sensitivity of hepatocellular carcinoma cells. Int J Cancer. 2012;130:356-364. [PubMed] [DOI] |
| 15. | Mantovani A. Role of inflammatory cells and mediators in tumor invasion and metastasis. Cancer Metastasis Rev. 2010;29:241. [PubMed] [DOI] |
| 16. | Bortolami M, Kotsafti A, Cardin R, Farinati F. Fas / FasL system, IL-1beta expression and apoptosis in chronic HBV and HCV liver disease. J Viral Hepat. 2008;15:515-522. [PubMed] [DOI] |
| 17. | Nakagawa H, Maeda S, Yoshida H, Tateishi R, Masuzaki R, Ohki T, Hayakawa Y, Kinoshita H, Yamakado M, Kato N. Serum IL-6 levels and the risk for hepatocarcinogenesis in chronic hepatitis C patients: an analysis based on gender differences. Int J Cancer. 2009;125:2264-2269. [PubMed] [DOI] |
| 18. | Gabay C, Lamacchia C, Palmer G. IL-1 pathways in inflammation and human diseases. Nat Rev Rheumatol. 2010;6:232-241. [PubMed] [DOI] |
| 19. | Kryczek I, Wei S, Szeliga W, Vatan L, Zou W. Endogenous IL-17 contributes to reduced tumor growth and metastasis. Blood. 2009;114:357-359. [PubMed] [DOI] |
| 20. | Hus I, Maciag E, Roliński J. [The role of Th17 cells in anti-cancer immunity]. Postepy Hig Med Dosw (Online). 2010;64:244-250. [PubMed] |
| 21. | Gu FM, Li QL, Gao Q, Jiang JH, Zhu K, Huang XY, Pan JF, Yan J, Hu JH, Wang Z. IL-17 induces AKT-dependent IL-6/JAK2/STAT3 activation and tumor progression in hepatocellular carcinoma. Mol Cancer. 2011;10:150. [PubMed] [DOI] |
| 22. | Gleimer M, Parham P. Stress management: MHC class I and class I-like molecules as reporters of cellular stress. Immunity. 2003;19:469-477. [PubMed] [DOI] |
| 23. | Gasser S, Raulet DH. The DNA damage response arouses the immune system. Cancer Res. 2006;66:3959-3962. [PubMed] [DOI] |
| 25. | Zhou C, Liu J, Li Y, Liu L, Zhang X, Ma CY, Hua SC, Yang M, Yuan Q. microRNA-1274a, a modulator of sorafenib induced a disintegrin and metalloproteinase 9 (ADAM9) down-regulation in hepatocellular carcinoma. FEBS Lett. 2011;585:1828-1834. [PubMed] [DOI] |
| 26. | 刘 丹, 田 秀春, 肖 芹, 王 翠梅, 顾 学文. 结肠癌组织中MICA和ADAM10的表达及其相关性. 临床与实验病理学杂志. 2011;27:652-654. |
| 27. | Kohga K, Takehara T, Tatsumi T, Ishida H, Miyagi T, Hosui A, Hayashi N. Sorafenib inhibits the shedding of major histocompatibility complex class I-related chain A on hepatocellular carcinoma cells by down-regulating a disintegrin and metalloproteinase 9. Hepatology. 2010;51:1264-1273. [PubMed] [DOI] |
| 28. | Doreau A, Belot A, Bastid J, Riche B, Trescol-Biemont MC, Ranchin B, Fabien N, Cochat P, Pouteil-Noble C, Trolliet P. Interleukin 17 acts in synergy with B cell-activating factor to influence B cell biology and the pathophysiology of systemic lupus erythematosus. Nat Immunol. 2009;10:778-785. [PubMed] [DOI] |
| 29. | Bond M, Fabunmi RP, Baker AH, Newby AC. Synergistic upregulation of metalloproteinase-9 by growth factors and inflammatory cytokines: an absolute requirement for transcription factor NF-kappa B. FEBS Lett. 1998;435:29-34. [PubMed] [DOI] |
| 30. | Cheng G, Wei L, Xiurong W, Xiangzhen L, Shiguang Z, Songbin F. IL-17 stimulates migration of carotid artery vascular smooth muscle cells in an MMP-9 dependent manner via p38 MAPK and ERK1/2-dependent NF-kappaB and AP-1 activation. Cell Mol Neurobiol. 2009;29:1161-1168. [PubMed] [DOI] |