修回日期: 2012-08-03
接受日期: 2012-08-06
在线出版日期: 2012-09-08
目的: 构建携tagln基因的真核表达载体, 建立稳定转染该质粒的人结肠癌细胞株RKO并鉴定.
方法: 通过Gateway克隆技术, 使用pOTB7-TAGLN-mut与pDONR221进行BP重组反应, 产生入门克隆, 再与pcDNA6.2/EmGFP-Bsd/V5-DEST空载体进行LR重组反应, 生成目的质粒pcDNA6.2/EmGFP-Bsd/V5-TAGLN-mut. 通过测序验证目的质粒的插入序列. 将携带tagln的真核表达载体和对照质粒稳定转染至人结肠癌细胞株RKO. 通过实时荧光定量PCR和免疫印迹检测tagln的mRNA和蛋白表达水平. 通过细胞侵袭实验了解transgelin在结肠癌细胞RKO中的作用.
结果: 携带tagln的真核表达载体测序分析显示插入序列及位点正确; 实时荧光定量PCR及免疫印迹结果显示, 稳定转染重组目的质粒的细胞株(RKO-TAGLN细胞)中tagln的表达水平与转染对照质粒的细胞株(RKO-CTRL细胞)及野生型RKO细胞相比明显上调, 差异具有统计学意义(mRNA相对表达水平分别为45.58±12.79、1.32±0.43和1, P<0.01;蛋白质灰度定量值为1.69±0.04、0.29±0.05和0.29±0.04, P<0.01). 细胞侵袭实验提示, RKO-TAGLN细胞较RKO-CTRL细胞的侵袭能力提高(161.76%±61.18%, P<0.01).
结论: 成功构建携tagln基因的真核表达载体并建立过表达transgelin的稳定细胞株和对照细胞株, 为研究transgelin在结肠癌中的作用奠定基础.
引文著录: 方媛媛, 苏红, 周慧敏, 林. TAGLN真核表达载体pcDNA6.2/EmGFP-Bsd/V5-TAGLN-mut及稳定转染细胞株的构建. 世界华人消化杂志 2012; 20(25): 2397-2403
Revised: August 3, 2012
Accepted: August 6, 2012
Published online: September 8, 2012
AIM: To construct a eukaryotic expression plasmid carrying tagln (the gene encoding transgelin) and establish the human colon carcinoma cell line RKO stably expressing tagln.
METHODS: Using the Gateway Technology, a BP recombination reaction was performed using a construct carrying the tagln gene (pOTB7-TAGLN-mut) and a donor vector (pDONR221) to create an entry clone (pDONR221-TAGLN-mut). An LR recombination reaction was then performed between the entry clone and the destination vector (pcDNA6.2/EmGFP-Bsd/V5-DEST) to generate a recombinant plasmid (pcDNA6.2/EmGFP-Bsd/V5-TAGLN-mut). The recombinant plasmid was confirmed by sequencing. Lipofectamine-mediated transfection was performed in RKO cells and stable transfectants were selected. The stable expression of tagln in RKO cells was validated by real-time RT-PCR and Western blot. Matrigel invasion assay was performed with these stable cell lines.
RESULTS: Sequencing analysis showed that tagln was successfully inserted into the pcDNA6.2/EmGFP-Bsd/V5-DEST plasmid. Real-time RT-PCR and Western blotting indicated that the expression of tagln increased remarkably in RKO cells transfected with the pcDNA6.2/EmGFP-Bsd/V5-TAGLN-mut plasmid (RKO-TAGLN cells) as compared to those transfected with the control vector (RKO-CTRL cells) and non-transfected RKO cells (relative mRNA expression levels 45.58 ± 12.79, 1.32 ± 0.43 vs 1, both P < 0.01; protein expression levels: 1.69 ± 0.04, 0.29 ± 0. 05 vs 0.29 ± 0.04, both P < 0.01). Overexpression of tagln increased cell invasion by 161.76% ± 61.18% in RKO cells (P < 0.01).
CONCLUSION: A eukaryotic expression plasmid carrying tagln has been successfully generated and a RKO cell line stably expressing tagln has been established. These lay a foundation for further research of the role of transgelin in human colon carcinoma.
- Citation: Fang YY, Su H, Zhou HM, Lin Y. Construction of a eukaryotic expression vector carrying tagln and establishment of a cell line stably expressing tagln. Shijie Huaren Xiaohua Zazhi 2012; 20(25): 2397-2403
- URL: https://www.wjgnet.com/1009-3079/full/v20/i25/2397.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i25.2397
结肠癌是消化系统最常见的恶性肿瘤之一, 在世界范围内, 其发生率在男性肿瘤患者中居第3位, 在女性肿瘤患者中居第2位. 近年来, 结肠癌的发病率在南美, 东欧以及亚洲呈现上升趋势, 我国的结肠癌发病率也在逐年升高[1-3]. 在美国和西欧国家, 随着早期诊断和治疗水平的上升, 结肠癌的病死率已经开始出现下降趋势[4]. 然而结肠癌转移是患者死亡的主要原因. 因此, 除早期诊断外, 有效抑制结肠癌转移, 对于延长患者的生存期也具有非常重要的意义. transgelin是一种在物种间高度保守的蛋白, 早期在人成纤维细胞中被发现, 属于平滑肌蛋白[5]. 近年来, 由于发现transgelin在肿瘤组织中存在异常表达, 因此transgelin与肿瘤的关系逐步受到学界的重视. 在既往的研究中, transgelin在肿瘤中所起的作用并不一致, 在各种肿瘤组织中的表达也呈现不同趋势, 甚至有学者提出, transgelin主要在肿瘤间质中表达, 由于肿瘤间质组织含量不同造成了transgelin表达的不同[3]. 然而, 在我们的前期研究中, 利用激光显微切割技术, 从结肠癌组织中收集肿瘤细胞进行定量蛋白组学分析, 发现transgelin在淋巴结转移阳性组中的表达明显高于淋巴结转移阴性组, 因此我们认为结肠癌细胞中transgelin高表达起促进转移的作用[6]. 在本研究中, 我们通过Gateway克隆技术构建携带tagln(编码transgelin蛋白的基因)的真核表达载体, 建立过表达transgelin的人结肠癌稳定细胞株RKO及对照细胞株, 为进一步研究transgelin在结肠癌转移中的作用机制奠定了基础.
包含tagln全长的质粒pOTB7-TAGLN-mut由Georgia Health Sciences University, GA, USA的Dr William S Dynan惠赠, 此质粒中的tagln含有2个位点的同义密码子突变[6]. NotⅠ限制性内切酶购自New England Biolabs; 质粒pcDNA6.2/EmGFP-Bsd/V5-DEST、pDONR221、BP Clonase Ⅱ混合物、LR Clonase Ⅱ混合物、感受态大肠杆菌菌株TOP 10、Lipofectamine 2000、blasticidin及TRIzol均购自Invitrogen; 质粒小提试剂盒购自QIAGEN; 质粒大提试剂盒购自OMEGA; 人结肠癌细胞株RKO购自中国科学院典型培养物保藏委员会细胞库; EMEM培养基、胎牛血清和OPTI-MEMⅠ培养基均购自Gibco; 胰蛋白酶购自Bioind; 提取蛋白质的裂解液购自Santa Cruz; 兔抗人transgelin抗体和鼠抗人GAPDH抗体均购自Abcam; 辣根过氧化物酶标记的山羊抗兔和山羊抗鼠抗体均购自Sigma-Aldrich; 实时定量PCR试剂盒购自TaKaRa.
1.2.1 transgelin真核表达载体pcDNA6.2/EmGFP-Bsd/V5-TAGLN-mut的构建: 首先将pOTB7-TAGLN-mut质粒线性化, 即取2 μg质粒、NotⅠ 限制性内切酶(10 U/μL)1 μL、10×NE缓冲液3 2 μL和10×BSA 2 μL, 补充DNase/RNase-free water至20 μL混匀; 37 ℃孵育 2 h后加入乙醇50 μL, 3 mol/L醋酸钠2 μL; 4 ℃、12 000 g离心1 min, 将线性化的质粒沉淀; 用700 mL/L乙醇洗涤沉淀 2次; 4 ℃、7 500 g离心5 min; 风干后用TE buffer 溶解DNA.
根据Gateway克隆技术(http://www.invitrogen.com)进行BP反应, 将150 ng线性化质粒pOTB7-TAGLN-mut、150 ng质粒pDONR221(1 μL)以及TE缓冲液混合(总体积8 μL)置于1.5 mL EP管中; 加入2 μL BP ClonaseⅡ混合物于25 ℃反应3 h; 加入2 μL蛋白激酶K(2 μg/μL); 37 ℃孵育10 min终止BP反应; 取2 μL BP反应产物转化50 μL TOP10感受态大肠杆菌, 将转化反应产物接种至含100 μg/mL卡那霉素的固体LB培养基; 于37 ℃培养14 h后挑取单克隆菌落; 其后将菌落接种至含100 μg/mL卡那霉素的液体LB培养基中; 37 ℃恒温摇床225 r/min振荡培养12 h; 取菌液接种至含有25 μg/mL氯霉素的固体LB培养基(原pDONR221含有氯霉素耐药基因, 经重组反应插入目的基因后, 氯霉素耐药基因消失); 37 ℃培养24 h后无菌落生长, 上述双重筛选初步验证BP反应产生正确的入门克隆pDONR221-TAGLN-mut.
使用经测序验证的入门克隆进行LR反应, 取150 ng pDONR221-TAGLN-mut、150 ng pcDNA6.2/EmGFP-Bsd/V5-DEST(1 μL)和TE缓冲液混合(总体积8 μL)置于1.5 mL EP管中, 加入2 μL LR ClonaseⅡ混合物, 混匀后于25 ℃反应2 h, 加入2 μL蛋白激酶K(2 μg/μL), 于37 ℃孵育10 min终止LR反应. 取2 μL LR反应产物转化50 μL感受态大肠杆菌TOP10, 将转化反应产物接种到含有100 μg/mL氨苄西林的固体LB培养基, 挑选单克隆菌落小规模扩增, 经过上述含氯霉素的固体LB培养基的双重筛选(质粒pcDNA6.2/EmGFP-Bsd/V5-DEST含有氯霉素耐药基因, 经重组反应插入目的基因后, 氯霉素耐药基因消失), 挑选出符合条件的菌落进行进一步扩增(具体步骤同BP反应). 根据质粒提取试剂盒的方法提取质粒.
1.2.2 入门克隆pDONR221-TAGLN-mut和重组目的质粒pcDNA6.2/EmGFP-Bsd/V5-TAGLN-mut测序分析: 将入门克隆和重组目的质粒送宝生物工程(大连)有限公司进行测序, 入门克隆使用引物M13F和M13R, 序列分别为5'-GTAAAACGACGGCCAG-3'和5'-CAGGAAACAGCTATGAC-3'; 重组目的质粒使用引物T7-F和V5-R, 序列分别为5'-TAATACGACTCACTATAGGG-3'和5'-ACCGAGGAGAGGGTTAGGGAT-3'.
1.2.3 细胞培养及稳定细胞株构建: 人结肠癌细胞株RKO用含有100 mL/L胎牛血清(FBS)的EMEM培养基(Eagle's minimal essential medium)在含50 mL/L CO2的37 ℃恒温培养箱中培养, 用0.25%胰蛋白酶-EDTA消化传代.
RKO细胞分别转染目的质粒pcDNA6.2/EmGFP-Bsd/V5-TAGLN-mut和空载对照质粒pcDNA6.2/EmGFP-Bsd/V5-DEST, 细胞分别命名为RKO-TAGLN和RKO-CTRL. 转染前24 h, 以20×104/孔的密度将细胞接种至24孔板中. 转染当天细胞融合度达90%, 按转染试剂说明将2 μL Lipofectamine 2000和2 μg质粒分别溶于50 μL OPTI-MEMⅠ培养基中, 两者混匀后室温孵育30 min, 滴入相应细胞培养孔中轻微震荡摇匀. 孵育8 h后更换新鲜培养基, 24 h后消化细胞, 以1:30稀释接种至直径60 mm培养皿中, 并用含50 μg/mL blasticidin的普通培养基继续培养, 每3 d换液1次. 2 wk后可在倒置荧光显微镜下观察到表达绿色荧光蛋白的细胞集落形成. 标记后挑取单克隆, 继续用50 μg/mL blasticidin的普通培养基进行培养扩增, 其后将携带相同质粒的数株单克隆细胞混合培养. 转染细胞进入稳定状态后, 用25 μg/mL blasticidin维持培养.
1.2.4 PCR检测: TRIzol法提取稳定转染细胞株RKO-TAGLN、RKO-CTRL和野生型RKO细胞(以下称RKO-WT)的总RNA, 并逆转录生成cDNA, 再以cDNA为模板, 进行实时定量PCR扩增, 目的基因tagln的上游引物为5'-GTTCCAGACTGTTGACCTCTTT-3', 下游引物为5'-CTGCGCTTTCTTCATAAACC-3'. 以GAPDH作为内参, 其上游引物为5'-ACAGCCTCAAGATCATCAGCAAT-3', 下游引物为5'-ATGGACTGTGGTCATGAGTCCTT-3'. PCR反应条件为95 ℃ 30 s后95 ℃ 5 s, 60 ℃ 20 s 循环40次, PCR扩增结束后绘制熔解曲线, 对目的基因的表达采用2-△△Ct法行相对定量分析.
1.2.5 免疫印迹检测: 应用RIPA buffer(Santa Cruz)提取稳定转染细胞株RKO-TAGLN、RKO-CTRL和RKO-WT的总蛋白. 取25 μg蛋白上样, 120 V恒压电泳1.5 h后转至硝酸纤维膜(NC膜), 30 V转膜1 h. 用含30 g/L BSA的TBST封闭NC膜1 h, 其后分别加入一抗(抗transgelin 1:500, 抗GAPDH 1:4 000), 4 ℃摇床孵育过夜. TBST洗膜3次, 每次10 min, 后加入相应二抗(辣根过氧化物酶标记的山羊抗鼠或者山羊抗兔IgG 1:30 000), 室温摇床孵育1 h. TBST洗膜3次, 每次10 min, ECL化学发光, 胶片曝光. 胶片经扫描后, 采用Quantity One软件进行灰度分析.
1.2.6 细胞侵袭实验: 用无血清EMEM培养基稀释matrigel至650 μg/mL, 每个transwell小室用100 μL的matrigel稀释液包被. 实验前, 用不含FBS的EMEM培养基培养细胞24 h, 将细胞消化后计数, 用含10 g/L BSA的EMEM培养基重悬细胞, 调整细胞密度为200×104/mL, 在transwell小室中加入100 μL细胞悬液. 在24孔板中加入600 μL含100 mL/L FBS的EMEM培养基, 将小室放入24孔板内, 放入37 ℃温箱培养48 h. 取出小室至干净的24孔板, 吸去上室培养基, 在24孔板内加入600 μL 4%多聚甲醛固定20 min, 取出后用棉签拭去小室膜上方的细胞. 风干后用800 μL 1 g/L结晶紫染色15 min, 然后用流动的清水洗净小室, 风干后倒置相差显微镜进行拍摄. 拍摄后用100 μL 10%醋酸洗脱至96孔板内, 酶标仪测量A595.
统计学处理 采用方差分析对两株稳定转染细胞和野生型RKO细胞的tagln mRNA及蛋白表达水平差异进行统计分析. 通过t检验分别对两株稳定转染细胞的侵袭能力差异进行统计分析. 数据通过SPSS13.0统计软件包进行处理. P<0.05为差异具有显著性.
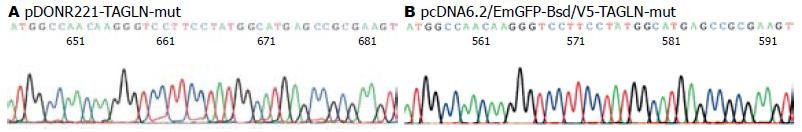
测序结果表明目的基因在预期位点成功插入, 且序列正确(图1), 表明入门克隆pDONR221-TAGLN-mut和重组目的质粒pcDNA6.2/EmGFP-Bsd/V5-TAGLN-mut构建成功.
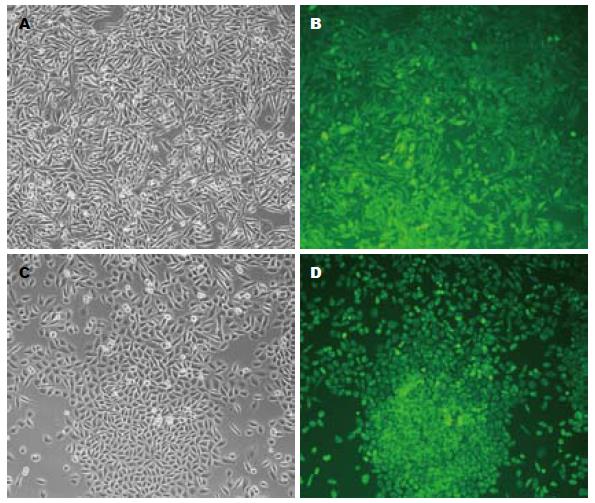
转染了目的质粒pcDNA6.2/EmGFP-Bsd/V5-TAGLN-mut和对照质粒pcDNA6.2/EmGFP-Bsd/V5-DEST的RKO细胞株, RKO-TAGLN和RKO-CTRL, 经过传代培养2 mo后, 在倒置荧光显微镜下观察, 两株细胞均一表达绿色荧光(图2).
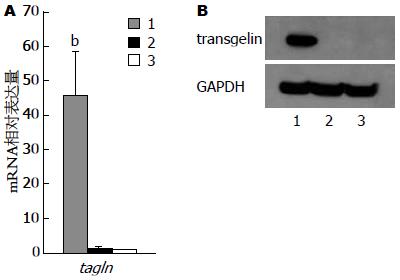
实时定量PCR结果显示, RKO-TAGLN细胞中tagln mRNA表达水平与其余两组相比, 明显增高超过40倍(P<0.01). RKO-CTRL与RKO-WT细胞相比, tagln mRNA表达水平无统计学差异(图3A). 免疫印迹灰度值分析显示, RKO-TAGLN与RKO-CTRL和RKO-WT细胞相比, transgelin蛋白表达水平分别增高(499.71%±113.45%)和(498.39%±97.09%), 差异均有统计学意义(P<0.01). RKO-CTRL与RKO-WT细胞的transgelin表达水平无统计学差异(图3B). 上述结果表明两株稳定细胞构建成功.
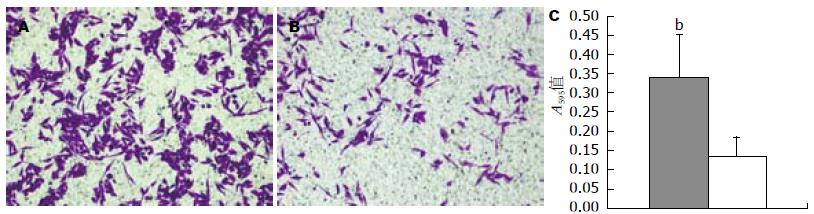
经过侵袭实验侵袭至transwell小室膜下方的细胞经过固定、染色后(图4A, B). 继而使用洗脱液将细胞洗脱, 通过测量洗脱液的A595值来评价细胞的侵袭能力. 结果显示, RKO-TAGLN细胞的A595值为0.3398±0.1125, RKO-CTRL细胞为0.1358±0.0493, 提示RKO-TAGLN细胞的侵袭能力比RKO-CTRL细胞显著增高(161.76%±61.18%), 差异有统计学意义(P<0.01, 图4C). 提示transgelin能增加结肠癌细胞RKO的侵袭能力.
传统的酶切和连接法构建载体, 酶切位点的选择上有比较多的局限性, 不仅需要回避目的基因内部的酶切位点以及选择载体多克隆位点区的酶切位点, 并且要保证在载体的插入方向正确, 操作复杂且克隆效率偏低, 载体与宿主系统之间具有较强的依赖性. Gateway克隆技术是一种新的通用型载体构建方法, 基于λ噬菌体位点特异性重组系统[7], 包括BP反应(包含attB位点的PCR产物、cDNA等与含attP位点的donor载体在BP Clonase Ⅱ混合物作用下反应生成入门克隆)和LR反应(包含attL位点的入门克隆与含有attR位点的目的载体在LR Clonase Ⅱ混合物作用下生成目的基因真核表达载体). 这种克隆技术保持开放阅读框不变, 快速高效实现DNA片段转移[8]. 能够将基因高效地克隆到一个或多个与Gateway克隆技术兼容的载体系统中. Gateway入门载体两端的接头不同, 能够很好地解决目的基因连入的方向问题, 而且, 在中间载体和表达载体上含有ccdB基因, 在普通大肠杆菌菌株中, ccdB蛋白可导致促旋酶介导的双链DNA断裂, 故携带有此基因的载体无法在普通大肠杆菌中繁殖, 只有发生重组被目的基因片段替换后, 才可以使宿主菌不受影响, 这就大大减低了载体构建过程中的假阳性[9]. 在植物表达载体的构建中, 这种技术已经得到广泛应用[10], 在国外Gateway克隆技术已普遍应用于生物医学, 但在国内仍未被广泛应用.
transgelin, 又称SM22(smooth muscle protein22), 是一种22 kDa大小的高度保守蛋白, 其基因定位于人类染色体11q23.2[11], transgelin普遍存在于血管和内脏平滑肌细胞中, 是平滑肌分化的早期标志[12]. 早期对于transgelin的研究主要集中在平滑肌细胞和衰老细胞中的功能[13], 随着研究的不断进展, transgelin与肿瘤的相关性逐渐受到人们的重视. 在结肠癌、肝癌以及前列腺癌等恶性肿瘤中, 均发现transgelin的过表达[6,14,15]. 也有部分研究[11,16]显示, transgelin在肿瘤组织中呈现低表达. 因而, transgelin在肿瘤的发生发展中的作用尚不明确. 前期实验中, 通过激光显微切割对有无淋巴结转移的结肠癌原发灶中的肿瘤细胞成分进行蛋白组学分析, 发现淋巴结转移阳性的结肠癌细胞中的transgelin表达明显高于淋巴结转移阴性组, 因此我们认为结肠癌细胞高表达transgelin能够促进肿瘤转移[6].
transgelin是肌动蛋白结合蛋白[17], 属于钙调理蛋白家族的成员, 具有N端钙调理蛋白同源性区域(CH)和C端钙调理蛋白样模块(CLIK), C端钙调理蛋白样模块(CLIK)是结合肌动蛋白的必要区域[18]. 肌动蛋白参与细胞骨架的形成, 而细胞骨架在细胞增殖、凋亡和迁移等过程中扮演重要角色[19,20]. transgelin可能作用于肌动蛋白, 调节细胞骨架, 进而促进肿瘤细胞的转移.
从tagln的基因结构看, 包含有转化生长因子β(TGF-β)调控元件[21]和SMAD蛋白结合位点[22], Yu等[23]对人肺上皮细胞A549细胞的研究表明, TGF-β通过Alk5/SMAD3信号通路作用于tagln, 诱发上皮间质转化(epithelial-mesenchymal transition, EMT), 引起肺上皮细胞的迁移. 这些研究表明, transgelin很可能参与EMT过程. EMT是一个非常复杂的分子过程, 上皮细胞可以通过EMT过程"褪去"已分化细胞的特性, 比如细胞间的粘附现象、细胞极性现象、细胞缺乏运动能力等这些表型, 获得间质细胞的特征, 比如细胞具备移动能力、侵袭能力、抗凋亡能力等[24]. 新近有研究发现transgelin过表达于子宫内膜异位组织, 可能参与子宫内膜细胞的迁移和侵袭[25]; 也有研究显示, transgelin能促进肿瘤干细胞的迁移和侵袭[15]. 但也有报道发现, transgelin的缺失能增加肌动蛋白动力从而促进肿瘤细胞迁移[26]. 通过研究transgelin在结肠癌转移中的作用, 了解其分子的机制, 将为抑制结肠癌转移提供新的靶点.
本研究成功构建携tagln的绿色荧光蛋白真核表达载体, 并建立了稳定表达transgelin以及对照质粒的人结肠癌细胞株RKO, 通过细胞侵袭实验初步验证了transgelin在结肠癌细胞RKO中的作用, 为我们进一步研究transgelin在结肠癌细胞中的功能及在结肠癌转移中的作用机制奠定了基础.
感谢中山大学孙逸仙纪念医院肿瘤科程帝同志及铜陵市人民医院放射科严俊同志在实验技术讨论中给予的建议和帮助.
结肠癌是常见的恶性肿瘤之一, 90%的结肠癌患者死于肿瘤转移. tagln编码的tra-nsgelin, 属钙调理蛋白家族成员, 是平滑肌分化的早期标志物. 前期研究发现transgelin在有淋巴结转移的结肠癌原发灶中高表达.
高国全, 教授, 中山大学中山医学院生物化学教研室; 李革, 副教授, 延边大学附属医院; 周南进, 研究员, 江西省医学科学研究所
transgelin是一种肌动蛋白结合蛋白, 与细胞迁移、侵袭有关, 参与EMT的过程, 但在各种肿瘤细胞中的表达和作用并不一致. transgelin在结肠癌转移中的作用机制有待进一步研究阐明.
与本研究结果相似, Lee等发现, transgelin能促进肿瘤干细胞的迁移和侵袭; Hidalgo等发现transgelin过表达于子宫内膜异位组织, 可能参与内膜细胞的迁移和侵袭. 而Thompson的报道却发现transgelin的缺失能增加肌动蛋白动力从而促进肿瘤细胞迁移.
使用gateway克隆技术构建携tagln基因的真核表达载体, 并建立过表达transgelin的稳定细胞株, 并初步验证了transgelin在结肠癌细胞中的相关生物学功能.
通过研究transgelin在结肠癌转移中的作用机制, 为结肠癌转移提供新的分子基础, 为进一步预防和控制结肠癌转移提供新的靶点.
运用gateway技术构建TAGLN的真核表达载体及稳转细胞株, 选题科学, 有一定的创新性, 实验设计合理, 结论可靠, 对临床结肠癌转移研究有一定的意义.
编辑: 曹丽鸥 电编:鲁亚静
| 2. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 3. | Li N, Zhang J, Liang Y, Shao J, Peng F, Sun M, Xu N, Li X, Wang R, Liu S. A controversial tumor marker: is SM22 a proper biomarker for gastric cancer cells? J Proteome Res. 2007;6:3304-3312. [PubMed] [DOI] |
| 4. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin. 2012;62:10-29. [PubMed] [DOI] |
| 5. | Thweatt R, Lumpkin CK, Goldstein S. A novel gene encoding a smooth muscle protein is overexpressed in senescent human fibroblasts. Biochem Biophys Res Commun. 1992;187:1-7. [PubMed] [DOI] |
| 6. | Lin Y, Buckhaults PJ, Lee JR, Xiong H, Farrell C, Podolsky RH, Schade RR, Dynan WS. Association of the actin-binding protein transgelin with lymph node metastasis in human colorectal cancer. Neoplasia. 2009;11:864-873. [PubMed] |
| 7. | Landy A. Dynamic, structural, and regulatory aspects of lambda site-specific recombination. Annu Rev Biochem. 1989;58:913-949. [PubMed] [DOI] |
| 8. | Magnani E, Bartling L, Hake S. From Gateway to MultiSite Gateway in one recombination event. BMC Mol Biol. 2006;7:46. [PubMed] [DOI] |
| 9. | Bernard P, Couturier M. Cell killing by the F plasmid CcdB protein involves poisoning of DNA-topoisomerase II complexes. J Mol Biol. 1992;226:735-745. [PubMed] [DOI] |
| 10. | Xu R, Li QQ. Protocol: Streamline cloning of genes into binary vectors in Agrobacterium via the Gateway(R) TOPO vector system. Plant Methods. 2008;4:4. [PubMed] [DOI] |
| 11. | Prasad PD, Stanton JA, Assinder SJ. Expression of the actin-associated protein transgelin (SM22) is decreased in prostate cancer. Cell Tissue Res. 2010;339:337-347. [PubMed] [DOI] |
| 12. | Assinder SJ, Stanton JA, Prasad PD. Transgelin: an actin-binding protein and tumour suppressor. Int J Biochem Cell Biol. 2009;41:482-486. [PubMed] [DOI] |
| 13. | Kim TR, Cho EW, Paik SG, Kim IG. Hypoxia-induced SM22α in A549 cells activates the IGF1R/PI3K/Akt pathway, conferring cellular resistance against chemo- and radiation therapy. FEBS Lett. 2012;586:303-309. [PubMed] [DOI] |
| 14. | Peng J, Zhang Q, Ma Y, Wang Y, Huang L, Zhang P, Chen J, Qin H. A rat-to-human search for proteomic alterations reveals transgelin as a biomarker relevant to colorectal carcinogenesis and liver metastasis. Electrophoresis. 2009;30:2976-2987. [PubMed] [DOI] |
| 15. | Lee EK, Han GY, Park HW, Song YJ, Kim CW. Transgelin promotes migration and invasion of cancer stem cells. J Proteome Res. 2010;9:5108-5117. [PubMed] [DOI] |
| 16. | Zhao L, Wang H, Deng YJ, Wang S, Liu C, Jin H, Ding YQ. Transgelin as a suppressor is associated with poor prognosis in colorectal carcinoma patients. Mod Pathol. 2009;22:786-796. [PubMed] |
| 17. | Prinjha RK, Shapland CE, Hsuan JJ, Totty NF, Mason IJ, Lawson D. Cloning and sequencing of cDNAs encoding the actin cross-linking protein transgelin defines a new family of actin-associated proteins. Cell Motil Cytoskeleton. 1994;28:243-255. [PubMed] [DOI] |
| 18. | Fu Y, Liu HW, Forsythe SM, Kogut P, McConville JF, Halayko AJ, Camoretti-Mercado B, Solway J. Mutagenesis analysis of human SM22: characterization of actin binding. J Appl Physiol. 2000;89:1985-1990. [PubMed] |
| 19. | Pawlak G, Helfman DM. Cytoskeletal changes in cell transformation and tumorigenesis. Curr Opin Genet Dev. 2001;11:41-47. [PubMed] [DOI] |
| 20. | Qian Y, Corum L, Meng Q, Blenis J, Zheng JZ, Shi X, Flynn DC, Jiang BH. PI3K induced actin filament remodeling through Akt and p70S6K1: implication of essential role in cell migration. Am J Physiol Cell Physiol. 2004;286:C153-C163. [PubMed] [DOI] |
| 21. | Adam PJ, Regan CP, Hautmann MB, Owens GK. Positive- and negative-acting Kruppel-like transcription factors bind a transforming growth factor beta control element required for expression of the smooth muscle cell differentiation marker SM22alpha in vivo. J Biol Chem. 2000;275:37798-37806. [PubMed] [DOI] |
| 22. | Chen S, Kulik M, Lechleider RJ. Smad proteins regulate transcriptional induction of the SM22alpha gene by TGF-beta. Nucleic Acids Res. 2003;31:1302-1310. [PubMed] [DOI] |
| 23. | Yu H, Königshoff M, Jayachandran A, Handley D, Seeger W, Kaminski N, Eickelberg O. Transgelin is a direct target of TGF-beta/Smad3-dependent epithelial cell migration in lung fibrosis. FASEB J. 2008;22:1778-1789. [PubMed] [DOI] |
| 24. | Bates RC, Mercurio AM. The epithelial-mesenchymal transition (EMT) and colorectal cancer progression. Cancer Biol Ther. 2005;4:365-370. [PubMed] [DOI] |
| 25. | Dos Santos Hidalgo G, Meola J, Rosa E Silva JC, Paro de Paz CC, Ferriani RA. TAGLN expression is deregulated in endometriosis and may be involved in cell invasion, migration, and differentiation. Fertil Steril. 2011;96:700-703. [PubMed] [DOI] |
| 26. | Thompson O, Moghraby JS, Ayscough KR, Winder SJ. Depletion of the actin bundling protein SM22/transgelin increases actin dynamics and enhances the tumourigenic phenotypes of cells. BMC Cell Biol. 2012;13:1. [PubMed] [DOI] |