修回日期: 2012-08-02
接受日期: 2012-08-11
在线出版日期: 2012-09-08
目的: 研究利用miRNA干扰技术抑制FUT3基因表达对人胃癌KATO-Ⅲ细胞增殖的影响.
方法: 将前期实验构建成功的2对针对FUT3基因的特异性miRNA表达载体, 用脂质体转染入人胃癌KATO-Ⅲ细胞, RT-PCR检测FUT3基因表达水平的变化; 免疫细胞化学法、流式细胞术检测其合成抗原sLeA表达变化; MTT法、克隆形成实验检测FUT3基因的表达抑制对KATO-Ⅲ细胞增殖的影响.
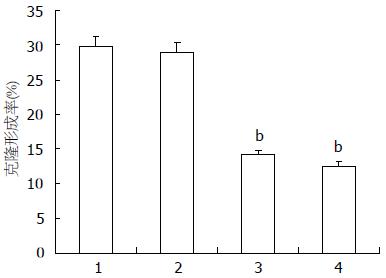
结果: 转染FUT3-miRNA的2个干扰组FUT3基因mRNA相对表达量分别为0.41±0.01, 0.36±0.02, 明显低于对照组(0.71±0.05)和空载体组(0.65±0.03, P<0.05); 细胞表面合成抗原sLeA的表达水平, FUT3-miRNA1组为35.51%±0.36%, FUT3-miRNA2组为26.05%±1.14%, 明显低于对照组(52.79%±2.62%)与空载体组(49.75%±1.29%, P<0.05); 与对照组(5.60%±0.63%)和空载体组(8.90%±0.91%)相比较, FUT3-miRNA1组(38.10%±1.96%)和FUT3-miRNA2组(49.04%±2.37%)能明显抑制细胞的增殖(P<0.05); 细胞的克隆形成能力FUT3-miRNA1组(14.10%±1.70%)和FUT3-miRNA2组(12.50%±1.96%), 显著低于对照组(29.79%±3.05%)和空载体组(28.92%±2.10%, P<0.05).
结论: FUT3靶向miRNA真核表达载体可有效抑制胃癌细胞的增殖能力.
引文著录: 辛永红, 郏雁飞, 蔡永君, 刘强, 汪运山. FUT3-miRNA重组质粒对人胃癌KATO-III细胞增殖的影响. 世界华人消化杂志 2012; 20(25): 2341-2346
Revised: August 2, 2012
Accepted: August 11, 2012
Published online: September 8, 2012
AIM: To investigate the effect of inhibition of FUT3 gene expression with miRNAs on the proliferation of gastric cancer cells (KATO-Ⅲ).
METHODS: Vectors carrying two miRNAs targeting the FUT3 gene were constructed and transiently transfected into KATO-III cells using lipidosome-mediated method. RT-PCR was performed to detect the expression of FUT3 mRNA, and immunocytochemistry and flow cytometry analysis were carried out to test expression variation of sLeA antigen. MTT assay and colony-forming assay were used to analyze cell proliferation and to detect the effect of decreased FUT3 expression on cell growth.
RESULTS: Compared to non-transfected cells and cells transfected with empty vector, the relative expression levels of FUT3 mRNA were significantly decreased (0.41 ± 0.01 vs 0.71 ± 0.05, 0.65 ± 0.03, both P < 0.05; 0.36 ± 0.02 vs 0.71 ± 0.05, 0.65 ± 0.03, both P < 0.05); the sLeA antigen expression levels were also significantly reduced (35.51% ± 0.36% vs 52.79% ± 2.62%, 49.75% ± 1.29%, both P < 0.05; 26.05% ± 1.14% vs 52.79% ± 2.62%, 49.75% ± 1.29%, both P < 0.05); cell growth was significantly inhibited (38.10% ± 1.96% vs 5.6% ± 0.63%, 8.9% ± 0.91%, both P < 0.05; 49.04% ± 2.37% vs 5.6% ± 0.63%, 8.9% ± 0.91%, both P < 0.05); and colony-forming ability was significantly reduced (14.10% ± 1.70% vs 29.79% ± 3.05%, 28.92% ± 2.10%, both P < 0.05; 12.50% ± 1.96% vs 29.79% ± 3.05%, 28.92% ± 2.10%, both P < 0.05) in FUT3-miRNA and FUT3-miRNA2 transfeced cells.
CONCLUSION: Transfection of miRNAs targeting the FUT3 gene can effectively inhibit the proliferation of KATO-Ⅲ cells.
- Citation: Xin YH, Jia YF, Cai YJ, Liu Q, Wang YS. Transfection of miRNAs targeting the FUT3 gene inhibits cell proliferation in human gastric cancer cell line KATO-III. Shijie Huaren Xiaohua Zazhi 2012; 20(25): 2341-2346
- URL: https://www.wjgnet.com/1009-3079/full/v20/i25/2341.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i25.2341
Lewis抗原是一组存在于细胞表面糖脂和糖蛋白糖链上的糖类抗原, 唾液酸化的Lewis A抗原(简称sLeA)在肿瘤细胞中高度表达, 与恶性肿瘤细胞的增殖、分化、黏附以及浸润密切相关[1-8], 很多学者将其作为恶性肿瘤诊断和评价预后的重要指标. α1,3/4-岩藻糖基转移酶(α1,3/4-fucosyltransferase, FUT3)是参与合成sLeA抗原的唯一关键酶[9-11]. 近年来, 有学者通过改变岩藻糖基结构或基因敲除方式来研究肿瘤细胞的增殖、黏附、迁移、侵袭等恶性行为的变化[12-14]. miRNA是近年来发现的一类内源性非编码单链RNA, 能通过与靶mRNA特异性碱基互补配对引起靶mRNA降解或抑制其翻译, 达到调控基因表达的目的[15,16]. miRNA能高效和特异性阻断靶基因的表达, 是继siRNA之后RNA干扰领域一种重要的研究手段和实验工具[17,18].
本研究拟采用miRNA干扰技术, 以较高表达Lewis血型抗原的胃癌细胞系KATO-Ⅲ为研究对象, 构建针对FUT3基因的miRNA干扰质粒, 将其以阳离子脂质体包裹的方式转染入胃腺癌细胞株KATO-Ⅲ中, 观察其在KATO-Ⅲ中对FUT3基因的沉默作用及对sLeA抗原表达水平的影响, 并研究FUT3基因的表达抑制对该肿瘤细胞增殖的影响. 本课题的研究将有利于探讨RNA干涉岩藻糖基转移酶表达对肿瘤细胞行为影响的可能机制, 并为肿瘤的预防和治疗提供新的思路和手段.
KATO-Ⅲ细胞株是低分化的人胃癌细胞, 属于悬浮细胞, 购自美国生物资源中心(American Type Culture Collection, ATCC); 转染试剂FuGENE HD Transfection Reagent(Roche); 抗Sialyl Lewis A(sLeA)抗体KM231(Chemicon), 羊抗鼠荧光二抗R-PE(SouthernBiotech); TRIzol Reagent(invitrogen); RT-PCR试剂盒(Takara); 免疫组织化学染色试剂盒Mouse SP Kit(北京中杉金桥生物技术公司)
1.2.1 细胞培养与转染: 人胃癌细胞株KATO-Ⅲ培养在含100 mL/L胎牛血清的DMEM中, 置于37 ℃ 50 mL/L CO2饱和湿度的培养箱中, 2-3 d后通过离心传代. 转染前24 h, 将肿瘤细胞接种在6孔培养板上, 每孔约5×105个细胞, 使每孔细胞饱和度在转染前达到90%以上, 铺板时不使用含抗生素的培养液, 次日按FuGENE HD转染试剂说明书方法转染. 实验分为4组: 对照组、空载体组、两干扰组(FUT3-miRNA1组和FUT3-miRNA2组).
1.2.2 RNA干扰效率的检测: (1)FUT3基因mRNA表达水平采用实时PCR检测: 转染48 h后收集细胞, 利用TRIzol Reagent提取转染细胞的总RNA. 使用RT-PCR试剂盒, 按50 ℃ 30 min, 99 ℃ 5 min, 5 ℃ 5 min的步骤分别合成cDNA. PCR反应引物序列如下: FUT3正向引物5'-GCAAGGCTTAGACCAGTTCG-3', 反向引物5'-AAAGGCCATGTCCATAGCAG-3', 产物长度337 bp; GAPDH正向引物5'-ATTCAACGGCACAGTCAAGG-3', 反向引物5'-CACCAGTGGATGCAGGGAT-3', 产物长度500 bp. 在PCR仪(PE5700)中扩增, 反应条件为94 ℃ 2 min; 94 ℃ 30 s, 56 ℃ 30 s, 72 ℃ 1 min, 30个循环. PCR扩增产物经2%琼脂糖凝胶电泳检测; (2)免疫细胞化学法检测FUT3表达产物sLeA抗原的变化: 操作按免疫细胞化学试剂盒(中杉金桥)说明书进行, 一抗和二抗的稀释浓度均为1:100. 在显微镜下进行观察并照相记录, 阳性细胞染色后呈棕黄色颗粒; (3)流式细胞术检测sLeA抗原表达的变化: 转染48 h后收获细胞, 用PBS洗2次, 加固定剂室温孵育细胞20 min, PBS洗2次; 室温孵育一抗(单抗sLeA)30 min, PBS洗2次, 室温避光孵育二抗(羊抗鼠荧光二抗R-PE)30 min, PBS洗2次, 最后用PBS悬浮细胞, 送流式细胞仪检测.
1.2.3 细胞的增殖活性变化: (1)MTT比色法来测定细胞活力: 将KATO-Ⅲ细胞接种于96孔培养板中, 细胞终密度约为2×104/mL, 体积100 µL, 接种后24 h进行转染. 分别培养0、24、48、72 h后每孔加入100 µL MTT液(5 g/L), 继续培养4 h后, 小心弃去上清液, 加入100 µL DMSO液, 震荡, 待蓝紫色溶解后, 在全自动酶标仪上测定各孔A492. 抑制率 = (1-实验组A值平均值/对照组A值平均值)×100%; (2)克隆形成实验: 细胞以1×103/mL的浓度接种于60 mm双层琼脂培养皿中, 置37 ℃ 50 mL/L CO2及饱和湿度条件下培养10-14 d, 观察细胞克隆的形成, 比较4组的克隆形成率. 克隆形成率 = (平均克隆数/接种细胞数)×100%.
统计学处理 应用SPSS统计软件对数据进行统计学分析, 实验数据以mean±SD表示, 组间比较采用单因素方差分析(one-way ANOVA), 以P<0.05为差异有统计学意义.
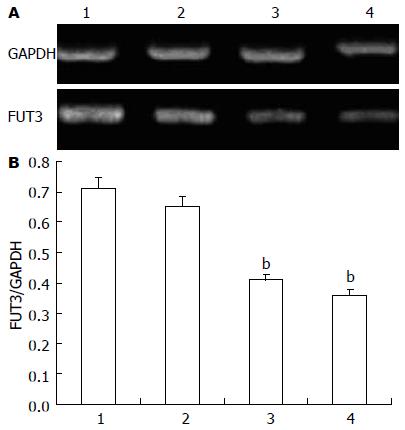
转染后48 h的RT-PCR结果显示, 各组均可见FUT3基因的特异性条带(337 bp)和内参GAPDH主带(500 bp), 与对照组(0.71±0.05)及空载体组(0.65±0.03)相比, FUT3-miRNA1组(0.41±0.01)和FUT3-miRNA2组(0.36±0.02)的FUT3 mRNA表达量均明显降低, 经比较差异有明显的统计学意义(均P<0.01), 说明两重组质粒均能抑制FUT3基因表达, 且FUT3-miRNA2的抑制效率较高(图1A). 而空载体组与对照组相比, 差异无统计学意义(P>0.05). 以内参基因GAPDH为基准分析各条带的相对密度值(图1B).
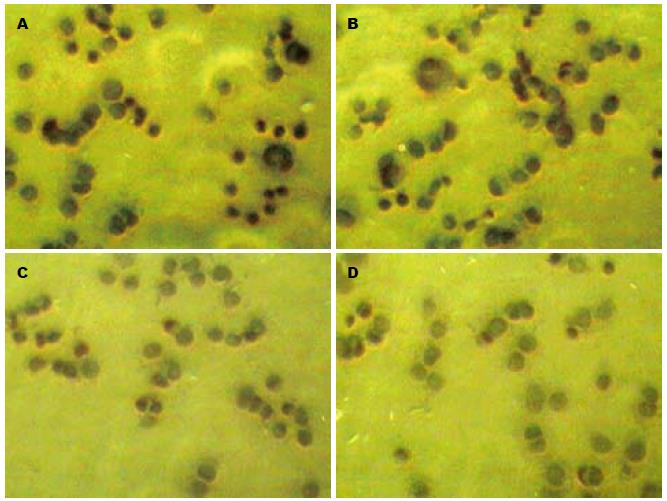
2.2.1 免疫细胞化学法分析: 免疫细胞化学染色检测sLeA抗原在细胞内的定位和表达. 结果显示抗原主要分布于细胞膜上, 对照组和空载体组的KATO-Ⅲ细胞膜表面的sLeA表达较多(图2A, B), 多数细胞均有棕黄色颗粒沉着, 黄色颗粒沉着代表sLeA抗原表达阳性, 分布较为广泛、均匀; 转染后的实验组KATO-Ⅲ细胞仅见少量的棕黄色颗粒沉着, 与对照组和空载体组相比, sLeA呈明显的低表达(图2C, D).
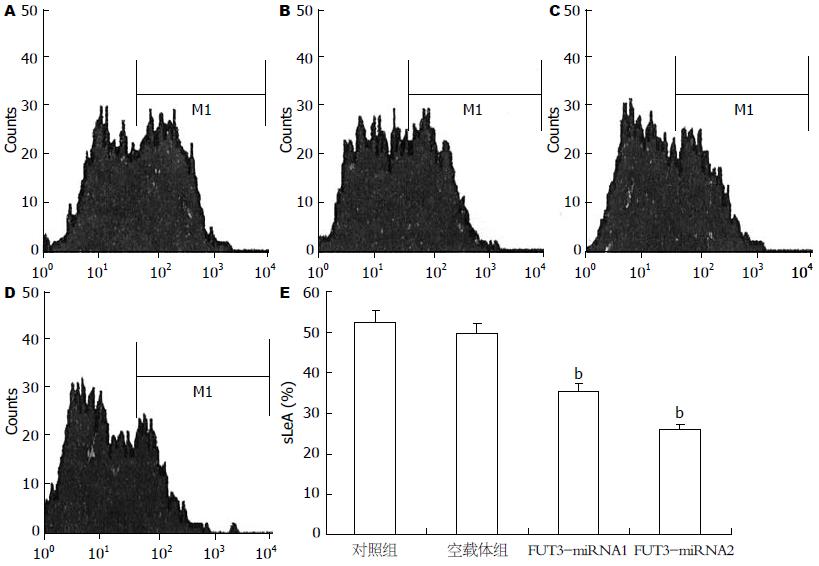
2.2.2 流式细胞术分析: 对照组和空载体组KATO-Ⅲ细胞膜表面sLeA表达量分别为52.79%±2.62%和49.75%±1.29%, FUT3-miRNA1组为35.51%±0.36%, FUT3-miRNA2组为26.05%±1.14%(图3A-D). 经统计学分析表明, 转染48 h后FUT3-miRNA1组的sLeA表达水平明显低于正常对照组及空载体组, 差异均有明显统计学意义(35.51%±0.36% vs 52.79%±2.62%, 49.75%±1.29%, 均P<0.01); FUT3-miRNA2组的sLeA表达水平也明显低于正常对照组及空载体组, 差异均有明显统计学意义(26.05%±1.14% vs 52.79%±2.62%, 49.75%±1.29%, 均P<0.01, 图3E), 可见2种miRNA质粒均能降低KATO-Ⅲ细胞膜表面sLeA的合成水平. 而空载体组与对照组相比, 差异无统计学意义(P>0.05).
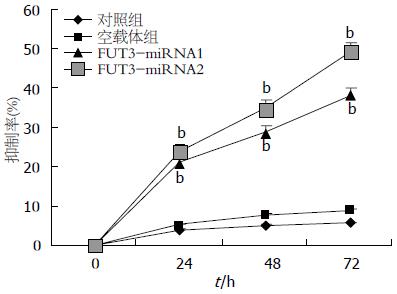
2.3.1 MTT法检测: 对照组与空载体组在各时间点细胞的生长未受明显影响(P>0.05), 而两干扰组FUT3-miRNA1和FUT3-miRNA2在转染24 h后细胞生长均明显受到抑制, 且抑制率随着作用时间延长而提高, 72 h时抑制率最高达到49%(49.04%±2.37% vs 5.60%±0.63%, 8.90%±0.91%, 均P<0.01, 图4). 相差显微镜下, 对照组细胞生长状况良好, 半贴壁半悬浮生长, 边缘较整齐, 呈圆形; FUT3-miRNA1/2干扰组细胞形态不规则, 细胞皱缩, 颗粒增多, 细胞碎片增加.
2.3.2 克隆形成实验: FUT3-miRNA1组和FUT3-miRNA2的克隆形成率分别为14.10%±1.70%、12.50%±1.96%, 两干扰组分别与对照组(29.79%±3.05%)及空载体组(28.92%±2.10%)比较, 细胞的克隆能力均明显下降, 经统计学分析, 差异均有统计学意义(14.10%±1.70% vs 29.79%±3.05%, 28.92%±2.10%, 均P<0.01)和(12.50%±1.96% vs 29.79%±3.05%, 28.92%±2.10%, 均P<0.01, 图5). 说明2种FUT3-miRNA重组质粒对于KATO-Ⅲ细胞的增殖力均有明显的抑制作用. 而空载体组与对照组相比, 差异则无统计学意义(P>0.05).
近年来, 随着分子生物学、分子遗传学、分子免疫学及转基因技术等学科的发展, 发现了许多与肿瘤发生、发展和预后密切相关的基因, 其中关于岩藻糖基转移酶基因及其合成产物的研究日益受到关注[19,20]. FUTs基因的表达是岩藻寡糖抗原合成及其表达调控的关键[21], 其中FUT3是唯一可形成α1,3与α1,4两类键的FUT, 既能合成带α1,3-Fuc的LeX、LeY、sLeX, 又能唯一合成带α1,4-Fuc的LeA、LeB及sLeA. 研究证实, sLeX和sLeA作为肿瘤相关抗原在许多恶性肿瘤细胞表面高度表达, 是血管内皮细胞(E)表面或血小板(P)表面选凝素(selectin)的配体, 在肿瘤细胞的黏附和识别过程中起着重要作用[22-25].
基于FUT3基因对Lewis血型抗原生物合成的调控作用, 其已经成为肿瘤基因治疗研究的新靶点. 研究报道, 转有人FUT3基因的羊奶或牛奶可以结合人体内的幽门螺杆菌, 阻止他与胃肠细胞结合从而达到治疗或预防胃肠疾病的目的[26]. 有学者通过针对FUT3的反义核酸来阻断α1,3/4-岩藻糖基转移酶基因表达, 下调sLeA表达水平, 影响肿瘤细胞增殖, 抑制癌细胞的黏附和迁移[27,28]. 但应用miRNA技术来抑制FUT3表达的研究则鲜见报道.
近几年, RNAi已成为抑制特异性基因表达及研究基因功能的重要方法[29]. 人工miRNA元件以天然miRNA为基础骨架构建, 在体外人工合成含有特定茎环结构的pre-miRNA片段, 转染入细胞后模拟内源性miRNA的形成及降解靶基因的过程, 其有效沉默序列的筛选量要远少于传统siRNA, 且沉默效果高于siRNA. 基于这些优点, miRNA成为继siRNA之后RNA干扰领域又一重要的研究手段和实验工具[30].
本研究所构建的靶向FUT3的miRNA表达载体, 经转染入人胃癌KATO-Ⅲ细胞, 通过RT-PCR、免疫细胞化学和流式细胞术检测, 初步验证了所设计的两组miRNA干扰质粒均可通过降低岩藻糖基转移酶FUT3的表达, 明显下调KATO-Ⅲ细胞表面sLeA的合成, 其中FUT3-miRNA2的抑制效果比FUT3-miRNA1更明显, 而对照组和空载体组相比则无明显差异. MTT结果显示, RNA干扰FUT3基因表达后可明显抑制肿瘤细胞生长, 在转染后72 h时抑制作用最为明显, 抑制率可达49%; 克隆形成实验结果显示, 两组miRNA干扰质粒的克隆形成能力明显下降, 与对照组和空载体组相比, 存在显著性差异. 以上结果均显示两组miRNA重组质粒对胃癌细胞系KATO-Ⅲ的生长和增殖有明显抑制作用.
本实验所构建miRNA表达载体转染KATO-Ⅲ细胞, 可有效抑制FUT3基因的表达, 降低sLeA抗原的生物合成, 诱发RNAi效应, 并且对细胞的生长和增殖也有不同程度的影响. 但FUT3基因及其下游产物sLeA对胃癌细胞增殖调控的具体机制还有待于进一步研究.
胃癌是消化系常见的恶性肿瘤, 目前认为有关胃癌的发生与多因素相关. 近年研究表明, Lewis抗原与多种恶性肿瘤关系密切, 岩藻糖基转移酶(FUTs)是参与合成Lewis抗原的关键酶, FUT3是其中之一.
杜雅菊, 教授, 哈尔滨医科大学附属第二医院消化内科
Weston等研究发现, 人FUT3的反义核酸可通过阻断α1,3/4-岩藻糖基转移酶基因表达, 下调sLeA和sLeX的表达水平, 抑制结肠癌细胞的黏附和肝转移; Aubert等研究发现, 人FUT3的反义核酸序列可下调sLeA和sLeX的表达水平, 影响胰腺癌细胞的增殖和转移, 但不影响细胞的凋亡.
本实验利用miRNA干扰技术抑制FUTs的表达, 降低肿瘤细胞表面Lewis抗原合成水平, 进而影响肿瘤细胞的生物学行为, 达到治疗肿瘤的目的. 目前国内外鲜有报道.
本研究证实FUT3靶向miRNA真核表达载体可有效抑制胃癌细胞的增殖能力, 为肿瘤的基因治疗提供了新途径.
Lewis A抗原: 即唾液酸化Lewis-A抗原(sLeA), 是血管内皮细胞表面或血小板表面选凝素的配体. 在许多肿瘤细胞表面表达量异常升高, 与恶性肿瘤细胞的增殖、分化、黏附以及浸润密切相关.
本文构建了FUT3 miRNA特异性重组质粒, 探讨了miRNA沉默干扰FUT3基因对胃癌细胞增殖的影响. 该实验立题新颖, 具有一定的创新性.
编辑: 张姗姗 电编:鲁亚静
| 1. | Ugorski M, Laskowska A. Sialyl Lewis(a): a tumor-associated carbohydrate antigen involved in adhesion and metastatic potential of cancer cells. Acta Biochim Pol. 2002;49:303-311. [PubMed] |
| 2. | Alpaugh ML, Tomlinson JS, Ye Y, Barsky SH. Relationship of sialyl-Lewis(x/a) underexpression and E-cadherin overexpression in the lymphovascular embolus of inflammatory breast carcinoma. Am J Pathol. 2002;161:619-628. [PubMed] [DOI] |
| 3. | Brooks SA, Leathem AJ. Expression of the CD15 antigen (Lewis x) in breast cancer. Histochem J. 1995;27:689-693. [PubMed] |
| 4. | Ito H, Hiraiwa N, Sawada-Kasugai M, Akamatsu S, Tachikawa T, Kasai Y, Akiyama S, Ito K, Takagi H, Kannagi R. Altered mRNA expression of specific molecular species of fucosyl- and sialyl-transferases in human colorectal cancer tissues. Int J Cancer. 1997;71:556-564. [PubMed] [DOI] |
| 6. | Jeschke U, Mylonas I, Shabani N, Kunert-Keil C, Schindlbeck C, Gerber B, Friese K. Expression of sialyl lewis X, sialyl Lewis A, E-cadherin and cathepsin-D in human breast cancer: immunohistochemical analysis in mammary carcinoma in situ, invasive carcinomas and their lymph node metastasis. Anticancer Res. 2005;25:1615-1622. [PubMed] |
| 7. | Liu F, Qi HL, Chen HL. Regulation of differentiation- and proliferation-inducers on Lewis antigens, alpha-fucosyltransferase and metastatic potential in hepatocarcinoma cells. Br J Cancer. 2001;84:1556-1563. [PubMed] [DOI] |
| 8. | Capelle MA, Brügger P, Arvinte T. Spectroscopic characterization of antibodies adsorbed to aluminium adjuvants: correlation with antibody vaccine immunogenicity. Vaccine. 2005;23:1686-1694. [PubMed] [DOI] |
| 9. | Narimatsu H. [Human fucosyltransferases: tissue distribution of blood group antigens, cancer-associated antigens and fucosyltransferases]. Tanpakushitsu Kakusan Koso. 1998;43:2394-2403. [PubMed] |
| 10. | Dupuy F, Germot A, Marenda M, Oriol R, Blancher A, Julien R, Maftah A. Alpha1,4-fucosyltransferase activity: a significant function in the primate lineage has appeared twice independently. Mol Biol Evol. 2002;19:815-824. [PubMed] [DOI] |
| 14. | 岳 丽玲, 樊 丽, 牛 英才, 刘 吉成. RNA干扰敲减FucT VII表达抑制人结肠癌细胞HT-29和HUVECs的粘附能力. 中国生物化学与分子生物学报. 2010;26:290-294. |
| 15. | Ying SY, Chang DC, Lin SL. The microRNA (miRNA): overview of the RNA genes that modulate gene function. Mol Biotechnol. 2008;38:257-268. [PubMed] [DOI] |
| 17. | 王 凯, 李 乐平, 郭 琼行, 苗 瑞政, 程 力, 靖 昌庆, 王 金申. 靶向ING1基因的miR-622真核表达载体在胃癌细胞MKN-45中的鉴定及其功能. 世界华人消化杂志. 2011;19:2810-2815. [DOI] |
| 21. | Raes G, Ghassabeh GH, Brys L, Mpofu N, Verschueren H, Vanhecke D, De Baetselier P. The metastatic T-cell hybridoma antigen/P-selectin glycoprotein ligand 1 is required for hematogenous metastasis of lymphomas. Int J Cancer. 2007;121:2646-2652. [PubMed] [DOI] |
| 22. | Juntavee A, Sripa B, Pugkhem A, Khuntikeo N, Wongkham S. Expression of sialyl Lewis(a) relates to poor prognosis in cholangiocarcinoma. World J Gastroenterol. 2005;11:249-254. [PubMed] |
| 23. | Magnani JL. The discovery, biology, and drug development of sialyl Lea and sialyl Lex. Arch Biochem Biophys. 2004;426:122-131. [PubMed] [DOI] |
| 24. | Miyoshi E, Moriwaki K, Nakagawa T. Biological function of fucosylation in cancer biology. J Biochem. 2008;143:725-729. [PubMed] [DOI] |
| 25. | Kimura H, Shinya N, Nishihara S, Kaneko M, Irimura T, Narimatsu H. Distinct substrate specificities of five human alpha-1,3-fucosyltransferases for in vivo synthesis of the sialyl Lewis x and Lewis x epitopes. Biochem Biophys Res Commun. 1997;237:131-137. [PubMed] [DOI] |
| 26. | Xu HT, Zhao YF, Lian ZX, Fan BL, Zhao ZH, Yu SY, Dai YP, Wang LL, Niu HL, Li N. Effects of fucosylated milk of goat and mouse on Helicobacter pylori binding to Lewis b antigen. World J Gastroenterol. 2004;10:2063-2066. [PubMed] |
| 27. | Aubert M, Panicot-Dubois L, Crotte C, Sbarra V, Lombardo D, Sadoulet MO, Mas E. Peritoneal colonization by human pancreatic cancer cells is inhibited by antisense FUT3 sequence. Int J Cancer. 2000;88:558-565. [PubMed] [DOI] |
| 28. | Weston BW, Hiller KM, Mayben JP, Manousos GA, Bendt KM, Liu R, Cusack JC. Expression of human alpha(1,3)fucosyltransferase antisense sequences inhibits selectin-mediated adhesion and liver metastasis of colon carcinoma cells. Cancer Res. 1999;59:2127-2135. [PubMed] |
| 29. | 崔 欲晓, 刘 民, 李 欣, 汤 华. RNA干扰抑制癌胚抗原表达对结肠癌细胞增殖的影响. 中国生物化学与分子生物学报. 2009;25:78-82. |
| 30. | Mestdagh P, Feys T, Bernard N, Guenther S, Chen C, Speleman F, Vandesompele J. High-throughput stem-loop RT-qPCR miRNA expression profiling using minute amounts of input RNA. Nucleic Acids Res. 2008;36:e143. [PubMed] [DOI] |