修回日期: 2012-07-23
接受日期: 2012-08-19
在线出版日期: 2012-08-28
目的: 研究D-木糖(D-xylose)对酒精诱导的肝细胞发生脂肪性变的保护作用.
方法: 用酒精诱导肝HepG2细胞株损伤, 设立正常对照组、酒精损伤组和不同浓度的D-木糖保护组; 形态学观察细胞凋亡以及生长情况, 以MTT法检测细胞存活力, 通过油红O染色对存活细胞脂变程度进行观察并量化比较, RT-PCR检测PPARγ水平的变化, 综合评价酒精引起细胞脂肪性病变的机制.
结果: 肝HepG2细胞经酒精损伤后, 可见细胞形态肿胀变形或萎缩, 出现凋亡小体, 细胞数量明显降低, 脂肪变程度严重. 经不同浓度D-木糖给药处理, 各保护组的肝脏细胞存活率显著升高(88.5%、81.8%、75.4% vs 44.0%, P<0.05); 脂变程度明显减轻(0.63250±0.068172、0.60400±0042798、0.95538±0.067853 vs 0.97313±0.063481, P<0.05); 同时, 酒精损伤组PPARγ的mRNA表达水平较正常对照组有明显提高, 而D-木糖保护组中其表达量降低, 以高浓度组最为显著.
结论: D-木糖可降低酒精对肝细胞的损伤作用, 降低细胞脂变程度, 可能是通过降低脂肪生成的速度而实现的.
引文著录: 何东, 王晓雨, 程玉刚, 刘宛灵, 丁继程, 王冬梅, 李霞. D-木糖对酒精致肝细胞脂肪性变的保护作用. 世界华人消化杂志 2012; 20(24): 2259-2264
Revised: July 23, 2012
Accepted: August 19, 2012
Published online: August 28, 2012
AIM: To investigate the protective effect of D-xylose against alcohol-induced hepatic cell steatosis.
METHODS: HepG2 cells were divided into three groups: normal control group, alcohol-injured group, and D-xylose group. Steatosis was induced with alcohol in cells in the alcohol-injured group and D-xylose group. The D-xylose group was treated with different concentrations of D-xylose. After treatment, cell apoptosis and growth were observed based on morphology, while cell viability was tested by MTT assay. The degree of steatosis in viable cells was evaluated by Oil Red O staining. RT-PCR was employed for testing the changes in PPARγ expression levels.
RESULTS: In the D-xylose groups, hepatic cell survival rate was increased significantly (88.5%, 81.8%, 75.4% vs 44.0%, all P < 0.05) and the degree of steatosis was alleviated (0.63250 ± 0.068172, 0.60400 ± 0042798, 0.95538 ± 0.067853 vs 0.97313 ± 0.063481, all P < 0.05) compared to the alcohol-injured group. The mRNA level of PPARγ was significantly higher in the alcohol-injured group than in the control group; however, D-xylose significantly reduced the degree of steatosis in a concentration-dependent manner.
CONCLUSION: D-xylose can reduce alcohol-induced hepatic cell injury and steatosis possibly by decreasing lipid generation.
- Citation: He D, Wang XY, Cheng YG, Liu WL, Ding JC, Wang DM, Li X. D-xylose protects against alcohol-induced steatosis in HepG2 cells. Shijie Huaren Xiaohua Zazhi 2012; 20(24): 2259-2264
- URL: https://www.wjgnet.com/1009-3079/full/v20/i24/2259.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i24.2259
过量饮酒摄入的乙醇在肝脏代谢过程中消耗大量的辅酶与细胞色素, 造成肝脏代谢紊乱, 导致脂肪在肝脏的代谢障碍而形成酒精性脂肪肝[1]. 普遍认为其主要机制与乙醇在肝细胞内代谢造成的脂质过氧化反应及高反应性羟自由基对肝组织的损伤作用有关[2,3]. 乙醇还可通过影响乙醇脱氢酶(alcohol dehydrogenase, ADH)和微粒体乙醇氧化系统中的细胞色素P450ⅡE1(cytochrome P450ⅡE1, YPⅡE1)等乙醇代谢的主要酶类, 从而影响线粒体和微管的功能, 导致肝细胞功能的损伤[4]. 除此之外, 酒精经过肝细胞内代谢产生的乙醛在活体生理状态下能与多种蛋白发生共价结合, 形成稳定和不稳定的乙醛蛋白加和物(acetaldehyde-protein adduct, APA), 其形成不仅改变了蛋白质的结构, 而且还导致蛋白质功能异常, 如: 蛋白酶的失活、DNA修复蛋白的功能障碍、谷胱甘肽的耗竭、线粒体的损伤、氧利用障碍和胶原蛋白合成增加, 并且还可引发抗原诱生免疫反应, 产生相应抗体, 引起肝细胞炎症、坏死及纤维组织增生[5,6]. Purohit等[7]研究还发现乙醛通过削弱过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor alpha, PPAR-α)的功能促使肝脏脂肪堆积. PPAR家族是一种由配体激活的转录因子, 是动物糖脂代谢的主要核调节受体, 其中PPARγ被认为是调节脂肪组织分化的主要核受体因子, 参与调节机体能量稳态和脂质稳态[8]. D-木糖(化学式: C5H10O5)是一种戊醛糖, 近年来的研究表明其对人体肠道内双歧杆菌的增殖有较高促进作用, 食用木糖能改善人体的微环境, 提高免疫系统功能, 且木糖与钙同时摄入, 可以提高人体对钙的吸收率和保留率, 防止便秘, 与食物的配伍性好, 其本身在人体内经过易化扩散不完全吸收利用[9-11]. 其对于实验动物的血清甘油三酯以及低密度脂蛋白的降低, 与高密度脂蛋白含量的升高有一定的作用, 并可降低实验动物体内丙氨酸氨基转移酶以及天门冬氨酸氨基转移酶水平. 但是关于D-木糖对于脂肪变的抑制作用与PPARγ调节的关系未发现报道, 因此成为本实验研究的方向之一.
本研究以细胞培养为基础, 用酒精损伤的方法处理肝HepG2细胞株, 以模拟体内肝细胞酒精性病变, 通过多种方法观察D-木糖对损伤细胞的保护作用及机制, 有助于深层次的解释与理解其在细胞保护以及脂肪变的干预过程中的作用, 旨在为进一步探讨D-木糖应用于肝细胞损伤疾病以及肝脏相关慢性疾病的防控提供实验依据.
所用HepG2细胞株由山东大学医学院细胞生物学研究所提供; D-木糖(纯度>98%)由济南圣泉唐和唐生物科技有限公司提供; DMEM培养基(美国Hyclone公司); 新生牛血清(四季青公司); MTT、胰蛋白酶、DMSO均购自美国Sigma公司; TRIzol试剂购自Invitrogen生物科技有限公司; 其他试剂主要有hanks缓冲溶液、抗生素、无水乙醇、油红O染液等. 试验用仪器包括: Bio-rad公司酶标仪、二氧化碳恒温培养箱、超净工作台以及相差显微镜. 其他常用试剂与耗材均由山东大学医学院细胞生物学研究所提供.
1.2.1 细胞培养基及酒精损伤与D-木糖保护方法: 基本培养基为DMEM高糖培养基, 含10%新生牛血清以及100 U/mL青霉素、60 µg/mL链霉素. 含药培养基配制: 以D-hanks溶液配制成浓度为12 g/L的D-木糖溶液. 使用时的浓度是高浓度保护组600 µg/mL、中浓度保护组300 µg/mL、低浓度保护组150 µg/mL, 在酒精损伤前提前12 h加入细胞培养基中. 酒精损伤浓度为200 nmol/mL, 正常对照组加入等量D-hanks溶液. 酒精损伤2 h后吸出各孔内培养液, 分别进行相关检测.
1.2.2 细胞培养与分组实验: 细胞培养生长到80%时, 胰酶消化整瓶细胞后计数, 分别接种到6孔、24孔和96孔培养板, 接种细胞量为前2者2×104/孔, 后者1×104/孔, 严格无菌操作后置于37 ℃、50 mL/L CO2、饱和湿度培养箱内培养, 每日定期观察并记录细胞生长状况, 待布满孔板后进行试验操作. 其中24孔板用于油红O染色, 96孔板用于MTT法检测细胞存活率, 6孔板用于收集细胞提取总RNA.
1.2.3 油红O染色: 加入酒精处理2 h后, 吸掉培养基, PBS洗2次/5 min, 新鲜配制10%甲醛固定10 min, 油红O染液染色20 min, 显微镜下观察拍照; 60%异丙醇萃取油红O 10 min后, 用酶标仪检测在510 nm波长处的吸光度(A)值, 对脂肪变程度进行定量分析[12]. 每组4孔, 以上实验均重复3次.
1.2.4 MTT法检测细胞存活率: 按照损伤液制备分组进行划分, 高、中、低浓度保护组以及酒精损伤组均每组10孔, 正常对照组12孔, 调零用6孔. 96孔板在1.2.2的基础上, 吸去每孔内的损伤液后更换为基础培养基100 µL, 之后继续加入MTT溶液20 µL(0.5% MTT, 5 mg/mL), 继续培养4 h后终止培养, 吸去孔内培养液以及MTT溶液, 加入100 µL的二甲基亚砜(dimethyl sulfoxide, DMSO), 在摇床低速震荡10 min, 使结晶充分溶解后, 置于酶标仪490 nm, 测定A值. 计算各组A平均值, 减去调零组平均值后, 以正常对照组存活率为100%, 其余各组A值调零后与正常对照组A值相比, 可得其存活率.
1.2.5 PPARγ活性水平变化的检测: 酒精处理2 h后, 收集细胞, 用TRIzol试剂裂解细胞, 提取总RNA, 设计PPARγ和内参GAPDH的引物. PPARγ-forward: 5'-GACCACTCGCATTCCTTT-3'、PPARγ-reverse: 5'-GGCATTGTGAGACATCCC-3'; GAPDH-forward: 5'-CAAGGTCATCCATGACAACTTTG-3'、GAPDH-reverse: 5'-GTCCACCACCCTGTTGCTGTAG-3', PCR扩增, 琼脂糖凝胶电泳鉴定, 凝胶成像仪拍照分析, 应用Image-Master VDS图像扫描分析系统测定目的条带与内参条带的A值.
统计学处理 采用SPSS16.0统计软件对实验数据进行统计学处理, 各组实验独立重复3次以上, 各个数据差异显著性检验采用单因素方差分析, 两组间比较用t检验. 计量资料用mean±SD表示, 病理形态学结果采用对比描述分析.
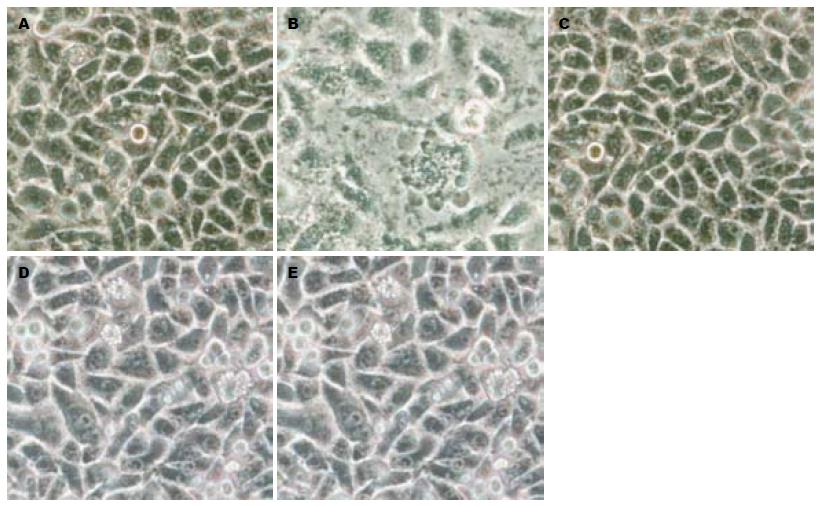
细胞在高浓度保护组(图1C)形态学表现与正常对照组(图1A)近似, 贴壁情况良好, 形态完整; 中、低浓度保护组(图1D, E)细胞形态数目差距不明显, 但低浓度保护组细胞形态更接近于酒精损伤组; 酒精损伤组(图1B)可见细胞肿胀变形或萎缩, 出现凋亡小体, 细胞形态不饱满, 视野内细胞数量明显降低.
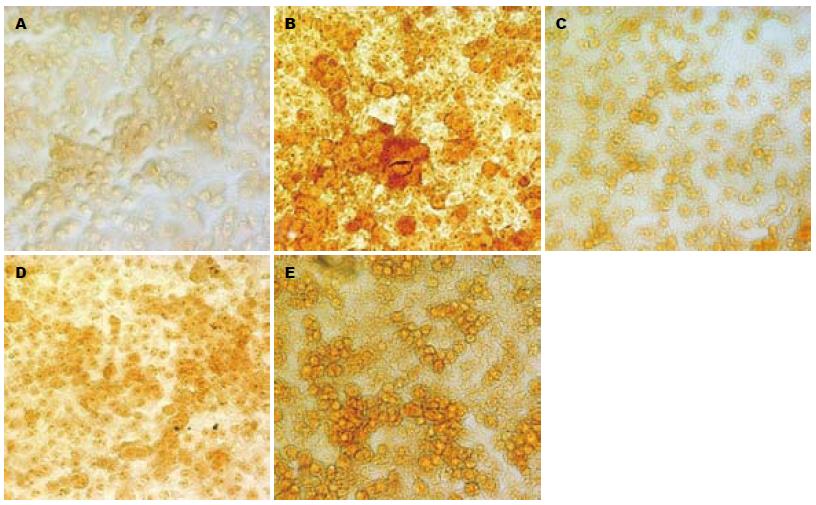
高浓度保护组(图2C)同正常对照组(图2A)细胞脂肪变情况较轻, 其他组别表现为: 中、低浓度保护组(图2D, E)脂肪变程度差异不大, 酒精损伤组(图2B)出现较严重的细胞层次紊乱情况, 染色后可发现细胞密集区域细胞脂肪变程度严重, 同药物保护各组均有明显的差异. 异丙醇溶液脱色后测定A值如表1所示. 用SPSS l6.0统计分析软件对表1数据进行独立样本T-检验, 再经LSD法分别进行组间比较, 结果显示酒精损伤组和低浓度用药组与正常对照组之间差异显著, 高、中浓度用药组与酒精损伤组之间差异显著, 有统计学意义(P<0.05). 说明在D-木糖的作用下可有效降低细胞脂肪变程度.
酒精损伤组和中、低浓度用药组与正常对照组之间差异显著, 各组均与酒精损伤组之间差异显著, 有统计学意义(P<0.05, 表1). 说D-木糖可以提高细胞存活率, 拮抗细胞凋亡过程, 且细胞存活率随着用药浓度的升高而增加.
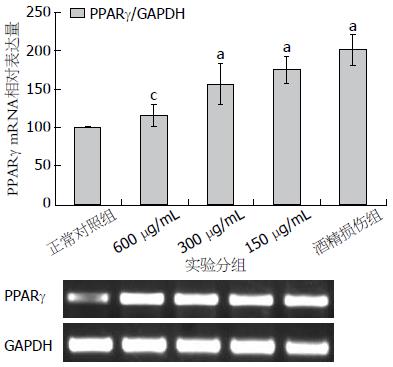
酒精处理2 h后的PPARγ琼脂糖凝胶电泳结果, 用Image-Master VDS对电泳图谱进行定量分析, 经统计学分析结果表明, 酒精损伤组PPARγ活性水平明显升高, 与正常对照组之间差异显著, 有统计学意义(P<0.05), 且中低浓度用药组也如此. 但随着D-木糖浓度的升高, 高浓度用药组水平下降趋势明显, 与正常对照组之间没有显著差异, 而与酒精损伤组差异显著(P<0.05, 图3). 说明D-木糖降低了酒精对细胞的损伤作用.
酒精为肝细胞损伤的常用造模药物. 本研究以HepG2细胞作为模型探讨D-木糖作用于肝脏细胞脂肪变的作用. 在酒精损伤的作用下, 代谢酒精的过程破坏了正常的细胞氧化环节, 从而导致脂肪的不完全代谢. 尽管酒精损伤细胞作用于细胞氧化环节, D-木糖作用于细胞代谢的过程尚不明确, 但我们已有实验结果提示D-木糖在细胞内不仅仅是通过调整高密度脂蛋白受体表达上调从而实现对抗脂肪变的过程(文章待发表), 还可能与保护细胞氧化过程顺利进行有关. 形态学观察及油红O染色显示, D-木糖作用于细胞可以降低脂肪变的程度, 仅从实验结果分析未能证实其对于已经发生脂肪变性的肝脏细胞是否存在逆转作用. 若D-木糖可以作用于细胞氧化环节, 那其是否也可以作用于已经发生脂肪变的细胞, 起到保护肝脏细胞的作用, 还有待于进一步深入研究.
PPAR是一类由配体激活的转录因子, 属于核激素受体超家族, 有α、β和γ 3种亚型, 不同亚型在体内不同器官的分布及功能也不尽一致. PPARγ主要表达在棕色和白色脂肪组织及小肠组织中, 可被多种脂肪酸及其衍生物激活, 是参与调节糖、脂质代谢的重要因子, 通过调控多种在脂类代谢不同途径的基因表达, 发挥调控细胞分化、脂肪的储存和调节胰岛素的作用[13], 参与炎症、细胞凋亡等病理过程[14], 因此在脂肪细胞分化过程的研究中受到越来越多的关注.
PPARγ存在4种亚型: PPARγ-1、PPARγ-2、PPARγ-3和PPARγ-4, 均由同一基因编码, 由于启动子和转录后剪接方式的不同而产生. 其中PPARγ-1是PPARγ最主要的亚型, 分布相对广泛, 主要分布在脂肪组织、肝脏、心脏、胰腺、肠、肾脏和骨骼肌等组织, 其中在大肠和脂肪组织表达量最高, 其在正常肝细胞中的表达量仅为脂肪组织的10%-20%[15-17]. 因此本研究中我们对PPARγ-1的活性进行检测. 实验结果表明: 酒精损伤组的mRNA表达显著提高, 而在D-木糖的作用下, 其mRNA的表达量及脂肪的合成作用降低, 并且这种抑制作用同D-木糖的剂量存在一定相关性, 即D-木糖对于干预肝细胞脂肪变的作用可能来源于其对PPARγ表达量的调节, 这一系列实验结果反映D-木糖对于细胞内部脂肪合成过程的干预机制, 可能是通过降低PPARγ的表达调节过程从而调整脂肪合成的速度.
对于肝脏的保护药物, 提高细胞存活率是一项重要的参考指标, 本研究中经高浓度D-木糖药物保护的肝脏细胞存活率趋近于正常组, 而其中低剂量组表现出来的差异不显著, 这对于调整作用剂量以及寻找合适的应用剂量有着重要的意义[18].
总之, D-木糖不仅可调节胃肠道微环境以及免疫活动, 其本身也可以作为细胞生理过程中的物质参与细胞氧化过程, 从而对酒精致肝脏细胞损伤起到保护作用. 因此本研究为D-木糖对脂肪病变的改善作用机制提供了实验依据, 为将其进一步应用于人体防治等方面提供了理论参考.
骨酒精性肝损伤在人群中具有较高的发生率, 其导致肝脂肪性变是一种常见的肝损伤变性, 而如何控制与逆转肝脂肪性变一直是研究的热点. D-木糖(D-xylose)对于高脂血症大鼠血清中的脂类物质具有一定的调节作用, 机制与高密度脂蛋白的作用密切相关, 而高密度脂蛋白作为脂类逆向转运至肝脏的物质其主要在小肠与肝脏内合成, 其对于肝脏自身的脂质代谢具有何种调节功能及调节机制, 成为所关心的重点.
迟宝荣, 教授, 吉林大学第一医院消化内科
自从Okazaki等于1990年开始报道低聚木糖在食品开发以及其具体功能的应用以来, 国内的相关研究集中于其在食品工业中的制备以及实验诊断学方面的应用, 尚未有关于D-木糖单体在肝脏脂质代谢调节以及对肝细胞保护等相关的研究, 本实验项目填补了相关的研究方向的空白.
本实验在利用传统的MTT法测定细胞存活率的同时, 克服了传统的细胞培养实验测定脂肪变程度方法繁琐的缺点, 以往的脂肪变程度一般通过软件处理后进行测定, 组间比较无法定量. 本实验利用了改进后的异丙醇脱色的原理,即在油红O染色法中洗脱浮色后, 利用异丙醇脱色法洗脱结合的油红O, 加以定量分析.
D-木糖不仅能够降低脂类物质的含量, 同时可直接调节肝细胞自身脂质代谢, 作用效果更为直接. 与阿托伐他汀等传统的他汀类调脂药物相比, D-木糖的不良反应在动物实验中并不明显, 且无横纹肌溶解风险, 因此应用的安全性更高. 但D-木糖的应用途径与剂量等尚需深入探讨.
该文研究D-木糖对酒精诱导的肝细胞发生脂肪性变的保护作用, 有关D-木糖对肝细胞酒精性病变的保护作用国内研究较少, 该文具有很强的创新性.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Tipoe GL, Liong EC, Casey CA, Donohue TM, Eagon PK, So H, Leung TM, Fogt F, Nanji AA. A voluntary oral ethanol-feeding rat model associated with necroinflammatory liver injury. Alcohol Clin Exp Res. 2008;32:669-682. [PubMed] [DOI] |
| 2. | Chen J, Robinson NC, Schenker S, Frosto TA, Henderson GI. Formation of 4-hydroxynonenal adducts with cytochrome c oxidase in rats following short-term ethanol intake. Hepatology. 1999;29:1792-1798. [PubMed] [DOI] |
| 5. | Wang HJ, Zakhari S, Jung MK. Alcohol, inflammation, and gut-liver-brain interactions in tissue damage and disease development. World J Gastroenterol. 2010;16:1304-1313. [PubMed] [DOI] |
| 6. | Herttua K, Mäkelä P, Martikainen P. Changes in alcohol-related mortality and its socioeconomic differences after a large reduction in alcohol prices: a natural experiment based on register data. Am J Epidemiol. 2008;168:1110-1118; discussion 1126-1131. [PubMed] [DOI] |
| 7. | Purohit V, Russo D, Coates PM. Role of fatty liver, dietary fatty acid supplements, and obesity in the progression of alcoholic liver disease: introduction and summary of the symposium. Alcohol. 2004;34:3-8. [PubMed] [DOI] |
| 8. | Bensinger SJ, Tontonoz P. Integration of metabolism and inflammation by lipid-activated nuclear receptors. Nature. 2008;454:470-477. [PubMed] [DOI] |
| 12. | Ramírez-Zacarías JL, Castro-Muñozledo F, Kuri-Harcuch W. Quantitation of adipose conversion and triglycerides by staining intracytoplasmic lipids with Oil red O. Histochemistry. 1992;97:493-497. [PubMed] [DOI] |
| 13. | Vosper H, Khoudoli GA, Graham TL, Palmer CN. Peroxisome proliferator-activated receptor agonists, hyperlipidaemia, and atherosclerosis. Pharmacol Ther. 2002;95:47-62. [PubMed] [DOI] |
| 14. | Berger J, Moller DE. The mechanisms of action of PPARs. Annu Rev Med. 2002;53:409-435. [PubMed] [DOI] |
| 16. | Braissant O, Foufelle F, Scotto C, Dauça M, Wahli W. Differential expression of peroxisome proliferator-activated receptors (PPARs): tissue distribution of PPAR-alpha, -beta, and -gamma in the adult rat. Endocrinology. 1996;137:354-366. [PubMed] [DOI] |
| 17. | Meirhaeghe A, Fajas L, Gouilleux F, Cottel D, Helbecque N, Auwerx J, Amouyel P. A functional polymorphism in a STAT5B site of the human PPAR gamma 3 gene promoter affects height and lipid metabolism in a French population. Arterioscler Thromb Vasc Biol. 2003;23:289-294. [PubMed] [DOI] |