修回日期: 2012-01-15
接受日期: 2012-07-08
在线出版日期: 2012-08-18
目的: 探讨哌啶类生物碱洛贝林(Lobeline)能否逆转人胃癌多药耐药细胞株SGC7901/VCR的多药耐药, 并进一步探讨洛贝林逆转其多药耐药的机制, 评估其有效性.
方法: 以人胃癌多药耐药细胞株SGC7901/VCR为研究对象, 用四氮唑蓝(MTT)法分别测定在无和有洛贝林(细胞无毒浓度10 μmol/L)作用下多药耐药细胞株SGC7901/VCR对VCR及5-Fu的半数生长抑制率, 并由此求其耐药逆转的倍数; RT-PCR分别检测在无和不同终浓度洛贝林(5、10、20、50、100 μmol/L)作用下多药耐药细胞株SGC7901/VCR的多药耐药基因MDR1 mRNA表达情况; Western blot分别检测在无和不同终浓度洛贝林(5、10、20、50、100 μmol/L)作用下多药耐药细胞株SGC7901/VCR的P-gp蛋白表达.
结果: 在洛贝林无毒作用浓度(10 μmol/L)作用下, 多药耐药细胞株SGC7901/VCR对化疗药的敏感性增加, VCR对耐药细胞株的IC50由原来的16.55 μg/L±0.13 μg/L变成7.27 μg/L±0.65 μg/L, 逆转指数约为2.28; 5-Fu对耐药细胞株的IC50由原来的11.01 μg/L±0.43 μg/L变成9.53 μg/L±0.79 μg/L, 逆转指数约为1.16; RT-PCR检测示多药耐药细胞株SGC7901/VCR呈现MDR1 mRNA高度表达, 随洛贝林终作用浓度的增大, MDR1 mRNA表达逐渐下降, 各组间差距有统计学意义(P<0.05); Western blot检测表明多药耐药细胞株SGC7901/VCR高度表达P-gp蛋白, 随洛贝林作用终浓度依次增加P-gp蛋白表达依次减弱, 组间呈浓度依赖性, 差别有统计学意义(P<0.05).
结论: 无细胞毒作用浓度的洛贝林可以逆转胃癌多药耐药细胞株SGC7901/VCR的多药耐药, 增强VCR和5-Fu的化疗敏感性. 洛贝林对SGC7901/VCR细胞多药耐药的逆转可能机制为抑制P-gp蛋白的表达.
引文著录: 谷苗, 李国庆, 彭昌能. 洛贝林逆转胃癌细胞SGC7901/VCR多药耐药的作用. 世界华人消化杂志 2012; 20(23): 2184-2188
Revised: January 15, 2012
Accepted: July 8, 2012
Published online: August 18, 2012
AIM: To investigate the reversal effects of lobeline on multidrug resistance (MDR) of human gastric carcinoma cell line SGC7901/VCR, and to explore the possible mechanisms involved.
METHODS: The human gastric carcinoma cell line SGC7901/VCR that had multidrug resistant phenotype was used in this study. MTT assay was used to determine the IC50 of VCR and 5-Fu for non-treated SGC7901/VCR cells and SGC7901/VCR cells treated with non-toxic concentration of lobeline (10 μmol/L). RT-PCR was used to detect MDR1 mRNA expression in non-treated SGC7901/VCR cells and SGC7901/VCR cells treated with different final concentrations (5, 10, 20, 50, 100 μmol/L) of lobeline. Western blot was used to determine intracellular P-gp protein expression.
RESULTS: Treatment with 10 μmol/L lobeline increased the chemotherapy sensitivity of SGC7901/VCR cells, and the IC50 of VCR declined from 16.55 μg/L ± 0.13 μg/L to 7.27 μg/L ± 0.65 μg/L, with a reversion index of 2.28. The IC50 of 5-Fu declined from 11.01 μg/L ± 0.43 μg/L to 9.53 μg/L ± 0.79 μg/L, and the reversion index is 1.16. RT-PCR analysis demonstrated that SGC7901/VCR cells highly expressed MDR1 mRNA, and lobeline decreased MDR1 mRNA expression in a concentration-dependent manner (P < 0.05). Western blot analysis indicated that SGC7901/VCR cells highly expressed P-glycoprotein, and lobeline decreased P-glycoprotein expression in a concentration-dependent manner (P < 0.05).
CONCLUSION: Lobeline can reverse the multidrug resistance of SGC7901/VCR cell line and increase chemotherapy sensitivity of SGC7901/VCR cell line to VCR and 5-Fu possibly via mechanism associated with inhibiting the expression of P-glycoprotein.
- Citation: Gu M, Li GQ, Peng CN. Lobelin reverses multidrug resistance of human gastric carcinoma cell line SGC7901/VCR. Shijie Huaren Xiaohua Zazhi 2012; 20(23): 2184-2188
- URL: https://www.wjgnet.com/1009-3079/full/v20/i23/2184.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i23.2184
在我国, 胃癌死亡率已居主要恶性肿瘤(胃癌、肝癌、肺癌、食管癌)死亡的首位. 胃癌的预后不佳, 其5年生存率低于20%[1]. 化疗是目前治疗恶性肿瘤的主要手段之一, 尽管新的抗癌药物和化疗方案不断推出, 但治疗效果仍不理想, 其中一个重要原因就是肿瘤对化疗药物产生耐药性, 而多药耐药性是肿瘤细胞免受化疗药物攻击最重要的细胞防御机制. 洛贝林, 是半边莲的主要组成部分, 隶属哌啶类生物碱, 别名山梗菜碱、祛痰菜碱、北美山梗菜碱, Ma等[2]研究证实用无细胞毒作用的洛贝林(10 μmol/L)作用于多药耐药结肠癌Caco-2及白血病CEM/ADR5000细胞后, P-glycoprotein(P-gp)活性的表达被抑制, 且在对阿霉素化疗的细胞中可表现出对多药耐药(multidrug resistance, MDR)有逆转作用, 其可以提高肿瘤耐药细胞株对耐药药物的化疗敏感、杀伤性. 目前洛贝林逆转胃癌多药耐药细胞株的相关研究鲜有报道, 本实验通过洛贝林干预胃癌多药耐药细胞株SGC7901/VCR, 对其不同作用下的细胞耐药作用做进一步研究, 观察其是否通过抑制P-gp的表达来逆转MDR, 初步探讨其逆转多药耐药细胞株的作用机制.
人胃癌多药耐药细胞株SGC7901/VCR由中南大学细胞中心购买, 维持在VCR终浓度为0.1 g/L的RPMI 1640培养液中连续传代培养, 实验前2 wk撤除VCR. 长春新碱(VCR: 1 mg/支)购自深圳万乐药业有限公司; 5-氟尿嘧啶(5-Fu, 0.25 g/10 mL)购自天津金耀氨基酸有限公司; 盐酸洛贝林(3 g/L)购自北京市燕京药业有限公司; 即用PCR扩增试剂盒购自瑞士Fluda; S100A6鼠抗人单克隆抗体购自Santa cruz公司; 抗鼠二抗购自武汉博士德公司; 鼠抗人P-gp单克隆抗体购自Sigma公司; DNA Marker DL 2000购自TaKaRa. 其他试剂均为进口或国产分析纯.
1.2.1 SGC7901/VCR细胞的培养: 细胞维持在VCR终浓度为0.1 g/L的RPMI 1640培养液中连续传代培养, 在37 ℃、95%饱和湿度、50 mL/L CO2培养箱中培养, 每2 d换液1次, 用0.25%的胰酶消化液消化, l:2传代1次. 于实验前2 wk撤除VCR.
1.2.2 MTT法测洛贝林逆转SGC7901/VCR的多药耐药: (1)按照VCR、5-Fu血药浓度高峰的不同倍数加入不同浓度的药物(VCR血药浓度高峰为50 mg/L, 取其0.02、0.10、0.20、0.40、0.80倍浓度; 5-Fu血药浓度高峰为10 mg/L, 取其0.1、0.5、l.0、2.0、4.0倍浓度; (2)无毒剂量的洛贝林(10 μmol/L)的浓度在Ma等[2]的文献参考下制定, MTT法具体分组方式见表1.
| 分组 | 处理因素 |
| 阴性对照组 | 不加药物的细胞悬液 |
| 空白对照组 | 不含细胞的RPMI-1640全培养液 |
| 细胞处理组 | 分别为单加倍数浓度稀释的化疗药(VCR/5-Fu)处理组 |
| 药物处理组 | 无毒剂量的洛贝林(10 μmol/L)+各组倍数浓度稀释的化疗药处理组 |
1.2.3 RT-PCR法测定洛贝林干预下SGC7901/VCR细胞MDR1 mRNA的表达: 采用Primer Premier 5.0软件设计引物, 序列见表2. 对各个实验组进行不同处理并收集各个处理组细胞, 采用TRIzol法提取RNA, 用逆转录试剂盒进行反转录, 半定量PCR进行MDR1的检测.
| 名称 | 序列 | 长度1 |
| MDR1 | 上游: 5'-CCGAACCGTTGTTTCTTTGACT-3' | 317 |
| 下游: 3'-ATAGTCGTCGGGTGTAGTAGTA-5' | ||
| GAPDH | 上游: 5'-AGGTCCACCACTGACACGTT-3' | 310 |
| 下游: 3'-TAACGACTACTAGAACTCCG-5' |
1.2.4 Western blot法测定洛贝林干预下SGC7901/VCR细胞中P-gp蛋白的表达: 对各个实验组进行不同处理并收集各个处理组细胞, 按照标准程序进行Western blot, 检测不同处理组P-gp蛋白的表达差异.
统计学处理 各组实验数据以mean±SD表示, 采用SPSS16.0统计软件进行单因素方差分析(One-Way ANOVA), 组间均数比较采用LSD检验, P<0.05认为有统计学意义.
Ma等[2]研究证明在洛贝林无毒浓度(10 μmol/L)作用下可以逆转肿瘤细胞的多药耐药. 我们分别在不同VCR、5-Fu浓度的SGC7901/VCR处理组中加入洛贝林, 使其终浓度维持在10 μmol/L, 发现同等浓度的VCR和5-Fu显示了对SGC7901/VCR的耐药性有部分逆转, 提高了细胞中化疗药物的浓度, 增加了化疗药的敏感性, VCR对的IC50由原来的16.55 mg/L±1.05 mg/L变成7.27 mg/L±0.65 mg/L, 逆转倍数约为2.28; 5-Fu对SGC7901/VCR株的IC50由原来的11.01 μg/L±0.43 μg/L变成9.53 μg/L±0.79 μg/L, 逆转倍数约为1.16. 结果显示洛贝林对VCR的逆转倍数高于对5-Fu的逆转倍数. 现研究已经证明VCR本身就是P-gp底物, 是P-gp底物转运部位的竞争性配体, 可被P-gp泵到细胞外, 而5-Fu耐药机制为部分P-gp介导. 数据提示VCR的逆转倍数大于5-Fu的逆转倍数, 又可以间接说明洛贝林的逆转机制和P-gp密切相关.
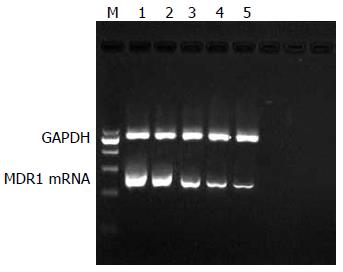
SGC7901/VCR细胞在300 bp左右的位置有清晰条带, 与预计产物大小为317 bp相符, 多药耐药细胞株SGC7901/VCR存在MDR1 mRNA的过度表达, 灰度扫描定量分析显示, SGC7901/VCR细胞MDR1 mRNA水平随着洛贝林的作用浓度增大, 其表达水平依次降低, 各组间比较存在统计学差异(P<0.05, 图1).
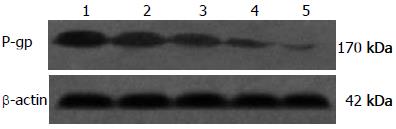
耐药细胞株存在P-gp的过度表达, 经过不同浓度的洛贝林处理组(终浓度分别为10、20、50、100 μmol/L)作用于SGC7901/VCR后检测细胞内P-gp蛋白的表达水平, 灰度扫描定量分析显示, 随着洛贝林浓度的增加P-gp的表达逐渐下调, 呈浓度依赖性降低, 与对照组、不同洛贝林浓度分组比较差异具有显著性(P<0.05, 图2).
在我国, 胃癌死亡率已居主要恶性肿瘤(胃癌、肝癌、肺癌、食管癌)死亡的首位. 胃癌的预后不佳, 其5年生存率低于20%. 研究证明, 肿瘤细胞的MDR和P-gp在肿瘤细胞膜上的过量表达有密切相关性[3-4], P-gp通过水解ATP酶获得能量, 将化疗药物及离子如Ca2+跨膜主动转运出细胞达到细胞内化疗药物浓度下降, 从而化疗作用减弱而产生耐药, 其是典型的能量依赖性"药物泵". 本实验通过RT-PCR检测, 发现在SGC7901/VCR细胞表面有MDR1 mRNA的高度表达, 并随洛贝林终作用浓度的增大, 分别表现为MDR1 mRNA的表达水平逐渐下降, 提示洛贝林逆转耐药的作用可能与下调MDR1 mRNA表达有关. 通过Western blot检测不同组别SGC7901/VCR的P-gp表达情况, 发现耐药细胞株高度表达的P-gp随各组洛贝林终作用浓度的增大而表达下降, 提示洛贝林可以抑制在MDR中起关键作用的P-gp的表达, 二者之间存在剂量依存关系, 进一步表明其逆转作用可能通过降低P-gp的表达及跨膜转运作用来逆转MDR1, 增强耐药细胞对抗肿瘤药物的敏感性, 从而逆转MDR1.
Ma等[2]通过检测P-gp特异性的荧光底物罗丹明123, 已证实在洛贝林无毒、低细胞毒浓度作用下, 耐药细胞株内罗丹明123浓度可明显增高. 说明在洛贝林存在时, 肿瘤细胞蓄积和外排罗丹明123能力下降, 通过降低P-gp的功能, 增强耐药细胞对抗肿瘤药物的敏感性, 达到逆转MDR. 国内有研究证实通过一定终浓度的洛贝林干预人结肠癌多药耐药细胞株HCT-8/VCR和人乳腺癌多药耐药细胞株MCF-7/ADM, 结果显示洛贝林可分别逆转二者的多药耐药, 且耐药细胞株内P-gp荧光底物罗丹明123的荧光强度增加, 说明其抑制了P-gp的外排[5,6].
目前, 研究中成药制剂对肿瘤细胞生物学的影响主要从细胞毒作用、诱导肿瘤细胞凋亡、逆转多药耐药、提高机体免疫力等方面研究. 高永琳等[7]报道, 半边莲作用于Hela细胞时, 其对细胞增殖的直接抑制作用不明显, 但其可以通过细胞外钙离子的内流来增加细胞内游离钙的浓度来诱导细胞凋亡, 并在其他对诱导肝癌细胞凋亡的实验中得到证实[8]. 细胞内钙耗竭是一种细胞凋亡信号, 通过内质网的DNase Ⅰ和核骨架蛋白酶库等进入近核区或引起生物小分子的释放, 促使细胞外钙离子的内流而达到诱导凋亡的目的[9]. 而洛贝林属于半边莲植物的哌啶生物碱, 我们通过半边莲的作用机制, 推论洛贝林除了抑制P-gp的表达外, 还可能通过一系列未知后续反应来增加细胞内钙离子的浓度来诱导肿瘤细胞的凋亡.
细胞内游离钙离子的浓度改变也是多种受体激活后信号传递过程的中心环节, 特别是对MDR1和P-gp的表达和细胞生物学功能[10,11]. Belpomme等[11]报道, 钙通道阻滞剂维拉帕米可以逆转P-gp介导的MDR, 增加肿瘤细胞内化疗药物的浓度及敏感性, 延长患者的生存期, 主要就是其降低细胞内游离钙离子浓度.
蛋白激酶C(protein kinase C, PKC)是钙离子的重要靶蛋白, 在与钙结合后, PKC被激活, 发生磷酸化, 研究表明[12-14]其在多种表达MDR的肿瘤细胞中活性提高, 提示与P-gp、MDR密切相关, 且增强PKC在细胞中的表达可诱导肿瘤细胞对化疗药物的耐受[15], 其机制可能跟PKC对P-gp转运功能及调节有关[16], 可见PKC与MDR关系密切相关.
洛贝林通过抑制P-gp的表达后, 是否通过调节细胞内基础钙的水平从而导致PKC功能下降? 是否是钙信号和PKC等上游信号从而引起下游因素功能的改变, 进而导致逆转多药细胞的耐药? 而要提高细胞内钙离子浓度是通过激活细胞膜上的钙离子通道, 从而使细胞外的钙离子内流, 还是将细胞内的钙离子释放出来, 洛贝林是哪种途径占优势? 洛贝林是否是BCRP和P-gp全部或者部分的作用底物? 其主次、机制、平衡如何?这些我们都要进一步证实.
半边莲, 桔梗科植物, 主要化学成分含生物碱、黄酮甙、皂甙和氨基酸等, 国内有学者证实其对胃癌细胞有抑制作用. 洛贝林, 是半边莲的主要组成部分, 隶属哌啶类生物碱, 别名山梗菜碱、祛痰菜碱、北美山梗菜碱.
傅春彬, 主任医师, 吉化集团公司总医院一院消化内科
研究证实, 一定浓度的洛贝林可逆转人结肠癌和人乳腺癌多药耐药细胞株的多药耐药,但目前洛贝林逆转胃癌多药耐药细胞株的相关研究鲜有报道.
Ma等研究证实, 用无细胞毒作用的洛贝林(10 μmol/L)作用于多药耐药结肠癌Caco-2及白血病CEM/ADR5000细胞后, P-gp活性的表达被抑制, 且在对阿霉素化疗的细胞中可以表现出对MDR有逆转作用, 其可以提高肿瘤耐药细胞株对耐药药物的化疗敏感、杀伤性.
本研究证明无细胞毒浓度的洛贝林可以抑制P-gp的表达, 从而逆转其SGC7901/VCR的多药耐药, 具有一定的科研价值和临床意义.
编辑: 张姗姗 电编:鲁亚静
| 1. | 孙 秀娣, 牧 人, 周 有尚, 戴 旭东, 张 思维, 皇甫 小梅, 孙 杰, 李 连弟, 鲁 凤珠, 乔 友林. 中国胃癌死亡率20年变化情况分析及其发展趋势预测. 中华肿瘤杂志. 2004;26:4-9. |
| 2. | Ma Y, Wink M. Lobeline, a piperidine alkaloid from Lobelia can reverse P-gp dependent multidrug resistance in tumor cells. Phytomedicine. 2008;15:754-758. [PubMed] [DOI] |
| 3. | Loo TW, Clarke DM. Location of the rhodamine-binding site in the human multidrug resistance P-glycoprotein. J Biol Chem. 2002;277:44332-44338. [PubMed] [DOI] |
| 4. | Kim IJ, Bae YT, Kim SJ, Kim YK, Kim DS, Lee JS. Determination and prediction of P-glycoprotein and multidrug-resistance-related protein expression in breast cancer with double-phase technetium-99m sestamibi scintimammography. Visual and quantitative analyses. Oncology. 2006;70:403-410. [PubMed] [DOI] |
| 6. | 陈 嘉, 申 良方, 周 蓉蓉, 姚 蔚, 钟 美佐, 朱 虹, 曾 珊. 洛贝林逆转人乳腺癌细胞MCF-7/ADM耐药作用及其机制. 中南大学学报(医学版). 2009;34:738-743. |
| 9. | Smit MJ, Leurs R, Bloemers SM, Tertoolen LG, Bast A, De Laat SW, Timmerman H. Extracellular ATP elevates cytoplasmatic free Ca2+ in HeLa cells by the interaction with a 5'-nucleotide receptor. Eur J Pharmacol. 1993;247:223-226. [PubMed] [DOI] |
| 10. | Stradal TB, Gimona M. Ca(2+)-dependent association of S100A6 (Calcyclin) with the plasma membrane and the nuclear envelope. J Biol Chem. 1999;274:31593-31596. [PubMed] [DOI] |
| 11. | Belpomme D, Gauthier S, Pujade-Lauraine E, Facchini T, Goudier MJ, Krakowski I, Netter-Pinon G, Frenay M, Gousset C, Marié FN. Verapamil increases the survival of patients with anthracycline-resistant metastatic breast carcinoma. Ann Oncol. 2000;11:1471-1476. [PubMed] [DOI] |
| 12. | Drew L, Groome N, Hallam TJ, Warr JR, Rumsby MG. Changes in protein kinase C subspecies protein expression and activity in a series of multidrug-resistant human KB carcinoma cell lines. Oncol Res. 1994;6:429-438. [PubMed] |
| 13. | Hu YP, Robert J. Inhibition of protein kinase C in multidrug-resistant cells by modulators of multidrug resistance. J Cancer Res Clin Oncol. 1997;123:201-210. [PubMed] [DOI] |
| 14. | Budworth J, Gant TW, Gescher A. Co-ordinate loss of protein kinase C and multidrug resistance gene expression in revertant MCF-7/Adr breast carcinoma cells. Br J Cancer. 1997;75:1330-1335. [PubMed] [DOI] |
| 15. | Bond TD, Valverde MA, Higgins CF. Protein kinase C phosphorylation disengages human and mouse-1a P-glycoproteins from influencing the rate of activation of swelling-activated chloride currents. J Physiol. 1998;508:333-340. [PubMed] [DOI] |
| 16. | Yuan YW, Sun AM, Li CG. Correlation of multidrug resistance with up-regulation of protein kinase C expression in KBV200 cells. Diyi Junyi Daxue Xuebao. 2005;25:1341-1343, 1356. [PubMed] |