修回日期: 2012-06-14
接受日期: 2012-06-30
在线出版日期: 2012-07-28
目的: 制作大鼠重症急性胰腺炎(severe acute pancreatitis, SAP)模型, 检测不同时间点趋化因子CXCL11及其受体CXCR3在SAP肺组织中的动态变化, 探讨他们在SAP肺功能损害过程中的作用.
方法: 48只SD大鼠, 雌雄不限, 随机分为2组: 对照组(C组), SAP组(P组), 每组24只. 4%牛黄胆酸钠逆行胰胆管注射建立SAP大鼠模型, 剂量为1 mL/kg, C组打开腹腔后仅仅翻动胰腺组织数次. 每组随机分为4个亚组, 每个亚组6只. 4个组分别在1、3、6、12 h抽血、处死, 留取组织标本. 分别检测各不同时间点组的血清淀粉酶、肺湿干重比, 胰腺组织、肺组织病理, 免疫组织化学法检测肺CXCL11及CXCR3的表达, 酶联免疫吸附试验(ELISA)检测血清中的CXCL11的水平.
结果: P组各亚组血清淀粉酶值明显升高(P<0.01 vs C组); 肺湿干重比值: P组3、6、
12 h组较C组明显升高(P<0.05); 胰腺组织、肺组织病理: 3、6、12 h P组肺组织损伤明显; 免疫组织化学显示P组CXCL11与CXCR3蛋白表达较C组表达明显增强(P<0.05), ELISA显示: 1、3、6、12 h P组血清CXCL11蛋白较C组明显增高(P<0.01).
结论: CXCL11/CXCR3可能参与大鼠SAP急性肺功能损害的发病过程.
引文著录: 吴兴, 张海峰, 丁晓凌, 强晖, 曹维, 周国雄. 趋化因子CXCL11及其受体CXCR3在重症急性胰腺炎相关肺损害中的作用. 世界华人消化杂志 2012; 20(21): 1967-1972
Revised: June 14, 2012
Accepted: June 30, 2012
Published online: July 28, 2012
AIM: To investigate the expression of chemokine CXCL11 and its receptor CXCR3 in acute lung injury associated with severe acute pancreatitis (SAP).
METHODS: Forty-eight SD rats were randomly and equally divided into two groups: control group and SAP group. SAP was induced in rats of the SAP group by retrograde injection of 4% sodium taurocholate into the bili-pancreatic duct. Each group was further randomly and equally divided into four subgroups for testing at different time points. The rats were randomly selected to be executed at 1, 3, 6, and 12 h after induction of SAP. Serum amylase, wet/dry weight ratio of the lung, and histological changes of the lung were measured. Expression of CXCL11 and CXCR3 proteins in the lung was detected by immunohistochemistry. Serum levels of CXCL11 were measured by enzyme-linked immunosorbent assay (ELISA).
RESULTS: Serum amylase was significantly higher in the SAP group than in the control group (P < 0.01). The lung wet/dry weight ratio was significantly higher at 3, 6, and 12 h in the SAP group than in the control group (all P < 0.05). The expression of CXCL11 and CXCR3 in the lung (all P < 0.05) and serum levels of CXCL11 at various time points (all P < 0.01) were significantly higher in the SAP group than in the control group (all P < 0.05).
CONCLUSION: CXCL11 and CXCR3 may play important roles in the pathogenesis of acute lung injury in SAP.
- Citation: Wu X, Zhang HF, Ding XL, Qiang H, Cao W, Zhou GX. Expression of CXCL11 and CXCR3 in acute lung injury associated with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2012; 20(21): 1967-1972
- URL: https://www.wjgnet.com/1009-3079/full/v20/i21/1967.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i21.1967
重症急性胰腺炎(severe acute pancreatitis, SAP)病情重, 可出现全身炎症反应综合征(systemic inflammatory respone sydrome, SIRS), 常累及肝、肺、肾、肠、胃等器官, 导致多器官损害, 而肺脏是最常受累的胰外器官之一. SAP患者大约60%伴有肺损伤或急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)[1]. 目前对于SAP合并肺损伤(acute lung injury, ALI)的机制仍不确切. Rinderknecht等[2]首次提出异常激活的胰酶在造成胰腺组织损伤的过程中, 产生一系列炎性介质, 这些炎症介质进入血液和淋巴管, 继而进入全身, 激活其他组织的炎性细胞, 进一步释放大量的炎性介质, 从而产生SIRS, 甚至多器官功能障碍综合征包括急性肺功能受损. 可见, 在AP形成与发展过程中, 炎性细胞的浸润与活化起着关键作用, 而炎性细胞的浸润与活化需要趋化因子的参与.
有研究表明在慢性胰腺炎中CXCL11及CXCR3表达有明显增加, 但在SAP中CXCL11是否参与及机制尚不清楚. 本实验通过制作SAP大鼠模型, 检测肺组织中CXCL11、CXCR3的表达情况, 探讨CXCL11及CXCR3在SAP急性肺损伤中的作用, 为临床早期判断SAP肺功能损伤的严重程度提供一个新指标, 为今后临床工作中SAP肺功能损伤的治疗方案提供新的理论依据.
健康SD大鼠, 清洁级, 雌雄不限, 体质量220 g±20 g, 由南通大学实验动物中心提供;牛磺胆酸钠(T86339-1G)购自美国Sigma公司; 兔抗鼠CXCL11抗体(1:100)、兔抗鼠CXCR3抗体(1:50)、ABC免疫组织化学试剂盒、大鼠CXCL11 ELISA试剂盒购自上海劲马生物公司.
1.2.1 动物模型的建立及实验分组: 48只健康SD大鼠随机分成2组: 对照组(C组)、SAP组(P组), 每组24只大鼠. 每组再随机分成4个亚组, 每个亚组6只大鼠. 参照Lankisch等[3]和苗明等[4]的方法经改良制作而成. 大鼠术前禁食12 h, 不禁水, 用10%水合氯醛(300 mg/kg体质量)腹腔内注射麻醉、备皮, 腹部皮肤消毒, 正中切口进腹, 胆胰管十二指肠开口处予无损伤金属夹夹闭, 注射器针头向十二指肠开口方向插入胆胰管, 以0.1 mL/min的速度向胆胰管内注射4%牛磺胆酸钠, 剂量为1 mL/kg, 5 min后拔除注射针, 松开金属夹, 缝合关腹. C组仅翻动胰腺2次后关腹. 各组分别随机选取6只大鼠于1、3、6、12 h予以抽血处死, 取材检测有关指标.
1.2.2 淀粉酶测定: 采用碘-淀粉比色法, 操作按照试剂提供商的说明书进行, 用深圳迈瑞半自动生化分析仪测定.
1.2.3 肺湿干重比测定: 取大鼠的右肺组织, 拭去血迹后称重, 所得数量为湿重; 将肺组织放入60 ℃烤箱内72 h, 取出称重, 所得数量为干重. 肺湿干重比为肺湿重/肺干重, 反映肺组织水肿程度.
1.2.4 病理组织学检测: 胰腺组织、肺组织经HE染色后, 由2位专业的病理医师双盲阅片, 每组随机取3张切片, 每张切片随机选取10个高倍镜视野, 以水肿、中性粒细胞浸润、出血、细胞坏死来评价胰腺组织、肺组织损伤的程度.
1.2.5 免疫组织化学检测: 切片常规脱蜡至水, 高温高压组织抗原修复, CXCL11、CXCR3抗体按1:200稀释, 常规脱蜡、水化、微波恢复抗原, 最后经DAB显色, 常规复染封片. 用试剂公司提供的阳性切片作为阳性对照, 以PBS代替一抗作为阴性对照, 结果用彩色病理图像分析系统采集图像. 所有免疫组织化学染色结果均由2位病理医生在双盲条件下完成, 在高倍镜(×400)下检测, 以细胞浆、核膜或胞膜呈现棕黄色颗粒为阳性细胞, 每张切片随机观察10个不同视野, 计数阳性细胞占所有细胞的百分数. 按阳性细胞数<5%为(-), 5%-10%为(+), 11%-50%为(++), >50%为(+++)进行数据统计.
1.2.6 酶联免疫吸附试验检测: 采用双抗体夹心法测定大鼠CXCL11水平, 即将抗大鼠CXCL11单抗包被于酶标板上, 标准品和大鼠血清标本中的CXCL11与单抗结合, 加入生物素化的抗大鼠CXCL11抗体, 形成免疫复合物连接在酶标板上, 辣根过氧化物酶标记的链霉卵白素与生物素结合, 加入酶底物, 出现黄色, 加终止液硫酸终止反应, 颜色变深. 测出吸光度(A)值, CXCL11质量浓度与其A值呈正比, 绘制标准曲线, 然后再求出大鼠血清标本中CXCL11的质量浓度.
统计学处理 实验数据采用mean±SD表示, 采用SPSS13.0统计软件处理. 采用单因素方差分析对各组均数进行比较, P<0.05具有显著性差异.
1、3、6、12 h时间点的P组血淀粉酶与C组比较均明显升高, 有统计学意义(P<0.01, 表1).
3、6、12 h时间点的P组与C组相比, 肺湿干重比明显升高, 有统计学意义(P<0.05, 表2).
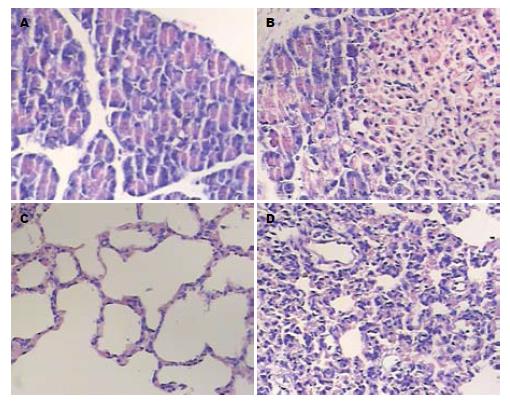
胰腺组织: C组胰腺、胰周脂肪组织、网膜均无异常, 胰腺粉红色有弹性, 无腹水. P组6 h后肉眼可见大量血性腹水, 胰腺水肿, 有出血灶、坏死, 呈深棕红色, 胰周及网膜可见皂化斑, 与周围组织黏连(图1A, B). 胰腺组织的病理积分: 1、3、6、12 h时间点的P组与C组相比明显升高, 有统计学意义(P<0.05, 表3).
肺组织: C组各时间点肺组织病理未见肺间质水肿、肺泡细胞坏死, 未也见肺泡出血、肺泡间质炎性细胞浸润. 大体标本粉红色, 无出血, 富有弹性. 光镜下见肺泡结构清晰, 肺泡壁薄, 肺泡内未见红细胞及渗出液. P组1 h组标本未见明显变化, 亦无间质水肿; 3 h组可见肺间质水肿, 有少量炎细胞浸润, 亦可见少量坏死; 6 h组和12 h组大体标本失去弹性, 颜色灰暗, 可见胸水, 镜下见肺间质水肿, 肺泡结构紊乱, 肺泡内见红细胞, 大量肺泡细胞坏死, 有大量炎性细胞浸润(图1C, D). 肺组织的病理积分: 1、3、6、12 h时间点的P组与C组相比明显升高, 有统计学意义(P<0.05, 表4).
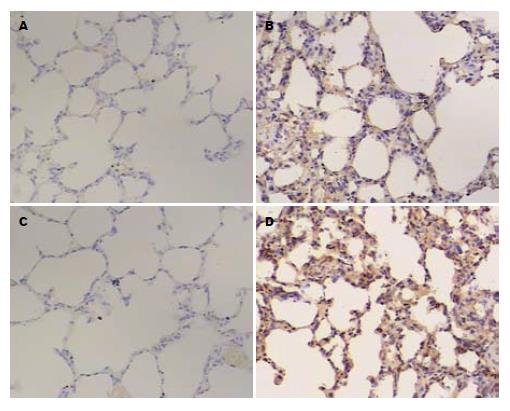
C组大鼠各时间点肺组织免疫组织化学染色未见CXCL11蛋白的阳性表达, 细胞着淡蓝色, 未见炎性细胞浸润, 未见阳性表达细胞. P组术后3、6、12 h组可见CXCL11蛋白的阳性表达, 着色加深, 可见深棕色染色, 表达面积增加; 与C相比, 差异具有统计学意义(P<0.05, 图2A, B).
C组各时间点CXCR3蛋白的表达不明显, 偶见单个核细胞表达CXCR3, 着色较浅. P组3、6、12 h时间点的CXCR3表达明显增强, 细胞着色明显加深呈棕黄色, 与C组相比, 差异具有统计学意义(P<0.05, 图2C, D).
急性肺功能损伤是AP常见并发症, 多种机制参与其发生, 其确切的发生率尚未确定. 趋化因子及其受体在急性肺功能损伤发病中的作用已经成为研究急性肺功能损伤病因、发病机制及诊疗的热点问题[5,6]. 趋化因子是一类控制细胞定向迁移的因子, 其功能的行使有赖于趋化因子及其受体的介导. 二者之间相互作用具有交叉性, 一种趋化因子能与多个趋化因子受体结合, 一种趋化因子受体也可有几个高亲和性配体, 趋化因子与趋化因子受体结合后具有广泛的生物学功能, 影响多种生理和病理过程. 趋化因子相互作用控制着各种免疫细胞的定向迁移, 使免疫细胞到达感染、创伤和细胞异常增殖的部位, 执行清除感染、促进创伤癒合和消灭异常增殖细胞, 维持组织细胞的平衡等功能. 趋化因子及其受体的表达和功能异常, 将导致免疫细胞不能在正确的位置行使正确的功能. 多个研究表明趋化因子在AP以及伴发的急性肺功能损伤中扮演了重要角色, 如白介素8(interleukin-8, IL-8)、单核细胞趋化蛋白-1、生长相关原癌基因、正常T细胞表达和分泌的活化调节蛋白等[7-13].
CXCL11是其中非ELR类趋化因子, 主要表达在正常个体胸腺、脾、肺、胰腺等器官或组织的星形胶质细胞、支气管内皮细胞、血管内皮细胞等[14], 正常情况其表达量较少. 干扰素-γ(interferon-γ, IFN-γ)是其强烈诱导剂, 肿瘤坏死因子(tumor necrosis factor, TNF)、脂多糖(lipopolysaccharide, LPS)、IL-1与其有协同作用. CXCR3是CXCL11的受体, 有7个含疏水氨基酸的α螺旋穿膜结构, 经异源三聚体G蛋白传递信号, 属视紫红质样G蛋白偶联受体超家族. CXCR3主要表达在T细胞上, 而且Th1>Th2, 其配体有CXCL9、CXCL10与CXCL11, 其中CXCL11与其结合最牢固, 且可阻断另2个配体的结合[15,16]. CXCL11-CXCR3在炎症、感染、肿瘤、应激、自身免疫、变态反应、移植排斥反应、艾滋病(AIDS)、淋巴细胞归巢以及新生血管形成等众多病理生理的发生发展过程中均有参与[17,18]. 在炎症、感染等条件下, IFN刺激血管内皮细胞等产生CXCL11, 后者刺激活化的T细胞迁移, 同时产生IFN等细胞因子, 形成正反馈回路.
有资料表明, CXCL11-CXCR3系统的细胞趋化作用是免疫炎症反应的一个重要环节[19,20]. 本次实验结果显示CXCL11的变化符合胰腺炎病程及免疫学变化, 对照组CXCL11蛋白在血清中的表达也很少, 肺组织免疫组织化学显示CXCR3及CXCL11也很少表达, 该组大鼠肺组织结构正常, 血清淀粉酶正常. 而模型组肺组织免疫组织化学显示CXCR3及CXCL11表达明显增强, 血清CXCL11表达也增加, 并逐渐升高, 且与肺组织的病理损伤呈正比, 统计学处理示存在明显差异. 上述结果提示, CXCL11可能是AP早期的炎症介质, 参与了AP早期的急性炎症反应过程, 可能在SAP早期的急性肺功能损伤中起到了重要的作用. 检测CXCL11蛋白的动态变化, 或许可以帮助判断AP早期急性肺功能损伤的发生.
总之, 本实验显示在SAP早期, CXCL11-CXCR3参与了胰腺炎急性肺损害过程, 增加其病理损伤.
重症急性胰腺炎(SAP)易出现全身炎症反应综合征(SIRS), 可导致多器官损害, 而肺脏是最常受累的胰外器官之一, 出现肺功能损害其死亡率明显升高.
夏时海, 副教授, 副主任医师, 中国人民解放军武警后勤学院附属医院肝胆胰脾科(中心)
多项研究表明多种炎症趋化因子参与了SAP急性肺功能受损的发生、发展过程,但在SAP中CXCL11是否参与及其机制尚不清楚.
研究表明趋化因子在AP以及伴发的急性肺功能损伤中扮演了重要角色, 如白介素8(IL-8)、单核细胞趋化蛋白-1、生长相关原癌基因、正常T细胞表达和分泌的活化调节蛋白等.
研究SAP肺组织中CXCL11、CXCR3的表达情况, 探讨CXCL11及CXCR3对SAP急性肺损伤发生、发展的影响, 为临床工作提供新的理论依据.
本文有一定的创新性, 并能为今后临床工作中SAP肺功能损伤的治疗方案提供新的理论依据, 具有一定的应用价值.
编辑: 张姗姗 电编:鲁亚静
| 1. | Surbatović M, Jovanović K, Radaković S, Filipović N. [Pathophysiological aspects of severe acute pancreatitis-associated lung injury]. Srp Arh Celok Lek. 2005;133:76-81. [PubMed] [DOI] |
| 2. | Rinderknecht H. Fatal pancreatitis, a consequence of excessive leukocyte stimulation? Int J Pancreatol. 1988;3:105-112. [PubMed] |
| 3. | Lankisch PG, Ihse I. Bile-induced acute experimental pancreatitis. Scand J Gastroenterol. 1987;22:257-260. [PubMed] [DOI] |
| 4. | 苗 明, 朱 飞鹏. 常用医药动物模型. 北京: 人民卫生出版社 2007; 143-144. |
| 7. | Brady M, Bhatia M, Christmas S, Boyd MT, Neoptolemos JP, Slavin J. Expression of the chemokines MCP-1/JE and cytokine-induced neutrophil chemoattractant in early acute pancreatitis. Pancreas. 2002;25:260-269. [PubMed] [DOI] |
| 8. | Shokuhi S, Bhatia M, Christmas S, Sutton R, Neoptolemos JP, Slavin J. Levels of the chemokines growth-related oncogene alpha and epithelial neutrophil-activating protein 78 are raised in patients with severe acute pancreatitis. Br J Surg. 2002;89:566-572. [PubMed] [DOI] |
| 9. | Rau B, Baumgart K, Krüger CM, Schilling M, Beger HG. CC-chemokine activation in acute pancreatitis: enhanced release of monocyte chemoattractant protein-1 in patients with local and systemic complications. Intensive Care Med. 2003;29:622-629. [PubMed] |
| 10. | Bhatia M, Brady M, Zagorski J, Christmas SE, Campbell F, Neoptolemos JP, Slavin J. Treatment with neutralising antibody against cytokine induced neutrophil chemoattractant (CINC) protects rats against acute pancreatitis associated lung injury. Gut. 2000;47:838-844. [PubMed] [DOI] |
| 11. | Bhatia M, Hegde A. Treatment with antileukinate, a CXCR2 chemokine receptor antagonist, protects mice against acute pancreatitis and associated lung injury. Regul Pept. 2007;138:40-48. [PubMed] [DOI] |
| 12. | Osman MO, Kristensen JU, Jacobsen NO, Lausten SB, Deleuran B, Deleuran M, Gesser B, Matsushima K, Larsen CG, Jensen SL. A monoclonal anti-interleukin 8 antibody (WS-4) inhibits cytokine response and acute lung injury in experimental severe acute necrotising pancreatitis in rabbits. Gut. 1998;43:232-239. [PubMed] [DOI] |
| 13. | Zhou GX, Zhu XJ, Ding XL, Zhang H, Chen JP, Qiang H, Zhang HF, Wei Q. Protective effects of MCP-1 inhibitor on a rat model of severe acute pancreatitis. Hepatobiliary Pancreat Dis Int. 2010;9:201-207. [PubMed] |
| 15. | Clark-Lewis I, Mattioli I, Gong JH, Loetscher P. Structure-function relationship between the human chemokine receptor CXCR3 and its ligands. J Biol Chem. 2003;278:289-295. [PubMed] [DOI] |
| 16. | Liu L, Callahan MK, Huang D, Ransohoff RM. Chemokine receptor CXCR3: an unexpected enigma. Curr Top Dev Biol. 2005;68:149-181. [PubMed] [DOI] |
| 17. | Petrai I, Rombouts K, Lasagni L, Annunziato F, Cosmi L, Romanelli RG, Sagrinati C, Mazzinghi B, Pinzani M, Romagnani S. Activation of p38(MAPK) mediates the angiostatic effect of the chemokine receptor CXCR3-B. Int J Biochem Cell Biol. 2008;40:1764-1774. [PubMed] [DOI] |
| 19. | 陈 晓理, 黄 兴兰, 吴 浩, 吴 晓娟. 常用免疫抑制剂对急性胰腺炎免疫异常的调节作用. 中国普外基础与临床杂志. 2002;9:384-387. |
| 20. | Müller M, Carter S, Hofer MJ, Campbell IL. Review: The chemokine receptor CXCR3 and its ligands CXCL9, CXCL10 and CXCL11 in neuroimmunity--a tale of conflict and conundrum. Neuropathol Appl Neurobiol. 2010;36:368-387. [PubMed] [DOI] |