修回日期: 2012-06-07
接受日期: 2012-06-30
在线出版日期: 2012-07-28
目的: 探讨清热化瘀中药对急性肝衰竭(acute liver failure, ALF)模型大鼠肝功能及生存期的影响.
方法: 采用D-氨基半乳糖(D-GalN)单次腹腔注射构建ALF大鼠模型, 125只SD大鼠以是否接受造模和药物干预随机分为空白组、模型组、复方甘草酸苷组和清热化瘀中药组; 每组再以36、96 h两个时间点继续随机分为1、2两个亚组, 共8组, 其中亚组1用于造模后36 h取血及肝组织标本, 亚组2用于观察96 h内大鼠的生存率. 以全自动生化分析法检测血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)、门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、总胆红素(total bilirubin, TBIL)、白蛋白(albumin, ALB)和胆碱酯酶(cholinesterase, CHE), 全自动血凝分析法检测血浆凝血酶原时间(prothrombin time, PT), 常规HE染色作肝组织病理学观察.
结果: 模型组、复方甘草酸苷组及清热化瘀中药组估计平均生存时间分别为64.6、71.9、83.3 h; log-rank检验提示清热化瘀中药组累积生存率高于模型组(χ2 = 4.428, P<0.05). 与模型组相比, 空白组、清热化瘀中药组和复方甘草酸苷组血清ALT、AST、TBIL及血浆PT水平均显著下降(P<0.01), 清热化瘀中药组低于复方甘草酸苷组(P<0.01). 与模型组相比, 空白组、清热化瘀中药组和复方甘草酸苷组在血清ALB和CHE水平均明显升高(P<0.01), 清热化瘀中药组高于复方甘草酸苷组(P<0.01). 与模型组相比, 清热化瘀中药组和复方甘草酸苷组肝组织损伤程度积分明显下降(1.84±0.13, 2.85±0.20 vs 3.56±0.24, 均P<0.01), 清热化瘀中药组低于复方甘草酸苷组(P<0.01).
结论: 清热化瘀中药可显著减轻D-GalN诱导急性肝衰竭大鼠肝细胞的损伤, 改善肝功能及肝脏病理并降低ALF模型大鼠的病死率、延长生存期, 对ALF患者有潜在的临床应用价值.
引文著录: 张扬, 扈晓宇, 骆建兴, 陈果, 高舒迪. 清热化瘀中药对急性肝衰竭模型大鼠肝功能及生存期的影响. 世界华人消化杂志 2012; 20(21): 1961-1966
Revised: June 7, 2012
Accepted: June 30, 2012
Published online: July 28, 2012
AIM: To investigate the effect of herbs for clearing heat and resolving stasis on liver function and survival in rats with acute liver failure (ALF).
METHODS: Rats were intraperitoneally injected with D-GalN (1.4 g/kg) to induce ALF. One hundred and twenty-five SD rats were randomly divided into four group: normal group, model group, Stronger Neo-Minophagen C (SNMC) group, and Qingre Huayu herbs group according to whether or not to undergo ALF induction and interventional drugs. Each group was further randomly divided into two subgroups for testing at different time points. One subgroup was used to collect blood and liver tissue samples, while the other was applied to observe the survival of rats 96 h after ALF induction. Serum alanine aminotransferase (ALT), aspartate aminotransferase (AST), total bilirubin (TBIL), albumin(ALB), cholinesterase (CHE) and plasma prothrombin time (PT) were measured, and hepatic histopathological changes were observed by microscopy after HE staining.
RESULTS: After 96-hour treatment, mean survival time of rats in the three groups were 64.6, 71.9, and 83.3 h, respectively. The cumulative survival rate of rats in the Qingre Huayu herbs group was higher than that of rats in the model group (χ2 = 4.428, P < 0.05). Compared to the model group, the levels of serum ALT, AST, TBIL and plasma PT were remarkably reduced in the normal group, Qingre Huayu herbs group, and SNMC group (all P < 0.01). The levels of serum ALT, AST, TBIL and plasma PT were significantly lower in the Qingre Huayu herbs group than in the SNMC group (all P < 0.01). Compared to the model group, liver pathological score was significantly lower in the Qingre Huayu herbs group and SNMC group (1.84 ± 0.13, 2.85 ± 0.20 vs 3.56 ± 0.24, both P < 0.01), and in the Qingre Huayu herbs group than in the SNMC group (P < 0.01). In contrast, the levels of serum ALB and CHE were significantly higher in the normal group, Qingre Huayu herbs group, and SNMC group (all P < 0.01) than in the model group, and in the Qingre Huayu herbs group than in the SNMC group (P < 0.01).
CONCLUSION: Qingre Huayu herbs can significantly relieve liver cell's damage, improve liver function and liver pathology, reduce mortality, extend survival time in D-GalN-induced acute liver failure rats, which indicated its potential use in patients with ALF.
- Citation: Zhang Y, Hu XY, Luo JX, Chen G, Gao SD. Effect of herbs for clearing heat and resolving stasis on liver function and survival in rats with acute liver failure. Shijie Huaren Xiaohua Zazhi 2012; 20(21): 1961-1966
- URL: https://www.wjgnet.com/1009-3079/full/v20/i21/1961.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i21.1961
急性肝衰竭(acute liver failure, ALF)是由多种原因引起的肝脏代谢及免疫功能急骤丧失, 出现以肝性脑病、凝血障碍等为特征的一种暴发性、严重的临床综合征, 部分可进展为多脏器功能衰竭, 未经肝移植者死亡率往往超过90%[1]. 近年来, 随着人工肝支持系统为基础的内科综合治疗的不断进步, 临床疗效有所提高, 但总体病死率仍高达40%[2], 所以寻找一种切实可靠的干预方法, 具有重要的临床价值. 本单位2007-09/2010-01应用前瞻性、队列研究方法, 对清热化瘀中药复方"清肝方"治疗ALF的临床疗效进行了初步验证[3]. 为进一步明确其作用环节, 本研究构建D-氨基半乳糖(D-GalN)诱导的大鼠ALF模型, 观察其对ALF模型大鼠肝功指标、凝血指标、肝脏病理及生存期等的影响.
SD大鼠(共125只, ♀, 体质量180 g±20 g, 清洁级), 购自成都中医药大学实验动物中心[合格证号为SCXK(川)2008-011]; D-GalN购自上海弘邦医药科技有限公司(批号: HB-S0009-20111202); 复方甘草酸苷片(商品名: 美能, 25 mg/片×100片/盒)购自日本米诺发源制药株式会社(批号: 10111), 用前加蒸馏水稀释为1.56 g/L; 清热化瘀中药复方(茵陈-败酱草-黄芩-虎杖-生大黄-赤芍: 2:4:4:4:1:4)购自成都中医药大学附属医院药局, 经成都中医药大学药学院中药鉴定教研室严铸云教授鉴定为正品药材后, 水煎、过滤、浓缩至2.97 g生药/mL, 4 ℃保存备用; ALT、AST检测试剂盒购自中生北控生物科技股份有限公司(批号: 110401); TBIL检测试剂盒购自四川迈克生物科技股份有限公司(批号: 0911051); ALB检测试剂盒购自四川迈克生物科技股份有限公司(批号: 1211051); CHE检测试剂盒购自宁波美康生物科技有限公司(批号: 20120209); PT检测试剂盒购自美国STAGO公司(批号: STA-NEOCIPLUS107206); BCD-236H型-70 ℃电冰箱(中国海尔集团有限公司); KDC-2046型低速冷冻离心机(科大创新股份有限公司); 7170A型全自动生化分析仪(日本日立公司); STA-EVOLUTION型全自动血凝分析仪(法国STAGO公司); Z7-12P2型组织脱水机(孝感亚光医用电子技术有限公司); RM2245型组织切片机(德国LEICA公司); BMJ-Ⅲ型组织包埋机和PHY-Ⅲ型摊片机/烘片机(常州中威电子仪器厂).
1.2.1 D-GalN造模剂量的筛选及动物模型的构建: 分别以D-GalN 1.2、1.4、1.6、1.8 g/kg单次腹腔注射进行建模预实验, 根据动物死亡率、肝脏病理、肝功能损害及相关文献[4,5], 确定1.4 g/kg为建模最佳剂量. 建模前12 h禁食, 以D-GalN 1.4 g/kg单次腹腔注射建立大鼠ALF模型. 建模后正常饮水、进食.
1.2.2 动物分组及给药: 125只SD大鼠随机分为空白组、模型组、复方甘草酸苷组和清热化瘀中药组, 每组再以36、96 h两个时间点继续随机分为1、2两个亚组, 共8组. 其中空白组中的两个亚组各有10只, 其他各组中的亚组1、2各有20、15只.
所有给药剂量均为《医用实验动物学》"动物与人体的每公斤体重剂量折算系数表"[6]折算出的大鼠等效剂量. 给药如下: 清热化瘀中药组: 每只大鼠给予10 mL/(kg·d)"清肝方"灌胃, 每毫升含药2.97 g; 复方甘草酸苷组: 每只大鼠给予10 mL/(kg·d)"美能"灌胃, 每毫升含药1.56 mg; 空白组与模型组给予10 mL/(kg·d)灭菌蒸馏水灌胃. 从造模前的第3天起定时灌胃, 1次/d.
1.2.3 标本采集及处理: 动物处死前12 h, 禁食不禁水. D-GalN造模36 h后, 取亚组1存活大鼠, 经股动脉取血6 mL, 其中4 mL置于干燥管中, 另2 mL置于枸橼酸钠抗凝管中, 由成都中医药大学附属医院检验科分离血清作肝功能和凝血功能检测. 断颈处死动物后, 沿腹正中线剖开皮肤, 分离出肝组织, 取肝左叶相同部位(1.0 cm×1.0 cm×0.2 cm)存放于10%中性福尔马林液固定, 送成都里来生物医学实验中心作常规HE染色. 亚组2大鼠用于造模后96 h生存率的统计.
1.2.4 观察指标及检测: (1)一般情况: 观察造模96 h内各组大鼠行为学变化; (2)生存率: 以腹腔注射的时间为标准点, 观察各组大鼠造模后96 h的存活情况, 并记录其生存时间; (3)肝功能检测: 血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)、门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、总胆红素(total bilirubin, TBIL)、白蛋白(albumin, ALB)和胆碱酯酶(cholinesterase, CHE)测定用全自动生化分析法; (4)凝血功能检测: 血浆凝血酶原时间(prothrombin time, PT)测定用全自动血凝分析法; (5)肝脏病理组织学观察: 常规脱水石蜡包埋切片后, 作HE染色, 光镜下观察, 同时对肝组织损伤程度作半定量分析. 半定量分析赋值标准[7]: "-"为组织结构正常, 记0分; "+"为可见肝细胞点状坏死, 记1分; "++"为肝细胞坏死范围<1/3, 记2分; "+++"为肝细胞坏死范围占肝小叶1/3-2/3, 记3分; "++++"为肝细胞坏死范围>2/3, 记4分. 由2位工作3年以上的病理医生读片, 结果判定不一致的大鼠不纳入此研究. 具体研究流程见图1.
统计学处理 计量资料用mean±SD表示, 组间差异用单因素方差分析进行比较, 方差齐性用LSD检验, 方差不齐用Dunnett's检验; 计数资料采用RC检验. 应用Kaplan-Meier法估计各组大鼠的生存时间, 采用log-rank检验进行组间生存分布比较. 全部统计分析采用SPSS17.0统计分析软件进行计算, P<0.05为差异有统计学意义.
模型组于造模后12 h出现进食及活动减少, 反应迟钝, 毛蓬松、竖立, 或全身皮毛为汗液浸湿, 部分伴尿失禁、尿黄, 精神萎糜、嗜睡, 也可呈激惹状态; 40 h可发展至昏睡状态, 痛觉反应迟钝或消失, 尿深黄; 终末期可见四肢或全身抽搐, 口腔、四肢末端出血. 24 h时动物开始出现死亡, 在40-72 h内动物死亡最多, 72 h后大鼠一般状态逐渐好转, 对外界反应渐趋正常. 复方甘草酸苷组及清热化瘀中药组大鼠, 出现上述症状的次数较少, 程度较轻, 且持续时间更短. 空白组大鼠一切正常.
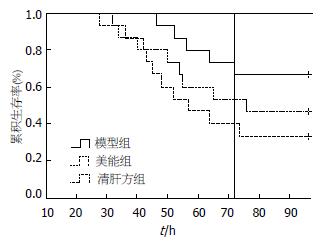
各亚组2大鼠观察至造模后96 h, 模型组(n = 15)死亡10例(66.7%), 复方甘草酸苷组(n = 15)死亡8例(53.3%), 清热化瘀中药组(n = 15)死亡5例(33.3%), 经RC检验, 3组存活及死亡大鼠数比较, 差异无统计学意义(χ2 = 3.379, P>0.05). 模型组、复方甘草酸苷组及清热化瘀中药组估计平均生存时间分别为64.6、71.9、83.3 h; log-rank检验提示清热化瘀中药组累积生存率高于对照组(χ2 = 4.428, P<0.05), 而复方甘草酸苷组与模型组、清热化瘀中药组差异均无统计学意义(χ2 = 0.635, 1.455, P>0.05, 图2).
与模型组相比, 空白组、清热化瘀中药组和复方甘草酸苷组血清ALT、AST、TBIL和血浆PT水平均显著下降(P<0.01), 清热化瘀中药组低于复方甘草酸苷组(P<0.01); 而这3组的血清ALB和CHE水平较模型组相比均明显升高(P<0.01), 清热化瘀中药组高于复方甘草酸苷组(P<0.01), 均有统计学意义(表1).
| 分组 | n | ALT(U/L) | AST(U/L) | TBIL(µmol/L) | ALB(g/L) | CHE(U/L) | PT(s) |
| 空白组 | 10 | 35.02±3.41 | 148.30±13.54 | 1.61±0.29 | 35.92±2.48 | 562.45±30.67 | 13.56±1.15 |
| 模型组 | 20 | 442.09±36.04b | 913.67±77.57b | 36.97±3.62b | 23.17±2.24b | 340.60±39.28b | 32.10±2.43b |
| 复方甘草酸苷组 | 20 | 256.93±24.37d | 384.03±23.28d | 23.41±2.42d | 25.16±2.47d | 420.00±49.14d | 30.24±2.11d |
| 清热化瘀中药组 | 20 | 138.53±14.14df | 313.13±39.48df | 18.93±1.87df | 29.41±2.12df | 524.41±47.60df | 24.83±2.16df |
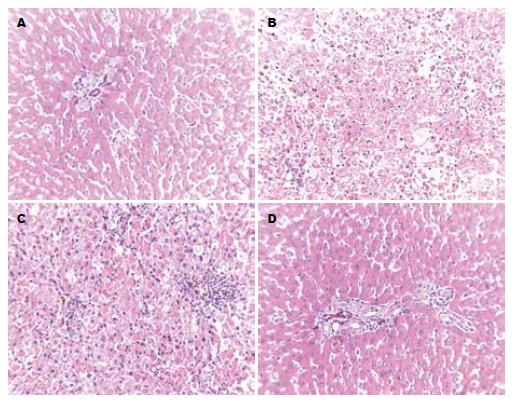
空白组肝小叶结构正常, 肝索及肝窦清楚, 肝细胞以中央静脉为中心呈放射状排列, 肝窦状隙未见扩张; 肝细胞大小较均匀, 肝细胞质丰富, 细胞核圆形、丰满, 汇管区结构正常. 模型组肝小叶结构紊乱, 肝索及肝窦形态不清楚, 部分肝细胞极度肿胀或有脂肪空泡, 并进一步胞核消失、肝细胞坏死, 坏死区域呈大片状分布, 坏死灶内有孤立成团炎细胞, 残余汇管区内亦可见炎细胞. 复方甘草酸苷组肝小叶结构紊乱, 部分肝细胞明显肿胀或有脂肪空泡, 细胞间界限不清, 胞浆淡染, 肝细胞呈灶状坏死、崩解, 坏死灶内有孤成团立炎细胞. 清热化瘀中药组肝小叶结构正常, 肝索及肝窦清楚, 部分肝细胞浆轻度浊肿, 细胞间尚有界限, 胞浆淡染; 肝小叶内可见散在的肝细胞坏死, 汇管区结构正常, 个别汇管区内有少许炎细胞分布(图3).
ALF是一种以肝脏功能严重损害, 出现凝血障碍和黄疸、肝性脑病为特征的暴发性临床综合征[1,8]. 不同地区的致病因素有所差异: 在美国, 对乙酰氨基酚中毒是ALF最常见的病因, 据统计, 对乙酰氨基酚引起的ALF占肝衰竭总数的50%; 国内则以各型肝炎病毒感染为主, 占52.83%-75.00%. 其临床预后差: 采用包括人工肝支持系统、肝移植在内的内外科综合治疗, 其总体死亡率仍高达40%, 未经肝移植的ALF患者死亡率更超过90%[2,9,10]. 目前中药或中药复方在治疗ALF方面的动物与临床研究报道较多[11-15].
本研究主要观察清热化瘀中药复方(茵陈、败酱草、黄芩、虎杖、生大黄、赤芍)对ALF大鼠模型的疗效. 祖国医学将其归为"急黄"、"瘟黄"、"天行发黄"等范畴. 隋·巢元方《诸病源候论》云: "脾胃有热, 谷气郁蒸, 因热毒所加, 故卒然发黄, 心满气喘, 命在顷刻, 故云急黄也." 本病病因主要是外感湿热疫毒之邪, 内有乖戾之气. 病机责之于毒热炽盛内陷, 湿浊蒙蔽清窍, 少阳枢机不利, 气机升降失常, 终致毒、热互结, 迫血妄行; 湿热熏蒸肝胆, 胆汁不循常道而外溢; 气机逆乱, 水裹血阻. 故清热化瘀是中医治疗ALF的治疗大法. 方中以大剂茵陈为君, 功专清利肝胆湿热, 为退黄之要药. 配大剂生大黄、败酱草、黄芩为臣, 其中生大黄味苦性寒, 功擅泻下攻积, 荡涤积滞, 畅阳明谷道而引湿热之毒从后阴而出; 败酱草、黄芩苦寒燥湿解毒, 加强利湿退黄之功. 伍以大剂虎杖、赤芍为佐, 其中虎杖利湿退黄、泻火解毒, 又活血祛瘀, 与茵陈相配消除湿浊; 赤芍凉血清热, 活血散瘀, 利于黄疸消退. 诸药合用, 势大力宏, 共奏清热通下, 和解祛瘀之功.
本研究结果表明: 清热化瘀中药组累计生存率优于复方甘草酸苷组(P<0.05), 血清ALT、AST和TBIL水平低于复方甘草酸苷组(P<0.01), 血清ALB和CHE水平高于复方甘草酸苷组(P<0.01), 血浆PT水平低于复方甘草酸苷组(P<0.01), 肝组织损伤程度积分显著低于复方甘草酸苷组(P<0.01). 提示: 清热化瘀中药可减轻ALF模型大鼠肝细胞的损伤, 改善肝功能及肝脏病理, 延长生存时间, 降低死亡率, 疗效优于复方甘草酸苷, 值得临床医生重视.
但是, 本文也有研究不足之处. 首先本文没能详细阐述清热化瘀中药治疗ALF的作用机制; 其次, D-GalN大鼠肝衰竭模型本身的局限性决定了实验结果的说服力有限. 本文结果究竟属偶然性还是必然性, 需要从更大样本的多中心临床研究中得到证实, 这也正是我们未来的工作方向.
急性肝衰竭(ALF)是一种暴发式、严重的临床综合征, 病死率极高. 近年随着肝移植和人工肝技术的快速发展, 其存活率明显改善, 但总体死亡率仍达40%, 故探索更为有效的治疗方案意义重大.
刘成海, 研究员, 上海中医药大学附属曙光医院(东部)肝病研究所
ALF归属中医"急黄"、"天行发黄"等范畴, 其病因病机关键在于"毒"和"瘀". 解毒化瘀为ALF的基本治法, 观察清热化瘀中药对ALF模型大鼠的生存影响, 提示使用清热化瘀中药可能会明显改善ALF临床预后.
本课题组前期的研究工作表明, 清热化瘀中药可显著改善乙型肝炎相关性慢加急性肝衰竭患者的肝功能和凝血功能等, 减少并发症, 提高疗效, 降低病死率.
本研究采用公认的ALF动物模型, 通过药理学实验, 了解清热化瘀中药对ALF的生存影响.
清热化瘀中药能显著改善ALF模型大鼠肝细胞的损伤, 显著延长实验动物的生存时间、显著降低实验动物的死亡率, 为临床上应用清热化瘀中药治疗ALF提供理论依据.
该研究通过制备ALF大鼠模型, 并观察清热化瘀中药对其肝功能及生存期的影响, 选题具有一定科学性和创新性.
编辑: 张姗姗 电编:鲁亚静
| 1. | Bernal W, Auzinger G, Dhawan A, Wendon J. Acute liver failure. Lancet. 2010;376:190-201. [PubMed] [DOI] |
| 2. | Lee WM. Acute liver failure. Semin Respir Crit Care Med. 2012;33:36-45. [PubMed] [DOI] |
| 3. | Hu XY, Zhang Y, Chen G, Zhong S, Fan XJ. [A prospective cohort study on the influence of high doses of herbs for clearing heat and resolving stasis on survival rates in patients with hepatitis B-related acute-on-chronic liver failure]. Zhongxiyi Jiehe Xuebao. 2012;10:176-185. [PubMed] |
| 4. | Zhang L, Kang W, Lei Y, Han Q, Zhang G, Lv Y, Li Z, Lou S, Liu Z. Granulocyte colony-stimulating factor treatment ameliorates liver injury and improves survival in rats with D-galactosamine-induced acute liver failure. Toxicol Lett. 2011;204:92-99. [PubMed] [DOI] |
| 6. | 施 新猷. 医用实验动物学. 西安: 陕西科学技术出版社 1989; 417-421. |
| 11. | O'Grady JG. Acute liver failure. Postgrad Med J. 2005;81:148-154. |