修回日期: 2012-05-20
接受日期: 2012-06-16
在线出版日期: 2012-07-18
目的: 探讨枯草杆菌肠球菌二联活菌胶囊对非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)患者肠道菌群失调的干预作用.
方法: 选择肠道菌群中具有代表性的细菌共8种(肠杆菌、肠球菌、葡萄球菌、双歧杆菌、乳杆菌、拟杆菌、梭菌、酵母样真菌)进行培养和计数, 检测所有被研究者的血清内毒素、TNF-α、IL-6和ALT的浓度. 选择健康正常成人30例作为正常对照组(A组), NASH共60例, 随机分为常规治疗组(B组)和观察组(C组)各30例, B组采用常规保肝治疗, C组常规保肝治疗的同时联用枯草杆菌肠球菌二联活菌胶囊治疗, 治疗4 wk, 比较各组治疗前后肠道细菌数量的变化和内毒素、TNF-α、IL-6、ALT的变化, 并比较B组和C组治疗后临床症状的缓解情况.
结果: 与A组比较, 治疗前NASH组肠杆菌显著增多(7.28±1.22 vs 6.54±1.08, t = 4.83, P<0.01), 而双歧杆菌、乳酸杆菌、拟杆菌显著减少(7.13±1.28 vs 8.83±1.24, t = -6.65, P<0.01; 6.67±1.21 vs 7.31±1.12, t = -2.16, P<0.05; 6.99±1.31 vs 7.82±1.15, t = -2.41, P<0.05); 血清中内毒素、IL-6、TNF-α的浓度显著增高(168.37 EU/L±24.13 EU/L vs 110.53 EU/L±18.33 EU/L, t = 11.69, P<0.01; 42.62 ng/L±12.65 ng/L vs 21.58 ng/L±8.47 ng/L, t = 7.71, P<0.01; 15.98 ng/L±3.19 ng/L vs 8.63 ng/L±2.49 ng/L, t = 11.97, P<0.01); C组治疗后与治疗前比较双歧杆菌、乳杆菌、拟杆菌的数量显著增多(P<0.01), 肠杆菌的数量显著减少(P<0.05), 血清中内毒素、TNF-α、IL-6、ALT的浓度显著降低(P<0.01), C组治疗后临床症状较B组有显著改善.
结论: NASH患者存在肠道菌群失调、革兰氏阴性杆菌过度生长, 提示肠道微生态失衡可能参与了NASH的发生发展. 枯草杆菌肠球菌二联活菌胶囊可明显改善NASH肠道菌群失调, 降低血清中内毒素、TNF-α、IL-6、ALT的水平, 改善临床症状.
引文著录: 杨林辉, 郭华, 蔡俊, 蔡晓伟, 刘贵伦, 陈东风. 枯草杆菌肠球菌二联活菌胶囊对非酒精性脂肪性肝炎肠道菌群失调的干预作用. 世界华人消化杂志 2012; 20(20): 1873-1878
Revised: May 20, 2012
Accepted: June 16, 2012
Published online: July 18, 2012
AIM: To investigate the interventional effect of microbiological capsules (Medilac-S) containing Bacillus subtilis and Enterococcus on intestinal flora in patients with nonalcoholic steatohepatitis (NASH).
METHODS: Thirty healthy adults and sixty patients with NASH were included, and they were divided into three groups: group A (30 healthy adults, control group), group B (30 patients, treated with basic drugs), and group C (30 patients, treated with basal drugs and Medilac-S). Eight types of representative bacteria of the intestinal flora were cultivated and counted, and the levels of serum endotoxin, TNF-α, IL-6 and ALT was determined in all groups before treatment and 4 wk after treatment.
RESULTS: Compared to group A, the numbers of Bacillus bifidus, Bacillus lactis and Bacteroides decreased (7.13 ± 1.28 vs 8.83 ± 1.24, t = -6.65, P < 0.01; 6.67 ± 1.21 vs 7.31 ± 1.12, t = -2.16, P < 0.05; 6.99 ± 1.31 vs 7.82 ± 1.15, t = -2.41, P < 0.05), that of Enterobacteria increased (7.28 ± 1.22 vs 6.54 ± 1.08, t = 4.83, P < 0.01), and serum levels of endotoxin, IL-6 and TNF-α increased (168.37 EU/L ± 24.13 EU/L vs 110.53 EU/L ± 18.33 EU/L, t = 11.69, P < 0.01; 42.62 ng/L ± 12.65 ng/L vs 21.58 ng/L ± 8.47 ng/L, t = 7.71, P < 0.01; 15.98 ng/L ± 3.19 ng/L vs 8.63 ng/L ± 2.49 ng/L, t = 11.97, P < 0.01) in patients with NASH (groups B and C) before the treatment. After 4 weeks of treatment, the numbers of Bacillus bifidus, Bacillus lactis and Bacteroides increased significantly (all P < 0.01), that of Enterobacteria decreased (P < 0.05), and serum levels of endotoxin, TNF-α, IL-6 and ALT decreased remarkably (P < 0.05) in group C but not in group B compared to group A. The clinical symptoms were improved more apparently in group C than in group B.
CONCLUSION: Alteration of intestinal flora and overgrowth of Gram-negative bacilli probably participate in the development of NASH. Medilac-S can effectively improve intestinal flora, decrease serum levels of endotoxin, TNF-α, IL-6 and ALT, and improve clinical symptoms in patients with NASH.
- Citation: Yang LH, Guo H, Cai J, Cai XW, Liu GL, Chen DF. Intervention effect of microbiological capsules containing Bacillus subtilis and Enterococcus on intestinal flora in patients with NASH. Shijie Huaren Xiaohua Zazhi 2012; 20(20): 1873-1878
- URL: https://www.wjgnet.com/1009-3079/full/v20/i20/1873.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i20.1873
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)近年来的发病率正稳步上升. 非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)是NAFLD病程进展中的主要阶段, 近一半的NASH患者可发展至肝纤维化, 约15%发展至肝硬化, 3%进展至最终的肝衰竭[1]. NAFLD的发病机制至今尚未明确, 在众多致病因素中, 小肠细菌过度生长、细菌移位、肠黏膜通透性改变等所致的肠源性内毒素血症(intestinal endotoxemia, IETM)在NASH的发病中起着重要的作用. 随着"肠-肝"轴(gut-liver axis)[2]这一新概念的提出, 肠道菌群正成为肝病研究热点. 本文就NASH患者肠道菌群的变化及其肠源性内毒素血症进行初步研究, 并采用枯草杆菌肠球菌二联活菌胶囊进行干预, 观察枯草杆菌肠球菌二联活菌胶囊对NASH的治疗作用.
2010-03/2011-10本院经临床、实验室和B超(或CT)检查诊断为NASH患者60例, 男32例, 女28例, 年龄25-70岁, 平均年龄47.5岁±l2.3岁. 所有患者诊断符合NASH诊断标准[3]. 排除感染、使用抗生素、微生态调节剂、酸奶、胃肠道动力药物及其他可影响肠道通透性制剂的患者. 另选择30例健康成年人且愿意受试者为正常对照组(A组), 男女各15例, 年龄20-70岁, 平均47.1岁±10.7岁. NASH组患者随机分为治疗组(B组)和观察组(C组)各30例.
1.2.1 治疗: B组给予常规保肝治疗, 口服甘草酸二胺肠溶胶囊(江苏正大天晴药业有限公司, 规格150 mg)3粒/次, 3次/日; C组在B组治疗的基础上加上枯草杆菌肠球菌二联活菌胶囊(北京韩美药品有限公司)口服治疗, 500 mg/次, 3次/日, 疗程均为4 wk. 实验期间不使用抗菌药物及其他影响肠道菌群的制剂.
1.2.2 肠道菌群的培养及检测: 采集实验对象的新鲜粪便标本2份分别盛放在普通无菌小瓶和无氧小瓶迅速送至实验室. 肠道菌群的培养及检测: 称取新鲜粪便0.5 g加入4.5 mL 0.9%的无菌氯化钠溶液中, 按l0倍连续稀释法稀释至10-9. 分别取10-9、10-7、10-5、10-3、10-1, 稀释液50 μL依次接种在选择性培养基上. 肠道菌群的选择: 选择具有代表性的需氧菌3种(肠杆菌、肠球菌、葡萄球菌), 厌氧菌4种(双歧杆菌、乳杆菌、拟杆菌、梭菌)及酵母样真菌进行培养. 培养基选择: 肠球菌、葡萄球菌用羊血平板, 肠杆菌用中国兰琼脂平板, 真菌用沙氏培养基, 双歧杆菌用BS血琼脂平板, 乳酸杆菌为MRS营养琼脂, 拟杆菌用BDS培养基, 梭菌采用RCM培养基(强化梭菌培养基). 需氧菌置35 ℃孵箱培养24 h, 酵母样真菌置25 ℃孵箱培养48-72 h, 厌氧菌采用抽气换气培养法培养48 h. 使用ATB全自动微生物鉴定系统(法国生物梅里埃公司)进行细菌鉴定. 结果以每克粪便湿重中菌落形成单位的对数值表示(lgCFU/g).
1.2.3 血清指标的检测: 清晨空腹静脉血6 mL离心后取血清置-70 ℃冰箱中保存待测. 血清内毒素定量测定采用鲎试剂基质偶氮显色法(试剂盒由上海伊华医学科技公司提供); TNF-α和IL-6的检测采用酶联免疫法定量测定(试剂盒由深圳晶美生物工程有限公司提供), 按说明书进行操作; 血清ALT的检测使用日立7170A全自动生化分析仪检测.
1.2.4 临床疗效的评定: 记录B、C两组治疗前乏力、肝区不适、腹胀、厌食、腹泻、便秘等临床症状以及治疗后的缓解情况(症状减轻或消失), B超检查治疗前肝脏肿大情况以及治疗后回复情况(缩小或恢复正常大小), 并做疗效比较分析, 结合血清学指标ALT做疗效判定.
统计学处理 计量资料使用mean±SD表示. 使用SPSS17.0统计软件进行统计学分析, 组间比较采用独立样本t检验, 治疗前后比较采用配对t检验; 直线相关采用Pearson相关分析; 率的比较采用χ2检验, P<0.05提示差异有统计学意义.
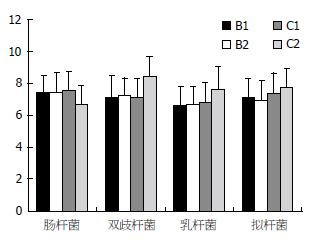
治疗前NASH组与A组比较各肠道菌群发生显著变化, 肠杆菌显著增加(t = 4.83, P<0.01), 而双歧杆菌、乳杆菌、拟杆菌显著减少(t = -6.65, P<0.01; t = -2.16, P<0.05; t = -2.41, P<0.05); 而肠球菌、葡萄球菌、酵母真菌和梭菌没有发生显著改变(P>0.05, 表1).
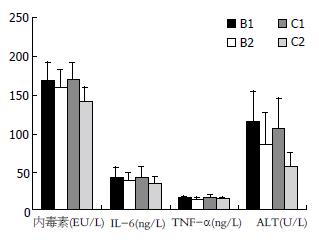
治疗前NASH组与A组比较, 内毒素、IL-6和TNF-α等指标均显著增加(t = 11.69、7.71、11.97, P<0.01, 表2).
治疗前两组所有菌落数比较均无统计学意义(P>0.05), 提示二者具有可比性; B组治疗后与治疗前比较无显著差异(P>0.05), 而C组治疗后与治疗前比较有显著改变, 其中肠杆菌显著减少(t = -2.79, P<0.05), 而双歧杆菌、乳杆菌、拟杆菌显著增加(t = 4.27, P<0.01; t = 3.25, P<0.01; t = 2.93, P<0.01, 表3, 图1).
治疗前两组所有指标比较均无统计学意义(P>0.05), 提示二者具有可比性; B组内毒素、IL-6、TNF-α与治疗前比较无显著改变(P>0.05); C组治疗后与治疗前比较内毒素、IL-6、TNF-α、ALT均有显著降低(t = -3.98、-2.42、-2.27、-8.61, P<0.01). 治疗后C组与B组比较, ALT差异显著(t = -4.73, P<0.01, 表4, 图2).
在有显著变化的4种细菌中, 只有肠杆菌与内毒素显著正相关(r = 0.644, P<0.01), 而肠杆菌与TNF-α、IL-6均不相关(P>0.05); 血清内毒素和TNF-α、IL-6显著正相关(r = 0.485, P<0.01; r = 0.477, P<0.01).
治疗前有症状的NASH患者主要为乏力、腹胀、肝区不适、厌食、腹泻或便秘, 其中腹胀和腹泻占到了NASH组的一半以上, 而其他症状则占NASH组的20%-40%, 12例患者无任何不适症状, 占总例数的20%. 治疗后C组与B组比较临床症状及肝肿大缓解更显著(P<0.05或0.01, 表5, 6).
| 分组 | n | 乏力 | 肝区不适 | 腹胀 | 厌食 | 腹泻 | 便秘 | 肝肿大 |
| B组 | 30 | 9(30) | 11(36.6) | 16(53.3) | 10(33.3) | 17(56.7) | 9(30) | 16(53.3) |
| C组 | 30 | 8(26.6) | 9(30) | 17(56.6) | 6(20) | 15(50) | 6(20) | 19(63.3) |
| 分组 | 乏力缓解 | 肝区不适缓解 | 腹胀缓解 | 厌食缓解 | 腹泻缓解 | 便秘缓解 | 肝肿大缩小 |
| B组 | 5(55.5) | 4(36.3) | 7(43.7) | 5(50) | 4(23.52) | 2(22.2) | 8(50) |
| C组 | 8(100) | 8(88.8) | 15(88.2) | 6(100) | 13(86.6) | 5(83.3) | 16(84.2) |
| χ2值 | 4.65 | 4.10 | 7.34 | 4.36 | 12.75 | 5.40 | 4.71 |
| P值 | <0.05 | <0.05 | <0.01 | <0.05 | <0.01 | <0.05 | <0.05 |
研究证实肠道菌群失调不仅参与了肥胖的发生[4-6], 还与NASH关系密切[7]. 本研究显示NASH患者肠道菌群发生了显著变化, 双歧杆菌、乳杆菌和拟杆菌的菌落数均较正常对照组明显减少(P<0.05), 而肠杆菌的菌落数较正常对照组则有显著增加(P<0.01), 这提示NASH患者肠道菌群发生了显著改变, 以肠杆菌为代表的需氧菌显著增长, 而以双歧杆菌及乳杆菌为代表的厌氧菌却显著降低, 这证实了NASH存在菌群失调及肠道革兰氏阴性杆菌过度生长. 现有研究表明内毒素及炎性细胞因子均参与了NASH的发生发展. 内毒素不仅直接损害肝细胞, 而且使肠道微生态环境发生改变, 加重肠道菌群失调[8]. 此外, 内毒素还能激活肝脏库普弗细胞引发炎症级联反应[9-13], 引发肝细胞凋亡、坏死. 本研究中NASH患者的血清内毒素水平、TNF-α和IL-6较正常对照组显著增加, 直线相关分析显示肠杆菌与内毒素显著正相关, 而内毒素与TNF-α、IL-6显著正相关, 表明肠杆菌、内毒素、炎症细胞因子间关系密切, 他们对NASH的发生发展起着重要作用, 推测正是由于NASH患者肠道革兰氏阴性杆菌过度生长导致内毒素生成过多, 且破坏了肠道原有的生物屏障功能, 结果使大量的细菌内毒素通过损害的肠黏膜屏障进入门静脉形成IETM, 内毒素及炎症细胞因子共同参与肝损害的病理过程.
枯草杆菌肠球菌二联活菌胶囊是新型的微生态制剂, 有较强的调节肠道菌群的作用[14,15]. 枯草杆菌肠球菌二联活菌治疗NASH国内外报道少见. 本研究显示C组治疗后以肠杆菌为代表的需氧菌减少(P<0.05), 而以双歧杆菌、乳杆菌、拟杆菌为代表的厌氧菌显著增多(P<0.01), 血清内毒素、TNF-α和IL-6也显著降低(P<0.05), 这与储建坤等[16]的研究结果一致. 而B组则没有发生显著变化(P>0.05), 这提示C组肠道菌群失调及IETM较B组得到了明显改善. 而B组和C组治疗前后比较ALT均显著降低, 但二者比较后者降低更显著(P<0.01), 这提示甘草酸二胺胶囊保肝治疗降酶效果显著, 但仅能从一定程度上降低转氨酶, 不能显著降低IETM以及炎症因子TNF-α和IL-6的水平. 相反, C组由于枯草杆菌肠球菌二联活菌促进肠道菌群的修复及平衡, 从一定程度上解决了肠道菌群失调及肠道革兰氏阴性杆菌过度生长的问题, 修复了受损的肠黏膜屏障, 降低了IETM, 进一步抑制了肝脏库普弗细胞产生细胞因子对肝脏的"二次打击", 改善了肝脏的炎症程度, 因而内毒素、炎症细胞因子水平及转氨酶显著降低, 所以C组的"保肝"效果明显强于B组.
从临床症状缓解情况及肝肿大的回缩情况看, 治疗后C组乏力、腹胀、肝区不适、厌食、大便次数增多或便秘症状、肝肿大均较B组有显著改善, 这提示联合使用保肝药和枯草杆菌肠球菌二联活菌胶囊进行干预治疗, 效果优于单用保肝药治疗, 这与张纪伟等[17]的研究结果一致. 我们在试验中还观察到虽然ALT显著降低, 临床症状也明显改善, 但C组治疗后各血清学指标仍远>正常值, 这提示联合保肝和肠道干预治疗仍然难以取得最理性的治疗效果, 原因是NASH的发病是多因素共同作用的结果, 可能仅从这两方面干预仍不能完全阻止NASH的进展, 另一方面, 我们的研究也只观察了4 wk, 长时间的干预治疗究竟效果如何仍不得而知, 所以一方面对于该治疗方案时效关系的观察还将继续进行, 另一方面对于NASH发病机制的研究则显得更为重要.
总之, NASH患者存在肠道菌群失调、革兰氏阴性杆菌过度生长和IETM, 提示肠道微生态失衡参与了NASH的发生发展. 给予枯草杆菌肠球菌二联活菌胶囊调节肠道菌群治疗, 可以恢复肠道微生态平衡, 减轻IETM, 降低炎症因子的分泌, 减少对肝细胞"二次打击", 从而对延缓NASH进展为肝纤维化、肝硬化可能具有重要作用, 所以联合使用保肝药和微生态制剂治疗NASH仍不失为目前较为理想的治疗方案.
非酒精性脂肪性肝病(NAFLD)的发病机制至今尚未明确, 在众多致病因素中, 小肠细菌过度生长、细菌移位、肠黏膜通透性改变等所致的肠源性内毒素血症(IETM)在非酒精性脂肪性肝炎(NASH)的发病中起着重要的作用.
任晓峰, 教授, 东北农业大学动物医学学院微生物室
随着"肠-肝"轴(Gut-Liver Axis)这一新概念的提出, 肠道菌群正成为肝病研究热点.
研究表明内毒素及炎性细胞因子均参与了NASH的发生发展. 内毒素不仅直接损害肝细胞, 而且使肠道微生态环境发生改变, 加重肠道菌群失调.
本文就NASH患者肠道菌群的变化及其肠源性内毒素血症进行初步研究, 并采用枯草杆菌肠球菌二联活菌胶囊进行干预, 观察枯草杆菌肠球菌二联活菌胶囊对NASH的治疗作用.
本实验立项依据较合理, 对临床合理应用该药物有一定的指导意义.
编辑: 曹丽鸥 电编:鲁亚静
| 1. | Sheth SG, Gordon FD, Chopra S. Nonalcoholic steatohepatitis. Ann Intern Med. 1997;126:137-145. [PubMed] |
| 2. | Vanni E, Bugianesi E. The gut-liver axis in nonalcoholic fatty liver disease: Another pathway to insulin resistance? Hepatology. 2009;49:1790-1792. [PubMed] [DOI] |
| 4. | Bäckhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A, Semenkovich CF, Gordon JI. The gut microbiota as an environmental factor that regulates fat storage. Proc Natl Acad Sci U S A. 2004;101:15718-15723. [PubMed] [DOI] |
| 5. | Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature. 2006;444:1027-1031. [PubMed] [DOI] |
| 6. | Cani PD, Amar J, Iglesias MA, Poggi M, Knauf C, Bastelica D, Neyrinck AM, Fava F, Tuohy KM, Chabo C. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes. 2007;56:1761-1772. [PubMed] [DOI] |
| 7. | Wigg AJ, Roberts-Thomson IC, Dymock RB, McCarthy PJ, Grose RH, Cummins AG. The role of small intestinal bacterial overgrowth, intestinal permeability, endotoxaemia, and tumour necrosis factor alpha in the pathogenesis of non-alcoholic steatohepatitis. Gut. 2001;48:206-211. [PubMed] [DOI] |
| 8. | Han DW. Intestinal endotoxemia as a pathogenetic mechanism in liver failure. World J Gastroenterol. 2002;8:961-965. [PubMed] [DOI] |
| 9. | Norman K, Pirlich M. Gastrointestinal tract in liver disease: which organ is sick? Curr Opin Clin Nutr Metab Care. 2008;11:613-619. [PubMed] |
| 10. | Hirose M, Nishikawa M, Qian W, Haque A, Mashimo M, Inoue M. Mannose-conjugated alendronate selectively depletes Kupffer cells and inhibits endotoxemic shock in the mice. Hepatol Res. 2006;36:3-10. [PubMed] [DOI] |
| 11. | Higuchi Y, Kawakami S, Yamashita F, Hashida M. The potential role of fucosylated cationic liposome/NFkappaB decoy complexes in the treatment of cytokine-related liver disease. Biomaterials. 2007;28:532-539. [PubMed] [DOI] |
| 12. | Yee SB, Harkema JR, Ganey PE, Roth RA. The coagulation system contributes to synergistic liver injury from exposure to monocrotaline and bacterial lipopolysaccharide. Toxicol Sci. 2003;74:457-469. [PubMed] [DOI] |
| 13. | Barton GM, Medzhitov R. Toll-like receptor signaling pathways. Science. 2003;300:1524-1525. [PubMed] [DOI] |
| 14. | Kim YG, Moon JT, Lee KM, Chon NR, Park H. [The effects of probiotics on symptoms of irritable bowel syndrome]. Korean J Gastroenterol. 2006;47:413-419. [PubMed] |