修回日期: 2012-05-20
接受日期: 2012-06-01
在线出版日期: 2012-07-18
目的: 探讨低氧下5-Fu化疗抵抗的机制.
方法: MTT检测常氧和低氧下的细胞活力, 并计算5-Fu的半数抑制浓度(IC50). 以IC50的5-Fu分别作用细胞常氧和低氧组细胞24、48和72 h后, 收集标本, Hoechst33342染色法检测侧群(side population, SP)细胞的比例, 免疫细胞化学法检测低氧诱导因子(hypoxia-inducible factor-2α, HIF-2α), 荧光免疫细胞化学法检测ABCG2(ATP-binding cassette superfamily G member 2)的表达.
结果: 常氧和低氧下, 5-Fu均呈时间、剂量依赖性地抑制SGC7901细胞增殖, 其IC50分别为100、200 mg/L. 常氧下SP细胞的比例为1.87%, 低氧诱导后其比例逐渐增加. 常氧下5-Fu-IC50作用于细胞不用时间后, SP细胞的比例无明显变化, 低氧下其比例却逐渐增加. 常氧下, HIF-2α和ABCG2蛋白呈低水平表达, 且5-Fu-IC50作用于不同时间后也无明显变化, 低氧下5-Fu-IC50作用于不同时间后二者的表达逐渐增加.
结论: 低氧下5-Fu对胃癌SGC7901细胞存在化疗抵抗可能与低氧通过诱导HIF-2α-ABCG2通路的表达、促进肿瘤细胞的干细胞化有关, 这可能是肿瘤化疗抵抗和复发的根源.
引文著录: 张小茜, 冯玉光, 吴美英, 朱芸, 白红霞, 王西艳. 5-Fu对低氧下胃癌SGC7901细胞系中SP细胞比例及HIF-2α、ABCG2表达的影响. 世界华人消化杂志 2012; 20(20): 1813-1818
Revised: May 20, 2012
Accepted: June 1, 2012
Published online: July 18, 2012
AIM: To investigate the mechanism of resistance to 5-fluorouracil (5-Fu) chemotherapy in gastric cancer cells under hypoxia.
METHODS: The proliferative activity of SGC7901 cells was determined by MTT assay, and the half maximal inhibitory concentration (IC50) of 5-Fu under normoxia and hypoxia was calculated. After 5-Fu at a concentration of IC50 was incubated with cells for 24, 48 or 72 h under hypoxia, the percentage of SP cells was detected by Hoechst 33342 staining, the expression of HIF-2α protein was detected by immunocytochemistry, and the expression of ABCG2 was detected by fluorescence immunocytochemistry.
RESULTS: 5-Fu inhibited the proliferation of SGC7901 cells in a dose- and time-dependent manner under normoxia and hypoxia. The IC50 of 5-Fu under normoxia and hypoxia was 100 mg/L and 200 mg/L, respectively. The ratio of SP cells in SGC7901 cells was 1.87% under nomoxia, and significantly increased after induction by hypoxia for 24, 48, and 72 h. Treatment with 5-Fu had no significant impact on the proportion of SP cells under normoxia, but gradually increased SP cell proportion under hypoxia. The expression levels of HIF-2α and ABCG2 proteins in SGC7901 cells were lower under normoxia. Treatment with 5-Fu had no significant impact on the expression of HIF-2α and ABCG2 proteins under normoxia, but gradually increased their expression under hypoxia.
CONCLUSION: The mechanism underlying the resistance of SGC7901 cells to 5-Fu under hypoxia may be related to inducing HIF-2α and ABCG2 expression and promoting stemness.
- Citation: Zhang XQ, Feng YG, Wu MY, Zhu Y, Bai HX, Wang XY. Effect of 5-Fu on the ratio of SP cells and expression of HIF-2α and ABCG2 in human gastric cancer cell line SGC7901 under hypoxia. Shijie Huaren Xiaohua Zazhi 2012; 20(20): 1813-1818
- URL: https://www.wjgnet.com/1009-3079/full/v20/i20/1813.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i20.1813
低氧是多种实体肿瘤包括胃癌的特征之一, 可诱导肿瘤细胞低氧诱导因子(hypoxia-inducible factor, HIFs)的活性, HIFs与肿瘤的血管生成、侵袭转移及放化疗抵抗等恶性生物学表型密切相关[1]. 低氧通过诱导干细胞产生HIFs, 调控Notch和Oct4、Wnt、c-Myc、ABCG2(ATP-binding cassette superfamily G member 2)等多种干细胞信号通路的表达, 维持干细胞未分化特征[2-5]. 最近很多学者从不同的细胞系和肿瘤组织中分离到了一群侧群(side population, SP)细胞, 可以作为研究肿瘤干细胞的重要资源[6]. ABCG2是分选多潜能干细胞的标记, 参与肿瘤的多药耐药, 而多药耐药是导致胃癌化疗失败的一个重要原因[7-9]. 研究表明ABCG2是HIF-2α的一个直接靶基因, 低氧通过诱导HIF-2α-ABCG2通路高表达导致肿瘤干细胞的多药耐药[10,11]. 研究低氧下化疗药物对肿瘤干细胞的影响有助于深入阐明化疗抵抗的干细胞机制, 具有重要的理论及临床意义. 肿瘤低氧可降低化疗药5-Fu的抗肿瘤活性[12], 我们推测5-Fu化疗抵抗可能与低氧促进肿瘤细胞的干细胞化有关, 为此我们研究了低氧下5-Fu对人胃癌SGC7901细胞系中SP细胞的比例及HIF-2α、ABCG2表达变化的影响.
人胃癌细胞株SGC7901购自山东省医学科学院; 5-Fu为上海旭东海普药业有限公司生产; 氯化钴(CoCl2)购于美国Sigma公司; RPMI 1640培养基、MTT均购自美国Gibco公司; 胎牛血清(杭州四季青); HIF-2α、ABCG2多克隆抗体、罗丹明标记山羊抗兔IgG及SP-9000免疫组化试剂盒均为为北京中杉金桥生物技术有限公司产品.
1.2.1 细胞培养: 人胃癌细胞株SGC7901接种于含100 mL/L胎牛血清、青霉素、链霉素各l×105 U/L的RPMI 1640培养液中, 置37 ℃、50 mL/L CO2培养箱内常规传代培养. 化学缺氧剂CoCl2(浓度为150 μmol/L)用于模拟肿瘤内低氧微环境.
1.2.2 MTT法测定常氧和低氧下5-Fu对胃癌细胞的增殖抑制率: 取对数生长期的细胞,以2×104/L的密度接种于96孔培养板, 每孔体积为200 μL. 分为常氧组和低氧组, 低氧组待细胞贴壁后分别加入CoCl2和不同浓度的5-Fu(25、50、100、200 mg/L), 常氧对照组不加CoCl2. 在37 ℃、50 mL/L CO2培养箱中培养24、48、72 h后, 用移液枪吸走旧培养基, 每孔加入5 g/L MTT溶液20 μL和新鲜培养基180 μL, 继续培养4 h; 吸尽上清液, 加入二甲基亚砜100 μL/孔, 振荡10 min充分溶解, 在酶标仪上以490 nm波长测每孔的吸光度A值. 细胞生长抑制率 = (对照孔A值-实验孔A值)/对照孔A值×100%.
1.2.3 Hoechst33342染色法检测5-Fu对低氧下SGC7901细胞SP细胞比例的影响: 取对数生长期的SGC7901制成2×108/L的细胞悬液, 每孔0.5 mL, 加入放有盖玻片的24孔板内. 设常氧组、低氧组, 低氧组加入CoCl2和半数抑制浓度的5-Fu(200 mg/L), 常氧组只加半数抑制浓度的5-Fu(100 mg/L), 分别培养24、48、72 h后取出细胞爬片, PBS冲洗, 冷丙酮固定13 min. 细胞爬片加入0.1% Triton室温放置20 min, 加入适量Hoechst33342, 37 ℃避光孵育30 min, PBS冲洗, 最后用PBS封片. 倒置荧光显微镜下观察, 计算SP细胞所占比例.
1.2.4 免疫细胞化学法观察5-Fu对低氧下胃癌细胞HIF-2α表达: 分组同1.2.3, 取制备好的细胞爬片, 按试剂盒步骤检测HIF-2α, DAB显色, 脱水, 透明, 中性树胶封片. 用已知阳性的乳腺癌切片作为阳性对照, 以PBS代替一抗作为阴性对照. 结果判定: HIF-2α的阳性结果为细胞浆内有棕黄色颗粒出现. 采用Imagepro plus图像分析软件, 检测HIF-2α阳性细胞的平均A值, 以间接反映HIF-2α蛋白的表达量, 并取其均值.
1.2.5 免疫荧光法检测5-Fu对低氧下胃癌细胞ABCG2蛋白的表达: 分组同1.2.3, 将细胞爬片依次加入0.1% Triton、山羊血清, 一抗4 ℃过夜, 滴加罗丹明标记山羊抗兔IgG, 37 ℃避光孵育1 h, PBS冲洗, 最后用PBS封片, 荧光显微镜下观察并拍照. 用已知阳性的精原细胞瘤切片作为阳性对照, 以PBS代替一抗作为阴性对照. 结果判定: ABCG2的阳性结果为细胞质表达红色荧光.
统计学处理 定量资料的统计描述用mean±SD表示, MTT用析因设计分析, 组间比较用t检验和单因素方差分析, 用统计软件SPSS17.0分析, P<0.05为有统计学意义.
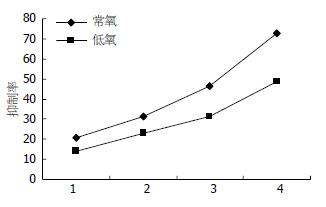
低氧环境下, 不同浓度的5-Fu作用不同时间后, SGC7901细胞的增殖活性显著高于常氧对照组(F = 3544.12, P<0.01). 低氧环境下, 相同浓度的5-Fu呈时间依赖性地抑制SGC7901细胞增殖, 作用48 h其增殖抑制率显著高于24 h, 72 h又高于48 h; 不同浓度的5-Fu呈剂量依赖性地抑制SGC7901细胞增殖, 50 mg/L组高于25 mg/L组, 100 mg/L组高于50 mg/L组, 而200 mg/L组又显著高于100 mg/L组(均P<0.01, 表1). 细胞在接种后的48-72 h处于对数生长期, 常氧和低氧下不同浓度的5-Fu作用于SGC7901细胞48 h后的生长抑制率分别为(常氧: 20.57%、31.11%、46.40%、72.62%; 低氧: 14.15%、 23.00%、 31.35%、 48.63%); 故5-Fu在常氧和低氧下对SGC7901细胞的IC50分别约为100、200 mg/L(图1).
| 5-Fu | 24 h | 48 h | 72 h | |||
| 低氧 | 常氧 | 低氧 | 常氧 | 低氧 | 常氧 | |
| 0 mg/L组 | 0.839±0.005 | 0.781±0.014 | 0.839±0.005 | 0.778±0.008 | 0.840±0.002 | 0.778±0.009 |
| 25 mg/L组 | 0.819±0.031 | 0.744±0.005 | 0.716±0.009 | 0.618±0.011 | 0.700±0.013 | 0.578±0.011 |
| 50 mg/L组 | 0.775±0.008 | 0.713±0.005 | 0.646±0.009 | 0.536±0.013 | 0.600±0.010 | 0.485±0.010 |
| 100 mg/L组 | 0.733±0.013 | 0.672±0.003 | 0.576±0.005 | 0.417±0.007 | 0.498±0.012 | 0.330±0.011 |
| 200 mg/L组 | 0.644±0.071 | 0.608±0.005 | 0.431±0.005 | 0.213±0.011 | 0.311±0.009 | 0.159±0.014 |
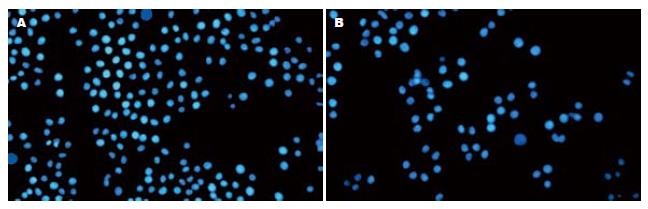
荧光显微镜下观察可见, SP细胞的胞核较大, 呈圆形或者椭圆形, 淡染或者低染. 胃癌SGC7901经Hoechst33342染色后胞核呈低染的比例为1.87%. 常氧下IC50的5-Fu作用24、48和72 h后, SP细胞比例无明显变化, 低氧下IC50的5-Fu作用24、48和72 h后, SP细胞的比例逐渐增加, 分别为3.36%、3.64%、4.00%, 与同时间点的常氧组相比, 差异具有统计学意义(t = 3.215、5.667、4.286, 均P<0.05, 图2).
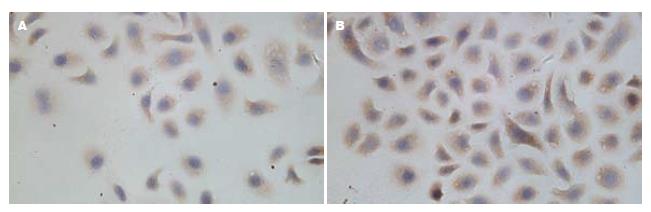
常氧下HIF-2α蛋白呈低水平表达, IC50的5-Fu作用不同时间后HIF-2α蛋白的表达无明显变化, 低氧环境下, IC50的5-Fu作用不同时间后, HIF-2α蛋白的表达逐渐增加, 与同时间点的常氧组比较, 差异有统计学意义(常氧下A值0.319±0.007, 常氧加IC50的5-Fu作用24、48、72 h后A值无明显变化, 低氧加IC50的5-Fu作用后A值依次为: 24 h 0.585±0.017, 48 h 0.780±0.012, 72 h 0.824±0.014, F = 344.659, P<0.01, 图3).
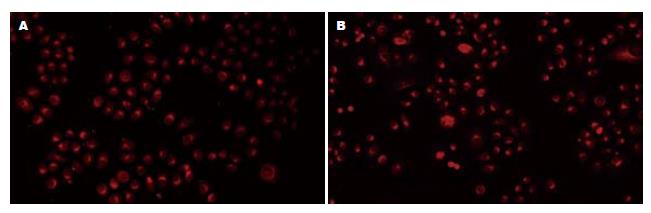
常氧下ABCG2蛋白呈低水平表达, IC50的5-Fu作用不同时间后, ABCG2蛋白的表达无明显变化, 低氧环境下, IC50的5-Fu作用不同时间后, ABCG2蛋白的表达逐渐增加, 与同时间点的常氧组比较, 差异有统计学意义(常氧下A值0.304±0.015, 低氧加IC50的5-Fu作用后A值依次为: 24 h 0.464±0.039, 48 h 0.599±0.024, 72 h 0.781±0.017, F = 301.496, P<0.01, 图4).
由于肿瘤细胞的快速增殖和血管生长的相对滞后, 实体肿瘤包括胃癌中普遍存在低氧区域, 低氧下发生化疗抵抗是肿瘤化疗失败的重要原因[13], 多种化疗药物低氧下抗肿瘤作用下降[14]. 低氧微环境可诱导肿瘤细胞产生HIFs, 包括HIF-1、HIF-2和HIF-3. HIF-2在血管生长、骨髓造血和能量代谢中起非常重要作用. HIF-2α是HIF-2的功能性亚基和活性亚基, 且HIF-2α的高表达与肿瘤细胞的血管生成、侵袭转移及放化疗抵抗密切相关[15-18]. 此外, 低氧可导致基因组的不稳定, 促进肿瘤干细胞的发生[19]. Hoechest33342是一种脂溶性DNA结合染料, 可以穿过细胞膜而与DNA结合, 在紫外光激发下可发出蓝色和红色两种荧光, 主要应用在细胞周期的研究. 1996年, Goodell等[20]在用Hoechst33342荧光染料对小鼠骨髓造血干细胞进行检测时, 发现不到0.1%的一小群细胞呈彗星状分布在细胞主群的一侧, 他们将这群细胞称为SP细胞. Kondo等[21]最早在大鼠胶质瘤细胞系C6中首先发现了肿瘤系中SP细胞的存在. 近年来在多种肿瘤细胞系中都发现了SP细胞, 他们具有自我更新和多向分化增殖潜能, 因此将SP作为鉴定干细胞的标志之一, SP细胞可以作为干细胞研究的重要资源[22].
近有很多研究报道, SP细胞是肿瘤发生、发展、复发、转移和化疗抵抗的根源[6,23,24]. Das等[25]报道, 低氧会促使肿瘤的SP细胞迁移到低氧区域而且会导致SP细胞的扩增. 最近的研究还表明, 低氧微环境可激活HIF-2α-ABCG2信号通路[6,26], 使干细胞标志物ABCG2表达增加, 从而促进SP细胞处于未分化状态和增强SP细胞外排药物的能力. 乳腺癌耐药蛋白[breast cancer resistance protein(BCRP/ABCG2)]是与干细胞表型有密切关系的一个, 被认为是一个通用的干细胞标志物[27]. 诱导凋亡是5-Fu抗肿瘤的基本机制[28], 研究表明, 肿瘤低氧可降低5-Fu的抗肿瘤活性[12]. 此外, 5-Fu是细胞周期特异性药物, 对细胞各个周期均有抑制作用, 以S期的作用最佳[29].
本研究发现, 低氧模拟剂可显著促进SP细胞的比例及HIF-2α、ABCG2蛋白的表达, 与常氧组比较明显升高, 这与最近的很多研究报道相一致[18,20,28]. 其机制可能与低氧微环境促进SP细胞扩增及诱导肿瘤细胞HIF-2α-ABCG2表达增加有关. 低氧微环境下5-Fu呈时间和剂量性地抑制SGC7901细胞增殖, 但与常氧组相比, 其抑制作用减弱, 这可能与低氧促进ABCG2表达升高相关. 低氧微环境下, 随着5-Fu作用时间的延长, SP细胞的比例及HIF-2α、ABCG2蛋白的表达逐渐增加, 与常氧组各时间点比较均具有统计学意义. 这与大量的S期细胞被杀死, 残存的G0期细胞增多及低氧促进SP细胞扩增有关. SP细胞具有的强大的外排药物能力和所处的相对静息的细胞周期都导致其更高的耐药能力, 这是导致临床上胃癌化疗失败的主要原因之一.
总之, 我们的研究结果提示, 胃癌细胞中存在表达肿瘤干细胞标志物的SP细胞, 低氧微环境下这类细胞的比例增加和活性增强导致了胃癌的化疗抵抗. 阻断低氧和SP细胞之间的调节通路, 诱导其分化及改善肿瘤中存在的低氧环境等, 有助于改善胃癌的化疗抵抗, 增强化疗效果, 其具体机制有待于进一步研究.
低氧是多种实体肿瘤包括胃癌的特征之一, 低氧不但可以维持肿瘤干细胞的未分化状态, 还可以诱导非肿瘤干细胞的去分化, 从而表现肿瘤干细胞特征, 可能是低氧下肿瘤放化疗抵抗和复发的根源.
陈卫昌, 教授, 苏州大学附属第一医院消化内科
化疗是当前治疗胃癌的主要手段之一, 但治疗效果仍无重大进展, 其主要原因就是胃癌细胞对化疗药物产生了多药耐药, 该领域是目前研究的一个热点, 但具体耐药机制尚不十分明确.
研究表明ABCG2是HIF-2α的一个直接靶基因, 低氧通过诱导HIF-2α-ABCG2通路高表达导致肿瘤干细胞的多药耐药.
本研究结果表明低氧可降低5-Fu的抗肿瘤活性, 并初步揭示其机制可能与低氧通过诱导HIF-2α-ABCG通路的表达, 促进肿瘤细胞的干细胞化有关.
本文主要探讨了低氧下5-Fu对胃癌SGC7901细胞存在化疗抵抗可能与低氧通过诱导HIF-2α-ABCG通路的表达、促进肿瘤细胞的干细胞化有关. 选题尚可, 设计合理, 有一定的研究参考价值.
编辑: 张姗姗 电编:闫晋利
| 1. | Bertout JA, Patel SA, Simon MC. The impact of O2 availability on human cancer. Nat Rev Cancer. 2008;8:967-975. [PubMed] [DOI] |
| 2. | Simon MC, Keith B. The role of oxygen availability in embryonic development and stem cell function. Nat Rev Mol Cell Biol. 2008;9:285-296. [PubMed] [DOI] |
| 3. | Zhang J, Li L. Stem cell niche: microenvironment and beyond. J Biol Chem. 2008;283:9499-9503. [PubMed] [DOI] |
| 4. | Heddleston JM, Li Z, Lathia JD, Bao S, Hjelmeland AB, Rich JN. Hypoxia inducible factors in cancer stem cells. Br J Cancer. 2010;102:789-795. [PubMed] [DOI] |
| 5. | Hiyama A, Skubutyte R, Markova D, Anderson DG, Yadla S, Sakai D, Mochida J, Albert TJ, Shapiro IM, Risbud MV. Hypoxia activates the notch signaling pathway in cells of the intervertebral disc: implications in degenerative disc disease. Arthritis Rheum. 2011;63:1355-1364. [PubMed] [DOI] |
| 6. | Hu L, McArthur C, Jaffe RB. Ovarian cancer stem-like side-population cells are tumourigenic and chemoresistant. Br J Cancer. 2010;102:1276-1283. [PubMed] [DOI] |
| 7. | Doyle LA, Ross DD. Multidrug resistance mediated by the breast cancer resistance protein BCRP (ABCG2). Oncogene. 2003;22:7340-7358. [PubMed] [DOI] |
| 8. | Kim M, Turnquist H, Jackson J, Sgagias M, Yan Y, Gong M, Dean M, Sharp JG, Cowan K. The multidrug resistance transporter ABCG2 (breast cancer resistance protein 1) effluxes Hoechst 33342 and is overexpressed in hematopoietic stem cells. Clin Cancer Res. 2002;8:22-28. [PubMed] |
| 9. | Wielinga P, Hooijberg JH, Gunnarsdottir S, Kathmann I, Reid G, Zelcer N, van der Born K, de Haas M, van der Heijden I, Kaspers G. The human multidrug resistance protein MRP5 transports folates and can mediate cellular resistance against antifolates. Cancer Res. 2005;65:4425-4430. [PubMed] [DOI] |
| 10. | Martin CM, Ferdous A, Gallardo T, Humphries C, Sadek H, Caprioli A, Garcia JA, Szweda LI, Garry MG, Garry DJ. Hypoxia-inducible factor-2alpha transactivates Abcg2 and promotes cytoprotection in cardiac side population cells. Circ Res. 2008;102:1075-1081. [PubMed] [DOI] |
| 11. | Xiang L, Liu ZH, Huan Q, Su P, Du GJ, Wang Y, Gao P, Zhou GY. Hypoxia-inducible factor-2a is associated with ABCG2 expression, histology-grade and Ki67 expression in breast invasive ductal carcinoma. Diagn Pathol. 2012;7:32. [PubMed] [DOI] |
| 12. | Yoshiba S, Ito D, Nagumo T, Shirota T, Hatori M, Shintani S. Hypoxia induces resistance to 5-fluorouracil in oral cancer cells via G(1) phase cell cycle arrest. Oral Oncol. 2009;45:109-115. [PubMed] [DOI] |
| 13. | Shannon AM, Bouchier-Hayes DJ, Condron CM, Toomey D. Tumour hypoxia, chemotherapeutic resistance and hypoxia-related therapies. Cancer Treat Rev. 2003;29:297-307. [PubMed] [DOI] |
| 14. | Cosse JP, Michiels C. Tumour hypoxia affects the responsiveness of cancer cells to chemotherapy and promotes cancer progression. Anticancer. Agents Med Chem. 2008;8:790-797. [PubMed] |
| 15. | Löfstedt T, Fredlund E, Holmquist-Mengelbier L, Pietras A, Ovenberger M, Poellinger L, Påhlman S. Hypoxia inducible factor-2alpha in cancer. Cell Cycle. 2007;6:919-926. [PubMed] [DOI] |
| 16. | Koukourakis MI, Giatromanolaki A, Skarlatos J, Corti L, Blandamura S, Piazza M, Gatter KC, Harris AL. Hypoxia inducible factor (HIF-1a and HIF-2a) expression in early esophageal cancer and response to photodynamic therapy and radiotherapy. Cancer Res. 2001;61:1830-1832. [PubMed] |
| 17. | Roberts AM, Watson IR, Evans AJ, Foster DA, Irwin MS, Ohh M. Suppression of hypoxia-inducible factor 2alpha restores p53 activity via Hdm2 and reverses chemoresistance of renal carcinoma cells. Cancer Res. 2009;69:9056-9064. [PubMed] [DOI] |
| 18. | Koukourakis MI, Giatromanolaki A, Sivridis E, Simopoulos C, Turley H, Talks K, Gatter KC, Harris AL. Hypoxia-inducible factor (HIF1A and HIF2A), angiogenesis, and chemoradiotherapy outcome of squamous cell head-and-neck cancer. Int J Radiat Oncol Biol Phys. 2002;53:1192-1202. [PubMed] [DOI] |
| 19. | Nelson DA, Tan TT, Rabson AB, Anderson D, Degenhardt K, White E. Hypoxia and defective apoptosis drive genomic instability and tumorigenesis. Genes Dev. 2004;18:2095-2107. [PubMed] [DOI] |
| 20. | Goodell MA, Brose K, Paradis G, Conner AS, Mulligan RC. Isolation and functional properties of murine hematopoietic stem cells that are replicating in vivo. J Exp Med. 1996;183:1797-1806. [PubMed] [DOI] |
| 21. | Kondo T, Setoguchi T, Taga T. Persistence of a small subpopulation of cancer stem-like cells in the C6 glioma cell line. Proc Natl Acad Sci USA. 2004;101:781-786. [PubMed] [DOI] |
| 22. | Challen GA, Little MH. A side order of stem cells: the SP phenotype. Stem Cells. 2006;24:3-12. [PubMed] [DOI] |
| 23. | Yao J, Cai HH, Wei JS, An Y, Ji ZL, Lu ZP, Wu JL, Chen P, Jiang KR, Dai CC. Side population in the pancreatic cancer cell lines SW1990 and CFPAC-1 is enriched with cancer stem-like cells. Oncol Rep. 2010;23:1375-1382. [PubMed] |
| 24. | Fillmore CM, Kuperwasser C. Human breast cancer cell lines contain stem-like cells that self-renew, give rise to phenotypically diverse progeny and survive chemotherapy. Breast Cancer Res. 2008;10:R25. [PubMed] [DOI] |
| 25. | Das B, Tsuchida R, Malkin D, Koren G, Baruchel S, Yeger H. Hypoxia enhances tumor stemness by increasing the invasive and tumorigenic side population fraction. Stem Cells. 2008;26:1818-1830. [PubMed] [DOI] |
| 26. | Covello KL, Kehler J, Yu H, Gordan JD, Arsham AM, Hu CJ, Labosky PA, Simon MC, Keith B. HIF-2alpha regulates Oct-4: effects of hypoxia on stem cell function, embryonic development, and tumor growth. Genes Dev. 2006;20:557-570. [PubMed] [DOI] |
| 27. | Zhou S, Schuetz JD, Bunting KD, Colapietro AM, Sampath J, Morris JJ, Lagutina I, Grosveld GC, Osawa M, Nakauchi H. The ABC transporter Bcrp1/ABCG2 is expressed in a wide variety of stem cells and is a molecular determinant of the side-population phenotype. Nat Med. 2001;7:1028-1034. [PubMed] [DOI] |
| 28. | Yoshida K, Yamaguchi K, Osada S, Kawaguchi Y, Takahashi T, Sakashita F, Tanaka Y. Challenge for a better combination with basic evidence. Int J Clin Oncol. 2008;13:212-219. [PubMed] [DOI] |