修回日期: 2012-05-07
接受日期: 2012-06-16
在线出版日期: 2012-07-08
目的: 探讨胃癌组织中microRNA-433表达差异以及其可能下调的机制, 及在低表达microRNA-433胃癌细胞系中提升其表达的量对细胞生长的影响.
方法: 取胃癌组织及其正常癌旁组织43例, 实时定量检测两者表达差异, 并结合病例分析. 使用1、5、10 μmol/L 5-Aza-CdR干预胃癌SGC-7901细胞, 检测每组microRNA-433的表达变化. 转染microRNA-433 mimics进入SGC-7901细胞, 用流式细胞术检测细胞增殖凋亡情况.
结果: 胃癌组织相对其正常癌旁组织, microRNA-433表达量明显减低, 差异有明显统计学意义(P<0.05), microRNA-433表达与性别、分化、年龄无明显关系(P>0.05), 同肿瘤分期有统计学意义(P<0.05). 胃癌细胞系SGC-7901中microRNA-433的表达相对于正常胃黏膜上皮细胞GES-1明显减低. SGC-7901细胞通过甲基化酶抑制剂5-Aza-CdR以浓度1、5、10 μmol/L处理5 d之后, 分别检测microRNA-433的表达, 相对未处理组, 其表达均有上升并且呈现出剂量依赖性. 将microRNA-433 mimics转染至SGC-7901中提高其表达, 通过流式细胞术检测发现, 相比未处理组, 提高表达后肿瘤细胞凋亡率上升, 具有统计学意义(P<0.05).
结论: microRNA-433在胃癌组织中表达减低, 并且同肿瘤分期有关. 使用5-Aza-CdR作用SGC-7901肿瘤细胞系后, microRNA-433的表达明显上升. 其表达下调的机制可能是由于前端启动子区域高甲基化造成, 转染提升肿瘤细胞中microRNA-433的表达, 可以促进肿瘤细胞的凋亡. microRNA-433具有潜在的抑癌作用.
引文著录: 李睿东, 韩高雄, 李伟, 陶凯雄. microRNA-433在胃癌组织中的表达下降及对胃癌细胞系生长的影响. 世界华人消化杂志 2012; 20(19): 1726-1731
Revised: May 7, 2012
Accepted: June 16, 2012
Published online: July 8, 2012
AIM: To investigate the expression of microRNA-433 in gastric cancer and to explore the possible mechanisms involved.
METHODS: The expression level of microRNA-433 in 43 cases of gastric cancer and matched adjacent normal tissue samples was examined by qRT-PCR. The relationship between microRNA-433 expression and clinical features of gastric cancer was analyzed. Human gastric cancer SGC-7901 cells were treated with 1, 5, or 10 μmol/L of 5-Aza-CdR for five days, and the expression level of microRNA-433 in treated cells was determined. SGC-7901 cells were then transfected with a microRNA-433 mimic, and the proliferation and apoptosis of the transfected cells were examined by FCM.
RESULTS: The expression level of microRNA-433 was lower in gastric cancer than in normal gastric tissue (P < 0.05). MicroRNA-433 expression was associated with tumor stage (P < 0.05), but not with sex, age or tumor differentiation. The expression level of microRNA-433 in SGC-7901 cells was significantly lower than that in gastric mucosal cell line GES-1. Treatment of SGC-7901 cells with 5-Aza-CdR up-regulated microRNA-433 expression in a dose-dependent manner. Transfection of SGC-7901 cells with a microRNA-433 mimic up-regulated the expression of microRNA-433 and increased cell apoptosis.
CONCLUSION: The expression level of microRNA-433 is lower in gastric cancer than in normal gastric tissue. MicroRNA-433 expression correlates with tumor stage. Treatment of SGC-7901 cells with 5-Aza-CdR up-regulates microRNA-433 expression possibly by regulating promoter methylation. Transfection of SGC-7901 cells with a microRNA-433 mimic accelerates apoptosis of tumor cells, suggesting that microRNA-433 is a potent tumor suppressor.
- Citation: Li RD, Han GX, Li W, Tao KX. Down-regulation of microRNA-433 expression in gastric cancer: Possible mechanisms involved. Shijie Huaren Xiaohua Zazhi 2012; 20(19): 1726-1731
- URL: https://www.wjgnet.com/1009-3079/full/v20/i19/1726.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i19.1726
在世界范围内, 胃癌(gastric cancer, GC)发病率居高不下, 在男性恶性肿瘤当中占第2位, 仅次于肺癌, 在女性恶性肿瘤中占据第4位. 在我国, 目前胃癌在各种恶性肿瘤中已经占据首位. 微小核糖核酸(microRNAs, miRNAs)是一种微小非编码RNAs, 在翻译水平通过与mRNA的3'UTR(untranslated region, UTR)完全或不完全结合加速mRNA的降解或者抑制mRNA的降解[1]. 目前有相当多的研究发现, microRNAs在肿瘤的发生发展中有着重要的作用, microRNAs在细胞内表达异常可以引起多种肿瘤[2]. microRNAs的表达调控机制仍未完全阐明, 但许多研究成果显示, 相当部分的microRNAs表达受到表观遗传学的调控, DNA甲基化修饰便是其中之一[3-7]. 表观遗传学在动物的生命过程中具有极其重要的作用, 与相当多疾病的产生和演变也有着密切的联系. 在基因中, 有许多抑癌基因和癌基因, 前者启动子前端甲基化有可能导致肿瘤的发生和发展, 后者启动子前端去甲基化也可以导致肿瘤的发生或发展. 许多实验也证明, 改变基因的甲基化状态, 往往可以改变或逆转肿瘤的发展. Luo等[8]通过基因芯片筛查发现miRNA-433在胃癌细胞系和肿瘤组织中表达下降, 但是未对临床标本进行实时PCR检测进一步验证, 于是本实验首先检测临床标本中miRNA-433的表达差异, 然后在SGC-7901中转染miRNA-433的mimics对细胞的生长的影响, 探讨miRNA-433在胃癌发生发展中的作用及其潜在功能. 5-氮杂-2'-脱氧胞苷(5-aza-2'-deoxycytidine, 5-Aza-CdR), 一种DNA甲基转移酶(DNA methyltransferase, DNMT)抑制剂, 通过抑制甲基化转移酶, 可使多种启动子区域高甲基化的抑癌基因重新表达或表达增高[9,10]. 鉴于miRNA-433前端启动子区域存在CpG岛, 其可能由于甲基化从而导致表达下降, 故而给予SGC-7901胃癌细胞系5-Aza-CdR处理, 观察miRNA-433表达变化, 探索miRNA-433在胃癌中表达下调的机制.
收集华中科技大学同济医学院附属协和医院胃肠外科胃癌手术患者43例标本(2010-08/2011-09)作为研究对象, 其中男28例, 女15例, 年龄28-74岁, 平均年龄55.2岁. 所有患者术前均未进行化学治疗, 标本适当处理后置于-80 ℃冰箱, 留作日后使用; 细胞株SGC-7901, GES-1为华中科技大学同济医学院附属协和医院腹腔镜外科实验室冻存; 胎牛血清, 1640培养基均购自Hyclone公司; Opti-MEM培养基、lipofectaminTM2000购自Invitrogen公司; 5-氮杂-2-脱氧胞苷由sigma公司提供; TRIzol试剂, 逆转录、qRT-PCR试剂盒均由TAKARA提供; microRNA mimics和neagtive control购自广州锐博生物公司; microRNA引物及内参U6引物由南京金斯瑞公司合成.
1.2.1 胃癌标本中实时定量PCR检测miRNA-433表达: (1)RNA提取. 按TRIzol试剂说明书抽提标本中总RNA, DEPC水对RNA进行溶解, 用分光光度计测量260 nm和280 nm下吸光度(A)值, 以确定和调整RNA的浓度和纯度; (2)miRNA-433在胃癌标本中的表达检测. 本实验选择U6基因作为内部参照, 引物序列引自参考文献[3]. 用提取的1 μg总RNA同miRNA-433 RT Primer 2 μL, U6 RT Primer 2 μL, 5×PrimerScript®Buffer 4 μL, PrimerScript® RT Enzyme Mix Ⅰ 1 μL, 余下加入无RNA酶双蒸水补足至20 μL体系. 设置反应条件为: 42 ℃ 60 min, 70 ℃ 10 min. 反应结束后-80 ℃保存. 然后以20 μL体系进行实时定量PCR, 体系包括: SYBR®Primix Ex TagTMⅡ(2×)10 μL, microRNA-433 Forward Primer(10 μmol/L)1 μL, microRNA-433 Reverse Primer(10 μmol/L)1 μL, RT产物(cDNA)2 μL, 灭菌蒸馏水6 μL. 反应条件设置为: 95 ℃预变性: 30 s; 95 ℃变性: 10 s, 60 ℃退火: 20 s, 70 ℃延伸: 10 s, 循环45次. 实时定量PCR使用Applied Biosystems 7500设备, 每个样品设3个复孔. 根据每孔荧光信号达到阈值时经历的循环数作为Ct值, 以U6为内参, 使用相对定量法, 用n = 2-∆∆Ct表示肿瘤中miRNA-433相对正常组织表达的倍数, 此时∆∆Ct = (CtmiRNA-433-CtU6)肿瘤-(CtmiRNA-433-CtU6)正常.
1.2.2 细胞培养及去甲基化处理以及对miRNA-433表达的检测: (1)细胞培养. 冻存的SGC-7901细胞株在37 ℃水中快速复苏, 加入4 mL 1640培养基后快速1 000 r/min离心5 min, 弃上清, 用5 mL 1640培养基重悬, 移入培养瓶中, 置于37 ℃、50 mL/L CO2培养箱中. 正常胃黏膜上皮细胞系GES-1采取同上相同的步骤培养; (2)检测胃癌正常黏膜细胞系GES-1同SGC-7901细胞miRNA-433的表达差异. 取生长对数期细胞, 分别种于6孔培养板中, 每孔种植5×105个细胞, 24 h细胞贴壁生长后, PBS洗涤2遍, TRIzol法提取总DNA, 逆转录后进行实时定量PCR, 检测两者之间表达差异; (3)细胞培养干预及检测. 6孔板中每孔种植0.5×105个细胞, 种植5组, 每组3个复孔, 放入37 ℃温箱培养4 h后, 分别在每孔中加入0、1、5、10 μmol/L 5-Aza-CdR, 阴性对照组分别加入等量的DMSO, 每天更换培养基并按上述加药, 5 d后实时定量PCR检测microRNA-433的表达变化; (4)转染miRNA-433 mimics对SGC-7901细胞系生长的影响. 转染前1 d, 细胞悬浮计数, 6孔板每孔种4×105个肿瘤细胞, 共设3孔, 设立对照、空白、转染组, 设3个复孔. 用250 μL不含血清培养基Opti-MEM稀释mimics和阴性对照, 孵育5 min. 然后用250 μL不含血清培养基Opti-MEM稀释5 μL lipofectaminTM2000, 将两者混合室温孵育20 min, 混合液加入已经添加不含血清培养基Opti-MEM 1.5 mL 6孔板中, 6 h后更换普通培养基. 转染后36 h, 将6孔板培养液吸出, PBS洗涤一次, 胰酶消化2 min, 将细胞从板中吹打下来, 收集进离心管中, 离心计数, 取5×104-10×104个细胞, 离心弃上清加入195 μL Annexin V-FITC结合液重悬, 再加入5 μL Annexin V-FITC, 轻轻混匀. 室温孵育20 min, 离心弃上清, 加入Annexin V-FITC结合液190 μL, 加入10 μL碘化丙啶染色液, 冰浴放置, 流式检测.
统计学处理 SPSS19.0统计软件包处理数据, 实验数据以mean±SD表示, 采用Wilcoxon符号秩检验(配对正常组和肿瘤组), Mann-Whitney U检验(2组)和Kruskal-Wallis H检验(多组)进行统计学处理, P<0.05具有统计学意义, P<0.001具有显著统计学差异.
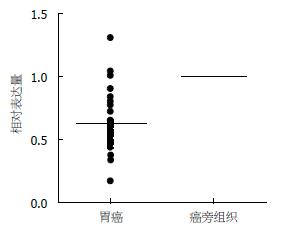
在以U6为内参照的情况下, 同胃癌癌肿周边正常组织比较, miRNA-433的表达量在胃癌中是相对下降的, 其表达量(n = 2-∆∆Ct)N值为0.623±0.197, 可以见得, miRNA-433在肿瘤细胞上皮中的表达是明显低于其对应的正常组织胃黏膜(图1). 并且发现miRNA-433在TNM分期Ⅰ、Ⅱ相比Ⅲ、Ⅳ期明显增高(表1), 具有统计学意义(P = 0.035).
| n | miRNA-433表达量 | P 值 | |
| 性别 | 0.236 | ||
| 男 | 28 | 0.654±0.219 | |
| 女 | 15 | 0.558±0.138 | |
| 分化程度 | 0.842 | ||
| 高中分化 | 26 | 0.621±0.160 | |
| 低分化 | 17 | 0.625±0.249 | |
| 年龄 | 0.582 | ||
| ≤60 | 24 | 0.605±0.156 | |
| >60 | 19 | 0.645±0.241 | |
| TNM分期 | 0.024 | ||
| Ⅰ, Ⅱ | 29 | 0.701±0.180 | |
| Ⅲ, Ⅳ | 14 | 0.460±0.115 |
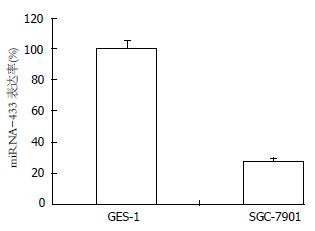
SGC-7901中的miRNA-433的表达量较低, 相对于正常胃黏膜细胞系GES-1下调了72.7%, 差异性明显(P<0.05, 图2).
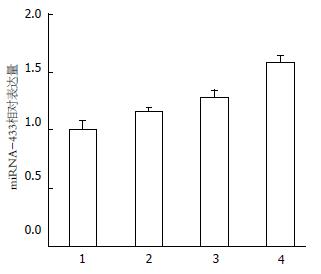
同未进行处理的SGC-7901细胞相比, 其细胞表达miRNA-433的量随着5-Aza-CdR的量增加而增加, 0 µmol/L组为1.00±0.08, 1 µmol/L组为1.16±0.03, 5 µmol/L组为1.28±0.06, 10 µmol/L组为1.57±0.06, Kruskal-Wallis H检验差异有明显统计学意义(P = 0.016, 图3).
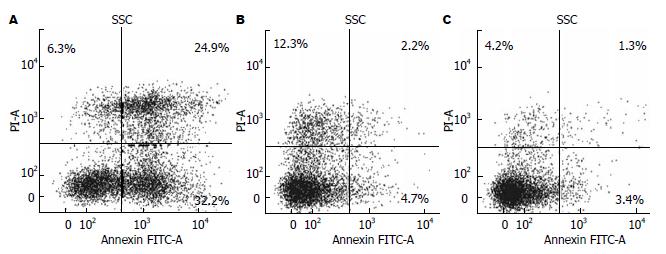
转染后导致肿瘤细胞凋亡增加. Mimics组凋亡明显, 达到24.4%±1.1%, 其阴性对照组为3.2%±1.0%, 正常对照组为2.5%±1.0%. 其中mimics同其余两组相比, 统计学差异明显(P<0.05), 阴性对照同正常组无明显差别(P>0.05, 图4).
已经有越来越多的研究表明, 一些microRNAs在人类的肿瘤性疾病中表达出现混乱[11-16]. 具有抑癌作用的miRNAs, 其表达下调或缺失将导致其靶蛋白脱离控制, 表达上调, 促进肿瘤细胞过度增殖, 生长加速, 凋亡缺失, 从而导致了肿瘤细胞的产生和肿瘤的发生和发展[17-20]. 例如, 在慢性淋巴细胞白血病中发现miRNA-15和miRNA-16表达下调甚至缺失[21]; 在胆管癌中, miRNA-513下调, 使得肿瘤细胞发生免疫逃避而发生肿瘤[22]. 同时, miRNAs的表达出现异常, 也有近期研究发现, 在胃癌中有多个miRNA的表达发生下调, 其中有些是由于其启动子发生了高甲基化, 这些miRNA在正常表达的情况下被证实具有一定的抑癌功能[23-28]. 例如, miRNA-34b、miRNA-34c在胃癌细胞中启动子CpG岛发生高甲基化从而导致其低表达, 而正常人黏膜中却没有甲基化这一现象[29]. 从而提示, miRNAs启动子区域高甲基化也是胃癌的发生机制之一.
在本实验中, 首先通过对临床标本应用Real-time RT-PCR技术检测了43例标本中肿瘤和肿瘤旁正常组织miRNA-433的表达情况, 结果发现: 相比正常的胃黏膜组织, 肿瘤部分miRNA-433的表达明显降低, 差异有统计学意义(P<0.05), 与Luo等[8]的研究结果相一致. 并且通过临床病例分析, 发现microRNA-433在TNM分期3, 4期同1, 2期相比, 晚期肿瘤病例的表达相对早期病例较低, 具有统计学差异(P<0.05). 与Ueda等[30]的研究结果具有类似性. 至于在胃癌中miRNA-433下调的机制, 本文首次通过将甲基化抑制剂5-氮杂-2-脱氧胞苷加入到低表达miRNA-433的胃癌细胞系SGC-7901中作用一段时间后, 再去检测miRNA-433的表达是否有变化, 并且通过实时定量PCR的方法, 证实了在加入了5-氮杂-2-脱氧胞苷后, SGC-7901中的microRNA-433的表达提升明显, 同未加药组相比具有明显的统计学意义(P<0.05). 由此间接证明了microRNA-433前端启动子CpG岛甲基化是导致了microRNA-433在胃癌中下调的可能机制之一. 关于microRNA的作用机制, Luo等[8]提出并且证实其可以结合与生长因子受体结合蛋白2(growth factor receptor-bound protein 2, GRB2), 抑制其翻译表达, 从而通过多条通路抑制细胞生长、增殖、分化. 叶韵斌等[31]证实抑制GRB2的表态抑制乳癌细胞生长并诱导细胞调亡. 我们通过将miRNA-433的mimics转染到SGC-7901细胞系中, 提高了miRNA-433在胃癌细胞系中表达之后, 用流式细胞术检测其对细胞凋亡的影响, 发现mimics组相比空白和阴性对照组, 其细胞凋亡率上升, 差异具有统计学意义(P<0.05).
总之, 本次研究证明了microRNA-433相比正常癌旁组织, 在胃癌组织中其表达是下调的, 其表达同肿瘤分期相关. 通过实时定量PCR间接证明了microRNA-433启动子甲基化在其下调机制中具有明显作用, 最后通过转染mimics, 流式细胞术检测细胞凋亡, 证明了microRNA-433具有一定的抑癌基因作用. 因此, 通过药物改变miRNA-433启动子甲基化状态可能成为靶向治疗胃癌的靶点.
目前有相当多的研究发现, microRNAs在肿瘤的发生发展中有着重要的作用, microRNAs在细胞内表达异常可以引起多种肿瘤.
姜相君, 主任医师, 青岛市市立医院消化科
Luo等提出并且证实miRNA-433可以结合与生长因子受体结合蛋白2, 抑制其翻译表达, 从而通过多条通路抑制细胞生长, 增殖, 分化.
本文收集充足标本, 对miRNA-433的表达同临床病理进行了分析, 其次又验证了miRNA-433的潜在抑癌作用, 从表观遗传的角度阐述了miRNA-433表达可能导致肿瘤的发生.
本文初步验证miRNA-433的功能, 对其潜在抑癌作用和表达下调机制进行了分析, 为临床分子靶向治疗提供了思路.
本文立题新颖, 研究思想明确, 对从microRNA角度治疗胃癌等提供了较好的参考依据.
编辑: 曹丽鸥 电编:鲁亚静
| 1. | Fassan M, Croce CM, Rugge M. miRNAs in precancerous lesions of the gastrointestinal tract. World J Gastroenterol. 2011;17:5231-5239. [PubMed] [DOI] |
| 2. | Kasinski AL, Slack FJ. Epigenetics and genetics. MicroRNAs en route to the clinic: progress in validating and targeting microRNAs for cancer therapy. Nat Rev Cancer. 2011;11:849-864. [PubMed] [DOI] |
| 4. | Cheung HH, Davis AJ, Lee TL, Pang AL, Nagrani S, Rennert OM, Chan WY. Methylation of an intronic region regulates miR-199a in testicular tumor malignancy. Oncogene. 2011;30:3404-3415. [PubMed] [DOI] |
| 5. | Tsai KW, Wu CW, Hu LY, Li SC, Liao YL, Lai CH, Kao HW, Fang WL, Huang KH, Chan WC. Epigenetic regulation of miR-34b and miR-129 expression in gastric cancer. Int J Cancer. 2011;129:2600-2610. [PubMed] [DOI] |
| 6. | Shen R, Pan S, Qi S, Lin X, Cheng S. Epigenetic repression of microRNA-129-2 leads to overexpression of SOX4 in gastric cancer. Biochem Biophys Res Commun. 2010;394:1047-1052. [PubMed] [DOI] |
| 7. | Kim K, Lee HC, Park JL, Kim M, Kim SY, Noh SM, Song KS, Kim JC, Kim YS. Epigenetic regulation of microRNA-10b and targeting of oncogenic MAPRE1 in gastric cancer. Epigenetics. 2011;6:740-751. [PubMed] [DOI] |
| 8. | Luo H, Zhang H, Zhang Z, Zhang X, Ning B, Guo J, Nie N, Liu B, Wu X. Down-regulated miR-9 and miR-433 in human gastric carcinoma. J Exp Clin Cancer Res. 2009;28:82. [PubMed] [DOI] |
| 9. | Yang AS, Doshi KD, Choi SW, Mason JB, Mannari RK, Gharybian V, Luna R, Rashid A, Shen L, Estecio MR. DNA methylation changes after 5-aza-2'-deoxycytidine therapy in patients with leukemia. Cancer Res. 2006;66:5495-5503. [PubMed] [DOI] |
| 10. | Mossman D, Kim KT, Scott RJ. Demethylation by 5-aza-2'-deoxycytidine in colorectal cancer cells targets genomic DNA whilst promoter CpG island methylation persists. BMC Cancer. 2010;10:366. [PubMed] [DOI] |
| 11. | Weissmann-Brenner A, Kushnir M, Lithwick Yanai G, Aharonov R, Gibori H, Purim O, Kundel Y, Morgenstern S, Halperin M, Niv Y. Tumor microRNA-29a expression and the risk of recurrence in stage II colon cancer. Int J Oncol. 2012;40:2097-2103. [PubMed] |
| 12. | Li CL, Nie H, Wang M, Su LP, Li JF, Yu YY, Yan M, Qu QL, Zhu ZG, Liu BY. microRNA-155 is downregulated in gastric cancer cells and involved in cell metastasis. Oncol Rep. 2012;27:1960-1966. [PubMed] |
| 13. | Hassan O, Ahmad A, Sethi S, Sarkar FH. Recent updates on the role of microRNAs in prostate cancer. J Hematol Oncol. 2012;5:9. [PubMed] [DOI] |
| 14. | Lopez-Camarillo C, Marchat LA, Arechaga-Ocampo E, Perez-Plasencia C, Del Moral-Hernandez O, Castaneda-Ortiz EJ, Rodriguez-Cuevas S. MetastamiRs: Non-Coding MicroRNAs Driving Cancer Invasion and Metastasis. Int J Mol Sci. 2012;13:1347-1379. [PubMed] [DOI] |
| 15. | Mencia N, Selga E, Noé V, Ciudad CJ. Underexpression of miR-224 in methotrexate resistant human colon cancer cells. Biochem Pharmacol. 2011;82:1572-1582. [PubMed] [DOI] |
| 16. | 王 冬冬, 赵 文月, 宋 孟锜, 由 法平, 杨 永飞, 陈 立波, 杨 炼, 江 红. MicroRNA-377和组蛋白甲基转移酶SMYD3在肝细胞癌中的表达及两者的相关性. 世界华人消化杂志. 2010;18:1902-1906. [DOI] |
| 17. | Wei H, Ke HL, Lin J, Shete S, Wood CG, Hildebrandt MA. MicroRNA target site polymorphisms in the VHL-HIF1α pathway predict renal cell carcinoma risk. Mol Carcinog. 2012; Apr 19. [Epub ahead of print]. [PubMed] [DOI] |
| 18. | Ansari D, Chen BC, Dong L, Zhou MT, Andersson R. Pancreatic cancer: translational research aspects and clinical implications. World J Gastroenterol. 2012;18:1417-1424. [PubMed] [DOI] |
| 19. | Chen B, Zhang B, Luo H, Yuan J, Skogerbø G, Chen R. Distinct MicroRNA Subcellular Size and Expression Patterns in Human Cancer Cells. Int J Cell Biol. 2012;2012:672462. Epub 2012 Feb 12. [PubMed] |
| 20. | Sachdeva M, Liu Q, Cao J, Lu Z, Mo YY. Negative regulation of miR-145 by C/EBP-β through the Akt pathway in cancer cells. Nucleic Acids Res. 2012; Apr 11. [Epub ahead of print]. [PubMed] [DOI] |
| 21. | Calin GA, Dumitru CD, Shimizu M, Bichi R, Zupo S, Noch E, Aldler H, Rattan S, Keating M, Rai K. Frequent deletions and down-regulation of micro- RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia. Proc Natl Acad Sci U S A. 2002;99:15524-15529. [PubMed] [DOI] |
| 22. | Gong AY, Zhou R, Hu G, Li X, Splinter PL, O'Hara SP, LaRusso NF, Soukup GA, Dong H, Chen XM. MicroRNA-513 regulates B7-H1 translation and is involved in IFN-gamma-induced B7-H1 expression in cholangiocytes. J Immunol. 2009;182:1325-1333. [PubMed] |
| 23. | Tsai KW, Wu CW, Hu LY, Li SC, Liao YL, Lai CH, Kao HW, Fang WL, Huang KH, Chan WC. Epigenetic regulation of miR-34b and miR-129 expression in gastric cancer. Int J Cancer. 2011;129:2600-2610. [PubMed] [DOI] |
| 24. | Tsai KW, Hu LY, Wu CW, Li SC, Lai CH, Kao HW, Fang WL, Lin WC. Epigenetic regulation of miR-196b expression in gastric cancer. Genes Chromosomes Cancer. 2010;49:969-980. [PubMed] [DOI] |
| 25. | Hashimoto Y, Akiyama Y, Otsubo T, Shimada S, Yuasa Y. Involvement of epigenetically silenced microRNA-181c in gastric carcinogenesis. Carcinogenesis. 2010;31:777-784. [PubMed] [DOI] |
| 26. | Wada R, Akiyama Y, Hashimoto Y, Fukamachi H, Yuasa Y. miR-212 is downregulated and suppresses methyl-CpG-binding protein MeCP2 in human gastric cancer. Int J Cancer. 2010;127:1106-1114. [PubMed] [DOI] |
| 27. | Ando T, Yoshida T, Enomoto S, Asada K, Tatematsu M, Ichinose M, Sugiyama T, Ushijima T. DNA methylation of microRNA genes in gastric mucosae of gastric cancer patients: its possible involvement in the formation of epigenetic field defect. Int J Cancer. 2009;124:2367-2374. [PubMed] [DOI] |
| 28. | Tsai KW, Kao HW, Chen HC, Chen SJ, Lin WC. Epigenetic control of the expression of a primate-specific microRNA cluster in human cancer cells. Epigenetics. 2009;4:587-592. [PubMed] [DOI] |
| 29. | Suzuki H, Yamamoto E, Nojima M, Kai M, Yamano HO, Yoshikawa K, Kimura T, Kudo T, Harada E, Sugai T. Methylation-associated silencing of microRNA-34b/c in gastric cancer and its involvement in an epigenetic field defect. Carcinogenesis. 2010;31:2066-2073. [PubMed] [DOI] |
| 30. | Ueda T, Volinia S, Okumura H, Shimizu M, Taccioli C, Rossi S, Alder H, Liu CG, Oue N, Yasui W. Relation between microRNA expression and progression and prognosis of gastric cancer: a microRNA expression analysis. Lancet Oncol. 2010;11:136-146. [PubMed] [DOI] |
| 31. | 叶 韵斌, 陈 慧菁, 刘 枋, 李 洁羽, 陈 强. 抑制生长因子受体连接蛋白-2表达对乳癌细胞生长的影响. 中国药理学与毒理学杂志. 2008;22:55-62. |