修回日期: 2012-06-20
接受日期: 2012-06-27
在线出版日期: 2012-07-08
目的: 观察肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)刺激大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)情况下, 共培养体系中BMSCs对大鼠肝星状细胞(hepatic stellate cells, HSCs)凋亡的影响并探讨其机制.
方法: 全骨髓贴壁法分离、纯化SD大鼠BMSCs, 传至第3-4代使用. 运用6孔Transwell板建立共培养体系, 将TNF-α刺激BMSCs后与HSCs共培养. 实验分HSCs空白对照组、BMSCs空白对照组、正常共培养组、刺激共培养组; 采用流式细胞术检测HSCs凋亡, RT-PCR、Western blot分别检测RhoA与HGF mRNA及蛋白表达, ELISA测定细胞培养上清液中HGF含量.
结果: 刺激共培养组24 h、48 h HSCs RhoA蛋白(24 h: 0.864±0.006, 48 h: 0.688±0.013)及mRNA(24 h: 0.809±0.004, 48 h: 0.494±0.010)表达进行性下降, 与正常共培养组和HSCs空白对照组比较有显著性差异(P<0.01), BMSCs HGF蛋白(24 h: 1.032±0.003, 48 h: 1.060±0.003)及mRNA(24 h: 0.857±0.004, 48 h: 1.195±0.010)表达呈时间依赖性递增, 与正常共培养组比较差异有统计学意义(P<0.05); 刺激共培养组24 h、48 h HSCs凋亡率分别为6.583%±0.091%、29.960%±0.223%, 与正常共培养组(24 h: 4.700%±0.168%, 48 h: 23.140%±0.115%)比较差异有统计学意义(P<0.01).
结论: TNF-α刺激BMSCs后与HSCs共培养明显促进HSCs凋亡, 其机制可能是BMSCs通过旁分泌HGF抑制HSCs RhoA表达实现的.
引文著录: 罗显克, 陆正峰, 姜海行, 覃山羽, 陈国忠. 肿瘤坏死因子-α刺激骨髓间充质干细胞后对肝星状细胞凋亡的促进作用. 世界华人消化杂志 2012; 20(19): 1713-1719
Revised: June 20, 2012
Accepted: June 27, 2012
Published online: July 8, 2012
AIM: To observe the effect of rat bone marrow mesenchymal stem cells (BMSCs) stimulated by TNF-α on apoptosis of rat hepatic stellate cells (HSCs) in a co-culture system and to explore the possible mechanisms involved.
METHODS: BMSCs from SD rats were isolated, cultured, and purified by the whole bone marrow adherence method. BMSCs at passages 3-4 were stimulated by TNF-α and then co-cultured with HSCs in a Transwell co-culture system. Cells were divided into HSCs blank group, BMSCs blank group, normal co-culture group, and TNF-α-stimulated co-culture group. Apoptosis of HSCs was detected by flow cytometry; expression of RhoA and HGF mRNAs and proteins was tested by reverse transcription-polymerase chain reaction (RT-PCR) and Western blot, respectively; and concentration of hepatocyte growth factor (HGF) in cell supernatants was determined by ELISA.
RESULTS: Compared to the normal co-culture group and HSCs blank group, the expression of RhoA protein (24 h: 0.864 ± 0.006, 48 h: 0.688 ± 0.013) and mRNA (24 h: 0.809 ± 0.004, 48 h: 0.494 ± 0.010) in HSCs was significantly lower in the TNF-α-stimulated co-culture group (all P < 0.01). The expression of HGF protein (24 h: 1.032 ± 0.003, 48 h: 1.060 ± 0.003) and mRNA (24 h: 0.857 ± 0.004, 48 h: 1.195 ± 0.010) in BMSCs was significantly higher in the TNF-α-stimulated co-culture group than in the normal co-culture group (all P < 0.05). The apoptosis rate of HSCs was significantly increased in the TNF-α-stimulated co-culture group (24 h: 6.583% ± 0.091%; 48 h: 29.960% ± 0.223%) compared to the normal co-culture group (24 h: 4.700% ± 0.168%, 48 h: 23.140% ± 0.115%; both P < 0.01).
CONCLUSION: BMSCs stimulated by TNF-α enhance the apoptosis of HSCs possibly via paracrine production of HGF by BMSCs to down-regulate RhoA signaling in HSCs.
- Citation: Luo XK, Lu ZF, Jiang HX, Qin SY, Chen GZ. Bone marrow mesenchymal stem cells stimulated by TNF-α enhance the apoptosis of hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2012; 20(19): 1713-1719
- URL: https://www.wjgnet.com/1009-3079/full/v20/i19/1713.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i19.1713
大肝星状细胞(hepatic stellate cells, HSCs)的激活与增殖在肝纤维化发生过程中起关键的作用, 骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)移植可改善甚至逆转肝纤维化. 受损的肝组织可分泌肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)等炎症因子, TNF-α刺激间充质干细胞(mesenchymal stem cells, MSCs)后增加其向受损组织的迁移、定植能力, 促进肝细胞生长因子(hepatocyte growth factor, HGF)的表达[1], 研究显示, HGF转染MSCs明显抑制肝纤维化进程[2], RhoA活化促进HSCs的重塑和迁移[3]. 本实验在前期研究基础上, 将TNF-α刺激后的BMSCs与HSCs共培养情况下, 观察BMSCs对HSCs凋亡的影响, 探讨TNF-α刺激的BMSCs诱导HSCs凋亡的机制, 为临床治疗肝纤维化提供理论依据.
肝星状细胞系(HSC-T6)购自中山大学附属肿瘤医院细胞库; DMEM购自美国Gibco公司; 特级胎牛血清购自美国Hyclone公司; 肿瘤坏死因子-α购自美国Peprotech公司; 肝细胞生长因子ELISA试剂盒购自美国R&D system公司; 小鼠抗HGF单克隆抗体、小鼠抗RhoA单克隆抗体、HRP标记的山羊抗小鼠IgG购自美国Santa Cruz公司; TRIzol购自美国Invitrogen公司; 逆转录试剂盒购自美国MBI公司; Transwell insert半透膜购自美国Corning Costar公司; 100-120 g清洁级雄性SD大鼠购自广西医科大学实验动物中心.
1.2.1 BMSCs的分离、培养与鉴定: 参考文献[4]在无菌条件下分离培养, 颈椎脱臼法处死SD大鼠, 无菌分离股骨, 剪断股骨干, 用5 mL注射器吸L-DMEM轻轻冲出骨髓至髓腔变白. 1 000 r/min低速离心4 min收集细胞, 弃上清液, 用含100 mL/L胎牛血清的L-DMEM重悬细胞, 置于37 ℃、饱和湿度、50 mL/L CO2培养箱中培养, 24 h后全量换液, 以后每36-48 h全量换液一次, 待细胞长至80%-90%后, 用2.5 g/L胰酶消化, 按1:2传代, 首次传代时间需6-7 d.
1.2.2 HSC-T6的培养、传代: HSC-T6细胞于L-DMEM培养液(100 mL/L胎牛血清)、37 ℃、50 mL/L CO2培养箱中培养, 2 d后细胞铺满瓶底80%-90%即可传代.
1.2.3 细胞共培养: 参照文献[5-7]方法于6孔Transwell板下层接种BMSCs, 上层接种HSC-T6, 种板密度均为1.5×105 cells/well, 常规培养48 h. 实验分组: (1)HSCs空白对照组: 单纯HSCs培养; (2)BMSCs空白对照组: 单独BMSCs培养; (3)正常共培养组: BMSCs+HSCs共培养; (4)刺激共培养组: BMSCs+TNF-α+HSCs共培养(用0.1 μg/L TNF-α刺激BMSCs 5 h后弃去培养基, D-hanks液洗两遍, 换新鲜培养基后与HSCs共培养). 倒置相差显微镜下动态观察活体细胞形态学改变.
1.2.4 流式细胞仪检测细胞凋亡: 收集各组HSCs, 计数, 按照Annexin-V-FITC/P细胞凋亡试剂盒说明操作.
1.2.5 ELISA检测共培养上清液HGF浓度: 收集24、48 h时段BMSCs, 按说明书操作, 根据标准品A值绘制标准曲线, 计算每孔待测样本上清液中HGF质量浓度.
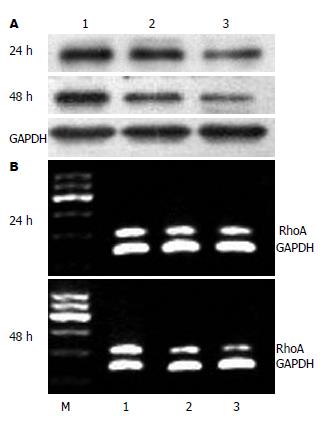
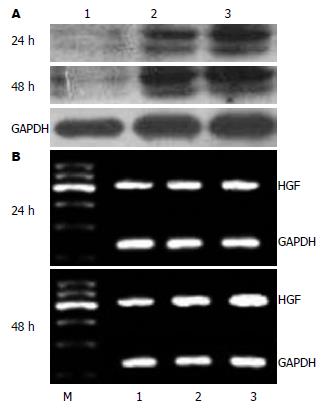
1.2.6 HSCs及BMSCs总RNA提取和RT-PCR: 收集24 h、48 h时段HSCs及BMSCs, 总RNA提取按TRIzol试剂盒说明进行操作. HSCs RhoA上游引物5'-TGGTGATGGAGCTTGTGGTAAG-3', 下游引物5'-AACATCAGTGTCTGGGTAGGAG-3'; BMSCs HGF上游引物5'-AGAGGCGAGGAGAAACGCAAAC-3', 下游引物5'-ATCCACGACCAGGAACAATGAC-3'; GAPDH上游引物 5'-GCCAGTAGACTCCACGACAT-3',下游引物5'-GCAAGTTCAACGGCACAG-3'. RhoA和GAPDH基因扩增条件: 95 ℃预变性5 min, 95 ℃变性45 s, 55 ℃退火45 s, 72 ℃ 1 min, 35个循环后72 ℃延伸5 min; HGF基因扩增条件: 95 ℃预变性5 min, 95 ℃变性45 s, 58 ℃退火45 s, 72 ℃ 1 min, 35个循环后72 ℃延伸5 min. 取 6 μL PCR产物及6 μL DNA Marker进行1.7%琼脂糖凝胶电泳, 采用凝胶图像分析仪进行A值扫描, 以目的基因/GAPDH的灰度比值表示相对目的基因mRNA水平.
1.2.7 HSCs及BMSCs总蛋白提取和Western blot检测: 用细胞裂解液提取24 h、48 h细胞总蛋白, 考马斯亮蓝比色法测定蛋白含量, 上样量为15 μg, 蛋白进行15%SDS-PAGE凝胶电泳, PVDF转膜, 非特异性封闭; 按步骤分别加入RhoA、HGF一抗和二抗, 显影. 用Quality One分析软件对条带进行积分吸光度比值测定.
统计学处理 数据资料以mean±SD表示, 组间比较采用t检验, 应用统计软件SPSS13.0进行分析, 以P<0.05为有统计学差异, P<0.01为有显著性差异.
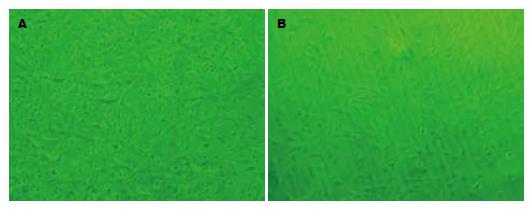
全骨髓贴壁法培养的BMSCs活性良好, 原代培养第5天细胞数量明显增多, 呈短梭状或星状(图1A), 可见较多杂细胞, 6-7 d即可传代; 传代培养至第3代后细胞形态基本上趋于一致, 胞体大, 折光性好, 细胞呈长条梭状, 旋涡状生长(图1B).
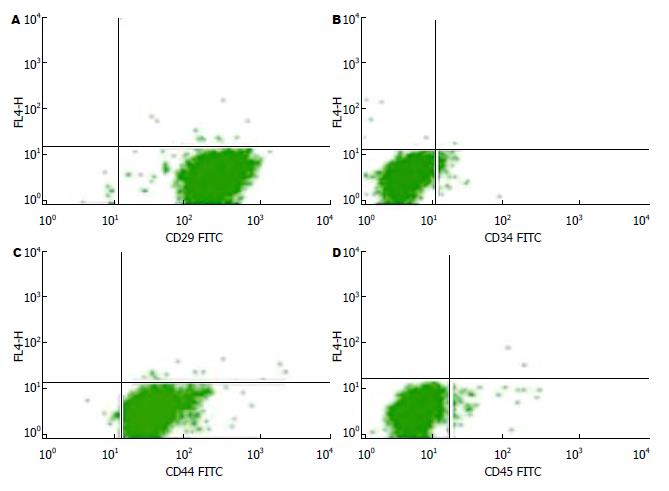
流式细胞仪检测细胞表面标志物CD29+、CD34-、CD44+、CD45-的表达率分别为99.45%、97.91%、99.52%、98.42%. 贴壁法可以获得较高纯度的BMSCs(图2).
培养48 h后, HSCs空白对照组HSCs折光性强, 胞体光滑, 细胞活性良好, 正常共培养组HSCs出现明显细胞皱缩现象, 细胞表面粗糙、折光性差、胞体变小, 刺激共培养组细胞未铺满瓶底即出现细胞明显皱缩现象(图3).
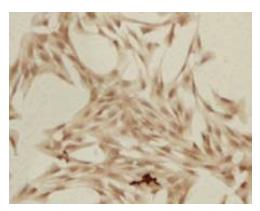
免疫组织化学染色显示, 培养24 h HSCs的α-SMA表达呈阳性, 并被特异性抗体染成棕色细条索状. HSCs呈星形、胞体大、呈片状伸展、伪足很长. α-SMA阳性表达率95%以上(图4).
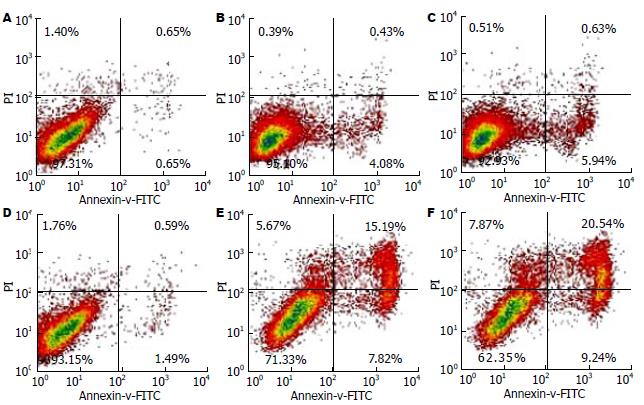
刺激共培养组24 h、48 h HSCs的凋亡率分别为6.583%±0.091%, 29.960%±0.223%, 明显高于正常共培养组的4.700%±0.168%, 23.140%±0.115%(P<0.01), 与HSCs空白对照组(1.347%±0.042%、2.933%±0.086%)比较差异有统计学意义(P<0.01, 图5).
刺激共培养组24 h、48 h HSCs RhoA蛋白及mRNA表达进行性下降, 与正常共培养组和HSCs空白对照组比较有显著性差异(P<0.01)(图6, 表1).
HSCs是肝脏的一种非实质细胞, 位于Disse间隙内, 研究发现, HSCs是正常及纤维化肝脏中细胞外基质(extracellular matrix, ECM)及胶原(collagen)的主要合成细胞, 他的激活与增殖在肝纤维化发生过程中起关键的作用[5], 因此找到促进HSCs凋亡, 进而减少ECM分泌及胶原的合成, 是防治肝纤维化的关键[8,9]. 众多研究表明, BMSCs能诱导HSCs凋亡[10,11], 对多种原因引起的肝损伤具有显著修复作用, 可改善甚至逆转肝纤维化[12-16], 通过旁分泌细胞因子和生长因子途径可能是其作用机制之一[17,18], 但其具体机制目前尚不明确.
TNF-α是受损的肝组织释放的重要炎症因子[19], 他不仅是MSCs发挥免疫抑制功能的始动因子[20], 同时还增强MSCs向受损组织的迁移、定植和黏附能力, 同时明显增加各种生长因子的表达与分泌[1,21-23], 包括白介素-6(interleukin-6, IL-6)、HGF等. 有研究发现TNF-α刺激人BMSCs可通过p38 MAPK和PI3K通路促进HGF分泌, 阻断BMSCs表面肿瘤坏死因子受体Ⅱ(TNF receptor Ⅱ, TNFRⅡ)可抑制HGF分泌[18]. 课题组前期实验[4]采用全骨髓贴壁法获得了较高纯度的大鼠BMSCs, 并证实TNF-α刺激大鼠BMSCs可以有效促进HGF的表达及分泌. 在大鼠肝纤维化模型的研究表明[10], BMSCs通过旁分泌HGF和TGF-β3上调HSCs p21和p27蛋白表达及下调cyclinD1蛋白表达, 使细胞周期停滞于G0/G1期, 从而抑制HSCs生长, 同时通过降低ERK1/2的磷酸化抑制HSCs的活化, 减少胶原Ⅰ、Ⅲ的表达, 从而减少肝纤维化的发生. BMSCs能分泌多种细胞因子[9,24], 如神经细胞生长因子(nerve growth factor, NGF)、胰岛素样生长因子1(insulin-like growth factor, IGF-1)、HGF等, 通过与肝细胞共培养发现, BMSCs表达肝细胞标志物CK-18、白蛋白、AFP等[25,26], 说明BMSCs具有分化成肝细胞的功能. Parekkadan等[10]将人来源的BMSCs与HSCs共培养发现, BMSCs可以显著减少胶原的合成, 抑制HSCs的增殖, 促进其凋亡; 抗体中和实验表明, BMSCs分泌的HGF在促进HSCs凋亡中起重要作用. Shi等[27]提出BMSCs通过分泌NGF与HGF介导, 诱导HSCs不可逆的细胞凋亡, 阻断TGF-β可以增加HSCs的凋亡. 这是否提示在共培养体系中, 增强BMSCs旁分泌能力可以抑制HSCs的活化, 促进HSCs的凋亡?课题前期实验已经证实TNF-α刺激大鼠BMSCs可以明显促进HGF的表达[4], 在此基础上, 本次实验将TNF-α刺激后的大鼠BMSCs与HSCs共培养, 发现伴随BMSCs HGF表达及分泌的增加, HSCs RhoA蛋白及mRNA的表达进行性下降, HSCs凋亡率增加, 与正常共培养组和HSCs空白对照组比较, 刺激组的变化具有显著性差异, 显然, TNF-α对BMSCs的刺激增强了这些影响. 其机制可能是TNF-α刺激BMSCs促进HGF的表达和分泌来抑制HSCs RhoA蛋白及mRNA的表达, 从而诱导HSCs凋亡, 因为目前已知Rho/Rho Kinase(ROCK)信号通路在HSCs的活化中起突出作用, RhoA蛋白是该通路中介导细胞骨架形成的重要蛋白, RhoA蛋白的活化促进HSCs的重塑和迁移[3], HGF作为RhoA的上游分子介导RhoA的活化[28], 运用Rho/Rho Kinase(ROCK)通路抑制剂Y-27632可以抑制肝纤维化的进程[29,30]. 在共培养体系中, 随着时间的延长, HGF的质量浓度呈进行性减少, 课题组认为这一现象的发生与其发挥生物学作用引起消耗有关.
但是, 在体内试验中, TNF-α刺激的BMSCs是否提高BMSCs向受损部位的"归巢率", 促进受损组织的修复?对TNF-α与BMSCs之间相互作用的深入研究, 无疑会在肝纤维化的干细胞移植治疗中产生积极作用.
肝星状细胞(HSCs)的激活与增殖在肝纤维化发生过程中起关键的作用, 骨髓间充质干细胞(BMSCs)移植可改善甚至逆转肝纤维化. 体外研究BMSCs与HSCs的作用机制具有重要意义.
石毓君, 副研究员, 四川大学华西医院移植工程与移植免疫实验室; 潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院干细胞与组织器官工程研究中心
目前, 国内外进行自体及异体BMSCs移植治疗肝病的研究越来越多, 但采用肿瘤坏死因子-α(TNF-α)刺激BMSCs后与HSCs共培养的研究极少.
研究显示, TNF-α是受损的肝组织释放的重要炎症因子, 他不仅是骨髓基质细胞(MSCs)发挥免疫抑制功能的始动因子, 同时还增强MSCs向受损组织的迁移、定植和黏附能力.
本文首次构建TNF-α刺激BMSCs后与HSCs共培养的方法, 显示其机制可能是BMSCs通过旁分泌HGF抑制HSCs RhoA表达来实现的.
本研究显示TNF-α刺激BMSCs后与HSCs共培养明显促进HSCs凋亡, 本次构建的共培养模型更加贴近BMSCs移植后所处的微环境, 具有重要的理论和实践意义.
本文研究方法得当, 具有一定的原创性.
编辑: 曹丽鸥 电编:鲁亚静
| 1. | Hemeda H, Jakob M, Ludwig AK, Giebel B, Lang S, Brandau S. Interferon-gamma and tumor necrosis factor-alpha differentially affect cytokine expression and migration properties of mesenchymal stem cells. Stem Cells Dev. 2010;19:693-706. [PubMed] [DOI] |
| 2. | Yu Y, Lu L, Qian X, Chen N, Yao A, Pu L, Zhang F, Li X, Kong L, Sun B. Antifibrotic effect of hepatocyte growth factor-expressing mesenchymal stem cells in small-for-size liver transplant rats. Stem Cells Dev. 2010;19:903-914. [PubMed] [DOI] |
| 3. | Li L, Li J, Wang JY, Yang CQ, Jia ML, Jiang W. Role of RhoA in platelet-derived growth factor-BB-induced migration of rat hepatic stellate cells. Chin Med J (Engl). 2010;123:2502-2509. [PubMed] |
| 4. | 陆 正峰, 姜 海行, 覃 山羽, 肖 健, 张 君红, 孟 云超. 肿瘤坏死因子α刺激骨髓间充质干细胞表达及分泌肝细胞生长因子. 中国组织工程研究与临床康复. 2011;15:2540-2544. |
| 5. | Friedman SL. Mechanisms of hepatic fibrogenesis. Gastroenterology. 2008;134:1655-1669. [PubMed] [DOI] |
| 7. | 陈 国忠, 姜 海行, 陆 正峰, 肖 健, 梁 梓宇, 覃 山羽. 骨髓间充质干细胞共培养对肝星状细胞增殖、凋亡和RhoA表达的调控. 世界华人消化杂志. 2010;18:1643-1649. [DOI] |
| 8. | Friedman SL. Hepatic stellate cells: protean, multifunctional, and enigmatic cells of the liver. Physiol Rev. 2008;88:125-172. [PubMed] [DOI] |
| 9. | Gressner OA, Weiskirchen R, Gressner AM. Evolving concepts of liver fibrogenesis provide new diagnostic and therapeutic options. Comp Hepatol. 2007;6:7. [PubMed] [DOI] |
| 10. | Parekkadan B, van Poll D, Megeed Z, Kobayashi N, Tilles AW, Berthiaume F, Yarmush ML. Immunomodulation of activated hepatic stellate cells by mesenchymal stem cells. Biochem Biophys Res Commun. 2007;363:247-252. [PubMed] [DOI] |
| 11. | Lin N, Hu K, Chen S, Xie S, Tang Z, Lin J, Xu R. Nerve growth factor-mediated paracrine regulation of hepatic stellate cells by multipotent mesenchymal stromal cells. Life Sci. 2009;85:291-295. [PubMed] [DOI] |
| 12. | Ramachandran P, Iredale JP. Reversibility of liver fibrosis. Ann Hepatol. 2009;8:283-291. [PubMed] |
| 13. | Gieling RG, Burt AD, Mann DA. Fibrosis and cirrhosis reversibility - molecular mechanisms. Clin Liver Dis. 2008;12:915-937, xi. [PubMed] [DOI] |
| 14. | Sakaida I, Terai S, Yamamoto N, Aoyama K, Ishikawa T, Nishina H, Okita K. Transplantation of bone marrow cells reduces CCl4-induced liver fibrosis in mice. Hepatology. 2004;40:1304-1311. [PubMed] [DOI] |
| 15. | Baertschiger RM, Serre-Beinier V, Morel P, Bosco D, Peyrou M, Clément S, Sgroi A, Kaelin A, Buhler LH, Gonelle-Gispert C. Fibrogenic potential of human multipotent mesenchymal stromal cells in injured liver. PLoS One. 2009;4:e6657. [PubMed] [DOI] |
| 16. | Terai S, Ishikawa T, Omori K, Aoyama K, Marumoto Y, Urata Y, Yokoyama Y, Uchida K, Yamasaki T, Fujii Y. Improved liver function in patients with liver cirrhosis after autologous bone marrow cell infusion therapy. Stem Cells. 2006;24:2292-2298. [PubMed] [DOI] |
| 17. | Wang J, Bian C, Liao L, Zhu Y, Li J, Zeng L, Zhao RC. Inhibition of hepatic stellate cells proliferation by mesenchymal stem cells and the possible mechanisms. Hepatol Res. 2009;39:1219-1228. [PubMed] [DOI] |
| 18. | Zhang A, Wang Y, Ye Z, Xie H, Zhou L, Zheng S. Mechanism of TNF-α-induced migration and hepatocyte growth factor production in human mesenchymal stem cells. J Cell Biochem. 2010;111:469-475. [PubMed] [DOI] |
| 19. | Böcker W, Docheva D, Prall WC, Egea V, Pappou E, Rossmann O, Popov C, Mutschler W, Ries C, Schieker M. IKK-2 is required for TNF-alpha-induced invasion and proliferation of human mesenchymal stem cells. J Mol Med (Berl). 2008;86:1183-1192. [PubMed] [DOI] |
| 20. | Ren G, Zhang L, Zhao X, Xu G, Zhang Y, Roberts AI, Zhao RC, Shi Y. Mesenchymal stem cell-mediated immunosuppression occurs via concerted action of chemokines and nitric oxide. Cell Stem Cell. 2008;2:141-150. [PubMed] [DOI] |
| 21. | Segers VF, Van Riet I, Andries LJ, Lemmens K, Demolder MJ, De Becker AJ, Kockx MM, De Keulenaer GW. Mesenchymal stem cell adhesion to cardiac microvascular endothelium: activators and mechanisms. Am J Physiol Heart Circ Physiol. 2006;290:H1370-H1377. [PubMed] [DOI] |
| 22. | Kim YS, Park HJ, Hong MH, Kang PM, Morgan JP, Jeong MH, Cho JG, Park JC, Ahn Y. TNF-alpha enhances engraftment of mesenchymal stem cells into infarcted myocardium. Front Biosci. 2009;14:2845-2856. [PubMed] [DOI] |
| 23. | Ren G, Zhao X, Zhang L, Zhang J, L'Huillier A, Ling W, Roberts AI, Le AD, Shi S, Shao C. Inflammatory cytokine-induced intercellular adhesion molecule-1 and vascular cell adhesion molecule-1 in mesenchymal stem cells are critical for immunosuppression. J Immunol. 2010;184:2321-2328. [PubMed] [DOI] |
| 24. | Crisostomo PR, Wang Y, Markel TA, Wang M, Lahm T, Meldrum DR. Human mesenchymal stem cells stimulated by TNF-alpha, LPS, or hypoxia produce growth factors by an NF kappa B- but not JNK-dependent mechanism. Am J Physiol Cell Physiol. 2008;294:C675-C682. [PubMed] [DOI] |
| 25. | Lange C, Bassler P, Lioznov MV, Bruns H, Kluth D, Zander AR, Fiegel HC. Hepatocytic gene expression in cultured rat mesenchymal stem cells. Transplant Proc. 2005;37:276-279. [PubMed] [DOI] |
| 26. | Lange C, Bassler P, Lioznov MV, Bruns H, Kluth D, Zander AR, Fiegel HC. Liver-specific gene expression in mesenchymal stem cells is induced by liver cells. World J Gastroenterol. 2005;11:4497-4504. [PubMed] |
| 27. | Shi L, Li G, Wang J, Sun B, Yang L, Wang G, Wang D, Mu L, Chen H, Jin L. Bone marrow stromal cells control the growth of hepatic stellate cells in vitro. Dig Dis Sci. 2008;53:2969-2974. [PubMed] [DOI] |
| 28. | Yanagisawa M, Huveldt D, Kreinest P, Lohse CM, Cheville JC, Parker AS, Copland JA, Anastasiadis PZ. A p120 catenin isoform switch affects Rho activity, induces tumor cell invasion, and predicts metastatic disease. J Biol Chem. 2008;283:18344-18354. [PubMed] [DOI] |
| 29. | Fukushima M, Nakamuta M, Kohjima M, Kotoh K, Enjoji M, Kobayashi N, Nawata H. Fasudil hydrochloride hydrate, a Rho-kinase (ROCK) inhibitor, suppresses collagen production and enhances collagenase activity in hepatic stellate cells. Liver Int. 2005;25:829-838. [PubMed] [DOI] |
| 30. | Ikeda H, Nagashima K, Yanase M, Tomiya T, Arai M, Inoue Y, Tejima K, Nishikawa T, Omata M, Kimura S. Involvement of Rho/Rho kinase pathway in regulation of apoptosis in rat hepatic stellate cells. Am J Physiol Gastrointest Liver Physiol. 2003;285:G880-G886. [PubMed] |