修回日期: 2012-04-26
接受日期: 2012-05-18
在线出版日期: 2012-06-28
目的: 研究BISAP(bedside index for severity in AP)评分联合凝血指标对急性胰腺炎(acute pancreatitis, AP)严重程度评估的意义.
方法: 回顾2008-2012年中国医科大学附属盛京医院收治的166例AP患者的临床资料. 对所有患者进行入院24 h的BISAP、APACHE-Ⅱ评分, 48 h的Ranson's及发病72 h内CTSI评分, 入院24 h内抽取静脉血测定部分凝血活酶活化时间、凝血酶原时间、D-二聚体(D-dimer)、纤维蛋白原及血小板水平. 分析凝血指标及BISAP评分对AP严重程度判断的意义, 并通过ROC曲线分析二者联合对AP严重程度评估的意义.
结果: 多因素Logistic回归分析发现, D-dimer对AP严重程度评估具有独立预测意义; 随着BISAP评分增加, SAP的比率增加; BISAP评分系统评估AP严重程度以2为临界点时Youden指数最大(0.541), ROC曲线下面积为0.836(0.776-0.896), 并不逊于传统评分系统; BISAP评分系统联合D-dimer能更好地评估AP患者的严重程度.
结论: BISAP是临床判断AP轻重程度的简单有效的指标, 将BISAP与D-dimer联合应用使得对AP严重程度的评估更为准确.
引文著录: 周慧慧, 林连捷, 郑长青, 林艳, 张静洁, 张立伟. BISAP联合凝血指标对急性胰腺炎严重程度评估的意义. 世界华人消化杂志 2012; 20(18): 1638-1643
Revised: April 26, 2012
Accepted: May 18, 2012
Published online: June 28, 2012
AIM: To explore the significance of BISAP (bedside index for severity in AP) combined with coagulation parameters in predicting the severity of acute pancreatitis (AP).
METHODS: One hundred and sixty-six patients with AP who were admitted to Shengjing Hospital of China Medical University from 2008 to 2012 were included in this study. The BISAP and APACHE-Ⅱ scores were calculated using data from the first 24 h from admission and the Ranson's score using data from the first 48 h. CTSI was calculated in patients who underwent CECT within 72 h from onset. The activated partial thromboplastic time (APTT), prothrombin time (PT), D-dimer, fibrinogen (FIB) and platelet (PLT) were measured within the first 24 h from admission. The area under the receiver operating characteristic (ROC) curve (AUC) was calculated to explore the significance of BISAP combined with coagulation parameters in predicting the severity of AP.
RESULTS: Multivariate Logistic regression analysis showed that D-dimer was an independent predictor of the severity of AP. Increased BISAP score is associated with an increased risk of severe AP (SAP). Taking 2 as the cutoff value for SAP, we obtained the maximum Youden index. The AUC for BISAP in predicting SAP was 0.836 (95%CI: 0.776-0.896), and the BISAP score performed similar to the three "traditional" scoring systems. BISAP score combined with D-dimer (BISAP+D) could improve the predictive validity.
CONCLUSION: BISAP score is an accurate means for predicting the severity of AP, and BISAP+D score may enhance the accuracy of early prediction of SAP.
- Citation: Zhou HH, Lin LJ, Zheng CQ, Lin Y, Zhang JJ, Zhang LW. Significance of BISAP combined with coagulation parameters in predicting the severity of acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2012; 20(18): 1638-1643
- URL: https://www.wjgnet.com/1009-3079/full/v20/i18/1638.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i18.1638
急性胰腺炎(acute pancreatitis, AP)是临床常见病和多发病, 重症急性胰腺炎(severe acute pancreatitis, SAP)病死率在20%-30%以上[1-4], 故早期预测和正确评估AP的严重程度, 把握其进展趋势, 在临床工作中非常重要. 目前用于AP评估的常用的评分体系有Ranson's评分、APACHE-Ⅱ评分、CTSI评分等[5-8], 由于他们的时限性、复杂性、局限性等因素, 影响了其临床应用, 需要一种简单、敏感的评估系统. 最近一种新型预测评分体系-BISAP(bedside index for severity in AP)评分体系[9]在美国大规模的AP病例研究中得到推广和验证, 被认为是一种能够预测AP严重程度及住院患者风险病死率的简便、精确的评分系统. 目前国内尚未有对该评分系统的验证报道. 另外, 有学者提出凝血功能紊乱与胰腺炎严重度密切相关, 凝血纤溶功能的紊乱可导致胰腺循环紊乱, 加重胰腺炎, 抗凝治疗可能是AP治疗的方法之一[10,11]. 本研究采用BISAP评分体系评估AP, 并将凝血指标引入BISAP评分系统, 以提高病情评估的准确率.
2008-07/2012-01在中国医科大学附属盛京医院接受治疗的AP患者, 根据选入标准和排除标准选入166例AP患者. 胰腺炎诊断标准符合以下3项中至少2项: (1)腹痛的特点; (2)血液淀粉酶或者脂肪酶大于正常高限的3倍; (3)腹部CT影像改变. 诊断为MAP或者SAP取决于48 h后是否有系统并发症和/或局部并发症. 系统并发症包括: (1)休克(收缩压<90 mmHg); (2)呼吸衰竭(PaO2<60 mmHg或者需要呼吸技术支持); (3)肾衰竭(血液透析后血肌酐值>2 mg/dL). 局部并发症包括: 胰腺脓肿、假性囊肿及胰腺坏死. 选入标准: 发病3 d内入院, 入院24 h内有BISAP、APACHE-Ⅱ评分, 48 h Ranson's及发病72 h内有CTSI评分, 入院24 h内有APTT、PT、D-dimer、FIB、PLT等指标. 排除标准: (1)资料不齐的患者; (2)其他非病情原因自动出院的患者; (3)入院后因病情危重无法行CT检查的患者; (4)恶性肿瘤、急性中毒、创伤以及近期或正在服用抗凝或抗血小板药物者. 166例患者, 其中男104例, 女62例, 年龄12-85岁, 平均年龄45岁±15岁. 根据患者的轻重程度将患者分为MAP组(n = 81)和SAP组(n = 85), 其中SAP组死亡9例, 死亡率10.59%.
1.2.1 患者评分及指标检测: 选取指标均为测得的最偏离正常值, 统一选取入院24 h内进行BISAP、APACHE-Ⅱ评分, 48 h Ranson's及发病72 h内CTSI评分, 入院24 h内抽取静脉血测定部分凝血活酶活化时间(partial thromboplastin time activation, APTT)、凝血酶原时间(prothrombin time, PT)、D-二聚体(D-dimer)、纤维蛋白原(fibrinogen, FIB)及血小板(platelet, PLT)水平.
1.2.2 治疗与观察目标: 所有患者病程早期均采用中西医结合内科保守治疗. 如患者出现急性呼吸窘迫综合征, 及时转ICU行呼吸机支持呼吸; 胰腺坏死伴有感染、胰周脓肿以及腹腔室膈综合征、病情危重内科治疗无效者, 转外科行手术治疗; 出现肾脏功能不全, 及时行持续性床旁血液滤过净化治疗. 观察结局的指标主要为出现并发症及死亡. 此次出院或死亡为观察截止时间.
统计学处理 采用SPSS18.0统计软件包进行统计分析; 计量资料采用mean±SD表示; 非连续性变量与多个自变量的回归采用Logistic回归分析; 相关性分析采用spearman相关分析, 诊断价值比较采用受试者工作特征曲线(ROC曲线)及曲线下面积(AUC).
将APTT、PT、D-dimer、FIB和PLT 5项指标进行多因素Logistic回归分析, 发现D-dimer进入回归模型, 说明D-dimer对AP患者病情严重程度判断有预测意义. 根据ROC曲线确定D-dimer评估SAP的最佳截点为418 μg/L; SAP组D-dimer阳性者69例, 阳性率为81.18%; MAP组D-dimer阳性者21例, 阳性率为25.93%, 两组比较差异有显著性(P<0.01). D-dimer与APACHE-Ⅱ、Ranson's及CTSI评分系统的相关系数分别为0.278、0.401、0.299, 差异有显著性(均P<0.01).
BISAP分值与MAP、SAP的分布列于表1, 随着BISAP分值的升高, 患SAP的可能性也随之增加.
| BISAP分值 | n | MAP | SAP |
| 0 | 31 | 29(93.5) | 2(0.65) |
| 1 | 48 | 32(66.7) | 16(33.3) |
| 2 | 51 | 17(33.3) | 34(66.7) |
| 3 | 23 | 3(13.0) | 20(87.0) |
| 4 | 11 | 0 | 11(100) |
| 5 | 2 | 0 | 2(100) |
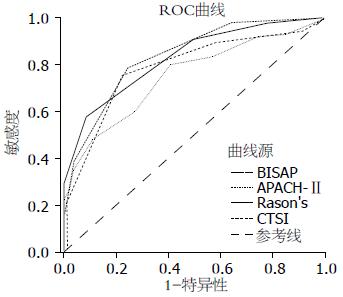
BISAP评分系统及各传统评分系统预测SAP的ROC曲线及曲线下面积(AUC)见图1及表2, 根据最佳约登指数确定截点为2, 此时他判断SAP的敏感性为78.82%, 特异性为75.31%, 约登指数和AUC分别为0.541和0.836; APACHE-Ⅱ的截点为8, 此时他判断SAP的灵敏度为80.00%, 特异度为59.26%, 约登指数和AUC分别为0.393和0.751; Ranson's的截点在3和4之间, 取3时判断SAP的灵敏度为71.76%, 特异度为75.31%, 约登指数为0.470, 取4时灵敏度为57.65%, 特异度为91.36%, 约登指数为0.490, AUC为0.830; CTSI的截点为4, 此时判断SAP的灵敏度为75.29%, 特异度为75.31%, 约登指数和AUC分别为0.531和0.760; 将BISAP评分系统与各传统评分系统的AUC进行比较, 差异不显著(P>0.05), 说明BISAP评分系统并与统评分系统相比对AP严重程度的预测能力相似.
| 评分系统 | AUC(95%CI) |
| BISAP | 0.836(0.776-0.896) |
| APACHE-Ⅱ | 0.751(0.677-0.825) |
| Ranson's | 0.830(0.769-0.890) |
| CTSI | 0.786(0.715-0.857) |
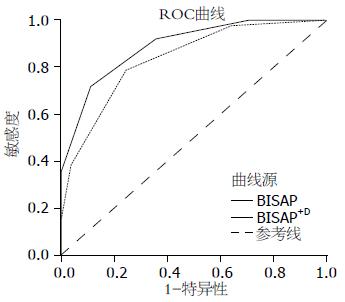
将BISAP评分与D-dimer联合评分(BISAP+D), 即将D-dimer≥418 μg/L记为1分纳入BISAP评分系统, 描记ROC曲线, 并计算AUC(图2). 与BISAP评分系统相比, BISAP评分及BISAP+D评分对AP患者预测SAP的AUC分别是0.836(0.776-0.896)和0.889(0.841-0.936)(P>0.05); 根据最佳约登指数确定最佳截点, 二者对应的评价指标及预测指标见表3.
| 评分系统 | 最佳约登指数 | 敏感性 | 特异性 | 阳性预测值 | 阴性预测值 |
| BISAP = 2 | 0.541 | 78.82% | 75.31% | 77.01% | 77.22% |
| BISAP+D = 3 | 0.607 | 71.76% | 88.89% | 87.14% | 75.00% |
AP有25%的患者表现为重症, 重症者并发症多, 病死率达20%-30%[1-4]. 尽管近年来AP的诊治已经取得了相当大的进步和成就, 但并发症仍是一个治疗难点, 对该病的预后起着决定性作用[12-17]. 通过早期快速对轻症和SAP作出诊断和鉴别, 有助于进行有效的治疗, 降低死亡率[12,17].
我国现普遍采用中华医学会消化病学分会2007年制定的SAP诊断标准[18]: 具备AP的临床表现和生化改变, 且具下列之一者: 局部并发症(胰腺坏死、假性囊肿、胰腺脓肿), 器官衰竭, Ranson's评分≥3, APACHE-Ⅱ评分≥8, CT分级为D、E. 这在区分AP的轻重程度上起了很大的作用. 但通过一系列研究发现, Ranson's评分、APACHE-Ⅱ评分及CTSI评分等标准存在一定的局限性.
Ranson's评分系统用于AP严重程度的评估有30多年的历史, 其预测病情程度及预后敏感度可达70%-80%[7]. 本组Ranson's评分体系评估SAP的ROC曲线下面积为0.830, 最佳截点在3与4之间, 取3时判断SAP的灵敏度特异度分别为71.76%、75.31%, 这与Forsmark等[19]研究(灵敏度特异度分别为75%、77%)接近; 取4时判断SAP的灵敏度为57.65%, 特异度为91.36%. 但因取4时对应的灵敏度较低, 可能会使一部分SAP患者漏诊而延误诊治, 故我们认为本组中取3时诊断价值最佳. 然而Ranson's评分体系需要收集患者入院48 h内的指标信息[19-23], 而且目前需要的很多指标在住院期间不能常规获得, 比如碱缺乏、液体丢失, 影响了对疾病的早期预测与评估.
APACHE-Ⅱ评分系统以其精确性在评估AP严重程度过程中被广泛认可, 但是该系统复杂、繁琐, 无针对SAP的特异性参数[24], 而一些重要参数如胰腺的损伤及一些有意义的并发症被忽略, 影响了疾病严重程度的评测[4]. 本组APACHE-Ⅱ评分体系评估SAP的ROC曲线下面积为0.751, 最佳截点为8, 此时他判断SAP的灵敏度为80.00%, 特异度为59.26%. 这与Osvaldt等[25]研究(灵敏度、特异度分别为75%、79%)的截点一致, 但灵敏度、特异度略有差异.
CTSI评分系统以直观的影像学指标反映了胰腺的病变情况, 其在评估胰腺坏死的发生、坏死范围等方面较其他评分系统更具优势, 但不能反映患者的全身炎症反应状态. 而且, 在发病早期, 影像学指标通常不会有明显的变化, 此外当患者出现肾功能衰竭或对比剂过敏时, 由于无法实施增强扫描, 可导致间质与坏死区别不佳, 因此, 对AP早期的预测与评估, CTSI评分系统存在一定的局限性.
BISAP评分系统采用患者入院24 h内的尿素氮水平、受损精神状态、全身炎症反应综合征、年龄、胸腔积液等5方面资料进行AP严重程度评分[9]. 对于AP住院患者病死风险率、系统并发症、胰腺坏死精确性的预测评估, BISAP评分体系与传统的APACHE-Ⅱ评分、Ranson's评分及CTSI评分系统相比较, 预测精确度无明显差异, 对SAP的评估简单有效[21,22]. 本组BISAP评分体系评估AP的严重程度的ROC曲线下面积为0.836, 这与Singh等[26]报道ROC曲线下面积为0.82一致, 但关于BISAP对SAP评估的最佳截点该文献中没有系统的报道, 本研究建议预测SAP最佳截点为2, 此时他判断AP轻重程度的敏感性为78.82%, 特异性为75.31%. 将BISAP评分系统与各传统评分系统的AUC进行比较, 差异不显著, 说明与传统评分系统相比, BISAP评分系统对AP轻重程度的预测能力相似. 本组中BISAP预测死亡的最佳截点为3, ROC曲线下面积为0.859, 这与Wu等[9]研究接近. BISAP评分系统能早期评估AP的严重程度, 并能预测死亡风险[9,21,22,26]. 本组研究中随着BISAP分值的升高, 患SAP的可能性也随之增加.
BISAP评分系统相对其他传统评分体系而言, 在临床实际工作中容易获取, 评判指标易被临床医师熟练掌握. 因而BISAP评分系统可作为一种更简便的评分体系在临床推广应用, 但同时也暴露出一些局限性, 如缺乏凝血方面的预测指标. 研究证实, 凝血系统的功能紊乱是AP重要的发病机制之一[27,28]. 本组将APTT、PT、D-dimer、FIB和PLT等5项指标进行多因素Logistic回归分析, 发现D-dimer进入回归模型, 说明D-dimer对AP患者病情严重程度判断有预测意义. D-dimer是出现继发纤溶时FIB在凝血酶的作用下转化为纤维蛋白, 纤维蛋白单体经活化的Ⅻ因子作用交联成不溶性凝块, 形成D-dimer交联的纤维蛋白被纤溶酶水解后产生的一种特异性降解产物, 其出现是继发纤溶的标志[29]. Kong等[30]提出AP患者中D-dimer明显升高, Radenkovic等[31]认为D-dimer可以作为早期预测AP患者器官衰竭的有效指标. D-dimer作为高凝状态和纤溶亢进的分子标志物, 提示SAP早期存在微循环血栓形成和继发性纤溶的改变. 有人认为血浆中D-dimer水平明显升高, 一方面反映体内纤维蛋白水平较高, 有形成血栓倾向; 另一方面D-dimer过多, 可促进局部炎症细胞特别是单核细胞合成并释放某些细胞因子(如IL-1、IL-2), 加剧胰腺微循环障碍、病情恶化. 本组资料显示SAP组D-dimer明显高于MAP组, 且D-dimer与APACHE-Ⅱ、Ranson's及CTSI评分之间存在相关性.
为了更好地预测严重程度, 我们将BISAP评分与D-dimer联合评分(BISAP+D)描记ROC曲线, 通过比较AUC来比较BISAP评分与BISAP+D评分在评估AP患者严重程度方面的价值. BISAP与BISAP+D评估SAP的ROC曲线下面积分别是0.836(0.776-0.896)和0.889(0.841-0.936), 虽然统计学没有显著差异, 但AUC明显增大; 而且两者根据最佳约登指数确定的最佳截点, 最佳约登指数分别为0.541和0.607, 对应的阳性预测值分别为77.01%和87.04%, 阴性预测值分别为77.22%和75.00%; 说明联合评分对AP的严重程度具有较好的预测价值, 可以提高预测的准确率. ROC曲线下面积没有显著差异, 这可能与样本量少有关, 有待于更大样本数据证实.
早期预测和正确评估AP的严重程度, 以便更好地指导治疗, 在临床工作中非常重要. 我们认为BISAP评分系统较传统评分系统简便, 且可以反复进行评估; 而我们提出的BISAP+D在评估AP的严重程度比BISAP更为准确, 同时不增加临床操作复杂性. 由于本研究为单中心回顾性研究, 不可避免地存在一定的局限性, 希望能多一些多中心的前瞻性研究以准确评价BISAP联合凝血指标在AP严重程度评估中的作用.
急性胰腺炎(AP)是目前常见病和多发病, 重症死亡率高, 早期预测和正确评估AP的严重程度, 把握其进展趋势, 在临床工作中非常重要. 目前由于传统评分应用的时限性、复杂性、局限性等因素, 影响了其在临床的应用, 需要一种简单、敏感的评估系统.
陈其奎, 教授, 中山大学附属第二医院消化内科
BISAP评分体系在美国大规模的AP病例研究中被认为是一种能够预测AP严重程度及住院患者风险病死率的简便、精确的评分系统. 目前国内尚未有对该评分系统的验证报道. 另外, 凝血功能紊乱可能与胰腺炎严重度密切相关.
2008年美国Wu等提出BISAP评分系统, 并证明其是一种能够预测AP严重程度及住院患者风险病死率的简便、精确的评分系统.
本研究证明, 早期预测和正确评估AP严重程度时BISAP评分系统较传统评分系统简便, 且可以反复进行评估; 且提出的BISAP联合凝血指标在评估AP的严重程度比BISAP更为准确, 同时不增加临床操作复杂性.
BISAP联合凝血指标能够简便准确地评估AP患者的病情变化, 对预测预后及指导临床有重要意义.
BISAP是近几年国际推行的AP严重程度评估的良好指标, 国内尚未全面推广. 本文增加凝血指标, 联合BISAP, 为AP的严重程度的判断提供良好的方法, 临床意义重大.
编辑: 张姗姗 电编:闫晋利
| 1. | Baron TH, Morgan DE. Acute necrotizing pancreatitis. N Engl J Med. 1999;340:1412-1417. [PubMed] [DOI] |
| 2. | Whitcomb DC. Clinical practice. Acute pancreatitis. N Engl J Med. 2006;354:2142-2150. [PubMed] [DOI] |
| 3. | Fagenholz PJ, Castillo CF, Harris NS, Pelletier AJ, Camargo CA. Increasing United States hospital admissions for acute pancreatitis, 1988-2003. Ann Epidemiol. 2007;17:491-497. [PubMed] [DOI] |
| 4. | Banks PA, Freeman ML. Practice guidelines in acute pancreatitis. Am J Gastroenterol. 2006;101:2379-2400. [PubMed] [DOI] |
| 5. | Knaus WA, Draper EA, Wagner DP, Zimmerman JE. APACHE II: a severity of disease classification system. Crit Care Med. 1985;13:818-829. [PubMed] [DOI] |
| 6. | Taylor SL, Morgan DL, Denson KD, Lane MM, Pennington LR. A comparison of the Ranson, Glasgow, and APACHE II scoring systems to a multiple organ system score in predicting patient outcome in pancreatitis. Am J Surg. 2005;189:219-222. [PubMed] [DOI] |
| 7. | Ranson JH, Rifkind KM, Turner JW. Prognostic signs and nonoperative peritoneal lavage in acute pancreatitis. Surg Gynecol Obstet. 1976;143:209-219. [PubMed] |
| 8. | Balthazar EJ, Robinson DL, Megibow AJ, Ranson JH. Acute pancreatitis: value of CT in establishing prognosis. Radiology. 1990;174:331-336. [PubMed] |
| 9. | Wu BU, Johannes RS, Sun X, Tabak Y, Conwell DL, Banks PA. The early prediction of mortality in acute pancreatitis: a large population-based study. Gut. 2008;57:1698-1703. [PubMed] [DOI] |
| 10. | Lu XS, Qiu F, Li JQ, Fan QQ, Zhou RG, Ai YH, Zhang KC, Li YX. Low molecular weight heparin in the treatment of severe acute pancreatitis: a multiple centre prospective clinical study. Asian J Surg. 2009;32:89-94. [PubMed] [DOI] |
| 11. | Zhang XP, Shi Y, Zhang L. Progress in the study of therapeutic effects of traditional Chinese medicine and extracts in treating severe acute pancreatitis. JOP. 2007;8:704-714. [PubMed] |
| 12. | Steinberg W, Tenner S. Acute pancreatitis. N Engl J Med. 1994;330:1198-1210. [PubMed] [DOI] |
| 13. | Johnson CD, Abu-Hilal M. Persistent organ failure during the first week as a marker of fatal outcome in acute pancreatitis. Gut. 2004;53:1340-1344. [PubMed] [DOI] |
| 14. | Perez A, Whang EE, Brooks DC, Moore FD, Hughes MD, Sica GT, Zinner MJ, Ashley SW, Banks PA. Is severity of necrotizing pancreatitis increased in extended necrosis and infected necrosis? Pancreas. 2002;25:229-233. [PubMed] [DOI] |
| 15. | Malangoni MA, Martin AS. Outcome of severe acute pancreatitis. Am J Surg. 2005;189:273-277. [PubMed] [DOI] |
| 16. | Rau BM, Bothe A, Kron M, Beger HG. Role of early multisystem organ failure as major risk factor for pancreatic infections and death in severe acute pancreatitis. Clin Gastroenterol Hepatol. 2006;4:1053-1061. [PubMed] [DOI] |
| 17. | Warshaw AL, Jin GL. Improved survival in 45 patients with pancreatic abscess. Ann Surg. 1985;202:408-417. [PubMed] [DOI] |
| 19. | Forsmark CE, Baillie J. AGA Institute technical review on acute pancreatitis. Gastroenterology. 2007;132:2022-2044. [PubMed] [DOI] |
| 20. | Ranson JH, Pasternack BS. Statistical methods for quantifying the severity of clinical acute pancreatitis. J Surg Res. 1977;22:79-91. [PubMed] [DOI] |
| 21. | Papachristou GI, Muddana V, Yadav D, O'Connell M, Sanders MK, Slivka A, Whitcomb DC. Comparison of BISAP, Ranson's, APACHE-II, and CTSI scores in predicting organ failure, complications, and mortality in acute pancreatitis. Am J Gastroenterol. 2010;105:435-441; quiz 442. [PubMed] [DOI] |
| 22. | Villacís X, Calle P, Patiño J, Calle G. [Score BISAP validation as a prognostic system in acute pancreatitis]. Rev Gastroenterol Peru. 2011;31:230-235. [PubMed] |
| 23. | Garcea G, Gouda M, Hebbes C, Ong SL, Neal CP, Dennison AR, Berry DP. Predictors of severity and survival in acute pancreatitis: validation of the efficacy of early warning scores. Pancreas. 2008;37:e54-e61. [PubMed] [DOI] |
| 25. | Osvaldt AB, Viero P, Borges da Costa MS, Wendt LR, Bersch VP, Rohde L. Evaluation of Ranson, Glasgow, APACHE-II, and APACHE-O criteria to predict severity in acute biliary pancreatitis. Int Surg. 2001;86:158-161. [PubMed] |
| 26. | Singh VK, Wu BU, Bollen TL, Repas K, Maurer R, Johannes RS, Mortele KJ, Conwell DL, Banks PA. A prospective evaluation of the bedside index for severity in acute pancreatitis score in assessing mortality and intermediate markers of severity in acute pancreatitis. Am J Gastroenterol. 2009;104:966-971. [PubMed] [DOI] |
| 27. | Maeda K, Hirota M, Ichihara A, Ohmuraya M, Hashimoto D, Sugita H, Takamori H, Kanemitsu K, Baba H. Applicability of disseminated intravascular coagulation parameters in the assessment of the severity of acute pancreatitis. Pancreas. 2006;32:87-92. [PubMed] [DOI] |
| 28. | Lindström OK, Tukiainen EM, Kylänpää ML, Mentula PJ, Puolakkainen PA, Wartiovaara-Kautto UM, Repo H, Petäjä JM. Thrombin generation in vitro and in vivo, and disturbed tissue factor regulation in patients with acute pancreatitis. Pancreatology. 2011;11:557-566. [PubMed] [DOI] |
| 29. | Salomone T, Tosi P, Palareti G, Tomassetti P, Migliori M, Guariento A, Saieva C, Raiti C, Romboli M, Gullo L. Coagulative disorders in human acute pancreatitis: role for the D-dimer. Pancreas. 2003;26:111-116. [PubMed] [DOI] |