修回日期: 2012-04-19
接受日期: 2012-05-20
在线出版日期: 2012-06-28
目的: 探讨Urotensin Ⅱ(UⅡ)在急性肝衰竭(acute liver failure, ALF)小鼠肝组织中的表达及损伤作用.
方法: ♂Balb/c小鼠随机分成4组(每组6只): 正常对照组(A组)、预处理对照组(B组)、模型组(C组)和预处理模型组(D组). 模型动物以脂多糖(lipopolysaccharide, LPS)/D-半乳糖胺(D-galactosamine, D-GalN)腹腔注射, 预处理动物在造模前30 min, 用UⅡ受体拮抗剂Urantide 0.6 mg/kg尾静脉注射. LPS/D-GalN攻击12 h后, 采集血清和肝组织标本, 并观察24 h小鼠存活情况; 采用Reitman-Frankel法检测血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)和天冬氨酸氨基转移酶(aspartate amino-transferase, AST)活性水平; 采用HE染色显微镜观察肝组织损伤程度; RT-PCR法检测UⅡ及其受体UT mRNA的表达; ELISA法检测血清UⅡ多肽分泌水平; 免疫组织化学方法检测肝组织UⅡ多肽及其UT受体蛋白质表达.
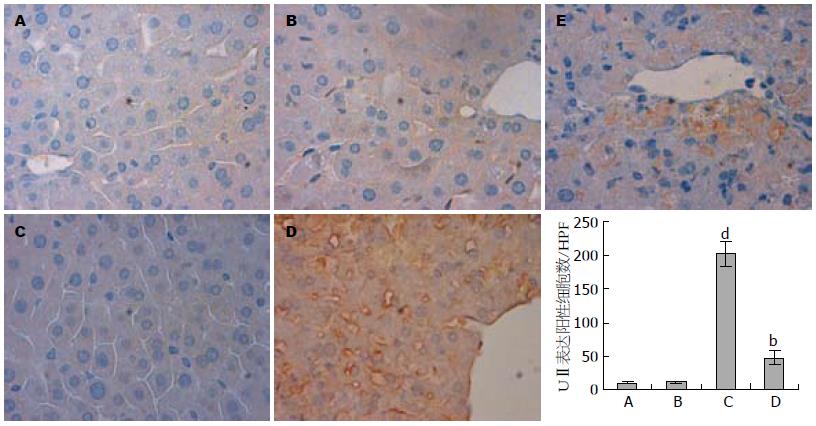
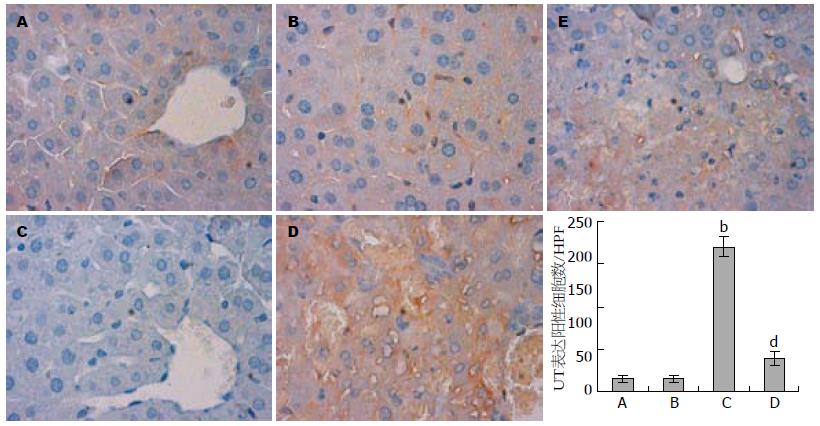
结果: C组小鼠死亡率为66.7%, A、B和D组所有动物均存活; LPS/D-GalN攻击引起C和D组小鼠血清ALT和AST水平显著升高(P<0.01), 而D组较C组显著降低(2 271.09 U/L±102.24 U/L vs 1 160.67 U/L±258.32 U/L, 1 569.42 U/L±204.04 U/L vs 1 030.31 U/L±108.09 U/L, P<0.01); C组小鼠肝组织结构破坏明显, 见大片出血性坏死及炎症表现, D组肝组织结构保持完整, 仅有局灶性出血坏死, 炎症明显减轻; C和D组小鼠血清UⅡ多肽水平较A和B组高(P<0.01), 但D组较C组明显降低(3.73 μg/L±0.52 μg/L vs 1.90 μg/L±0.27 μg/L, P<0.01); LPS/D-GalN诱导了C和D组小鼠肝组织UⅡ和UT的mRNA及蛋白质高水平表达, 而D组的表达水平较C组显著降低(P<0.01).
结论: LPS/D-GalN可诱导ALF小鼠肝组织表达和分泌UⅡ, 并促进肝组织UT受体的表达; UⅡ的表达与分泌可能存在正反馈调控机制; UⅡ/UT受体介导了LPS/D-GalN诱导的ALF的发生.
引文著录: 刘亮明, 梁冬雨, 张芳芳, 于芳苹, 赵亮, 叶长根. Urotensin Ⅱ在急性肝衰竭小鼠肝组织中的表达及损伤作用. 世界华人消化杂志 2012; 20(18): 1616-1622
Revised: April 19, 2012
Accepted: May 20, 2012
Published online: June 28, 2012
AIM: To investigate the expression and role of Urotensin Ⅱ (UⅡ) in lipopolysaccharide (LPS)/D-galactosamine (D-GalN)-induced acute liver failure (ALF) in mice.
METHODS: Male Balb/c mice were randomly and equally divided into four groups: normal control group (group A), pre-treatment control group (group B), ALF model group (group C), and pre-treatment model group (group D). ALF were induced in mice by intraperitoneal injection of LPS (50 μg/kg body weight)/D-GalN (800 mg/kg body weight). The pre-treatment mice were intravenously injected with Urantide (0.6 mg/kg body weight) 30 min before model induction. Serum and liver tissues were sampled 12 h after LPS/D-GalN injection. Mortality was calculated 24 h after attack. Serum levels of alanine aminotransferase (ALT) and aspartate aminotransferase (AST) were detected using the Reitman-Frankel method. Histopathological changes were observed by hematoxylin and eosin (HE) staining. Serum UⅡ levels were assessed by ELISA, and the expression of UⅡ and UT was detected by RT-PCR and immunohistochemistry.
RESULTS: A mortality of 66.7% was observed in group C, while all mice of groups A, B and D survived. Serum ALT and AST levels had a dramatic increase in groups C and D, but were significantly lower in group D than in group C (2 271.09 U/L ± 102.24 U/L vs 1 160.67 U/L ± 258.32 U/L, 1 569.42 U/L ± 204.04 U/L vs 1 030.31 U/L ± 108.09 U/L, both P < 0.01). Widespread destruction of liver architecture, hemorrhagic necrosis, and neutrophil infiltration were noted in group C, whereas liver architecture was completely preserved, and focal necrosis and fewer neutrophil infiltrates were observed in group D. After LPS/D-GalN challenge, serum UⅡ levels increased sharply in groups C and D, but were lower in group D than in group C (3.73 μg/L ± 0.52 μg/L vs 1.90 μg/L ± 0.27 μg/L, both P < 0.01). Overexpression of liver UⅡ and UT mRNAs and proteins was induced by the injection of LPS/D-GalN in groups C and D. Compared to group C, group D had lower levels of UⅡ and UT in the liver.
CONCLUSION: UⅡ expression and secretion can be induced by LPS/D-GalN challenge in the liver tissue of ALF mice via a positive feedback mechanism associated with promoting the expression of its receptor UT. UⅡ/UT receptor may be a vital mediator of LPS/D-GalN-induced ALF.
- Citation: Liu LM, Liang DY, Zhang FF, Yu FP, Zhao L, Ye CG. Expression and role of Urotensin Ⅱ in lipopolysaccharide/D-galactosamine-induced acute liver failure in mice. Shijie Huaren Xiaohua Zazhi 2012; 20(18): 1616-1622
- URL: https://www.wjgnet.com/1009-3079/full/v20/i18/1616.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i18.1616
急性肝衰竭(acute liver failure, ALF)是以免疫炎性反应为主要特征的肝组织损伤性疾病[1]. 炎症细胞因子特别是肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)等在ALF的发生发展过程中起了关键作用[2]. 然而, 对于ALF疾病的病理生理学机制的认识仍有待深入. 最近, 一种血管活性多肽类物质UrotensinⅡ(UⅡ)被发现具有显著的免疫炎症活性[3]. 研究显示, UⅡ可通过作用于其G-蛋白耦联受体UT, 促进单核细胞和巨噬细胞向炎症损伤部位聚集, 并促进黏附分子和趋化因子表达以及炎性细胞因子的释放等[4-6]. 已证实, 血管炎症损伤性疾病如动脉粥样硬化症、心脏慢性炎症损伤性疾病、肾脏免疫炎性损伤疾病和肝脏慢性炎症损伤性疾病等患者血中均有高水平UⅡ分泌[7-10]. 这提示UⅡ在组织炎症损伤性疾病中有重要作用. 本研究拟进一步检测小鼠ALF模型血清、肝组织内UⅡ及其受体UT的表达情况, 并采用UⅡ受体拮抗剂Urantide进行干预, 以探讨UⅡ/UT受体在ALF发病中的作用.
脂多糖(lipopolysaccharide, LPS), D-半乳糖胺(D-galactosamine, D-GalN)购自美国Sigma公司; Urantide购自日本PEPTIDE公司; 血清ALT和AST检测试剂盒由南京建成生物工程研究所提供; 小鼠UⅡ ELISA试剂盒购自美国Phoenix Pharmaceutical公司; 逆转录试剂盒购自加拿大Fermentas公司; DNA Marker和PCR反应试剂盒由北京天根公司提供; 健康♂Balb/c小鼠由上海交通大学附属第一人民医院动物中心提供, 鼠龄6 wk, 体质量20-22 g.
1.2.1 动物分组及处置: 24只小鼠按随机排列表随机分为4组(6只/组): 正常对照组(A组)、预处理对照组(B组)、模型组(C组)和预处理模型组(D组). 造模前30 min, B组和D组尾静脉注射UⅡ受体拮抗剂Urantide 0.6 mg/kg预处理(药物剂量参考文献[11]), A组和C组给予相应体积无菌NS尾静脉注射. C组和D组以LPS/D-GalN腹腔注射构建小鼠ALF模型, A组和B组则给予相应体积的NS腹腔注射. LPS/D-GalN攻击12 h后, 采集血清和肝组织标本, 并观察24 h小鼠死亡情况.
1.2.2 ALF模型制备: 参考文献[12], 以LPS 50 μg/kg联合D-GalN 800 mg/kg, 用0.2 mL无菌NS溶解后腹腔注射.
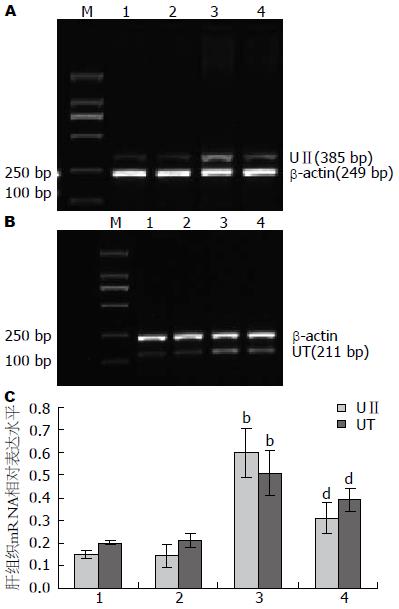
1.2.3 RT-PCR检测: 肝组织(50-100 mg)总RNA提取采用TRIzol试剂按说明书进行. 2 mg总RNA作为模板用于第一链cDNA的合成, 采用逆转录试剂盒(Fermentas公司)进行. 引物设计借助Primer Premier 6.0软件设计, 基因检测引物序列和产物长度如表1. 基因的反应条件均为: 94 ℃预变性5 min; 94 ℃ 1 min, 58 ℃ 45 s, 72 ℃ 45 s, 共32个循环; 72 ℃延伸10 min. PCR产物经2%琼脂糖电泳后, 经Bio-Rad凝胶成像分析系统分析条带灰度值, 计算目的基因的相对表达量.
| 基因 | 引物序列5'→3' | 产物长度 |
| UⅡ | F: GAGCATTCCCTTCATCGTAG | 385 bp |
| R: CATAGCGTTCACTGCTCATT | ||
| UT | F: CTTTCACTCAGCACCTCAT | 211 bp |
| R: CTTAGTTTTTCTCCACACTGTT | ||
| β-actin | F: TGCCGCATCCTCTTCCTC | 249 bp |
| R: CCACAGGATTCCATACCCAAG |
1.2.4 免疫组织化学检测: 肝组织获取后用10%甲醛液固定、常规石蜡包埋、切片, 用于检测UⅡ及UT受体的表达. 标本首先用内源性过氧化物酶阻断剂消除内源性过氧化物酶, 然后用动物非免疫血清进行封闭, 接着用1:300稀释的一抗37 ℃孵育1 h后(阴性对照以PBS代替一抗), 加生物素化二抗继续37 ℃孵育10 min, 最后加入DAB底物显色, 苏木精复染. 每步结束均用PBS冲洗3遍, 每次3 min. 以细胞质或细胞核内出现黄色颗粒为阳性表达. 在光学显微镜下计算每高倍视野(high power field, HPF)下的阳性细胞数.
1.2.5 ELISA检测: 依试剂盒说明书进行, 通过竞争酶联免疫反应法, 在酶标仪上测定吸光度A450, 查标准曲线, 得蛋白浓度.
1.2.6 血清转氨酶检测: 血清ALT和AST活性采用Reitman-Frankel法检测, 依据试剂盒说明书步骤进行. 血清样本通过与2.4-二甲基苯肼反应后, 在紫外分光光度仪上测定A505, 查标准曲线, 得活力单位.
1.2.7 肝组织病理学检测: 肝组织标本用10%甲醛液固定后, 常规石蜡包埋、切片, 苏墨-伊红染色, 显微镜观察.
统计学处理 数据用mean±SD表示, 组间比较用方差分析. 采用SPSS17.0统计软件进行统计学处理, P<0.05为差异有统计学意义.
以LPS/D-GalN攻击后24 h为监测终点, 计算各组小鼠的死亡率. C组小鼠24 h内死亡率为66.7%(4/6), 而A、B和D组小鼠均存活(表2). 这提示UⅡ受体UT的拮抗剂Urantide可有效保护小鼠免于LPS/D-GalN攻击引起的死亡.
| 时间点 | 0 h | 1 h | 2 h | 4 h | 6 h | 12 h | 24 h |
| A组(n) | 6 | 6 | 6 | 6 | 6 | 6 | 6 |
| B组(n) | 6 | 6 | 6 | 6 | 6 | 6 | 6 |
| C组(n) | 6 | 6 | 6 | 6 | 5 | 2 | 2 |
| D组(n) | 6 | 6 | 6 | 6 | 6 | 6 | 6 |
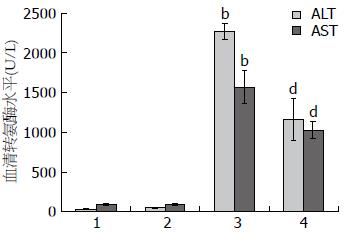
对腹腔注射LPS/D-GalN 12 h后小鼠血清ALT、AST活性水平进行检测. 其中, A、B、C和D组ALT水平分别为36.34 U/L±7.10 U/L, 50.67 U/L±8.02 U/L,2 271.09 U/L±102.24 U/L和1 160.67 U/L±258.32 U/L. 经统计学处理, C组和D组显著高于A组和B组(P<0.01), 而D组明显低于C组(P<0.01); A、B、C和D组AST水平分别为90.72 U/L±15.77 U/L, 94.08 U/L±17.60 U/L, 1 569.42 U/L±204.04 U/L和1 030.31 U/L±108.09 U/L. 统计学上, C组和D组比A组和B组显著升高(P<0.01), 而D组与C组相比显著降低(P<0.01). 各组小鼠血清ALT、AST活性统计学直方图见图1. 这表明, LPS/D-GalN可显著诱导小鼠肝损伤, 而UⅡ受体抑制剂Urantide明显减轻了小鼠肝损伤程度.
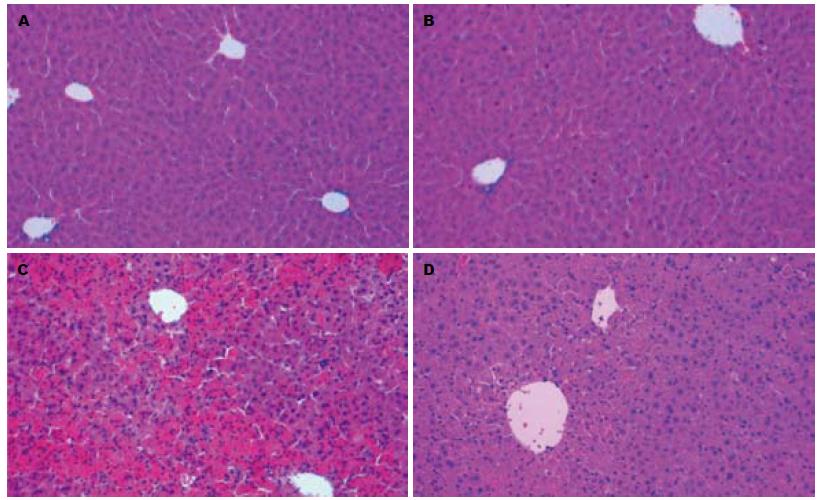
光学显微镜下观察, A组和B组小鼠肝组织结构正常, 无明显出血、坏死和炎症表现; C组小鼠肝组织结构破坏明显, 可见大片出血性坏死, 炎性细胞浸润显著; D组肝内肝小叶结构破坏较轻, 仅见局灶性出血坏死, 炎性浸润明显减轻(图2). 这表明, 通过抑制UⅡ信号传导有助于减轻肝组织炎症损伤的程度.
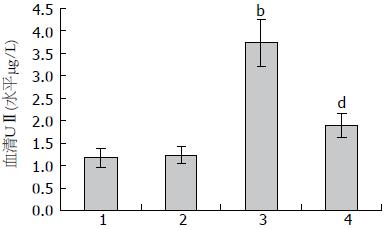
A、B、C和D组小鼠血清中UⅡ的分泌水平分别为1.16 μg/L±0.21 μg/L, 1.22 μg/L±0.19 μg/L, 3.73 μg/L±0.52 μg/L和1.90 μg/L±0.27 μg/L. 经统计学处理, C组和D组显著高于A组和B组(P<0.01), 而D组明显低于C组(P<0.01, 图3). 这提示, LPS/GalN攻击可诱导小鼠大量分泌UⅡ, 而UⅡ受体拮抗剂Urantide的应用显著抑制了血清UⅡ的分泌水平.
A、B、C和D组小鼠肝组织UⅡ mRNA的相对表达水平分别为0.15±0.02, 0.14±0.05, 0.60±0.11和0.31±0.07. 统计学上, C组和D组较A组和B组明显升高(P<0.01), 而D组较C组显著下降(P<0.01); A、B、C和D组小鼠肝组织UT受体mRNA的相对表达水平分别为0.20±0.01, 0.21±0.03, 0.51±0.10和0.39±0.05. 经统计学处理, C组和D组显著高于A组和B组(P<0.01), 而D组明显低于C组(P<0.01, 图4). 这提示, LPS/GalN攻击可诱导小鼠肝组织UⅡ、UT受体mRNA表达升高, 而UⅡ受体拮抗剂Urantide的应用显著抑制了肝组织UⅡ、UT受体mRNA的表达水平.
免疫组织化学染色可见, 在LPS/D-GalN攻击小鼠肝组织内UⅡ、UT蛋白的表达显著升高. 在肝内, UⅡ/UT表达细胞均为血管内皮细胞、胆管上皮细胞和肝窦内衬细胞(sinusoidal lining cells). 其中, 血管内皮细胞和库普弗细胞表达最为丰富, 而肝细胞无明显表达(图5, 6). A、B、C和D组小鼠肝组织UⅡ表达阳性细胞数分别为9.1±1.8, 10.7±2.3, 202.6±19.4和47.9±10.2. 经统计学处理, C组和D组表达显著高于A组和B组(P<0.01), 而D组明显低于C组(P<0.01); A、B、C和D组小鼠肝组织UT表达阳性细胞数分别为15.2±4.1, 14.8±3.6, 170.7±11.5和38.4±9.0. 统计学上, C组和D组较A组和B组明显升高(P<0.01), 而D组较C组显著下降(P<0.01). 这说明, 在LPS/GalN诱导的小鼠肝组织中UⅡ、UT蛋白质表达升高, Urantide预处理显著抑制了肝组织UⅡ、UT蛋白表达水平.
UⅡ是一种在硬骨鱼尾垂体中发现的具有生长抑素活性的多肽类物质[13]. 1998年首次克隆到了人UⅡ, 从而证实人和动物体内均存在UⅡ[14]. 在机体内, UⅡ存在于多种组织中如中枢运动神经元、脑垂体、心脏、脾脏、胸腺、胰腺、肾脏和前列腺等[14,15]. UⅡ存在多种生物学活性, 可引起血管收缩和舒张反应, 促进纤维形成和细胞增殖, 并对物质代谢有重要影响等[16,17]. 许多疾病如高血压病[18]、冠心病[19]、充血性心力衰竭[20]、2型糖尿病[21]和肝硬化[22]等患者体内UⅡ的水平均明显升高. 目前UⅡ在这些疾病中表达分泌增高的临床意义尚不清楚. Watanabe等[23]认为UⅡ血浆水平升高与脏器损伤的发生机制相关. 近年的研究表明, UⅡ可促进炎症损伤性疾病的发生和发展[24]. 在炎性损伤部位, 高水平UⅡ可募集炎性细胞[4], 促进内皮细胞表达和分泌组织因子和细胞黏附分子[5], 刺激前炎细胞因子如IL-6、IFN-1β的表达与分泌[6].
作为一个炎症免疫损伤性疾病, ALF与UⅡ之间的相互关系未见文献报道. 在本实验中, 我们首先研究了ALF期间UⅡ多肽分子的表达情况. 我们发现, LPS/D-GalN攻击诱导的ALF小鼠肝组织UⅡ的表达显著升高. 同时, 在此期间, 肝组织UⅡ分子的特异性G-蛋白耦联受体UT的表达也明显增强. 这提示UⅡ/UT受体系统可能在LPS/D-GalN诱导的ALF发病中有重要作用.
对肝组织的免疫组织化学分析显示, UⅡ和UT受体的表达细胞主要是肝脏非实质细胞, 而肝实质细胞并不表达UⅡ和UT受体. 在肝非实质细胞中, 以库普弗细胞和血管内皮细胞表达最为显著. 已知, 肝库普弗细胞和内皮细胞在免疫介导肝损伤(immune-mediated liver injury)的发病机制中起关键作用[25-27]. 库普弗细胞和肝内皮细胞均为机体固有免疫系统的重要组成部分[28,29]. 各种损伤因子的作用, 可通过刺激库普弗细胞对TNF-α、IL-1β、IFN-γ和IL-6等前炎细胞因子的级联式或瀑布式释放, 诱导肝细胞凋亡和坏死[30-33]; 库普弗细胞活化后, 可引起内皮细胞激活和功能失调, 从而进一步诱导微循环介质(microcirculation mediators)和前炎细胞因子的分泌、促进黏附分子表达上调[34], 并最终导致肝损伤及ALF发生. UⅡ/UT受体系统在ALF肝内免疫炎症相关细胞的表达, 可能提示其在ALF免疫炎性损伤机制中的重要作用.
为进一步验证UⅡ多肽分子在ALF肝损伤中的作用, 我们利用了UT受体的特异性拮抗剂Urantide以阻断UⅡ分子信号的传导. 结果发现, Urantide的应用显著减轻了ALF小鼠肝组织的炎症损伤表现, 使肝内大片出血坏死病变得到明显逆转. 更为重要的是, Urantide有效地保护了小鼠免于LPS/D-GalN攻击诱导的ALF和死亡. 这表明UⅡ在ALF小鼠肝组织的免疫炎症损伤发生发展中有关键性的影响. 此外, 我们在实验中还发现, Urantide对UⅡ信号的阻断作用进一步造成了肝内UⅡ和UT受体表达的下调. 这至少可以得到两方面的提示: (1)UⅡ和UT受体在免疫炎性细胞内的表达和分泌存在自分泌现象, 同时可能还存在着旁分泌. 即UⅡ的表达和分泌可对表达UT受体的自身细胞产生作用, 并可能对其他UT受体表达细胞产生影响; (2)UⅡ/UT受体系统存在正反馈调控机制. 免疫炎症细胞UⅡ的表达与分泌可进一步促进其自身的活化和对UⅡ/UT受体的表达, 从而可能产生级联式或瀑布式表达与分泌, 诱导或促进ALF的发生. 在肝内UⅡ表达上调的同时, 我们也发现血循环中UⅡ的水平也显著升高, 这提示UⅡ有可能对肝外器官产生影响. 但我们并不清楚这种影响有多大以及存在何种影响, 或者ALF的肝外表现是否也与血浆UⅡ升高有关等等, 都值得将来进一步研究. 从现有研究来看, UⅡ存在致炎激素样作用, 并存在前炎细胞因子的多种特性, 但UⅡ在免疫炎症中的作用研究才刚刚开始, 目前对其下结论还为时尚早.
急性肝衰竭(ALF)是肝组织的免疫炎症损伤性疾病, 病理机制尚不清楚. 近年发现Urotensin Ⅱ(UⅡ)存在显著的免疫炎症活性, 在许多脏器的炎症损伤过程中表达升高.
郑素军, 副教授, 副主任医师, 首都医科大学附属北京佑安医院人工肝中心
ALF的免疫炎症损伤机制是近年研究的热点. 在该研究领域中, 肝内非实质细胞(包括库普弗细胞和内皮细胞)的激活机制、细胞内信号传递, 以及与肝实质细胞之间的信息交换和分子网络是当前亟待研究的问题.
研究表明, UⅡ可促进炎症损伤性疾病的发生和发展. 在炎性损伤部位, 高水平UⅡ可募集炎性细胞、促进内皮细胞表达和分泌组织因子、细胞黏附分子, 刺激前炎细胞因子如IL-6、IFN-1β的表达与分泌.
本研究发现LPS/D-GalN可诱导小鼠肝组织UⅡ及其受体UT表达上调, 并首次证实了ALF的发生主要由UⅡ/UT受体系统所介导.
本研究成果为UⅡ/UT系统的肝损伤效应研究奠定了基础, 并可在ALF的免疫炎症损伤机制的研究中体现其应用价值, 将来有望为ALF治疗提供新的药物作用靶点.
本研究探讨了Urotensin Ⅱ在ALF小鼠肝组织中的表达情况, 并初步探讨UⅡ受体拮抗剂Urantide对肝损伤的保护作用. 该文创新性较好, 且写作思路清楚,为从多个角度探讨ALF的发病机制, 并寻找其治疗靶标提供了新的探索.
编辑: 张姗姗 电编:闫晋利
| 1. | Wu Z, Han M, Chen T, Yan W, Ning Q. Acute liver failure: mechanisms of immune-mediated liver injury. Liver Int. 2010;30:782-794. [PubMed] [DOI] |
| 2. | Williams R. Classification, etiology, and considerations of outcome in acute liver failure. Semin Liver Dis. 1996;16:343-348. [PubMed] [DOI] |
| 4. | Segain JP, Rolli-Derkinderen M, Gervois N, Raingeard de la Blétière D, Loirand G, Pacaud P. Urotensin II is a new chemotactic factor for UT receptor-expressing monocytes. J Immunol. 2007;179:901-909. [PubMed] |
| 5. | Cirillo P, De Rosa S, Pacileo M, Gargiulo A, Angri V, Fiorentino I, Prevete N, Petrillo G, De Palma R, Leonardi A. Human urotensin II induces tissue factor and cellular adhesion molecules expression in human coronary endothelial cells: an emerging role for urotensin II in cardiovascular disease. J Thromb Haemost. 2008;6:726-736. [PubMed] [DOI] |
| 6. | Johns DG, Ao Z, Naselsky D, Herold CL, Maniscalco K, Sarov-Blat L, Steplewski K, Aiyar N, Douglas SA. Urotensin-II-mediated cardiomyocyte hypertrophy: effect of receptor antagonism and role of inflammatory mediators. Naunyn Schmiedebergs. Arch Pharmacol. 2004;370:238-250. [PubMed] [DOI] |
| 7. | Maguire JJ, Kuc RE, Wiley KE, Kleinz MJ, Davenport AP. Cellular distribution of immunoreactive urotensin-II in human tissues with evidence of increased expression in atherosclerosis and a greater constrictor response of small compared to large coronary arteries. Peptides. 2004;25:1767-1774. [PubMed] [DOI] |
| 8. | Douglas SA, Tayara L, Ohlstein EH, Halawa N, Giaid A. Congestive heart failure and expression of myocardial urotensin II. Lancet. 2002;359:1990-1997. [PubMed] [DOI] |
| 9. | Balat A, Karakök M, Yilmaz K, Kibar Y. Urotensin-II immunoreactivity in children with chronic glomerulonephritis. Ren Fail. 2007;29:573-578. [PubMed] [DOI] |
| 10. | Liu D, Chen J, Wang J, Zhang Z, Ma X, Jia J, Wang Y. Increased expression of urotensin II and GPR14 in patients with cirrhosis and portal hypertension. Int J Mol Med. 2010;25:845-851. [PubMed] |
| 11. | Trebicka J, Leifeld L, Hennenberg M, Biecker E, Eckhardt A, Fischer N, Pröbsting AS, Clemens C, Lammert F, Sauerbruch T. Hemodynamic effects of urotensin II and its specific receptor antagonist palosuran in cirrhotic rats. Hepatology. 2008;47:1264-1276. [PubMed] [DOI] |
| 12. | Gong X, Luo FL, Zhang L, Li HZ, Wu MJ, Li XH, Wang B, Hu N, Wang CD, Yang JQ. Tetrandrine attenuates lipopolysaccharide-induced fulminant hepatic failure in D-galactosamine-sensitized mice. Int Immunopharmacol. 2010;10:357-363. [PubMed] [DOI] |
| 13. | Vaudry H, Do Rego JC, Le Mevel JC, Chatenet D, Tostivint H, Fournier A, Tonon MC, Pelletier G, Conlon JM, Leprince J. Urotensin II, from fish to human. Ann N Y Acad Sci. 2010;1200:53-66. [PubMed] [DOI] |
| 14. | Coulouarn Y, Lihrmann I, Jegou S, Anouar Y, Tostivint H, Beauvillain JC, Conlon JM, Bern HA, Vaudry H. Cloning of the cDNA encoding the urotensin II precursor in frog and human reveals intense expression of the urotensin II gene in motoneurons of the spinal cord. Proc Natl Acad Sci U S A. 1998;95:15803-15808. [PubMed] [DOI] |
| 15. | Coulouarn Y, Jégou S, Tostivint H, Vaudry H, Lihrmann I. Cloning, sequence analysis and tissue distribution of the mouse and rat urotensin II precursors. FEBS Lett. 1999;457:28-32. [PubMed] [DOI] |
| 16. | Ross B, McKendy K, Giaid A. Role of urotensin II in health and disease. Am J Physiol Regul Integr Comp Physiol. 2010;298:R1156-R1172. [PubMed] [DOI] |
| 17. | Kiss RS, You Z, Genest J, Behm DJ, Giaid A. Urotensin II differentially regulates macrophage and hepatic cholesterol homeostasis. Peptides. 2011;32:956-963. [PubMed] [DOI] |
| 18. | Rodrigo R, González J, Paoletto F. The role of oxidative stress in the pathophysiology of hypertension. Hypertens Res. 2011;34:431-440. [PubMed] [DOI] |
| 19. | Chai SB, Li XM, Pang YZ, Qi YF, Tang CS. Increased plasma levels of endothelin-1 and urotensin-II in patients with coronary heart disease. Heart Vessels. 2010;25:138-143. [PubMed] [DOI] |
| 20. | Ng LL, Loke I, O'Brien RJ, Squire IB, Davies JE. Plasma urotensin in human systolic heart failure. Circulation. 2002;106:2877-2880. [PubMed] [DOI] |
| 21. | Gruson D, Rousseau MF, Ketelslegers JM, Hermans MP. Raised plasma urotensin II in type 2 diabetes patients is associated with the metabolic syndrome phenotype. J Clin Hypertens (Greenwich). 2010;12:653-660. [PubMed] [DOI] |
| 22. | Romanelli RG, Laffi G, Vizzutti F, Del Bene R, Marra F, Caini P, Guerra CT, La Villa G, Barletta G. Elevated plasma levels of urotensin II do not correlate with systemic haemodynamics in patients with cirrhosis. Dig Liver Dis. 2011;43:314-318. [PubMed] [DOI] |
| 23. | Watanabe T, Arita S, Shiraishi Y, Suguro T, Sakai T, Hongo S, Miyazaki A. Human urotensin II promotes hypertension and atherosclerotic cardiovascular diseases. Curr Med Chem. 2009;16:550-563. [PubMed] [DOI] |
| 25. | Stuart WD, Kulkarni RM, Gray JK, Vasiliauskas J, Leonis MA, Waltz SE. Ron receptor regulates Kupffer cell-dependent cytokine production and hepatocyte survival following endotoxin exposure in mice. Hepatology. 2011;53:1618-1628. [PubMed] [DOI] |
| 26. | Smedsrød B, De Bleser PJ, Braet F, Lovisetti P, Vanderkerken K, Wisse E, Geerts A. Cell biology of liver endothelial and Kupffer cells. Gut. 1994;35:1509-1516. [PubMed] [DOI] |
| 27. | Pate M, Damarla V, Chi DS, Negi S, Krishnaswamy G. Endothelial cell biology: role in the inflammatory response. Adv Clin Chem. 2010;52:109-130. [PubMed] [DOI] |
| 28. | Ramadori G, Moriconi F, Malik I, Dudas J. Physiology and pathophysiology of liver inflammation, damage and repair. J Physiol Pharmacol. 2008;59 Suppl 1:107-117. [PubMed] |
| 29. | Wu J, Meng Z, Jiang M, Zhang E, Trippler M, Broering R, Bucchi A, Krux F, Dittmer U, Yang D. Toll-like receptor-induced innate immune responses in non-parenchymal liver cells are cell type-specific. Immunology. 2010;129:363-374. [PubMed] [DOI] |
| 30. | dos Santos DC, Neves PC, Azeredo EL, Pelajo-Machado M, Martinho JM, Pacheco-Moreira LF, Araújo CC, Cruz OG, de Oliveira JM, Pinto MA. Activated lymphocytes and high liver expression of IFN-γ are associated with fulminant hepatic failure in patients. Liver Int. 2012;32:147-157. [PubMed] [DOI] |
| 31. | Liu LM, Zhang JX, Wang XP, Guo HX, Deng H, Luo J. Pim-3 protects against hepatic failure in D-galactosamine (D-GalN)-sensitized rats. Eur J Clin Invest. 2010;40:127-138. [PubMed] [DOI] |
| 32. | Liu LM, Zhang JX, Luo J, Guo HX, Deng H, Chen JY, Sun SL. A role of cell apoptosis in lipopolysaccharide (LPS)-induced nonlethal liver injury in D-galactosamine (D-GalN)-sensitized rats. Dig Dis Sci. 2008;53:1316-1324. [PubMed] [DOI] |
| 34. | Vollmar B, Menger MD. The hepatic microcirculation: mechanistic contributions and therapeutic targets in liver injury and repair. Physiol Rev. 2009;89:1269-1339. [PubMed] [DOI] |