修回日期: 2012-03-27
接受日期: 2012-04-19
在线出版日期: 2012-06-18
目的: 观察丙泊酚对小鼠胃缺血/再灌注(ischemia-reperfusion, I/R)后胃黏膜损伤程度及胃黏膜细胞增殖及凋亡的影响, 探讨丙泊酚的胃保护作用及可能机制.
方法: 72只♂昆明小鼠随机分为4组: 假手术组(sham, S组)、I/R组、脂肪乳组(fat emulsion, F组)、丙泊酚组(propofol, P组). 通过夹闭小鼠腹腔动脉30 min后松开动脉夹再灌注1 h制作胃I/R模型. 取胃观察大体形态变化、计算胃黏膜损伤指数, HE染色光镜下观察病理形态学变化, 比色法测定丙二醛(malondialdehyde, MDA)含量和超氧化物歧化酶(superoxide dismutase, SOD)活性, 免疫组织化学方法和原位DNA末端标记(TUNEL)染色法分别检测胃黏膜细胞增殖和凋亡的表达情况, 蛋白免疫印迹法(Western blotting)测定胃黏膜组织中Bcl-2、Bax蛋白的表达.
结果: 腹腔注射25 mg/kg丙泊酚后胃黏膜损伤明显减轻, 具体表现为胃黏膜及黏膜下层的充血、水肿及糜烂均有明显改善; 与I/R组相比, P组细胞内MDA含量明显降低, SOD活性增强(P<0.01); 与I/R组相比, 丙泊酚可明显抑制胃黏膜细胞凋亡(33.9%±1.3% vs 60.8%±6.9%)、促进细胞增殖(16.0%±1.8% vs 6.4%±1.2%)、下调Bax(0.453±0.025 vs 0.268±0.023)及上调Bcl-2蛋白(0.513±0.014 vs 0.752±0.015)的表达(均P<0.01).
结论: 丙泊酚能促进小鼠胃I/R后胃黏膜细胞增殖、抑制细胞凋亡, 对胃I/R损伤有保护作用, 其可能机制与其清除氧自由基、抑制脂质过氧化有关.
引文著录: 刘河霞, 费素娟, 叶惠惠, 张姣丽, 张咏梅. 丙泊酚对小鼠胃缺血/再灌注后细胞增殖及凋亡的影响. 世界华人消化杂志 2012; 20(17): 1495-1501
Revised: March 27, 2012
Accepted: April 19, 2012
Published online: June 18, 2012
AIM: To observe the changes in proliferation and apoptosis of gastric mucosal cells in gastric ischemia-reperfusion (I/R) injury, and to clarify whether propofol has a gastric protection effect and the possible mechanisms involved.
METHODS: Seventy-two Kunming mice were randomly divided into four groups: sham operation group, I/R injury group, fat emulsion group, and propofol group. Except the sham operation group, I/R injury was induced in other groups by clamping the celiac artery for 30 min and allowing reperfusion for 1h. The mice were finally sacrificed to observe morphological changes and investigate gastric mucosal damage index (GMDI). The histological changes of the stomach were observed using light microscopy. The content of malondialdehyde (MDA) and activity of superoxide dismutas (SOD) in gastric mucosal cells were measured by colorimetry analysis. Immunohistochemistry and TdT-mediated d-UTP-biotin nick end-labeling (TUNEL) assay were used to observe PCNA expression and apoptosis in gastric mucosa, and the expression of Bax and Bcl-2 proteins was determined by Western blot.
RESULTS: Severe mucosal lesions induced by gastric I/R were considerably reduced following administration of propofol (25 mg/kg); mucosal and submueosal hyperemia, edema, and deep erosion were improved significantly. Compared to the I/R group, treatment with propofol significantly reduced gastric mucosal MDA content and cell apoptosis (33.9% ± 1.3% vs 60.8% ± 6.9%, P < 0.01), enhanced SOD activity, promoted cell proliferation (16.0% ± 1.8% vs 6.4% ± 1.2%, P < 0.01), and regulated Bax (0.453 ± 0.025 vs 0.268 ± 0.023, P < 0.01) and Bcl-2 (0.513 ± 0.014 vs 0.752 ± 0.015, P < 0.01) protein expression.
CONCLUSION: Propofol protects against gastric gastric I/R injury possibly by promoting gastric mucosal cell proliferation and inhibiting apoptosis.
- Citation: Liu HX, Fei SJ, Ye HH, Zhang JL, Zhang YM. Effect of propofol on proliferation and apoptosis of gastric mucosal cells in gastric ischemia-reperfusion injury in mice. Shijie Huaren Xiaohua Zazhi 2012; 20(17): 1495-1501
- URL: https://www.wjgnet.com/1009-3079/full/v20/i17/1495.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i17.1495
胃缺血/再灌注损伤(gastric ischemia reperfusion injury, GI/RI)是临床上普遍存在的一种脏器损伤现象, 各种严重的应激性刺激, 如创伤、烧伤、严重感染、休克、远隔器官的缺血再灌注、缺血性肠病及坏死性肠炎等[1-3]情况均可不同程度的导致GI/RI. GI/RI涉及较多的病理生理过程, 但主要与氧自由基有关[4]; 丙泊酚又叫异丙酚, 是临床上常用的静脉麻醉药, 现已有研究证实其除具有麻醉作用外, 还具有较强的抗氧化作用, 对缺血/再灌注(ischemia-reperfusion, I/R)引起的组织器官损伤有较好的保护作用, 但目前主要集中在对心、脑、肠等器官I/R损伤方面的研究[5-7], 而对GI/RI的研究却相对较少, 本研究通过建立小鼠GI/RI模型, 观察丙泊酚对GI/RI的影响, 进一步探讨其可能的机制.
健康昆明小鼠72只, ♂, 8-12周龄, 由徐州医学院实验动物中心提供[由江苏省科技厅批准, 许可证号: XYXK苏(2002-0038)]; 丙泊酚注射液(批号: GM399, Astra Zeneca公司, 意大利); 脂肪乳注射液(批号: 80EF088, 华瑞制药有限公司); MDA、SOD试剂盒(南京生物建成生物工程); 小鼠抗大鼠增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)单克隆抗体、SABC试剂盒(武汉博士德生物工程公司); Bax兔抗鼠多克隆抗体(P-19, sc-526)和Bcl-2兔抗鼠多克隆抗体(N-19, sc-492)(Santa Cruz公司, 美国); SDS-PAGE试剂盒(碧云天生物科技研究所); 原位细胞凋亡检测(TUNEL)试剂盒(Roche公司, 德国); 其他试剂为国产分析纯试剂.
1.2.1 分组: 在12 h节律下饲养, 室温及湿度分别维持在20 ℃和50%左右, 实验前禁食24 h、自由饮水. 将动物随机分为4组: 假手术组(sham, S组)、I/R组、脂肪乳组(fat emulsion, F组)、丙泊酚组(propofol, P组), 每组18只小鼠.
1.2.2 GI/RI模型的制备及标本采集: 按照Zhang等[8]方法制备GI/RI模型, 实验时用10%水合氯醛0.3 mL/100 g腹腔麻醉, 麻醉完全后将动物仰卧固定于手术台上, 剪毛, 开腹, 分离并夹闭腹腔动脉30 min, 去除动脉夹恢复血流. S组仅分离腹腔动脉, 不进行夹闭; P组及F组按照文献报道[9]分别在缺血30 min前腹腔注射丙泊酚或脂肪乳25 mg/kg, 各组于再灌注1 h后处死动物快速取胃, 向8只小鼠胃内注入40 g/L甲醛溶液10 mL固定5 min, 沿纵轴大弯侧剖开, 漂洗平铺拍照后继续固定于40 g/L甲醛溶液中用于病理学检测, 其余10只用冰的生理盐水洗去内容物取黏膜置于-80 ℃冰箱保存做分子生物学检测.
1.2.3 胃黏膜损伤指数的测定: 参照Zhang等[10]方法并加以改进测定胃黏膜损伤指数, 以腺胃区局限于胃上皮的点状糜烂、溃疡、出血灶的长度累积计分: 正常为0分, 损伤≤1 mm计1分, -2 mm计2分, -3 mm计3分, 余类推. 损伤宽度超过1 mm时分数加倍. 每组小鼠损伤分数的平均值为损伤指数.
1.2.4 组织病理学检测: 取置于40 g/L甲醛溶液中的胃组织做常规病理学切片, 行苏木素-伊红(HE)染色, 光学显微镜下观察胃组织病理形态变化.
1.2.5 胃黏膜SOD活性和MDA含量的测定: 按超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)试剂盒说明操作, SOD利用752分光光度计于波长550 nm测定吸光度(A)值, MDA于波长532 nm测定A值, 然后代入相应公式计算SOD(U/mg prot)值和MDA(nmol/mg prot)值.
1.2.6 胃黏膜PCNA检测: 用免疫组织化学法按照SABC试剂盒说明检测胃黏膜组织PCNA蛋白的表达, 石蜡切片的抗原修复采用pH 6.0的柠檬酸修复液, 加热至沸腾后3 min缓慢冷却; PCNA(抗体稀释比1:100)4 ℃过夜, 用PBS替代一抗作为阴性对照. 在高倍镜(×400)下随机选取10个细胞清晰的视野观察PCNA表达, 记录阳性细胞数及总细胞数, 以各组的阳性细胞百分率代表PCNA增殖指数. PCNA增殖指数(%) = PCNA阳性细胞数/计数细胞总数×100%.
1.2.7 胃黏膜细胞凋亡检测: 采用脱氧核糖核苷酸末端转移酶介导的缺口末端标记(TUNEL)法检测细胞凋亡, 操作过程严格按照试剂盒说明书进行, 将切片贴附于多聚赖氨酸处理过的载玻片上, 常规脱蜡至水, DAB显色, 苏木素复染, 脱水, 透明, 封片. 在显微镜下观察凋亡细胞核呈棕褐色. 每张切片随机取10个高倍镜视野(×400), 计数凋亡细胞及总细胞, 计算胃黏膜细胞凋亡指数, 胃黏膜细胞凋亡指数(%) = (凋亡细胞数目/总细胞数目)×100%.
1.2.8 胃组织蛋白免疫印迹(Western blotting)分析: 将已制备的细胞蛋白提取液测其蛋白浓度后, 经100 ℃水浴变性5 min, 取等量蛋白样品进行电泳, 经10%聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后, 以湿转法转至NC膜上, 3%BSA封闭液封闭2 h后分别加入适当比例稀释的一抗(Bcl-2、Bax兔抗鼠多克隆抗体1:500), 4 ℃过夜. 洗膜后加入相应的碱性磷酸酶标记的二抗, 室温孵育2 h, 洗膜后加入显色剂(NBT/BCIP显色试剂盒), 显色后条带经图像处理仪行激光扫描后测各条带A值, 蛋白激活水平以免疫印迹中相应条带的灰度值相对于内参组的比值来表示.
统计学处理 各组数据均以mean±SD表示, 采用SPSS13.0进行统计分析, 组间比较采用单因素方差分析(One-way ANOVA), 两两比较采用q检验. P<0.05为差异具有统计学意义.
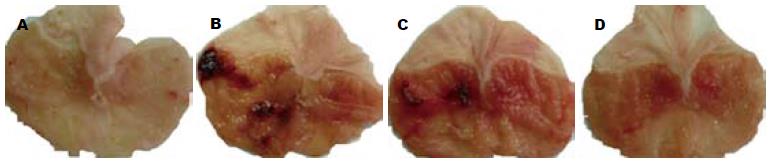
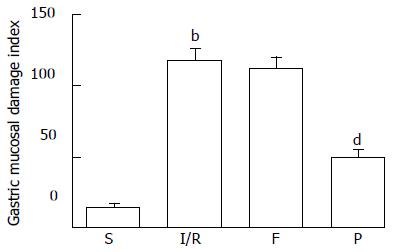
假手术组胃黏膜损伤不明显, 缺血30 min再灌注1 h后胃黏膜损伤明显增加, 胃黏膜损伤指数为118.0±24.3, 腹腔注射25 mg/kg丙泊酚后胃黏膜损伤较I/R组明显减少, 胃黏膜损伤指数为51.0±15.5, 差异有显著统计学意义(P<0.01). 而腹腔注射25 mg/kg脂肪乳后对缺血30 min再灌注1 h后胃黏膜损伤无明显影响, 黏膜损伤仍较重, 胃黏膜损伤指数为112.0±17.2(图1,2).
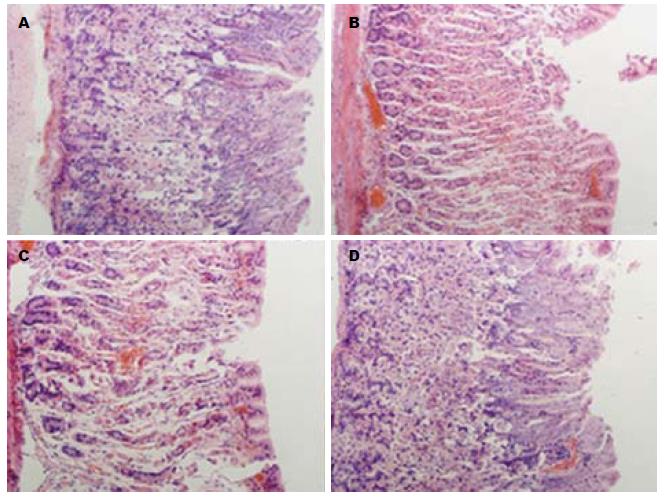
HE染色光镜下观察小鼠的胃组织形态, 结果显示: 假手术组胃黏膜上皮细胞及腺体排列整齐, 除有少量的出血点外无黏膜水肿和脱落, 胃组织结构基本完整; I/R组及脂肪乳组胃黏膜及黏膜下层出现严重的充血、水肿及糜烂; 与I/R组、脂肪乳组相比, 丙泊酚组胃组织病理变化明显减轻, 仅见轻度的黏膜上皮细胞脱落及黏膜下层水肿(图3).
胃缺血再灌注后胃黏膜组织SOD活性显著降低(P<0.01); MDA含量显著增高(P<0.01), 而丙泊酚组与I/R组比较, SOD活性显著增加(P<0.01); MDA含量则显著降低(P<0.01, 表1).
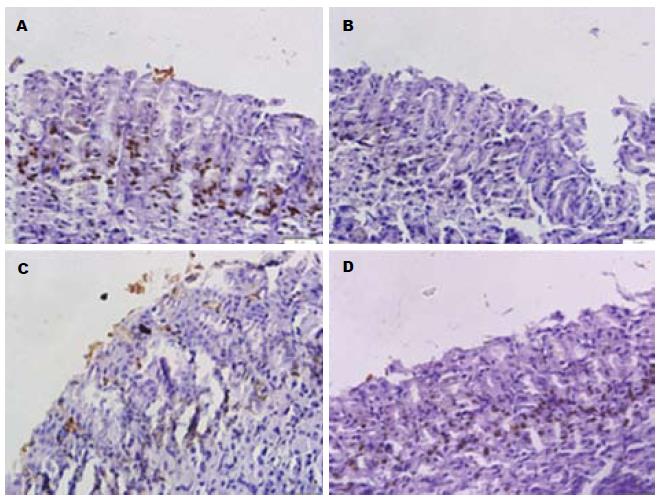
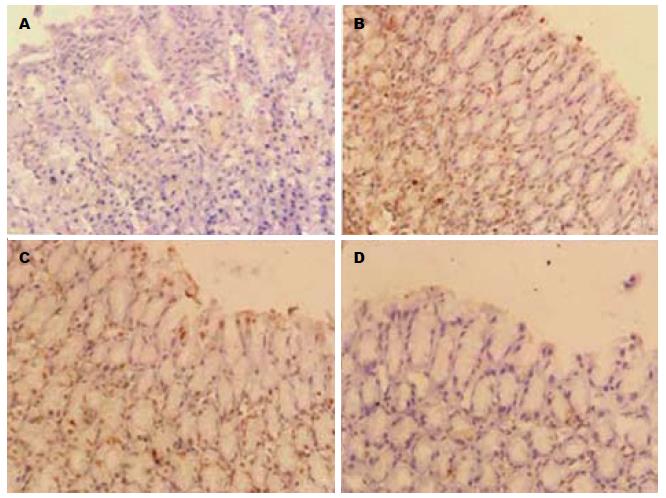
胃黏膜PCNA阳性细胞表达主要在黏膜层中上1/3交界附近, 假手术组胃黏膜此处有一定量的增殖细胞, PCNA增殖指数为25.9%±4.9%. I/R 1 h后增殖细胞明显减少, PCNA增殖指数为6.4%±1.2%, 与假手术组比较有显著性差异(P<0.01), 丙泊酚预处理后明显增加胃黏膜细胞PCNA蛋白的表达水平, PCNA增殖指数为16.0%±1.8%, 较I/R组明显增加(P<0.01), I/R组与脂肪乳组(5.3%±1.1%)相比无统计学意义(图4).
胃黏膜TUNEL阳性细胞染色为棕褐色, 主要位于胞核, 检测结果如图5所示: 在假手术组, 也会见到凋亡阳性细胞, 平均细胞凋亡率是14.0%. 在I/R组, 细胞凋亡率明显增加(60.8%±6.9%), 与假手术组比较有显著统计学意义. I/R组与F组相比无统计学意义. 然而与I/R组(60.7%±6.9%)和脂肪乳组(55.7%±2.9%)相比较, 丙泊酚组(33.9%±1.3%)的凋亡细胞率明显的降低(均P<0.01).
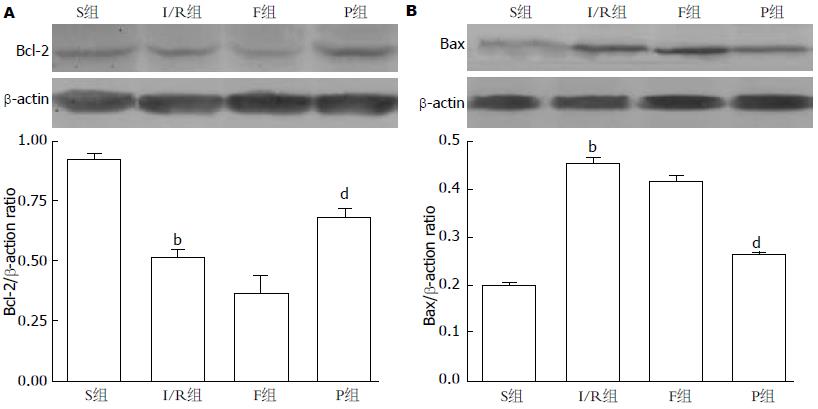
Western蛋白免疫印迹结果(图6)显示, 在假手术组中, 胃黏膜细胞Bax的蛋白表达水平很低(0.213±0.021). 与I/R组(0.453±0.025)及脂肪乳组(0.416±0.032)胃黏膜Bax蛋白表达水平相比, 丙泊酚组(0.268±0.023)胃黏膜Bax蛋白表达水平明显下降, 且有统计学意义(P<0.01); 而在假手术组中(0.922±0.011)胃黏膜Bcl-2蛋白表达水平最高, I/R组和脂肪乳组胃黏膜Bcl-2蛋白表达水平分别为: 0.513±0.014、0.486±0.298, 与丙泊酚组(0.752±0.015)胃黏膜Bax蛋白表达水平相比差异均有显著性(P<0.01).
近年来有许多研究证实了I/R损伤与细胞凋亡之间的关系非常密切, 是I/R损伤中细胞死亡的重要形式[11-13], 细胞凋亡是由体内外多种因素触发的、多种基因严格控制的一系列连锁反应的细胞死亡过程, 也称为程序性细胞死亡, 在正常情况下, 细胞凋亡与增殖保持着总数的平衡, 当细胞正常增殖和分化被扰乱, 平衡被打破导致细胞过度增殖和凋亡异常时, 就会诱发疾病的发生[14,15]. 胃I/R时, 机体氧化和抗氧化系统失衡, 氧自由基产生增多, 当在体内蓄积过多时就会使器官组织的细胞膜脂质过氧化, 细胞线粒体受损, 进而引起组织细胞凋亡坏死, 造成器官组织的损伤[16,17]. 而在与细胞凋亡有关的基因中Bcl-2与Bax被认为是目前研究凋亡调节机制中最重要的基因之一, 其中Bcl-2是重要的凋亡抑制基因, Bax是Bcl-2家族成员之一, 但与Bcl-2的作用相反, 属促凋亡基因, 能促进细胞凋亡[18-22].
丙泊酚又叫异丙酚, 化学名为2,6-双异丙基苯酚, 作为一种静脉麻醉药已经应用于临床十余年, 因其具有起效迅速、作用时间短、苏醒迅速而完全、持续输注后无蓄积等其他静脉麻醉药所无法比拟的特点, 被麻醉医师广泛运用于麻醉诱导、麻醉维持等临床情况[23-25]. 近几年随着消化内镜技术的迅速发展, 消化系统疾病的诊治率有了显著的提高, 但是普通内镜操作往往具有一定的风险和创伤, 易引起患者恶心、呕吐甚至恐惧而拒行内镜检查[26], 从而延误了疾病诊治的最佳时机, 而无痛内镜的开展解决了此问题, 在普通内镜的基础上对患者施以麻醉药物, 让患者在睡眠状态下接受检查, 是一种安全、舒适、有效的检查方法, 不但可以减轻患者痛苦, 还可以消除恐惧心理, 越来越受到患者的青睐, 具有较高的临床应用价值, 其中因丙泊酚具有其他麻醉药无法比拟的优点, 而被作为无痛内镜检查中最常用的麻醉药物[27,28]. 目前普遍认为丙泊酚除具有麻醉作用外, 还具有抗自由基、抑制脂质过氧化反应, 减轻细胞内钙超载以及抑制细胞凋亡等作用, 对心、脑、肺、肾等全身多脏器I/R损伤有较强的保护作用, Acquaviva等[29]研究进一步证实了上述观点并认为Bcl-2家族很可能是丙泊酚抑制细胞凋亡的主要作用位点. 此外麻醉药丙泊酚预处理的给药时机为缺血再灌注前, 与手术中麻醉药物的应用时间非常吻合, 因此麻醉药的合理应用具有更广阔的临床应用价值.
目前麻醉药丙泊酚的缺血预处理对消化器官的保护作用多集中在肝、肠等方面的研究, Kim等[30]研究表明丙泊酚对肝脏I/R有保护作用, Liu等[31]研究表明丙泊酚对肠I/R有保护意义. 而丙泊酚对胃I/R的影响尚少有报道, 本实验研究发现, 胃I/R后, MDA升高, SOD下降, 在缺血前30 min腹腔给予丙泊酚注射液25 mg/kg可以明显减轻由I/R引起的胃黏膜损伤, 提示丙泊酚可减少氧自由基产生并减轻体内脂质氧化程, 上调Bcl-2蛋白和下调Bax蛋白的表达, 降低胃黏膜细胞凋亡指数, 减轻胃黏膜细胞凋亡程度. 结果表明丙泊酚能促进小鼠胃I/R后胃黏膜细胞增殖、抑制细胞凋亡, 对GI/RI有保护作用, 其可能机制与其清除自由基、抑制脂质过氧化有关.
总之, 丙泊酚可以通过清除自由基、抑制脂质过氧化, 促进抗凋亡调控因子Bcl-2的表达, 抑制促凋亡的调控因子Bax的表达, 进而抑制细胞凋亡、促进细胞增殖, 减轻胃I/R引起的胃黏膜的出血、糜烂, 从而对GI/RI发挥显著的保护作用, 初步阐明了丙泊酚对GI/RI的调控及在临床上更加广阔的应用前景. 本研究只观察了丙泊酚对GI/RI细胞凋亡的影响, 但是丙泊酚对胃黏膜的保护作用是一个多基因、多环节、多途径调控的相互作用、相互影响的复杂过程, 并不单单是某一种或某一类基因表达的结果, 丙泊酚究竟是通过何种途径调控这一过程的, 这还有待于我们进一步研究, 以便更加准确地阐述丙泊酚对脏器I/R的保护作用机制, 并且为临床治疗GI/RI提供重要的理论依据.
在创伤、休克、肠道梗阻以及器官移植等外科手术过程中均可引起不同器官缺血/再灌注(I/R)损伤, 其中消化器官是比较敏感的器官, 较早较易受累, 还会产生许多严重的并发症, 对远隔器官如心、肺、肾等造成继发损害, 因此关于如何早期采取有效措施避免或减轻消化器官I/R损伤的研究已成为临床研究的热点.
陆伦根, 教授, 上海交通大学附属第一人民医院消化科
丙泊酚是临床上常用的静脉麻醉药, 现已有研究证实其除具有麻醉作用外, 还具有较强的抗氧化作用, 对I/R引起的组织器官损伤有较好的保护作用. 但目前主要集中在对心、脑、肠等器官I/R损伤方面的研究, 而对GI/RI的研究却相对较少.
近年来众多实验研究表明丙泊酚的抗氧化特性、对炎性因子的影响、抑制钙超载及细胞凋亡等作用能减轻I/R对组织器官的病理、生理反应, 从而减少组织器官的损害.
本文通过观察丙泊酚对小鼠胃I/R后胃黏膜损伤程度及胃黏膜细胞增殖及凋亡的影响, 发现丙泊酚能促进胃黏膜细胞增殖、抑制细胞凋亡等, 设计恰当简单, 思路较新颖.
本研究提示丙泊酚可为治疗或预防消化系统损伤提供新的药物靶点, 扩展了临床上消化系统疾病的治疗途径.
本文观察了丙泊酚对胃I/R时胃黏膜细胞增殖、凋亡及病理变化的影响, 设计合理, 层次分明, 对基础研究和临床研究具有一定的参考意义.
编辑: 曹丽鸥 电编:鲁亚静
| 1. | Brzozowski T, Konturek PC, Konturek SJ, Pajdo R, Kwiecien S, Pawlik M, Drozdowicz D, Sliwowski Z, Pawlik WW. Ischemic preconditioning of remote organs attenuates gastric ischemia-reperfusion injury through involvement of prostaglandins and sensory nerves. Eur J Pharmacol. 2004;499:201-213. [PubMed] [DOI] |
| 2. | Kotani T, Kobata A, Nakamura E, Amagase K, Takeuchi K. Roles of cyclooxygenase-2 and prostacyclin/IP receptors in mucosal defense against ischemia/reperfusion injury in mouse stomach. J Pharmacol Exp Ther. 2006;316:547-555. [PubMed] [DOI] |
| 3. | Savas C, Ozogul C, Karaöz E, Delibas N, Ozgüner F. Splenectomy reduces remote organ damage after intestinal ischaemia-reperfusion injury. Acta Chir Belg. 2003;103:315-320. [PubMed] |
| 4. | El Eter E, Hagar HH, Al-Tuwaijiri A, Arafa M. Nuclear factor-kappaB inhibition by pyrrolidinedithiocarbamate attenuates gastric ischemia-reperfusion injury in rats. Can J Physiol Pharmacol. 2005;83:483-492. [PubMed] [DOI] |
| 5. | Jin YC, Kim W, Ha YM, Shin IW, Sohn JT, Kim HJ, Seo HG, Lee JH, Chang KC. Propofol limits rat myocardial ischemia and reperfusion injury with an associated reduction in apoptotic cell death in vivo. Vascul Pharmacol. 2009;50:71-77. [PubMed] [DOI] |
| 6. | Wang H, Luo M, Li C, Wang G. Propofol post-conditioning induced long-term neuroprotection and reduced internalization of AMPAR GluR2 subunit in a rat model of focal cerebral ischemia/reperfusion. J Neurochem. 2011;119:210-219. [PubMed] [DOI] |
| 8. | Zhang JF, Zhang YM, Yan CD, Zhou XP. Neuroregulative mechanism of hypothalamic paraventricular nucleus on gastric ischemia-reperfusion injury in rats. Life Sci. 2002;71:1501-1510. [PubMed] [DOI] |
| 9. | Yuzbasioglu MF, Aykas A, Kurutas EB, Sahinkanat T. Protective effects of propofol against ischemia/reperfusion injury in rat kidneys. Ren Fail. 2010;32:578-583. [PubMed] [DOI] |
| 10. | Zhang YM, Wei EQ, Hu X, Xu M, Shi Y, Zhang JF. Administration of angiotensin II in the paraventricular nucleus protects gastric mucosa from ischemia-reperfusion injury. Brain Res. 2008;1212:25-34. [PubMed] [DOI] |
| 11. | Valen G. Cellular signalling mechanisms in adaptation to ischemia-induced myocardial damage. Ann Med. 2003;35:300-307. [PubMed] [DOI] |
| 12. | Bedirli N, Akyürek N, Kurtipek O, Kavutcu M, Kartal S, Bayraktar AC. Thoracic epidural bupivacaine attenuates inflammatory response, intestinal lipid peroxidation, oxidative injury, and mucosal apoptosis induced by mesenteric ischemia/reperfusion. Anesth Analg. 2011;113:1226-1232. [PubMed] [DOI] |
| 13. | Liao YH, Xia N, Zhou SF, Tang TT, Yan XX, Lv BJ, Nie SF, Wang J, Iwakura Y, Xiao H. Interleukin-17A contributes to myocardial ischemia/reperfusion injury by regulating cardiomyocyte apoptosis and neutrophil infiltration. J Am Coll Cardiol. 2012;59:420-429. [PubMed] [DOI] |
| 14. | Vollmers HP, Dämmrich J, Hensel F, Ribbert H, Meyer-Bahlburg A, Ufken-Gaul T, von Korff M, Müller-Hermelink HK. Differential expression of apoptosis receptors on diffuse and intestinal type stomach carcinoma. Cancer. 1997;79:433-440. [PubMed] [DOI] |
| 15. | Wagner S, Beil W, Westermann J, Logan RP, Bock CT, Trautwein C, Bleck JS, Manns MP. Regulation of gastric epithelial cell growth by Helicobacter pylori: offdence for a major role of apoptosis. Gastroenterology. 1997;113:1836-1847. [PubMed] [DOI] |
| 17. | Qiao WL, Wang L, Zhang JF, Zhang YM. Effects of gastric ischemia-reperfusion on gastric mucosal cellular apoptosis and proliferation in rats. Shengli Xuebao. 2006;58:237-243. [PubMed] |
| 18. | Adams JM, Cory S. The Bcl-2 protein family: arbiters of cell survival. Science. 1998;281:1322-1326. [PubMed] [DOI] |
| 19. | Park SE, Park C, Kim SH, Hossain MA, Kim MY, Chung HY, Son WS, Kim GY, Choi YH, Kim ND. Korean red ginseng extract induces apoptosis and decreases telomerase activity in human leukemia cells. J Ethnopharmacol. 2009;121:304-312. [PubMed] [DOI] |
| 20. | Garcia EJ, Lawson D, Cotsonis G, Cohen C. Hepatocellular carcinoma and markers of apoptosis (bcl-2, bax, bcl-x): prognostic significance. Appl Immunohistochem Mol Morphol. 2002;10:210-217. [PubMed] [DOI] |
| 21. | Huang YC, Chuang LY, Hung WC. Mechanisms underlying nonsteroidal anti-inflammatory drug-induced p27(Kip1) expression. Mol Pharmacol. 2002;62:1515-1521. [PubMed] [DOI] |
| 22. | Brambilla E, Negoescu A, Gazzeri S, Lantuejoul S, Moro D, Brambilla C, Coll JL. Apoptosis-related factors p53, Bcl2, and Bax in neuroendocrine lung tumors. Am J Pathol. 1996;149:1941-1952. [PubMed] |
| 23. | Thiry JC, Hans P, Deby-Dupont G, Mouythis-Mickalad A, Bonhomme V, Lamy M. Propofol scavenges reactive oxygen species and inhibits the protein nitration induced by activated polymorphonuclear neutrophils. Eur J Pharmacol. 2004;499:29-33. [PubMed] [DOI] |
| 24. | Xia Z, Huang Z, Ansley DM. Large-dose propofol during cardiopulmonary bypass decreases biochemical markers of myocardial injury in coronary surgery patients: a comparison with isoflurane. Anesth Analg. 2006;103:527-532. [PubMed] [DOI] |
| 25. | Bovill JG. Intravenous anesthesia for the patient with left ventricular dysfunction. Semin Cardiothorac Vasc Anesth. 2006;10:43-48. [PubMed] [DOI] |
| 27. | Martínez J, Casellas JA, Aparicio JR, Garmendia M, Amorós A. [Safety of propofol administration by the staff of a gastrointestinal endoscopy unit]. Gastroenterol Hepatol. 2007;30:105-109. [PubMed] [DOI] |
| 28. | Morse JW, Fowler SA, Morse AL. Endoscopist-administered propofol: a retrospective safety study. Can J Gastroenterol. 2008;22:617-620. [PubMed] |
| 29. | Acquaviva R, Campisi A, Murabito P, Raciti G, Avola R, Mangiameli S, Musumeci I, Barcellona ML, Vanella A, Li Volti G. Propofol attenuates peroxynitrite-mediated DNA damage and apoptosis in cultured astrocytes: an alternative protective mechanism. Anesthesiology. 2004;101:1363-1371. [PubMed] [DOI] |
| 30. | Kim SK, Jee D, Kim JY, Choi JH. Effects of propofol on early phase of warm hepatic ischemia/reperfusion injury. Hepatogastroenterology. 2007;54:2333-2336. [PubMed] |
| 31. | Liu KX, Chen SQ, Huang WQ, Li YS, Irwin MG, Xia Z. Propofol pretreatment reduces ceramide production and attenuates intestinal mucosal apoptosis induced by intestinal ischemia/reperfusion in rats. Anesth Analg. 2008;107:1884-1891. [PubMed] [DOI] |