修回日期: 2012-05-03
接受日期: 2012-05-08
在线出版日期: 2012-06-08
目的: 探讨同种异体骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)对急性肝衰竭动物高迁移率族蛋白B1(high mobility group Box 1, HMGB1)的影响.
方法: D-氨基半乳糖(D-GaIN)和脂多糖(LPS)诱导建立小鼠急性肝衰竭模型; 贴壁筛选法培养纯化Balb/c小鼠BMSCs, 传至第4代使用. 90只健康Balb/c小鼠随机均分为3组: 正常组、肝衰竭组、BMSCs治疗组. 分别于12、24、48 h检测各实验组ALT/AST水平, 48 h取各组肝脏行病理学检查. Western blot检测动物血清HMGB1含量.
结果: 急性肝功能衰竭小鼠经BMSCs移植治疗后生存率为83.3%, 与肝衰竭组小鼠存活率16.7%相比差异有显著性意义(P<0.05). 肝衰竭组与BMSCs治疗组12 h ALT/AST水平显著上升, 24 h达到高峰, 48 h开始下降, 肝衰竭组与BMSCs治疗组12、24、48 h ALT/AST水平显著高于正常组(P<0.01), BMSCs治疗组12、24、48 h ALT/AST水平明显低于肝衰竭组, 差异有显著性意义(P<0.05). 肝脏组织病理学结果显示BMSCs治疗组肝细胞变性及坏死程度以及炎症浸润程度轻于肝衰竭组. 免疫印迹显示, 正常组血清中测不到HMGB1, 肝衰竭组血清中HMGB1的含量显著高于BMSCs移植组血清中HMGB1的含量(P<0.01).
结论: BMSCs移植能够抑制肝衰竭中HMGB1水平, BMSCs通过抑制HMGB1减轻肝脏炎症反应治疗急性肝衰竭, 降低肝衰竭死亡率.
引文著录: 易珍, 孙水林, 刘翠云, 雷延昌. 同种异体骨髓间充质干细胞对急性肝衰竭HMGB1的影响. 世界华人消化杂志 2012; 20(16): 1396-1401
Revised: May 3, 2012
Accepted: May 8, 2012
Published online: June 8, 2012
AIM: To explore the influence of allogeneic bone marrow mesenchymal stem cell (BMSC) transpantion on serum levels of high group box protein B1 (HMGB1) in an animal model of acute live failure (ALF).
METHODS: Balb/c mice were given D-galactosamine (D-GaIN) and lipopolysaccharide (LPS) to induce acute liver failure. BMSCs were cultured and purified. Ninety healthy Balb/c mice were randomly assigned to three groups: normal control group, ALF group, and BMSC treatment group. ALT/AST levels were tested 12, 24, and 48 h after treatment, and liver tissue pathological examination was performed after 48 h. The expression of HMGB1 in serum was detected by Western blot.
RESULTS: The survival rate was significantly higher in the BMSC treatment group than in the ALF group (83.3% vs 16.7%, P < 0.05). AST/ALT levels in the ALF group and BMSC treatment group rose significantly at 12 h, peaked at 24 h, and began to fall at 48 h. ALT/AST levels at 12, 24 and 48 h were significantly higher in the ALF group and BMSC treatment group than in the normal group (all P < 0.01), and in the ALF group than in the BMSC treatment group (all P < 0.01). The degeneration and necrosis in liver tissue were less obvious in the BMSC treatment group than in the ALF group. HMGB1 was almost not detectable in normal mouse serum. Serum levels of HMGB1 were significantly higher in the ALF group than in the BMSC treatment group (P < 0.01).
CONCLUSION: BMSC transplantation inhibits HMGB1 expression, reduces liver inflammation, and thereby lowers mortality in mice with ALF.
- Citation: Yi Z, Sun SL, Liu CY, Lei YC. Influence of allogeneic bone marrow mesenchymal stem cell transplantation on serum levels of HMGB1 in mice with acute live failure. Shijie Huaren Xiaohua Zazhi 2012; 20(16): 1396-1401
- URL: https://www.wjgnet.com/1009-3079/full/v20/i16/1396.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i16.1396
同种异体骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)移植给治疗急性肝功能衰竭开辟了新的思路, 与肝原位移植相比, 干细胞自体移植有资源丰富、无排斥[1]、费用低、风险小等优势. BMSCs具有高度自我更新和多向分化潜能, BMSCs能在特定的环境中分化为类肝样细胞[2-4], 并能够通过抑制炎症反应和促进受损肝脏细胞再生[5-7], 降低肝衰竭动物死亡率, 但其作用机制尚不完全明了[8,9]. 高迁移率族蛋白B1(high mobility group Box 1, HMGBl)是一种非组蛋白核内结构蛋白. HMGBl的分泌较其他促炎细胞因子出现晚、持续时间长, 因此被称为晚期炎症介质[10]. 多个临床和实验研究表明肝衰竭时胞外HMGB1显著升高[11-13]. 因此, HMGBl可能参与了急性肝衰竭的病理生理过程并发挥了重要作用. 但BMSCs的移植对晚期炎症因子HMGB1的作用还未见报道. 本研究就自体BMSCs移植对肝衰竭动物模型血清中HMGB1释放的影响进行探讨, 为BMSCs治疗肝衰竭提供新的理论依据.
提取BMSCs的小鼠为2-3周龄Balb/c小鼠(清洁级), 体质量10 g±2 g. 动物模型小鼠为♂6-8周龄Balb/c小鼠(清洁级), 体质量20 g±2 g, 由南昌大学医学院动物科学部提供. 主要试剂及仪器: 胎牛血清、胰蛋白酶(Gibco公司), DMEM低糖培养基(Hyclone公司), 脂多糖(Sigma公司), D-氨基半乳糖(Solarbio公司), HMGB1兔抗鼠单抗(ABGENT公司), 化学发光底物(Thermo公司).
1.2.1 BMSCs的提取、纯化: 断颈处死2-3 wk♂Balb/c小鼠, 放入750 mL/L的乙醇中浸泡, 消毒5-10 min. 无菌条件下取双股骨和胫骨, 用生理盐水冲洗, 剔除骨表面的组织, 用手术剪从股骨或胫骨的中间剪断, 暴露骨髓腔, 用培养液DMEM培养基冲洗骨髓腔和骨骺端. 用1 mL的注射器将骨髓组织打成单个细胞悬液, 将细胞悬液离心13 000 g×10 min, 去上清, 用100 mL/L胎牛血清DMEM培养液重悬细胞接种于25 cm2塑料培养中. 48 h全量更换培养液, 倒置显微镜下观察细胞生长状态. 采用反复贴壁法, 获得贴壁生长的BMSCs. 以后每2-3 d换液一次, 直至长至80%-90%融合时, 用0.25%胰酶消化按1:2传代. 取第3代BMSCs, 用0.25%胰蛋白酶消化. 采用4.2×107/kg的细胞数[8]用0.5 mL无血清的培养基DMEM重悬供移植用.
1.2.2 小鼠BMSCs的鉴定: 细胞盖玻片风干后用40 g/L多聚甲醛固定细胞15 min, 用0.01 mol/L PBS液洗3遍, 每次5 min; 风干后滴加1%BSA封闭抗原, 于37 ℃下孵育30 min; 滴加CD34/CD29抗体(1:200), 37 ℃下孵育1.5 h后用0.01 mol/L PBS液洗3遍, 每次5 min; 滴加FITC标记的山羊抗兔IgG(1:400), 37 ℃下避光孵育40 min后用0.01 mol/L PBS液洗3遍, 每次5 min. 用50%甘油缓冲液封片, 置于荧光显微镜下观察, 并拍摄结果.
1.2.3 动物模型及分组: 将90只6-8周龄♂Balb/c小鼠室温饲养, 普通喂养2 d, 实验前动物禁食12 h, 不禁水, 将Balb/c小鼠随机分为3组: 急性肝衰竭组(n = 30)给予900 mg/kg D-氨基半乳糖和10 μg/kg内毒素, 用0.9%氯化钠溶液稀释至1 mL腹腔注射, BMSCs治疗组(n =30)小鼠以同样的方法致急性肝衰竭3 h后将配制好的BMSCs 4.2×107/kg, 用0.5 mL无血清的培养基DMEM重悬腹腔注射入小鼠体内, 正常对照组(n = 30)在相应时间点腹腔注射等量的生理盐水.
1.2.4 标本收集: 3组分别于注射后12、24和48 h行小鼠眼眶采血分离血清置于-80 ℃保存. 72 h时随机取各实验组3只小鼠, 颈椎脱臼法处死小鼠, 取出肝组织用40 g/L甲醛固定后送进行病理形态学HE染色.
1.2.5 血生化学检测: 全自动生化分析仪检测ALT/AST.
1.2.6 血清HMGB1的检测: 样品经12%的聚丙烯酰胺凝胶电泳, 并转移至硝酸纤维素膜上, 10%BSA 4 ℃封闭过夜. 1:500抗HMGB1抗体37 ℃孵育2 h. 1:5 000辣根过氧化物酶标记的鼠抗兔IgG抗体37 ℃孵育0.5 h. 化学发光法检测HMGB1水平. 使用Quntity one分析软件进行灰度分析.
统计学处理 所有数据用SPSS18.0软件作统计学分析, 数据资料以mean±SD表示, SPSS18.0绘制生存曲线. 不同时段AST/ALT结果采用重复测量设计资料的方差分析法, 两组之间的组间比较应用独立样本t检验.
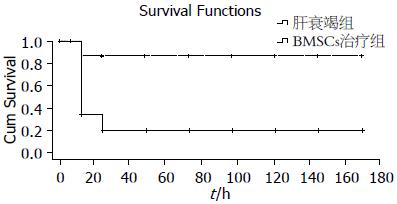
肝衰竭组小鼠1 wk生存率为16.7%, 死亡时间集中发生于给药12-48 h, 而BMSCs治疗组小鼠1 wk生存率为83.3%, 肝衰竭组和BMSCs治疗组比较小鼠生存率有显著差异(P<0.05, 图1).
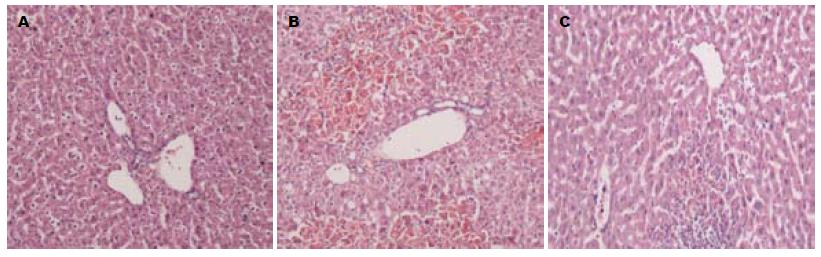
正常对照组小鼠肝组织经HE染色, 显示肝小叶结构完整. 肝衰竭组小鼠大量肝细胞片状坏死, 肝索断裂. 坏死区域大量炎细胞浸润. BMSCs治疗组小鼠肝小叶结构基本完整; 仅见局灶性炎细胞浸润(图2).
正常组小鼠血清ALT/AST水平在各时间点无明显变化. 肝衰竭组大鼠血清ALT水平在各时间点均高于正常组, 24 h出现高峰值. BMSCs治疗组小鼠12、24、48 h血清ALT, AST水平均显著低于肝衰竭组动物(表1, 2).
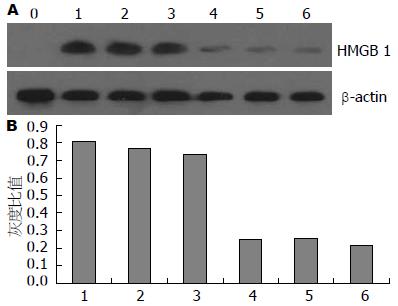
正常小鼠血清未测到HMGB1, 肝衰竭组小鼠血清中的HMGB1相对吸光度(0.7102±0.3216)较BMSCs治疗组中小鼠血清中HMGB1相对吸光度(0.2416±0.1689)显著上升(t = 79.69, P<0.05, 图3).
本研究选用♂Balb/c小鼠, 运用D-氨基半乳糖900 mg/kg和内毒素10 μg/kg建立♂Balb/c小鼠肝衰竭模型, 3 d内小鼠的死亡率为83.3%, ALT/AST水平显著上升, HE染色大量肝细胞片状坏死, 肝索断裂. 坏死区域大量炎细胞浸润, 与国内外肝衰竭模型相符. ♂Balb/c小鼠较♀对药物有相对稳定的应答, 比较容易建立肝衰竭模型. Balb/c小鼠个体差异小, 遗传基因纯, 质量体积小, 移植所需BMSCs数量少, 所以♂Balb/c小鼠是本实验比较理想的动物实验材料. 本研究选用2-3周龄Balb/c小鼠提取BMSCs, 从2-3周龄小鼠中获得的BMSCs较成年小鼠中获得的BMSCs有较强的细胞活性, 细胞增殖速度快, 而选用低于2周龄小鼠提取BMSCs则因小鼠体积很小, 很难获得足够的BMSCs. 故从BMSCs细胞活性和提取BMSCs细胞数量综合考虑本实验选用2-3周龄Balb/c小鼠.
实验结果表明BMSCs移植治疗肝衰竭对晚期炎症因子HMGB1具有抑制作用. BMSCs治疗组中小鼠血清中HMGB1水平显著低于肝衰竭组小鼠血清中的HMGB1水平(P<0.01), BMSCs治疗组小鼠的生存率显著高于肝衰竭组小鼠的生存率(P<0.05), 从HE染色的病理切片中我们可以观察到肝衰竭组中大量肝细胞片状坏死, 肝索断裂. 坏死区域大量炎细胞浸润. 而BMSCs治疗组中肝小叶结构基本完整; 仅见局灶性炎细胞浸润. 肝衰竭组与BMSCs治疗组血清中ALT/AST水平在各个时间段均显著高于正常组(P<0.01), 而肝衰竭组各个时间段血清中ALT/AST水平显著高于BMSCs治疗组(P<0.01). 从实验结果中可以发现血清HMGB1水平与小鼠生存率、ALT/AST水平、HE染色病理切片结果相一致, 这表明抑制HMGB1的释放对急性肝损伤具有修复作用.
急性肝衰竭, 病情非常凶险, 具有很高的死亡率. 急性肝衰竭时, 由于枯否细胞对内毒素灭活能力降低, 内毒素血症发生率可高达90%-100%, 在急性肝衰竭时Toll样受体(Toll-like receptors, TLRs)在各类免疫细胞中广泛表达[14], 内毒素可通过诱导TLRs活化核因子NF-κB, 刺激大量炎性因子释放, 导致继发性全身炎性反应综合征, 并且对肝病的预后产生影响[15,16]. HMGB1被证明是一个炎症因子[17,18], 他既可以通过活化的单核细胞/巨噬细胞、中性粒白细胞和内皮细胞主动释放, 也可以通过坏死的细胞被动释放[19,20]. HMGB1可视为一种作用广泛的晚期促炎症因子[21], 他不仅受到TNF-α、IL-1β的刺激和调控[22], 还能够直接促进炎症因子的释放[23](TNF、IL-1A/B、IL-6和IL-8), 促进外周血单核细胞(Peripheral blood mononuclear cells, PBMCs)释放趋化因子[24,25]. 反过来, PBMCs也产生不同的细胞因子, 参与组织损害. HMGB1刺激炎症细胞活化并向炎症部位聚集, 促进炎症因子分泌造成组织损伤[20]. 动物实验表明HMGBl参与急性肝衰竭病理生理过程并发挥重要作用[18,26], 慢性重型乙型肝炎患者血清中HMGB1的含量与疾病的严重程度密切相关. 提示晚期炎症介质HMGB1在慢性重型乙型肝炎患者肝衰竭的发生中可能起重要的作用[27].
系列基础与临床试验表明BMSCs对肝损伤具有修复功能, BMSCs能抑制过激免疫反应, 抑制肝细胞凋亡及抑制炎症反应(IL-1、TNF-α、IFN-γ、NOS), 治疗肝衰竭[28-31]. 本实验结果提示BMSCs移植能够降低肝衰竭小鼠血清中HMGB1的水平. BMSCs通过抑制HMGB1的释放, 阻止肝脏炎症反应进一步扩大, 从而减轻炎症反应. 降低血清ALT/AST水平, 使得肝脏组织炎症细胞浸润明显减轻, 部分肝小叶保持完整, 降低小鼠死亡率. 本实验给BMSCs治疗肝衰竭提供了新的理论基础. 由于BMSCs具体是通过何种途径降低肝衰竭小鼠血清中HMGB1的水平尚不清楚, 故需进一步研究以便深入了解BMSCs对肝衰竭中HMGB1的作用机制.
骨髓间充质干细胞(BMSCs)移植为治疗急性肝功能衰竭开辟了新的思路, 炎症因子高迁移率族蛋白B1(HMGB1)在肝衰竭的发生中具有重要作用. 然而, BMSCs移植治疗肝衰竭的机制尚不十分清楚.
张进祥, 副教授, 华中科技大学同济医学院附属协和医院
相关研究表明BMSCs能抑制过激的免疫反应, 抑制炎症因子IL-1、TNF -α、IFN-γ、NOS, BMSCs是否对晚期炎症因子HMGB1也具有抑制作用, 值得进一步探讨.
刘婷等不仅阐述了HMGB1在肝衰竭中的变化趋势, 而且还分析了HMGB1与其他炎症因子的相互作用关系.
BMSCs对肝损伤的修复机制众多, 本文从BMSCs能够抑制炎症反应的角度出发, 针对BMSCs对晚期炎症因子HMGB1作用进行研究. 为BMSCs治疗肝衰竭提供新的理论基础.
本研究应用目前较为成熟的肝衰竭小鼠模型, 发现BMSCs移植降低实验性肝衰竭动物血清HMGB1水平, 为BMSCs移植抑制肝衰竭动物炎症反应提供新的理论基础.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Barry FP, Murphy JM. Mesenchymal stem cells: clinical applications and biological characterization. Int J Biochem Cell Biol. 2004;36:568-584. [PubMed] [DOI] |
| 2. | Schwartz RE, Reyes M, Koodie L, Jiang Y, Blackstad M, Lund T, Lenvik T, Johnson S, Hu WS, Verfaillie CM. Multipotent adult progenitor cells from bone marrow differentiate into functional hepatocyte-like cells. J Clin Invest. 2002;109:1291-1302. [PubMed] |
| 3. | Mohamadnejad M, Namiri M, Bagheri M, Hashemi SM, Ghanaati H, Zare Mehrjardi N, Kazemi Ashtiani S, Malekzadeh R, Baharvand H. Phase 1 human trial of autologous bone marrow-hematopoietic stem cell transplantation in patients with decompensated cirrhosis. World J Gastroenterol. 2007;13:3359-3363. [PubMed] |
| 4. | Anzalone R, Lo Iacono M, Corrao S, Magno F, Loria T, Cappello F, Zummo G, Farina F, La Rocca G. New emerging potentials for human Wharton's jelly mesenchymal stem cells: immunological features and hepatocyte-like differentiative capacity. Stem Cells Dev. 2010;19:423-438. [PubMed] [DOI] |
| 5. | Luk JM, Wang PP, Lee CK, Wang JH, Fan ST. Hepatic potential of bone marrow stromal cells: development of in vitro co-culture and intra-portal transplantation models. J Immunol Methods. 2005;305:39-47. [PubMed] [DOI] |
| 6. | Matsuda Y, Matsumoto K, Ichida T, Nakamura T. Hepatocyte growth factor suppresses the onset of liver cirrhosis and abrogates lethal hepatic dysfunction in rats. J Biochem. 1995;118:643-649. [PubMed] |
| 7. | Ueki T, Kaneda Y, Tsutsui H, Nakanishi K, Sawa Y, Morishita R, Matsumoto K, Nakamura T, Takahashi H, Okamoto E. Hepatocyte growth factor gene therapy of liver cirrhosis in rats. Nat Med. 1999;5:226-230. [PubMed] [DOI] |
| 8. | Kuo TK, Hung SP, Chuang CH, Chen CT, Shih YR, Fang SC, Yang VW, Lee OK. Stem cell therapy for liver disease: parameters governing the success of using bone marrow mesenchymal stem cells. Gastroenterology. 2008;134:2111-2121, 2121. e1-e3. [PubMed] |
| 9. | Campard D, Lysy PA, Najimi M, Sokal EM. Native umbilical cord matrix stem cells express hepatic markers and differentiate into hepatocyte-like cells. Gastroenterology. 2008;134:833-848. [PubMed] [DOI] |
| 10. | Erlandsson Harris H, Andersson U. Mini-review: The nuclear protein HMGB1 as a proinflammatory mediator. Eur J Immunol. 2004;34:1503-1512. [PubMed] [DOI] |
| 11. | Zhou RR, Zhao SS, Zou MX, Zhang P, Zhang BX, Dai XH, Li N, Liu HB, Wang H, Fan XG. HMGB1 cytoplasmic translocation in patients with acute liver failure. BMC Gastroenterol. 2011;11:21. [PubMed] [DOI] |
| 14. | 陈 煜, 时 红波, 张 帆, 丁 美, 赵 军, 刘 旭华, 段 钟平. TLR2、TLR4和TLR9在慢性重型肝炎患者及肝衰竭大鼠中的表达. 世界华人消化杂志. 2010;18:1320-1325. [DOI] |
| 16. | Rolando N, Wade J, Davalos M, Wendon J, Philpott-Howard J, Williams R. The systemic inflammatory response syndrome in acute liver failure. Hepatology. 2000;32:734-739. [PubMed] [DOI] |
| 17. | Tsung A, Sahai R, Tanaka H, Nakao A, Fink MP, Lotze MT, Yang H, Li J, Tracey KJ, Geller DA. The nuclear factor HMGB1 mediates hepatic injury after murine liver ischemia-reperfusion. J Exp Med. 2005;201:1135-1143. [PubMed] [DOI] |
| 18. | Wang H, Bloom O, Zhang M, Vishnubhakat JM, Ombrellino M, Che J, Frazier A, Yang H, Ivanova S, Borovikova L. HMG-1 as a late mediator of endotoxin lethality in mice. Science. 1999;285:248-251. [PubMed] [DOI] |
| 19. | Scaffidi P, Misteli T, Bianchi ME. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation. Nature. 2002;418:191-195. [PubMed] [DOI] |
| 20. | Bonaldi T, Talamo F, Scaffidi P, Ferrera D, Porto A, Bachi A, Rubartelli A, Agresti A, Bianchi ME. Monocytic cells hyperacetylate chromatin protein HMGB1 to redirect it towards secretion. EMBO J. 2003;22:5551-5560. [PubMed] [DOI] |
| 21. | Treutiger CJ, Mullins GE, Johansson AS, Rouhiainen A, Rauvala HM, Erlandsson-Harris H, Andersson U, Yang H, Tracey KJ, Andersson J. High mobility group 1 B-box mediates activation of human endothelium. J Intern Med. 2003;254:375-385. [PubMed] [DOI] |
| 22. | Andersson U, Tracey KJ. HMGB1 in sepsis. Scand J Infect Dis. 2003;35:577-584. [PubMed] [DOI] |
| 23. | 卿 伯华, 曾 之耀, 王 湘英, 骆 永富, 李 振华, 张 兴文, 卢 义展. NF-κB、HMGB1在重症急性胰腺炎肠黏膜损伤中的时点表达及意义. 世界华人消化杂志. 2011;19; 3390-3396. [DOI] |
| 24. | Andersson U, Wang H, Palmblad K, Aveberger AC, Bloom O, Erlandsson-Harris H, Janson A, Kokkola R, Zhang M, Yang H. High mobility group 1 protein (HMG-1) stimulates proinflammatory cytokine synthesis in human monocytes. J Exp Med. 2000;192:565-570. [PubMed] [DOI] |
| 25. | Raucci A, Palumbo R, Bianchi ME. HMGB1: a signal of necrosis. Autoimmunity. 2007;40:285-289. [PubMed] [DOI] |
| 28. | Di Campli C, Zocco MA, Saulnier N, Grieco A, Rapaccini G, Addolorato G, Rumi C, Santoliquido A, Leone G, Gasbarrini G. Safety and efficacy profile of G-CSF therapy in patients with acute on chronic liver failure. Dig Liver Dis. 2007;39:1071-1076. [PubMed] [DOI] |
| 29. | Rafii S, Meeus S, Dias S, Hattori K, Heissig B, Shmelkov S, Rafii D, Lyden D. Contribution of marrow-derived progenitors to vascular and cardiac regeneration. Semin Cell Dev Biol. 2002;13:61-67. [PubMed] [DOI] |
| 30. | Haynesworth SE, Baber MA, Caplan AI. Cytokine expression by human marrow-derived mesenchymal progenitor cells in vitro: effects of dexamethasone and IL-1 alpha. J Cell Physiol. 1996;166:585-592. [PubMed] [DOI] |