修回日期: 2012-03-17
接受日期: 2012-04-19
在线出版日期: 2012-06-08
目的: 研究乙型肝炎病毒(hepatitis B virus, HBV)重组腺病毒对HepG2细胞的IL-17R和接头蛋白Act1表达的影响, 以及HBV对IL-17诱导NF-κB活化的影响.
方法: 采用实时荧光定量PCR(real-time PCR)检测HepG2细胞的IL-17、IL-17R和Act1的mRNA表达; 蛋白免疫印迹法(Western blot)检测IL-17R和Act1的蛋白表达; 免疫荧光检测NF-κB核移位; ELISA检测上清的IL-17含量.
结果: 各组HepG2细胞培养上清液中均未检测到IL-17且亦未检测HepG2细胞有IL-17的mRNA表达; HBV重组腺病毒组的IL-17R mRNA和蛋白的表达明显低于相应浓度对照组(0.68±0.02 vs 0.89±0.03, 0.33±0.06 vs 0.81±0.01, 0.12±0.01 vs 0.86±0.05, P<0.05; 蛋白: 0.84±0.12 vs 1.01±0.13, 0.56±0.09 vs 1.01±0.08, 0.24±0.08 vs 0.98±0.05), 且呈剂量和时间依赖性. 但HBV重组腺病毒组与对照组比较, 对HepG2细胞接头蛋白Act1的mRNA和蛋白表达水平无明显影响; 同时HBV重组腺病毒能抑制IL-17R诱导HepG2细胞的NF-κB活化. 但HBV重组腺病毒与对照组比较, 对接头蛋白Act1在mRNA和蛋白表达水平上影响无明显变化; 同时HBV重组腺病毒能抑制IL-17R诱导HepG2细胞的NF-κB活化.
结论: HBV重组腺病毒可降低HepG2细胞的IL-17R mRNA和蛋白的表达, 抑制IL-17R诱导HepG2细胞的NF-κB活化, 对HepG2细胞的IL-17R信号通路发挥抑制作用.
引文著录: 李映菊, 汪煜华, 高勇强, 梁瑜, 刘俊, 彭莉, 肖建华. 乙型肝炎病毒对HepG2细胞IL-17R信号通路的影响. 世界华人消化杂志 2012; 20(16): 1389-1395
Revised: March 17, 2012
Accepted: April 19, 2012
Published online: June 8, 2012
AIM: To investigate whether hepatitis B virus influences the expression of interleukin-17 (IL-17) receptor and the adaptor Act1 in HepG2 cells.
METHODS: The mRNA and protein expression of IL-17 receptor and the adaptor Act1 was determined by real-time PCR and Western blot, respectively. NF-kappa B nuclear translocation was detected by immunofluorescence. The content of IL-17 in cell supernatants was measured by ELISA.
RESULTS: IL-17 was not detected in the culture supernatants of HepG2 cells, and IL-17 mRNA expression was not detected in HepG2 cells. The mRNA and protein expression of IL-17 receptor was significantly lower in HepG2 cells infected with HBV recombinant adenovirus than in cells infected with corresponding concentration of wild adenovirus (mRNA: 0.68±0.02 0.89±0.03, 0.33±0.06 vs 0.81±0.01, 0.12±0.01 vs 0.86±0.05, all P < 0.05; protein: 0.84±0.12 vs 1.01±0.13, 0.56±0.09 vs 1.01±0.08, 0.24±0.08 vs 0.98±0.05, all P < 0.05), and the impact of HBV on the IL-17 receptor expression was dose- and time-dependent. However, HBV had no significant impact on the expression of adaptor Act1. Furthermore, HBV recombinant adenovirus inhibited NF-κB activation induced by IL-17 receptor.
CONCLUSION: Our results indicate that HBV recombinant adenovirus can down-regulate the mRNA and protein expression of IL-17 receptor, inhibit NF-κB activation induced by IL-17R, and thereby prevent the IL-17 receptor signaling pathway in HepG2 cells.
- Citation: Li YJ, Wang YH, Gao YQ, Liang Y, Liu J, Peng L, Xiao JH. Influence of HBV on the interleukin-17 receptor signaling pathway in HepG2 cells. Shijie Huaren Xiaohua Zazhi 2012; 20(16): 1389-1395
- URL: https://www.wjgnet.com/1009-3079/full/v20/i16/1389.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i16.1389
IL-17是近年来发现的效应Th17细胞分泌的一种特征性促炎症因子, 通过与IL-17受体结合, 募集细胞内接头蛋白Act1, 启动多条下游信号通路, 活化NF-κB, 诱导细胞表达细胞因子和趋化因子, 与多种炎症性疾病和自身免疫性疾病发生发展密切相关[1-5]. 近年来研究显示IL-17与乙型肝炎病毒(hepatitis B virus, HBV)相关的肝功能衰竭和肝硬化的发生发展密切相关[6-9], 同时研究者也发现乙型肝炎患者IL-17R的表达下调, 但下调的机制尚不清楚. 本研究应用腺病毒作为载体, 体外研究HBV对HepG2细胞的IL-17R和Act1表达的影响, 以及对IL-17R活化NF-κB的影响.
腺病毒空白载体由本所保存, HBV重组腺病毒由本研究所构建[含1.3倍HBV(adw亚型]全基因组); 人肝癌母细胞瘤HepG2、人胚肾293A细胞由本研究所保存; PrimeScriptTM RT reagent Kit试剂盒、SYBR Premix Ex TaqTM试剂盒均购自TaKaRa公司; BCA蛋白定量试剂盒和RIPA细胞裂解液购自碧云天; HBV核酸扩增荧光定量检测试剂盒购自上海申友; IL-17A、鼠抗人IL-17R一抗体、人抗鼠Act1一抗体、羊抗鼠二抗IgG购自Biolegend公司; NF-κB激活-核转运检测试剂盒购自碧云天; IL-17、IL-17受体、接头蛋白Act1、3-磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase, GAPDH) Real time PCR引物由上海生工合成.
1.2.1 重组腺病毒的扩增和纯化: 用含100 mL/L胎牛血清的DMEM培养液, 在37 ℃、50 mL/L CO2培养箱内大量培养293AD细胞, 隔天换液1次, 待细胞长至80%-90%时, 接种重组腺病毒, 72 h后出现细胞病理效应(cytopathic effect, CPE), 收集细胞和上清, 反复冻融3次(-20 ℃/37 ℃), 离心去除细胞碎片, 收集上清, 用氯化铯梯度离心纯化腺病毒, 然后进行定量检测.
1.2.2 重组腺病毒定量检测: 按HBV核酸扩增荧光定量检测试剂盒说明书对重组HBV腺病毒进行定量检测.
1.2.3 Real time PCR检测IL-17R、IL-17和Act1 mRNA: 把生长良好的HepG2细胞按1×105/mL接种于6孔培养板, 用含100 mL/L新生牛血清的DMEM培养基培养, 放置于37 ℃、50 mL/L CO2培养箱内培养, 隔天换液1次. 待细胞长至70%-80%时, 弃去原来的培养液, 无菌PBS洗3遍, 加无血清的DMEM培养基同步化12-24 h, 根据分组按不同时间点加相应的刺激因素, 用无血清的DMEM培养基继续培养, 并在同一时间点收细胞, 每组设2个复孔. (1)提取总RNA: 吸去培养基, 用无菌PBS洗3遍, 按照RNAiso Plus试剂盒说明提取总RNA, 提取总RNA样品, 检测其A260及A280值, 计算浓度及纯度; (2)逆转录合成cDNA: 根据每个样品浓度, 取适量样品的总RNA, 按PrimeScriptTM RT reagent Kit的说明加入反应体系, 37 ℃ 15 min、85 ℃ 5 s进行逆转录合成cDNA; (3)Real time PCR检测IL-17R、IL-17和Act1 mRNA: 按SYBR Premix Ex TaqTM试剂盒说明书操作, 取每种样品的cDNA检测的IL-17、IL-17R和Act1 mRNA, 引物序列如表1. 反应条件为: 95 ℃ 10 s; 95 ℃ 5 s, 60 ℃ 30 s, 50个循环; 95 ℃ 15 s, 60 ℃ 1 min; 65 ℃-95 ℃收集荧光.
| 基因 | 上游 | 下游 |
| IL-17 | 5'-ACATCCGCTCCAGGGAGAAATGAA-3' | 5'-ATCACAGGGCTGTGGTGAGAATCA-3' |
| IL-17R | 5'-AGGCCATAGTGAAGGCAGGAATCA-3' | 5'-ATTCCAAGGTGAGGTGGATCGGTT-3' |
| Act1 | 5'-TCCCTGTGCTCTTCCCAAATGCTA-3' | 5'-TTCTTGGGCCAGCTGTAGACATGA-3' |
| GAPDH | 5'-TCGACAGTCAGCCGCATCTTCTTT-3' | 5'-ACCAAATCCGTTGACTCCGACCTT-3' |
1.2.4 Western blot检测IL-17R和Act1蛋白表达: 把生长良好的HepG2细胞接种于培养瓶中, 培养细胞至70%-80%时, 同步化细胞进入对数生长期, 根据分组加相应的刺激因素, 用无血清的DMEM培养基继续培养, 并在同一时间点收细胞, 每组设2个复孔. 吸去培养基, 用无菌PBS洗3遍, RIPA细胞裂解液冰上裂解细胞30 min, BCA方法检测细胞总蛋白浓度. 按常规方法进行凝胶电泳, 转膜并封闭后, 分别加入IL-17R、Act1、GAPDH小鼠抗人单克隆抗体, 4 ℃过夜孵育; 再加入HRP标记的羊抗小鼠IgG多克隆抗体, 室温孵育1 h, 洗膜、显影、定影, 分析目的基因与内参基因GAPDH的条带灰度值.
1.2.5 ELISA检测上清IL-17表达: 按IL-17 ELSIA试剂盒说明书操作.
1.2.6 免疫荧光检测NF-κB核移位: 参考NF-κB激活-核转运检测试剂盒说明书, 把已经处理的HepG2细胞洗涤、固定、封闭, 加NF-κB p65抗体孵育, 抗兔Cy3孵育, DAPI染色, 抗荧光淬灭封片液封片, 荧光显微镜下观察. NF-κB为绿色荧光, 细胞核为蓝色荧光.
统计学处理 应用SPSS13.0统计软件进行分析, 数据结果以mean±SD表示, 计量资料采用两组独立样本的t检验, P<0.05表示有统计学意义.
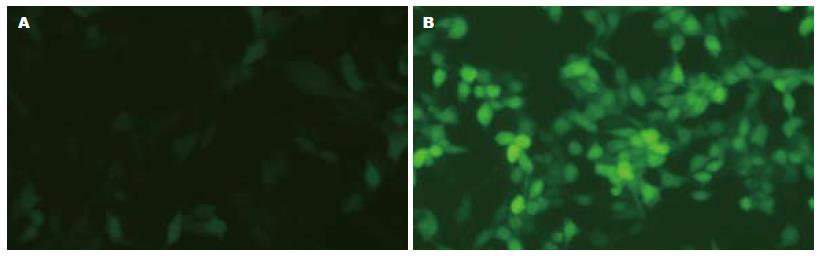
HBV重组腺病毒经扩增、纯化后, 进行定量PCR检测, 病毒指数值为: 1.31×1010. HBV重组腺病毒成功感染HepG2细胞, 48 h后几乎所有细胞都感染上HBV(图1).
2.2.1 不同浓度的HBV重组病毒对HepG2细胞的IL-17R和Act1 mRNA影响: 按0.0%、0.2%、1.0%、5.0%的比例将纯化好的HBV重组腺病毒感染6孔板中的HepG2细胞, 每个样品设2个复孔, 作用24 h收细胞, 随后抽提总RNA, 逆转录及使用SYBR Premix Ex TaqTM试剂盒对IL-17、IL-17R、Act1及GAPDH进行实时定量PCR. 通过对模板的倍释, 检测该体系的反应效率. 所有标本中未检测到IL-17 mRNA; IL-17R、Act1、GAPDH在SYBR Premix Ex TaqTM反应体系中的反应效率分别为1.04, R2 = 0.995; 1.06, R2 = 0.993; 0.96, R2 = 0.997. 此外, IL-17R、Act1及GAPDH的溶解曲线可见一束单一峰, 没有非特异性产物生成, 说明这3对引物的特异性较好, 该反应体系可以用于IL-17R和Act1相对mRNA水平的检测. 采用相对Ct值(△Ct)的方法计算出IL-17R和Act1的mRNA相对表达水平.
感染HBV重组腺病毒的HepG2细胞的IL-17R mRNA水平较相应浓度的感染空白腺病毒组的HepG2细胞IL-17R mRNA明显下降(P<0.05), 且随着感染病毒剂量的增加, IL-17R mRNA下降更明显, 且有统计学差异(P<0.05), Act1的mRNA变化在HBV感染组和对照组没有明显差别(表2).
| 剂量(%) | IL-17R | P值 | Act1 | P值 | ||
| HBV组 | 对照组 | HBV组 | 对照组 | |||
| mean±SD | mean±SD | mean±SD | mean±SD | |||
| 0.0 | 1.00±0.04 | 1.00±0.04 | 0.479 | 1.01±0.09 | 0.91±0.07 | 0.093 |
| 0.2 | 0.68±0.02 | 0.89±0.03 | 0.024 | 0.98±0.13 | 0.93±0.09 | 0.504 |
| 1.0 | 0.33±0.06 | 0.81±0.01 | 0.010 | 1.05±0.10 | 0.95±0.10 | 0.646 |
| 5.0 | 0.12±0.01 | 0.86±0.05 | 0.004 | 0.91±0.08 | 0.89±0.10 | 0.468 |
2.2.2 不同作用时间HBV重组病毒对HepG2细胞的IL-17R和Act1 mRNA影响: 分别在不同时间点(48、36、24、12、6、0 h)按1.0%的浓度感染HepG2细胞HBV重组腺病毒, 并在相应时间点设立野生腺病毒组进行对照. 同一时间点收细胞, 每组设2个复孔, 随着感染时间的延长IL-17R mRNA表达下降越明显, 在48 h下降的最低. 而且在同一时间点HBV重组腺病毒感染组较空白腺病毒感染组下降明显, 具有统计学差异(P<0.05). 同样Act1 mRNA表达与对照组没有明显变化, 也没有随着感染时间的延长出现明显变化(表3).
| 时间(h) | IL-17R | P值 | Act1 | P值 | ||
| HBV组 | 对照组 | HBV组 | 对照组 | |||
| mean±SD | mean±SD | mean±SD | mean±SD | |||
| 0 | 0.99±0.01 | 0.93±0.11 | 0.118 | 0.91±0.095 | 0.91±0.12 | 0.123 |
| 6 | 0.89±0.06 | 0.69±0.16 | 0.003 | 1.14±0.13 | 1.07±0.03 | 0.454 |
| 12 | 0.63±0.13 | 0.31±0.13 | 0 | 0.75±0.09 | 0.83±0.19 | 0.776 |
| 24 | 0.43±0.07 | 0.30±0.05 | 0.009 | 0.86±0.04 | 0.92±0.12 | 0.810 |
| 36 | 0.32±0.01 | 0.17±0.001 | 0.005 | 0.93±0.17 | 0.87±0.10 | 0.077 |
| 48 | 0.11±0.002 | 0.01±0.001 | 0.004 | 0.95±0.02 | 0.90±0.11 | 0.586 |
按0.0%、0.2%、1.0%、5.0%把纯化好的HBV重组腺病毒和空白腺病毒进行稀释, 分别作用于6孔板中HepG2细胞, 每个样品设2个复孔, 24 h收细胞, 同时检测IL-17R和Act1在蛋白水平的改变. 在UVP成像系统中对IL-17R、Act1和GAPDH条带灰度值进行分析, IL-17R蛋白表达与mRNA的结果相一致, HBV重组腺病毒感染组随着感染病毒剂量的增加蛋白表达灰带变淡, 具有统计学意义(P<0.05), 而对照组蛋白表达变化不明显. Act1蛋白表达在HBV感染组最高剂量组中稍有下降, 但与相同剂量的腺病毒感染组无明显差别, 其他剂量组之间该蛋白表达变化也不明显(图2, 表4).
| 剂量(%) | IL-17R | P值 | Act1 | P值 | ||
| HBV组 | 对照组 | HBV组 | 对照组 | |||
| mean±SD | mean±SD | mean±SD | mean±SD | |||
| 0.0 | 1.00±0.08 | 1.02±0.12 | 0.479 | 1.01±0.09 | 0.97±0.07 | 0.093 |
| 0.2 | 0.84±0.12 | 1.01±0.13 | 0.024 | 0.98±0.13 | 0.98±0.09 | 0.504 |
| 1.0 | 0.56±0.09 | 1.01±0.08 | 0.010 | 1.05±0.10 | 0.96±0.11 | 0.646 |
| 5.0 | 0.24±0.08 | 0.98±0.05 | 0.004 | 0.91±0.08 | 0.89±0.10 | 0.468 |
上清中未检出细胞因子IL-17.
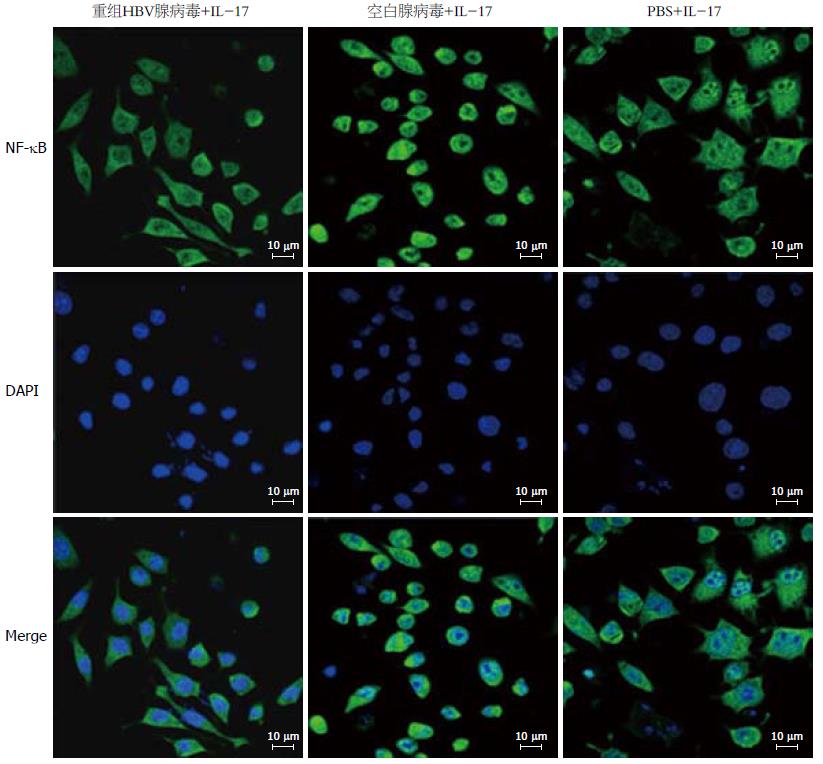
HepG2细胞按1.0%的浓度感染HBV重组腺病毒24 h, 再加IL-17(50 μg/L)作用HepG2细胞0、15、30、60、120 min, 通过免疫荧光观察NF-κB核移位, 同时设立空白对照和空白腺病毒对照, 染色后NF-B为绿色荧光, 细胞核为蓝色荧光. IL-17A能够刺激HepG2细胞的NF-κB活化, 出现核移位现象, 在刺激30 min就出现绿色荧光和蓝色荧光融合现象, 而感染HBV重组腺病毒的HepG2细胞, IL-17A刺激后, 绿色荧光和蓝色荧光融合现象受到抑制, 说明NF-κB活化被抑制(图3).
在HBV感染患者中, 各种免疫细胞通过释放细胞因子清除病毒和调节肝脏的损伤. IL-17是Th17细胞分泌的一种标志性促炎症因子, 通过与IL-17受体结合而发挥作用[10]. IL-17R在肝细胞、库普弗细胞、肝星状细胞、胆管上皮细胞、肝窦内皮细胞等多种肝脏细胞中广泛表达, 意味着IL-17在肝脏具有多种复杂功能[11]. 研究发现IL-17在乙型肝炎相关性慢加急性肝功能衰竭患者的肝脏局部显著升高, 通过IL-17R刺激肝脏细胞产生多种致炎因子(如IL-1、IL-6、TNF-α及IL-23), 介导肝脏炎症损伤加剧. 但同时也发现乙型肝炎患者外周单核细胞和髓系树突状细胞上IL-17R的表达水平低于正常健康对照, IL-17R刺激单核细胞和髓系树突细胞分泌炎性细胞因子没有正常健康者显著[7], 研究者推测IL-17R表达下调与血清L-17升高引起的负反馈效应有关, 但未予以进一步研究证实.
普遍认为HBV本身没有细胞毒性, 而是机体免疫应答导致肝脏免疫病理损伤[7-17], 但通过基因芯片和蛋白组学技术发现HBV感染对细胞增殖、基因表达、信号转导、糖脂类物质代谢等诸多方面存在不同程度的影响[18-21]. HBV本身是否可导致感染的细胞IL-17R表达下调, 未见研究报道. 本课题拟体外研究HBV对IL-17R的表达及IL-17R信号传导通路的影响.
IL-17及其受体参与NF-κB、STAT和AP1等核因子的信号转导途径. 已经证实IL-17受体胞内段SEFIR结构域通过与Act1的SEFIR结构同源结合, 募集Act1, 启动多条下游信号通路, 活化NF-κB, 与多种炎症性疾病和自身免疫性疾病发生发展密切相关[22]. NF-κB为核转录因子, 广泛存在于多种组织细胞中, 调控多种细胞因子和炎症介质等基因表达, 参与炎症反应. 通常情况下, NF-κB和IκB形成复合体, 以无活性形式存在于胞浆中. 当细胞受胞外信号刺激后, IκB激酶复合体(IκB kinase, IKK)活化将IκB磷酸化, 使NF-κB暴露核定位位点. 游离的NF-κB迅速移位到细胞核, 与特异性κB序列结合, 诱导相关基因转录[23]. 在成纤维细胞中Act1蛋白的缺乏可导致IL-17介导的细胞因子及趋化因子的表达减少, 选择性地降低IL-17诱导的NF-κB活化, 因此Act1是激活IL-17R信号传导, 活化NF-κB必需的成分[24].
传统的携带HBV基因组的质粒体外感染肝细胞效率低, 而以腺病毒为载体可以明显增加HBV的感染率[25], 因此, 本研究用腺病毒将1.3倍HBV基因组导入肝癌细胞株HepG2细胞, 在感染48 h后, 几乎所有HepG2细胞被HBV感染, 成功构建了HBV感染的细胞模型, 利用该模型我们研究HBV病毒对HepG2细胞的IL-17R信号传导通路的影响.
在本研究中, 我们发现HBV重组腺病毒能降低HepG2细胞的IL-17R mRNA和蛋白表达, 与空白对照的腺病毒存在统计学差异(P<0.05), 且降低程度呈剂量依赖性. HepG2细胞在感染HBV病毒48 h降到最低程度, 证实乙型肝炎患者IL-17R表达下降与HBV感染直接相关, 不是IL-17引起的负反馈调节的结果, 因为在本研究中HepG2细胞并没有分泌IL-17. 我们还进一步发现HBV重组腺病毒对IL-17引起的NF-κB的核转移有一定程度的抑制作用, 而HBV重组腺病毒对HepG2细胞的Act1基因转录和蛋白表达没有明显的影响, 说明这种抑制作用与IL-17R表达下调有关. 本研究证实了HBV对细胞因子IL-17及其信号通路的发挥有一定程度的抑制作用, 这可能是病毒自身一种对损伤的一种保护机制.
IL-17是近年来发现的效应Th17细胞分泌的一种特征性促炎症因子, 通过与IL-17受体结合发挥作用. 据报道IL-17与乙型肝炎病毒(HBV)相关的肝功能衰竭和肝硬化的发生发展密切相关.
王阁, 教授, 中国人民解放军第三军医大学第三附属医院
HBV感染不但引起机体免疫应答导致肝脏免疫病理损伤, 而且越来越多的证据证明HBV对细胞增殖、基因表达、信号转导、糖脂类物质代谢等诸多方面存在不同程度的影响.
研究发现乙型肝炎患者外周单核细胞和髓系树突状细胞中IL-17R的表达水平下降, 并推测IL-17R表达下调与血清L-17升高引起的负反馈效应有关, 但未予以进一步研究证实.
本研究成功构建了HBV感染的细胞模型, 并利用该模型研究HBV病毒对HepG2细胞的IL-17R信号传导通路的影响, 有助于揭示二者相互作用的具体分子机制.
本研究表明HBV对HepG2细胞的IL-17R信号通路发挥抑制作用, 研究内容丰富, 方法合理, 有说服力.
编辑: 张姗姗 电编:闫晋利
| 1. | Miossec P. Interleukin-17 in rheumatoid arthritis: if T cells were to contribute to inflammation and destruction through synergy. Arthritis Rheum. 2003;48:594-601. [PubMed] [DOI] |
| 2. | Nistala K, Moncrieffe H, Newton KR, Varsani H, Hunter P, Wedderburn LR. Interleukin-17-producing T cells are enriched in the joints of children with arthritis, but have a reciprocal relationship to regulatory T cell numbers. Arthritis Rheum. 2008;58:875-887. [PubMed] [DOI] |
| 3. | Bullens DM, Truyen E, Coteur L, Dilissen E, Hellings PW, Dupont LJ, Ceuppens JL. IL-17 mRNA in sputum of asthmatic patients: linking T cell driven inflammation and granulocytic influx? Respir Res. 2006;7:135. [PubMed] [DOI] |
| 4. | Wong CK, Lit LC, Tam LS, Li EK, Wong PT, Lam CW. Hyperproduction of IL-23 and IL-17 in patients with systemic lupus erythematosus: implications for Th17-mediated inflammation in auto-immunity. Clin Immunol. 2008;127:385-393. [PubMed] [DOI] |
| 5. | Fransson ME, Liljenfeldt LS, Fagius J, Tötterman TH, Loskog AS. The T-cell pool is anergized in patients with multiple sclerosis in remission. Immunology. 2009;126:92-101. [PubMed] [DOI] |
| 6. | Ge J, Wang K, Meng QH, Qi ZX, Meng FL, Fan YC. Implication of Th17 and Th1 cells in patients with chronic active hepatitis B. J Clin Immunol. 2010;30:60-67. [PubMed] [DOI] |
| 7. | Zhang JY, Zhang Z, Lin F, Zou ZS, Xu RN, Jin L, Fu JL, Shi F, Shi M, Wang HF. Interleukin-17-producing CD4(+) T cells increase with severity of liver damage in patients with chronic hepatitis B. Hepatology. 2010;51:81-91. [PubMed] [DOI] |
| 8. | Lemmers A, Moreno C, Gustot T, Maréchal R, Degré D, Demetter P, de Nadai P, Geerts A, Quertinmont E, Vercruysse V. The interleukin-17 pathway is involved in human alcoholic liver disease. Hepatology. 2009;49:646-657. [PubMed] [DOI] |
| 9. | Xu Y, DU WJ, Qin LY, Xing ZZ, Qin XH, Chen SJ. [Expression of interleukin-17 in hepatitis B related liver fibrosis]. Xibao Yu Fenzi Mianyixue Zazhi. 2009;25:133-135. [PubMed] |
| 10. | Chang SH, Reynolds JM, Pappu BP, Chen G, Martinez GJ, Dong C. Interleukin-17C promotes Th17 cell responses and autoimmune disease via interleukin-17 receptor E. Immunity. 2011;35:611-621. [PubMed] [DOI] |
| 11. | Patel DN, King CA, Bailey SR, Holt JW, Venkatachalam K, Agrawal A, Valente AJ, Chandrasekar B. Interleukin-17 stimulates C-reactive protein expression in hepatocytes and smooth muscle cells via p38 MAPK and ERK1/2-dependent NF-kappaB and C/EBPbeta activation. J Biol Chem. 2007;282:27229-27238. [PubMed] [DOI] |
| 12. | Webster GJ, Reignat S, Maini MK, Whalley SA, Ogg GS, King A, Brown D, Amlot PL, Williams R, Vergani D. Incubation phase of acute hepatitis B in man: dynamic of cellular immune mechanisms. Hepatology. 2000;32:1117-1124. [PubMed] [DOI] |
| 13. | Kakimi K, Guidotti LG, Koezuka Y, Chisari FV. Natural killer T cell activation inhibits hepatitis B virus replication in vivo. J Exp Med. 2000;192:921-930. [PubMed] [DOI] |
| 14. | Thimme R, Wieland S, Steiger C, Ghrayeb J, Reimann KA, Purcell RH, Chisari FV. CD8(+) T cells mediate viral clearance and disease pathogenesis during acute hepatitis B virus infection. J Virol. 2003;77:68-76. [PubMed] [DOI] |
| 15. | Guidotti LG, Ishikawa T, Hobbs MV, Matzke B, Schreiber R, Chisari FV. Intracellular inactivation of the hepatitis B virus by cytotoxic T lymphocytes. Immunity. 1996;4:25-36. [PubMed] [DOI] |
| 16. | Sigal LJ, Crotty S, Andino R, Rock KL. Cytotoxic T-cell immunity to virus-infected non-haematopoietic cells requires presentation of exogenous antigen. Nature. 1999;398:77-80. [PubMed] [DOI] |
| 17. | Guidotti LG, Rochford R, Chung J, Shapiro M, Purcell R, Chisari FV. Viral clearance without destruction of infected cells during acute HBV infection. Science. 1999;284:825-829. [PubMed] [DOI] |
| 21. | 张 维燕, 张 锦前, 王 琦, 李 国力, 王 晓春, 张 晨宇, 杨 涤, 成 军. 酵母双杂交技术对人胰腺cDNA文库中HBcAg结合蛋白基因的筛选. 世界华人消化杂志. 2008;16:1746-1750. [DOI] |
| 22. | Qian Y, Liu C, Hartupee J, Altuntas CZ, Gulen MF, Jane-Wit D, Xiao J, Lu Y, Giltiay N, Liu J. The adaptor Act1 is required for interleukin 17-dependent signaling associated with autoimmune and inflammatory disease. Nat Immunol. 2007;8:247-256. [PubMed] [DOI] |
| 23. | Kalia M, Kukol A. Structure and dynamics of the kinase IKK-β--A key regulator of the NF-kappa B transcription factor. J Struct Biol. 2011;176:133-142. [PubMed] [DOI] |
| 24. | Chang SH, Park H, Dong C. Act1 adaptor protein is an immediate and essential signaling component of interleukin-17 receptor. J Biol Chem. 2006;281:35603-35607. [PubMed] [DOI] |