修回日期: 2012-03-15
接受日期: 2012-04-17
在线出版日期: 2012-05-18
目的: 检测不同胃疾病黏膜中胃蛋白酶原(pepsinogen C, PGC)的表达及血清sPGC、sPGA浓度, 分析二者的相关性, 给临床工作提供更有益信息.
方法: 免疫组织化学染色法检测不同胃疾病黏膜组织中PGC的表达, 并结合ELISA法检测血清中sPGC、sPGA的含量. 之后用SPSS16.0分析软件进行统计学处理, P<0.05具有统计学意义.
结果: PGC在不同胃疾病黏膜中的表达有差异(P = 0.000). 浅表-萎缩-伴肠化-伴异型增生-腺癌, PGC阳性率呈现递减. sPGC、sPGA浓度在各组间比较差异有统计学意义(P = 0.000, P = 0.000). sPGA呈现递减, 浅表组与其余各组相比差异有统计学意义(P = 0.035, 0.000, 0.000, 0.000); 萎缩组与其余各组相比差异有统计学意义(P = 0.000, 0.000, 0.031); 肠化组/异型增生组与胃癌组比较差异有统计学意义(P = 0.047, 0.034); sPGC表现为逐渐上降趋势, 胃癌组与其他各组相比差异显著(P = 0.000, 0.000, 0.003, 0.001). 浅表-萎缩-肠化-异型增生-胃癌, PGC表达与sPGA呈负相关, 与sPGC呈正相关(r = 0.956, P = 0.011 vs sPGA; r = -0.968, P = 0.007 vs sPGC).
结论: PGC的动态表达与胃疾病的发生发展有良好的相关性; 血清sPGA明显降低提示可能与胃癌的发生发展有关; 若同时进行血清PG值及组织PGC抗原表达率检测, 二者具有良好的相关性, 可作为临床筛查胃癌及癌前疾病的指标.
引文著录: 王恬, 冯义朝, 王浩. PGC在不同胃疾病黏膜中的表达及与血清学水平的关系. 世界华人消化杂志 2012; 20(14): 1242-1245
Revised: March 15, 2012
Accepted: April 17, 2012
Published online: May 18, 2012
AIM: To detect the gastric expression levels of pepsinogen C (PGC) and serum levels of sPGA and sPGC in patients with various gastric diseases and to analyze their correlation.
METHODS: Gastric PGC were measured by immunohistochemistry, and serum levels of sPGA, sPGC were measured by ELISA in patients with various gastric diseases, respectively. The data were analyzed for significance using the SPSS16.0 software.
RESULTS: There were significant differences in gastric PGC expression among patients with different gastric diseases (P = 0.000). The positive rate of PGC expression was highest in patients with superficial gastritis (SG), followed by those with atrophic gastritis (AG), intestinal metaplasia (IM), dysplasia (DYS) and gastric carcinoma (Ca). The positive rate of PGC was significantly higher in SG than in other lesions (P = 0.035, 0.000, 0.000, 0.000), in AG than in IM, DYS and Ca (P = 0.000, 0.000, 0.031). There were also significant differences in serum levels of sPGA and sPGC among different patient groups (both P = 0.000). Similar to PGC expression, serum levels of sPGA also decreased in an order of SG-AG-IM-DYS-Ca. In contrast, serum levels of sPGC in Ca were significantly higher than those in other lesions (P = 0.000, 0.000, 0.003, 0.001). The positive rate of PGC expression had a positive correlation with serum levels of sPGA and a negative correlation with serum levels of sPGC (r = 0.956, P = 0.011 vs sPGA; r = -0.968, P = 0.007 vs sPGC).
CONCLUSION: Tissue expression of PGC is negatively associated with the malignant degree of gastric mucosa cells and positively with the development of gastric mucosal diseases. Combined detection of sPG and PGC expression can help screen and diagnose gastric mucosal diseases.
- Citation: Wang T, Feng YC, Wang H. Comparison of gastric expression and serum levels of PGC in patients with various gastric diseases. Shijie Huaren Xiaohua Zazhi 2012; 20(14): 1242-1245
- URL: https://www.wjgnet.com/1009-3079/full/v20/i14/1242.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i14.1242
胃癌是当今最常见的5种恶性肿瘤(其余4种为肺癌、肠癌、乳腺癌、肝癌)之一. 在我国, 每年新确诊胃癌患者有30万人, 死于胃癌者达16万人, 占全部恶性肿瘤死亡人数的23%, 在消化系肿瘤死亡人数中占50%. 胃蛋白酶原(pepsinogen C, PGC)最初出现在胚胎后期, 他标志着胃黏膜细胞的分化成熟和消化功能的逐渐完善, PGC的变化可以反映胃的分泌功能及分化程度[1]. 本研究采用免疫组织化学技术和酶联免疫吸附(ELISA)技术, 通过分析延安地区204例不同胃疾病黏膜组织中PGC表达和血清中PGC含量及2者相关性, 进一步诠释PGC作为胃癌标志物在胃癌诊治中的应用意义.
利用延安大学附属医院病理科2008-2009年胃镜及手术活检标本204例, 由病理科医师对其进行组织学诊断, 包括49例浅表性胃炎、35例萎缩性胃炎、40例伴肠化、39例伴异型增生、41例腺癌. 其中男性146例, 女性58例, 男:女 = 2.52:1; 最小5岁, 最大84岁, 平均年龄51.27岁; 各组在性别及年龄构成上差异无统计学意义(P>0.05). 浓缩型兔抗人胃蛋白酶原C多克隆抗体、(PGC)酶联免疫分析试剂盒、(PGA)酶联免疫分析试剂盒(上海活乐生物科技有限公司); 免疫组织化学SABC试剂盒(SA1020)、DAB染色剂试剂盒(武汉博士德生物科技有限公司). Walac 1470 WIZARD伽马计数器(芬兰), BioRad550酶标仪(德国).
1.2.1 胃蛋白酶原C的免疫组织化学染色(SABC法): (1)切片常规脱蜡水化; (2)消除内源性过氧化物酶; (3)抗原修复; (4)滴加5%BSA封闭液; (5)滴加一抗; (6)滴加二抗; (7)滴加SABC液; (8)滴加新鲜配制DAB试剂; (9)自来水冲洗, 苏木素复染、酒精水化, 脱水干燥; (10)中性树胶固定、封片, 光镜观察. 结果判定参照文献[2]采用综合评分法.
1.2.2 PGA、PGC血清ELISA检测: (1)平衡至室温; (2)标准品的稀释与加样; (3)加样; (4)温育; (5)配液; (6)洗涤; (7)加酶; (8)温育; (9)洗涤; (10)显色; (11)终止; (12)用酶标仪测定各孔吸光度(A)值.
统计学处理 利用SPSS统计软件包进行统计学处理, 独立样本K-S检验判断变量是否服从正态分布; 计数资料采用χ2检验、Fisher确切概率检验进行分析; 计量资料采用方差分析、t检验; P<0.05有统计学意义; 组织表达与血清含量相关性采用Pearson相关性分析.
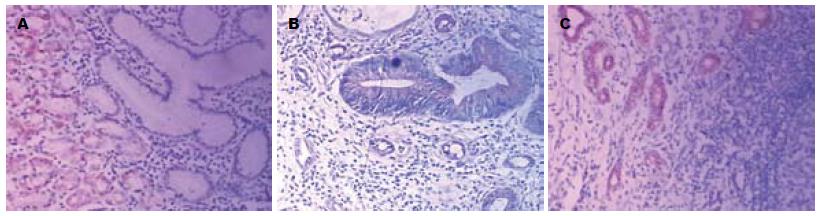
对204例组织均进行PGC染色, 发现各组PGC阳性率总体上有差异(P = 0.000). 从单纯浅表-单纯萎缩-伴肠化/异性增生-胃癌, PGC阳性表达率逐渐下降(95.9%-77.1%-55.0%-51.3%-7.3%). 通过两两比较发现, 即从良性疾病到胃癌前疾病, PGC表达率显著下降(P<0.05), 从胃癌前疾病到胃癌, PGC阳性表达率显著下降(P<0.05, 图1, 表1).
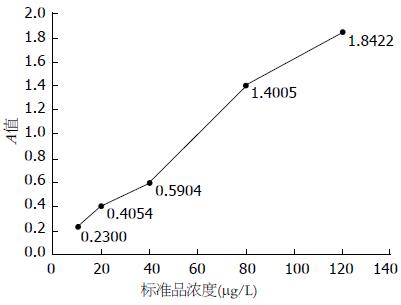
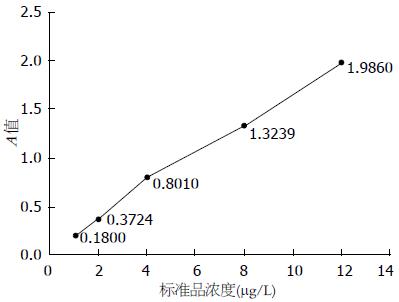
首先进行单因素方差分析, 结果显示不同胃疾病组血清PG浓度差异明显(sPGA F = 5.555, P = 0.000; sPGC F = 6.837, P = 0.000): 在单纯浅表组, 均数浓度最高为86.72 μg/L, 其次为单纯萎缩组(70.76 μg/L), 在癌前病变组(伴肠化/异性增生)则为59.87 μg/L、54.09 μg/L, 胃癌组浓度最低为43.79 μg/L, 总体上各组间sPGA浓度差异有统计学意义. 随着胃黏膜疾病的加重, 从单纯浅表-单纯萎缩-伴肠化/异性增生-胃癌, sPGC浓度也表现为逐渐上升趋势(依次均数浓度为7.77 μg/L、7.88 μg/L、8.86 μg/L、8.69 μg/L、11.02 μg/L), 总体上各组间sPGC浓度差异有统计学差异(P<0.05), 胃癌组与其他各组相比差异显著(均P<0.05), 但其余组间相互比较差异无统计学意义(均P>0.05, 图2, 3, 表2).
Pearson等级相关分析结果发现, 从单纯浅表-单纯萎缩-伴肠化/异性增生-胃癌, 随着病变的发展, PGC表达阳性率逐渐下降, sPGA浓度呈下降趋势, sPGC呈上升趋势, 其间具有良好的相关性(r = 0.956, P = 0.011 vs sPGA; r = -0.968, P = 0.007 vs sPGC).
PG是一种具有消化功能的内切酶, 属于天冬氨酸蛋白水解酶, 是胃蛋白酶的前体. PGC也称前胃泌素, 广泛分布于胃及近端十二指肠, 是胃黏膜细胞分化的终末产物, 可作为消化功能逐渐成熟的一种标志[3]. 由于考虑到PGA表达部位局限, 其临床意义不如PGC, 本组实验只测定了胃黏膜组织中PGC的表达水平.
近年来, 在胃黏膜中PGC表达情况报道较少, 且目前尚无明确实验证实癌组织PGC表达与临床特征有相关性. 我们通过对延安地区204例石蜡包埋的不同胃疾病黏膜组织进行PGC免疫组织化学染色, 结果表明PGC在胃癌及癌前病变中的阳性率依次下降(P<0.05): 单纯浅表(95.9%)、单纯萎缩组(77.1%)、伴肠化(55.0%)和伴异性增生(51.3%), 都低于单纯浅表组和单纯萎缩组, 而在胃癌组中表达率为7.3%, 仅有3例胃癌组织中发现阳性表达. PGC表达率在胃癌组与其余各组相比, 差异有统计学意义(P<0.05), 这与国内学者研究结果类似[4]. PGC作为胃分化成熟的一种功能蛋白酶, 在伴肠化和伴异型增生组中表达显著下降(P<0.05), 但二者间差异无统计学意义(P>0.05), 说明这二类胃疾病与胃良性疾病相比, 细胞分化障碍明显, 成熟程度低, 生物学特性更接近胃癌. 对于在胃癌中出现的阳性灶状, 我们复查了同一病例的HE染色发现, 皆为高分化癌(包括1例黏膜内癌), 由于PGC主要由成熟的腺细胞产生, 某些癌细胞表达PGC, 表明其个别细胞尚存在分泌正常蛋白产物的功能[5,6]. 从单纯浅表-单纯萎缩-伴肠化/异性增生-胃癌, PGC表达率显著下降(P<0.05), 而且在高分化胃癌中的表达率显著低于低分化胃癌, 亦表明PGC的表达具有组织学倾向性, PGC具有良好的鉴别胃良恶性疾病能力, 对于判定胃癌或胃疾病的发生发展有潜在的应用价值.
陕北地区是胃癌高发区, 高发人群又集中于延安地区. 我们对延安地区不同胃疾病患者进行血清学水平研究, 结果显示: sPGA水平在单纯萎缩组、伴肠化组、伴异性增生组和胃癌组明显低于单纯浅表组(均P<0.05), 伴肠化组和伴异性增生组间无显著性差异(P>0.05); sPGC水平在单纯浅表组、单纯萎缩组、伴肠化组、伴异性增生组明显低于胃癌组(P<0.05). 上述结果提示延安地区胃疾病患者血清PG水平与胃黏膜病变的程度密切相关, 随着胃黏膜病变的逐级加重, 血清sPGA水平降低, 本文结果与国内学者报道类似[7]. 主细胞大量破坏, 黏膜分泌功能受损, sPGA浓度下降; 另外可能由于致癌因子使胚细胞中PGC基因受损突变, 从而失去了分泌PGA的能力或者基因突变胚细胞又更新黏膜细胞, 使PGA分泌持续降低. 而分泌PGC的细胞分布较广, 且主要在成熟的腺细胞产生, 与癌细胞的分化关系不大, 故sPGC变化不明显, 各组间sPGC变化无统计学意义. 另外我们发现, 胃癌组在sPGA≥140 μg/L范围内也有较高的异常检出率, 可能是由于胃癌时伴有胃黏膜破损, 刺激主细胞分泌PG, 并使胃酸和胃泌素增加, 这2者又均可刺激PG的分泌, 而胃黏膜破损通透性增加又是可导致大量PG流入血液中的原因.
我们通过对不同胃黏膜PGC表达程度及血清PG水平变化的比较发现, 随着胃黏膜疾病组织学恶性程度的增加, 组织PGC表达率下降, 血清sPGA水平也有降低现象. 当细胞损伤时血清sPGC水平变化不明显, 表明单独应用血清sPGC诊断胃癌无显著意义, 这一点验证了PGC作为胃疾病发生发展判定指标在组织学上的意义更大; 而作为血清学的检查方法作用有限, 但如与血清sPGA值结合先进行大范围人群筛选, 然后再经胃镜确诊, 即可显著提高胃癌的检出率.
胃癌属于上皮源性恶性肿瘤, 检测各种上皮组织特异性标志物的表达, 是诊断早期胃癌的重要手段之一. 目前, 人们对肿瘤标志物胃蛋白酶原(PG)研究颇多, 认为其对胃癌的诊断价值较高.
陈国忠, 主任医师, 广西中医学院第一附属医院消化内科
目前国内外有学者进行了免疫组织化学染色检测, 也有学者进行血清学水平研究, 并通过基因多态性研究PG与胃癌的相关研究.
有研究表明PGC等位基因1型纯合型可能因为插入片段的缺失, 影响PGC的分泌或稳定性, 进而影响胃黏膜损伤的修复, 导致胃黏膜萎缩性病变的发病风险增加, 从而改变机体对胃癌的易感性.
本实验通过免疫组织化学与血清ELISA相结合方法对PGC进行研究, 目前此类报道不多.
同时进行血清PG值及PGC组织表达率检测, 二者有良好的相关性, 可作为临床筛查胃癌及癌前疾病的指标.
本文章有一定的创新性, 课题设计合理, 研究方法恰当, 有一定的科学意义.
编辑: 张姗姗 电编:闫晋利
| 1. | Kageyama T, Ichinose M, Tsukada-Kato S, Omata M, Narita Y, Moriyama A, Yonezawa S. Molecular cloning of neonate/infant-specific pepsinogens from rat stomach mucosa and their expressional change during development. Biochem Biophys Res Commun. 2000;267:806-812. [PubMed] [DOI] |
| 2. | 樊 代明, 张 学庸, 陈 希陶, 牟 震先, 胡 家露, 乔 太东, 陈 宝军, 王 俊义, 张 贞乾, 高 志清. 抗低分化胃癌细胞系MKN-46-9单克隆抗体的制备及免疫组化鉴定. 解放军医学杂志. 1988;13:12-15. |
| 3. | Korstanje A, den Hartog G, Biemond I, Lamers CB. The serological gastric biopsy: a non-endoscopical diagnostic approach in management of the dyspeptic patient: significance for primary care based on a survey of the literature. Scand J Gastroenterol Suppl. 2002;22-26. [PubMed] [DOI] |
| 5. | Fiocca R, Cornaggia M, Villani L, Capella C, Solcia E, Samloff IM. Expression of pepsinogen II in gastric cancer. Its relationship to local invasion and lymph node metastases. Cancer. 1988;61:956-962. [PubMed] [DOI] |
| 6. | Fernández R, Vizoso F, Rodríguez JC, Merino AM, González LO, Quintela I, Andicoechea A, Truan N, Díez MC. Expression and prognostic significance of pepsinogen C in gastric carcinoma. Ann Surg Oncol. 2000;7:508-514. [PubMed] [DOI] |
| 7. | 古 敬丽. 血清胃蛋白酶原、幽门螺旋杆菌与萎缩性胃炎相关性探讨. 河南科技大学学报(医学版). 2007;25:260-261. |