修回日期: 2012-03-18
接受日期: 2012-04-19
在线出版日期: 2012-05-18
目的: 探讨前入路绕肝提拉法右半肝切除对术中肿瘤细胞释放的影响.
方法: 选择2008-01/2011-06我院收治的拟行右半肝切除患者40例, 随机分为常规肝切除组和前入路绕肝提拉法肝切除组, 分别于手术开始前(切皮前)、术中离断肝实质之前(前入路绕肝提拉法组为分离肝后隧道、安置绕肝带、分离结扎右侧肝动脉和门静脉后; 常规肝切除组为游离肝周韧带, Pringle法阻断第一肝门后)、肝肿瘤切除后3个时间点, 自中心静脉置管处抽取血样, 行循环肝源性细胞检测. 比较两组患者中在各时间点检测结果阳性患者的比例.
结果: 前入路绕肝提拉法组和常规法组术前检测结果阳性患者比例无显著差异(2/18 vs 1/19, P>0.05). 术中肝切除前, 前入路绕肝提拉法组中心静脉血样肝源性细胞检测结果阳性患者显著少于常规法组(20% vs 55%, P = 0.022); 肝肿瘤切除后, 前入路绕肝提拉法组中心静脉血样肝源性细胞检测结果阳性患者亦显著少于常规法组(40% vs 80%; P = 0.010).
结论: 前入路绕肝提拉法较常规法肝切除可减少术中肿瘤细胞的血源性播散, 理论上减少了肝癌术中肿瘤细胞医源性播散, 降低了术后转移复发的风险.
引文著录: 余锋, 罗昆仑, 方征, 刘洪, 董志涛, 田志强, 陈磊, 殷正丰. 前入路绕肝提拉法对右半肝切除术中中心静脉循环肿瘤细胞的影响. 世界华人消化杂志 2012; 20(14): 1199-1203
Revised: March 18, 2012
Accepted: April 19, 2012
Published online: May 18, 2012
AIM: To monitor the generation of circulating tumor cells in central venous blood of patients undergoing right hepatectomy using anterior liver hanging (ALH) maneuver.
METHODS: From January 2008 to June 2011, 40 patients undergoing right hepatectomy were randomly allocated to ALH and conventional approach (CA) groups. Blood samples were collected from all patients through a central venous catheter, just before skin incision, just before parenchymal transection (after hilar dissection in the ALH group and after mobilization of the liver in the CA group), and after delivery of the tumor. All samples were detected for CTCs using an asialoglycoprotein receptor-based isolation strategy. The proportions of CTC-positive patients at various stages of surgery were compared between the two groups.
RESULTS: The proportion of CTC-positive patients showed no significant difference before surgery between the two groups (2/18 vs 1/19, P > 0.05) but was significantly lower in the ALH group than in the CA group before parenchymal transection and at the end of surgery after delivery of the tumor (20% vs 55%, 40% vs 80%, P = 0.022, 0.010).
CONCLUSION: Right hepatectomy using anterior liver hanging maneuver can reduce intraoperative blood-borne spread of tumor cells compared with the conventional method.
- Citation: Yu F, Luo KL, Fang Z, Liu H, Dong ZT, Tian ZQ, Chen L, Yin ZF. Monitoring of the generation of circulating tumor cells in central venous blood of patients undergoing right hepatectomy using anterior liver hanging maneuver. Shijie Huaren Xiaohua Zazhi 2012; 20(14): 1199-1203
- URL: https://www.wjgnet.com/1009-3079/full/v20/i14/1199.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i14.1199
肝切除手术中会造成肿瘤细胞播散, 这些播散至循环中的肿瘤细胞(circulating tumor cells, CTCs), 可能与肝癌术后肝内转移及远处转移密切相关[1]. 传统的右半肝切除术需在离断肝实质之前完全游离右半肝, 分离肝周韧带时压迫肝脏可能会加重肿瘤细胞播散进入循环系统或肝内门静脉系统. 2001年Belghiti等[2]采用绕肝提拉法完成肝切除术, 我中心对此技术进行了改进[3], 即改良式前入路绕肝提拉法(anterior liver hanging maneuver, ALH)肝切除术, 利用止血钳插入肝后下腔静脉前间隙, 建立肝后隧道并留置弹力带, 提拉肝脏达到局部肝血流控制, 在不游离肝脏的情况下完成肝切除术. 该方法不必提前游离肝脏和肿瘤, 直接断肝, 避免了对肝癌的强行分离, 从理论上减少了肿瘤细胞播散转移的机会. 本研究拟利用基于去唾液酸糖蛋白受体(asialoglycoprotein receptor, ASGPR)的循环肝癌细胞分离检测技术[4], 检测前入路绕肝提拉法和常规法(conventional approach, CA)右半肝切除术两种方法手术期间中心静脉循环肝癌细胞存在情况, 了解其术后复发转移的发生机制, 为防止肝癌术中的血行播散提供理论依据和方法.
40例患者中, 男31例, 女9例, 年龄37-70岁, 中位年龄56岁. 肝细胞癌30例, 肝海绵状血管瘤7例, 肝内胆管癌2例, Caroli病1例, 均行右半肝切除术. 随机分为常规法组和前入路绕肝提拉法组.
1.2.1 常规肝切除法(CA法): 游离肝周韧带, Pringle法阻断第一肝门. 肝硬化患者每次最长阻断时间为15 min, 间隔5 min后再次阻断; 无肝硬化患者每次最长阻断时间为20 min, 间隔5 min后再次阻断. 切断肝实质, 肝内离断出入肝的血管和胆道, 移除标本.
1.2.2 前入路绕肝提拉、半肝血流阻断法(简称ALH法): 按照罗昆仑等[3,5]介绍的方法进行, 即: (1)分离肝后下腔静脉前间隙, 建立肝后隧道, 置入绕肝提拉带; (2)解剖第一肝门, 结扎右侧肝动脉和门静脉, 阻断右半肝入肝血流; (3)前入路劈开肝实质, 直视下切除右半肝及肿瘤. 前入路绕肝提拉法组20例患者均成功建立肝后隧道并安置绕肝带. 切肝时无明显出血, 视野清晰, 断面管段系统显示清晰便于分别结扎. 绕肝带提拉肝脏后, 使肝后下腔静脉与肝脏之间产生接近1-2 cm的间隙, 切肝时无1例损伤肝后下腔静脉及肝静脉.
手术方式包括, ALH法组: 右半肝切除14例, 右半肝切除+右尾状叶切除2例, 右半肝切除+右门静脉癌栓取出3例, 右半肝切除+部分左内叶切除1例; CA法组: 右半肝切除17例, 右半肝切除+右尾状叶切除1例, 右半肝切除+右门静脉癌栓取出2例.
1.2.3 标本采集: 两组患者均于手术开始前(切皮前)、术中离断肝实质之前(ALH组为分离肝后隧道、安置绕肝带、分离结扎右侧肝动脉和门静脉后; CA组为游离肝周韧带, Pringle法阻断第一肝门后)与肝肿瘤切除后, 自中心静脉置管处各取血1次, 每次取血量为5 mL, 用含EDTA 5 mL抗凝管(Greiner bio-one, Germany)收集. 标本保存于4 ℃, 并且在采集后6 h内处理.
1.2.4 循环肝源性细胞检测: (1)采用Ficoll-Paque PLUS分离单个核细胞; (2)将细胞与生物素化去唾液酸胎球蛋白充分混合, 加入2 mmol/L的氯化钙溶液200 μL, 于37 ℃孵育45 min. 稀释缓冲液洗涤2次, 用20 μL抗生物素抗体磁珠4 ℃作用
15 min进行磁性标记, 然后将细胞用稀释缓冲液洗涤, 再用1 mL稀释缓冲液悬浮. 用稀释缓冲液平衡MS分离柱, 再使经磁性标记的细胞流经其中. 用稀释缓冲液(3×500 μL)将阴性细胞从分离柱中洗去. 然后将分离柱移开磁场, 用1 mL稀释缓冲液将残留在分离柱中的细胞快速冲出. 用离心涂片机将富集到的细胞组分在多聚赖氨酸玻片上制成细胞涂片, 37 ℃干燥15 min. 用4%甲醛固定15 min, 进行免疫荧光染色; (3)采用小鼠抗人肝细胞单克隆抗体(anti-human hepatocyte, Hep Par 1; Dako, Copenhagen, Denmark)鉴定肝癌细胞; (4)荧光显微镜下鉴定和计数. Hep Par 1阳性、DAPI阳性、CD45阴性, 并且符合形态学特征的细胞记为CTCs. 我们用中心静脉血样中的肝源性细胞作为术中肿瘤细胞播散的证据. ASGPR特异表达于肝实质细胞和肝癌细胞[6,7], 且Hep Par 1抗体能识别包括正常细胞和肝癌细胞在内的肝源性细胞[8,9]. 因此可认为用我们的系统检测到的细胞即为肝源性细胞.
统计学处理 计数资料采用χ2检验. 所有统计分析均采用SPSS18.0统计软件(SPSS/PC+, SPSS Inc., Chicago, IL)进行. P<0.05被认为有统计学意义.
2组病例在性别比例、年龄、肝硬化情况、肿瘤大小、HBV阳性率、良恶性比例及肝切除方式的差异无统计学意义(P>0.05), 具有可比性(表1).
| ALH法(n = 20) | CA法(n = 20) | |
| 性别(男:女) | 15:5 | 16:4 |
| 年龄(岁) | 54.6±9.4 | 55.9±8.1 |
| HBV阳性 | 10 | 11 |
| 伴肝硬化 | 8 | 10 |
| Child分期(A/B) | 19/1 | 17/3 |
| 肿瘤大小(cm) | 13.6±3.3 | 12.1±2.9 |
| 肝细胞癌 | 14 | 16 |
| 肝海绵状血管瘤 | 4 | 3 |
| 肝内胆管癌 | 1 | 1 |
| Caroli病 | 1 | 0 |
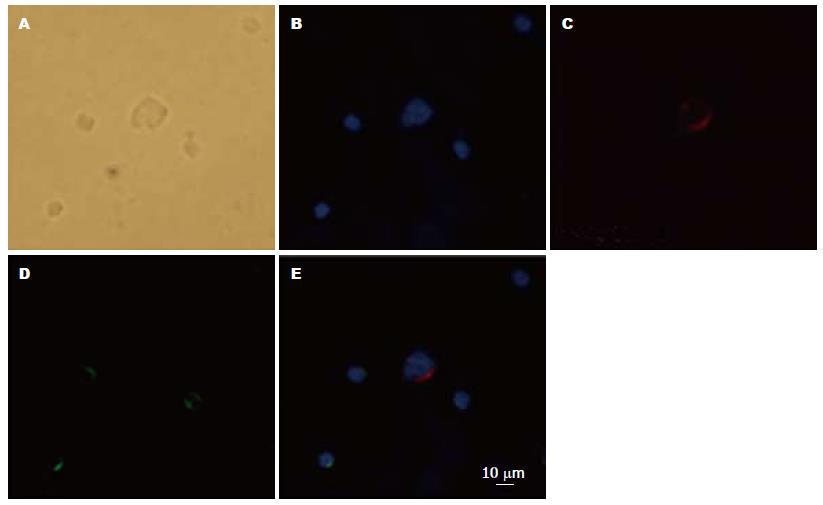
Hep Par 1阳性、DAPI阳性、CD45阴性, 细胞呈圆至椭圆形, 细胞核完整, 具有细胞体积大、核浆比高等恶性肿瘤细胞特征. 排除细胞碎片和非特异染色的细胞, 符合上述特征的细胞记为CTCs(图1).
手术开始前(切皮前)ALH法组2例中心静脉血样肝源性细胞检测阳性, 18例阴性; CA组1例检测结果阳性, 19例阴性, 两组阳性患者阳性率无显著差异(P>0.05). 肝实质离断之前ALH法组4例患者中心静脉血样肝源性细胞检测阳性, 16例检测结果为阴性; CA法组11例检测结果为阳性, 9例阴性. 肝肿瘤切除后, ALH法组8例检测结果阳性, 12例检测结果阴性; CA法组4例检测阴性, 16例检测结果阳性. 在肝切除前、肝肿瘤切除后两个时间点上, ALH法组患者中心静脉血样肝源性细胞检测结果阳性率均显著低于CA法组(20% vs 55%, 40% vs 80%; P值分别为0.022、0.010; 表2).
| 阴性(n) | 阳性(n) | P值 | |
| 肝切除前 | |||
| ALH法 | 16 | 4 | 0.022 |
| CA法 | 9 | 11 | |
| 肿瘤切除后 | |||
| ALH法 | 12 | 8 | 0.010 |
| CA法 | 4 | 16 |
目前认为, 肿瘤微转移灶起源于侵入循环中的肿瘤细胞. 因此, CTCs可能是肿瘤远处转移的一种标志[10]. 多数学者认为肝癌细胞的血源性播散是肝癌肝外转移的主要方式. 由于肝癌组织细胞间黏附作用较正常组织下降, 肿瘤细胞之间黏附因子缺乏, 手术过程肝癌组织和正常肝组织的挤压而造成的直接损伤, 导致肿瘤细胞入血; 手术外力亦可促进肿瘤细胞入血[11,12]. 外周血液或骨髓中存在的CTCs, 是导致肿瘤切除或肝移植术后复发转移的关键. 所以在手术前后前检测外周血中是否存在肝癌细胞, 可作为患者肿瘤复发、转移和预后的重要指标.
目前分离CTCs的标准方法是依赖于肿瘤细胞表面上皮性抗原的免疫磁珠富集技术[13]. 上皮细胞黏附分子(epithelial cell adhesion molecule, EpCAM)是一种上皮细胞特异性黏附分子, 广泛表达于上皮细胞和上皮来源的肿瘤细胞表面[14,15]. 基于EpCAM抗体磁珠的Cellsearch System已被FDA批准用于检测乳腺癌、结肠癌、前列腺癌CTCs[16]. 尽管肝癌细胞属于上皮性细胞, 但是肝癌细胞表面EpCAM表达率仅约35%左右[17-19]. 因此, Cellsearch System不适合用于富集、检测循环肝癌细胞, 并已被实验证实. ASGPR特异表达于肝实质细胞和肝癌细胞[20,21], 且Hep Par 1抗体能识别包括正常细胞和肝癌细胞在内的肝源性细胞[22,23]. 通常认为正常肝细胞一般不会进入血液循环, 除非演变成肿瘤细胞后才有这种可能, 因此可认为用我们的系统检测到的细胞即为肝癌细胞. 有报道显示感染了淋球菌的尿道上皮细胞和近端肾小管上皮细胞也表达ASGPR[24,25], 然而这些细胞一般不会出现在外周血中. 事实上, 即使有少量ASGPR阳性的非肝源性细胞存在于富集的细胞组分中, 也不会产生阳性结果, 因为我们采用肝细胞特异性抗体Hep Par 1检测肝癌细胞. 有30%左右HCC病例AFP阴性[26], 因此AFP抗体用于检测循环肝癌细胞可能会产生假阳性. 此外, 相比较于广谱角蛋白抗体CK3-6H5, 考虑到潜在的假阳性结果可能, 我们也更倾向于使用肝细胞特异性抗体Hep Par 1检测循环肝癌细胞.
右肝巨大肿瘤行常规右半肝切除手术时, 常需强行游离或搬动肝脏, 极易造成静脉撕裂出血、残肝血运障碍、术中肿瘤破裂和肿瘤细胞血源性播散等缺点[27,28]. Belghiti等对传统肝切除方法进行了技术改进, 利用止血钳插入肝后下腔静脉前间隙, 建立肝后隧道并留置弹力带, 提拉肝脏达到局部肝血流控制, 在不游离肝脏的情况下完成肝切除术, 即前入路绕肝提拉法. 该方法不必提前游离肝脏和肿瘤, 直接断肝, 这就避免了对肝癌的强行分离, 从而避免了肿瘤破裂或血管撕裂或游离面出血[29,30]. 阻断切除侧的全部肝静脉, 即使损伤肝静脉, 也可避免大出血及空气进入, 可以从容地进行分离及结扎、修补. 术中操作时肿瘤细胞也无法进入被切除肝段外的血管系统, 从理论上减少了肿瘤细胞播散转移的机会. 本研究结果显示, 在肝切除前、肝肿瘤切除后两个时间点上, ALH法组中中心静脉血样肝源性细胞检测结果阳性的患者均显著少于CA法组(20% vs 55%, 40% vs 80%; P值分别为0.022、0.010). 我们的研究通过中心静脉循环肝癌细胞的检测进一步证实: 前入路绕肝提拉法较常规肝切除法减少了术中肿瘤细胞的血源性播散. 这一结论为手术方式的改进对减少肝癌术中肿瘤细胞医源性播散和术后转移复发的风险提供了理论依据.
传统的右半肝切除术分离肝周韧带时压迫肝脏可能会加重肿瘤细胞播散进入循环系统或肝内门静脉系统. 改良式前入路绕肝提拉法肝切除术在不游离肝脏的情况下完成肝切除, 避免了对肝癌的强行分离, 从理论上减少了肿瘤细胞播散转移的机会.
金山, 主任医师, 内蒙古医学院附属医院普通外科
目前分离循环肿瘤细胞(CTCs)的标准方法是依赖于肿瘤细胞表面上皮性抗原的免疫磁珠富集技术. 上皮细胞黏附分子(EpCAM)是一种上皮细胞特异性黏附分子, 广泛表达于上皮细胞和上皮来源的肿瘤细胞表面. 基于EpCAM抗体磁珠的Cellsearch System已被FDA批准用于检测乳腺癌、结肠癌、前列腺癌CTCs.
本研究通过中心静脉循环肝癌细胞的检测证实: 前入路绕肝提拉法较常规肝切除法减少了术中肿瘤细胞的血源性播散. 这一结论为手术方式的改进, 对减少肝癌术中肿瘤细胞医源性播散和术后转移复发的风险提供了理论依据.
通过检测围手术期中心静脉中CTCs的存在情况, 了解不同手术方式对术中肿瘤细胞释放的影响, 为防止肝癌术中肿瘤细胞医源性播散提供了客观检测依据.
循环肿瘤细胞(CTCs): 存在于原发瘤和转移瘤之外的肿瘤细胞统称为游离肿瘤细胞, 其中进入血流的又称循环肿瘤细胞. 目前CTCs的临床意义在乳腺癌、结肠癌、前列腺癌等多种肿瘤中逐渐得到肯定, 乳腺癌CTCs的检测甚至已被引进最新的乳腺癌TNM分期标准.
本研究通过改良血流阻断方式减少了肿瘤细胞的播散, 有一定的临床意义.
编辑: 曹丽鸥 电编:鲁亚静
| 1. | Louha M, Nicolet J, Zylberberg H, Sabile A, Vons C, Vona G, Poussin K, Tournebize M, Capron F, Pol S. Liver resection and needle liver biopsy cause hematogenous dissemination of liver cells. Hepatology. 1999;29:879-882. [PubMed] [DOI] |
| 2. | Belghiti J, Guevara OA, Noun R, Saldinger PF, Kianmanesh R. Liver hanging maneuver: a safe approach to right hepatectomy without liver mobilization. J Am Coll Surg. 2001;193:109-111. [PubMed] [DOI] |
| 4. | Xu W, Cao L, Chen L, Li J, Zhang XF, Qian HH, Kang XY, Zhang Y, Liao J, Shi LH. Isolation of circulating tumor cells in patients with hepatocellular carcinoma using a novel cell separation strategy. Clin Cancer Res. 2011;17:3783-3793. [PubMed] [DOI] |
| 6. | Ashwell G, Harford J. Carbohydrate-specific receptors of the liver. Annu Rev Biochem. 1982;51:531-554. [PubMed] [DOI] |
| 7. | Trerè D, Fiume L, De Giorgi LB, Di Stefano G, Migaldi M, Derenzini M. The asialoglycoprotein receptor in human hepatocellular carcinomas: its expression on proliferating cells. Br J Cancer. 1999;81:404-408. [PubMed] [DOI] |
| 8. | Wennerberg AE, Nalesnik MA, Coleman WB. Hepatocyte paraffin 1: a monoclonal antibody that reacts with hepatocytes and can be used for differential diagnosis of hepatic tumors. Am J Pathol. 1993;143:1050-1054. [PubMed] |
| 9. | Minervini MI, Demetris AJ, Lee RG, Carr BI, Madariaga J, Nalesnik MA. Utilization of hepatocyte-specific antibody in the immunocytochemical evaluation of liver tumors. Mod Pathol. 1997;10:686-692. [PubMed] |
| 11. | Tacke J, Mahnken A, Roggan A, Günther RW. Multipolar radiofrequency ablation: first clinical results. Rofo. 2004;176:324-329. [PubMed] |
| 12. | Curley SA, Marra P, Beaty K, Ellis LM, Vauthey JN, Abdalla EK, Scaife C, Raut C, Wolff R, Choi H. Early and late complications after radiofrequency ablation of malignant liver tumors in 608 patients. Ann Surg. 2004;239:450-458. [PubMed] [DOI] |
| 13. | Paterlini-Brechot P, Benali NL. Circulating tumor cells (CTC) detection: clinical impact and future directions. Cancer Lett. 2007;253:180-204. [PubMed] [DOI] |
| 14. | Moldenhauer G, Momburg F, Möller P, Schwartz R, Hämmerling GJ. Epithelium-specific surface glycoprotein of Mr 34,000 is a widely distributed human carcinoma marker. Br J Cancer. 1987;56:714-721. [PubMed] [DOI] |
| 15. | Balzar M, Winter MJ, de Boer CJ, Litvinov SV. The biology of the 17-1A antigen (Ep-CAM). J Mol Med (Berl). 1999;77:699-712. [PubMed] [DOI] |
| 16. | Miller MC, Doyle GV, Terstappen LW. Significance of Circulating Tumor Cells Detected by the CellSearch System in Patients with Metastatic Breast Colorectal and Prostate Cancer. J Oncol. 2010;2010:617421. [PubMed] |
| 17. | de Boer CJ, van Krieken JH, Janssen-van Rhijn CM, Litvinov SV. Expression of Ep-CAM in normal, regenerating, metaplastic, and neoplastic liver. J Pathol. 1999;188:201-206. [PubMed] [DOI] |
| 18. | Ruck P, Wichert G, Handgretinger R, Kaiserling E. Ep-CAM in malignant liver tumours. J Pathol. 2000;191:102-103. [PubMed] [DOI] |
| 19. | Yamashita T, Forgues M, Wang W, Kim JW, Ye Q, Jia H, Budhu A, Zanetti KA, Chen Y, Qin LX. EpCAM and alpha-fetoprotein expression defines novel prognostic subtypes of hepatocellular carcinoma. Cancer Res. 2008;68:1451-1461. [PubMed] [DOI] |
| 20. | Díaz C, Vargas E, Gätjens-Boniche O. Cytotoxic effect induced by retinoic acid loaded into galactosyl-sphingosine containing liposomes on human hepatoma cell lines. Int J Pharm. 2006;325:108-115. [PubMed] [DOI] |
| 21. | Jain V, Nath B, Gupta GK, Shah PP, Siddiqui MA, Pant AB, Mishra PR. Galactose-grafted chylomicron-mimicking emulsion: evaluation of specificity against HepG-2 and MCF-7 cell lines. J Pharm Pharmacol. 2009;61:303-310. [PubMed] [DOI] |
| 22. | Butler SL, Dong H, Cardona D, Jia M, Zheng R, Zhu H, Crawford JM, Liu C. The antigen for Hep Par 1 antibody is the urea cycle enzyme carbamoyl phosphate synthetase 1. Lab Invest. 2008;88:78-88. [PubMed] [DOI] |
| 23. | Lugli A, Tornillo L, Mirlacher M, Bundi M, Sauter G, Terracciano LM. Hepatocyte paraffin 1 expression in human normal and neoplastic tissues: tissue microarray analysis on 3,940 tissue samples. Am J Clin Pathol. 2004;122:721-727. [PubMed] [DOI] |
| 24. | Seow YY, Tan MG, Woo KT. Expression of a functional asialoglycoprotein receptor in human renal proximal tubular epithelial cells. Nephron. 2002;91:431-438. [PubMed] [DOI] |
| 25. | Harvey HA, Ketterer MR, Preston A, Lubaroff D, Williams R, Apicella MA. Ultrastructural analysis of primary human urethral epithelial cell cultures infected with Neisseria gonorrhoeae. Infect Immun. 1997;65:2420-2427. [PubMed] |
| 26. | Murugavel KG, Mathews S, Jayanthi V, Shankar EM, Hari R, Surendran R, Vengatesan A, Raghuram K, Rajasambandam P, Murali A. Alpha-fetoprotein as a tumor marker in hepatocellular carcinoma: investigations in south Indian subjects with hepatotropic virus and aflatoxin etiologies. Int J Infect Dis. 2008;12:e71-e76. [PubMed] [DOI] |
| 27. | Makuuchi M, Mori T, Gunvén P, Yamazaki S, Hasegawa H. Safety of hemihepatic vascuiar occlusion during resection of the liver. Surg Gynecol Obstet. 1987;164:155-158. |
| 29. | Hirai I, Murakami G, Kimura W, Kanamura T, Sato I. How should we treat short hepatic veins and paracaval branches in anterior hepatectomy using the hanging maneuver without mobilization of the liver? An anatomical and experimental study. Clin Anat. 2003;16:224-232. [PubMed] [DOI] |
| 30. | Sato TJ, Hirai I, Murakami G, Kanamura T, Hata F, Hirata K. An anatomical study of short hepatic veins, with special reference to delineation of the caudate lobe for hanging maneuver of the liver without the usual mobilization. J Hepatobiliary Pancreat Surg. 2002;9:55-60. [PubMed] [DOI] |