修回日期: 2012-03-30
接受日期: 2012-04-19
在线出版日期: 2012-05-18
目的: 观察1,2-二甲基肼(1,2-dimethylhydrazine, DMH)是否可以诱导出小肠肿瘤, 并与大肠进行比较. 并探讨丁酸钠(sodium butyrate, NaBt)对DMH诱导肠道肿瘤的作用.
方法: 实验动物用SPF级♂Wistar大鼠, 大小为8-9周龄, 共分4组: DMH组、DMH+NaBt组、NaBt组、对照组. 实验30-32 wk之后过量麻醉使大鼠安乐死, 取出小肠和大肠, 观察肿瘤部位、数量、大小等; 然后用10%甲醛固定, 制作病理切片, 观察各部位组织学改变.
结果: 实验结束时DMH组大鼠死亡率60.00%(18/30), DMH+NaBt组死亡率48.00%(12/25). DMH组肠道肿瘤发生率66.67%(8/12), 4只肿瘤单发, 4只多发, 荷瘤率1.33(16/12), 小肠肿瘤4个, 大肠肿瘤12个; DMH+NaBt组肠道肿瘤发生率84.62%(11/13), 6只为单发肿瘤, 5只多发, 荷瘤率1.46(19/13), 小肠肿瘤3个, 大肠肿瘤16个. 两组之间肿瘤发生率及荷瘤率均无统计学差异. 无论是DMH组还是DMH+NaBt组, 结肠肿瘤发生率都高于小肠肿瘤, 统计学有显著性差异(75.00% vs 25.00%, P<0.05; 84.21% vs 15.79%, P<0.01). DMH组中肿瘤平均体积>0.05 cm3个数占37.5%; DMH+NaBt组中肿瘤平均体积>0.05 cm3个数占73.68%, 两组肿瘤大小有统计学差异(37.50% vs 73.68%, P<0.05). 与DMH+NaBt组相比, DMH组浸润深度多局限于黏膜层内, 有统计学差异(43.75% vs 10.53%, P<0.05).
结论: DMH也可诱导大鼠小肠肿瘤的发生, 但发生率明显低于大肠肿瘤; NaBt可能促进肿瘤生长, 关于NaBt对DMH诱导的肠道肿瘤作用仍需做进一步的深入研究.
引文著录: 朱丹, 王爱英, 金珠. 丁酸钠对DMH诱导大鼠肠道肿瘤的作用. 世界华人消化杂志 2012; 20(14): 1184-1190
Revised: March 30, 2012
Accepted: April 19, 2012
Published online: May 18, 2012
AIM: To investigate whether 1,2-dimethylhydrazine (DMH) can induce small intestinal tumors in rats and to examine the effect of sodium butyrate on DMH-induced small intestinal and large intestinal tumors.
METHODS: Eighty male Wistar rats were randomly divided into four groups: DMH group, DMH + NaBt group, NaBt group, and control group. After 30-32 weeks, rats were euthanized with an overdose of intravenous pentobarbital (200 mg/kg). After laparotomy, the small intestine and large intestine were dissected. The location, number, shape and size of intestinal tumors were examined and recorded. All tissues were subjected to hematoxylin and eosin (H&E) staining to observe histological changes.
RESULTS: The mortality rate of rats was 60.00% (18/30) in the DMH group and 48.00% (12/25) in the DMH + NaBt group. The intestinal tumor incidence was 66. 67% (8/12) in the DMH group with four small intestinal tumors and twelve large intestinal tumors observed. Four rats beared a single tumor while other four rats had multiple tumors. The mean number of beared tumors was 1.33. The intestinal tumor incidence was 84.62% (11/13) in the DMH + NaBt group with three small intestinal tumors and sixty large intestinal tumors observed. Six rats beared a single tumor while other five rats had multiple tumors. The mean number of beared tumors was 1.46. There were no significant differences in tumor incidence and mean tumor number between te DMH + NaBt group and DMH group. The large intestinal tumor incidence was significantly higher than the small intestinal tumor incidence in both the DMH group and DMH + NaBt group (75.00% vs 25.00%, P < 0.05; 84.21% vs 15.79%, P < 0.01). There were significant differences in average tumor volume (37.50% vs 73.68%, P < 0.05) and tumor infiltration depth (43.75% vs 10.53%, P < 0.05) between the DMH group and DMH + NaBt group.
CONCLUSION: These results suggest that small intestinal tumors can also be induced by DMH. Sodium butyrate can increase tumor malignancy by increasing tumor volume and infiltration depth.
- Citation: Zhu D, Wang AY, Jin Z. Effect of sodium butyrate on DMH-induced small intestinal and large intestinal tumors in rats. Shijie Huaren Xiaohua Zazhi 2012; 20(14): 1184-1190
- URL: https://www.wjgnet.com/1009-3079/full/v20/i14/1184.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i14.1184
有关大肠肿瘤的研究已有许多文献报道, 用1,2-二甲基肼(1,2-dimethylhydrazine, DMH)诱导大肠肿瘤的动物模型也已经成熟, 但是药物诱导小肠肿瘤动物模型报道很少, DMH对小肠肿瘤的诱导作用更是甚少报道. 丁酸钠(sodium butyrate, NaBt)作为一种去乙酰化酶抑制剂, 对DMH诱导动物大肠肿瘤的作用是近年研究的热点, 观点也不统一. 本研究用DMH诱导大鼠肠道肿瘤, 在观察大肠肿瘤形成的同时, 重点观察DMH是否可以诱导出小肠肿瘤, 并与大肠进行比较. 同时研究NaBt对DMH诱导的肠道肿瘤的作用, 为NaBt是否具有抗肿瘤特性提供实验依据.
实验动物采用SPF级♂Wistar大鼠, 大小为8-9周龄, 体质量约260 g. 饲养环境为北京大学医学部动物中心SPF实验室, 恒温、恒湿条件下喂养, 控制每日光照使昼夜时间各12 h, 饲料、水均不受限制. 动物购自北京维通利华实验动物技术有限公司, SPF级饲料由北京科澳协力饲料有限公司提供. 实验药物DMH和NaBt均购自Sigma公司.
1.2.1 肠道肿瘤模型的构建: 实验大鼠共分4组: (1)DMH组(30只), 实验第1天单次腹腔注射DMH(120 mg/kg, ip), 分别于第5周和第7周再次腹腔注射(20 mg/kg, ip); (2)DMH+NaBt组(25只), DMH给药方式同上, NaBt给药方法为实验开始第1天用动物饮用水配制为1.5%浓度供大鼠日常饮用, 每日1次, 现用现配; (3)NaBt组(15只), NaBt给药方法同上; (4)Control组(10只), 生理盐水注射, 给药方式同DMH. 动物实验经北京大学生物医学伦理委员会批准.
1.2.2 观察项目和取材: 实验过程中观察大鼠一般情况: 毛发色泽、腹部膨隆程度, 饮食、排便、营养状况、活跃状态、对刺激反应, 肛门有无红肿、糜烂, 每周观察体质量变化情况. 实验30-32 wk过量麻醉使大鼠安乐死, 充分暴露腹腔, 取出小肠和大肠, 将肠道沿纵轴剪开, 照相并记录肿瘤数量、部位、大小、肿瘤平均体积 = 长×(宽2/2)[1], 转移等. 取肿瘤和瘤旁约2-3 cm的组织, 全层充分展开固定于10%甲醛溶液中, 经过脱水、透明、石蜡包埋、5 μm厚连续切片, HE染色, 观察各部位组织学改变. 正常取材部位包括空肠、回肠和结肠.
统计学处理 用SPSS18.0统计软件包对数据进行χ2检验, t检验, 以P<0.05判定为有统计学意义.
实验结束时, DMH组大鼠死亡率60.00%(18/30), DMH+NaBt组死亡率48.00%(12/25), 两组比较无统计学差异; NaBt组和Control组各死亡1只. 解剖后多发现大鼠肠管胀气, 未发现肠道肿物和结节形成, 死亡原因可能为肠梗阻或自然死亡. 实验最初6 wk, 各组大鼠毛发光泽, 毛白顺滑, 饮食排便正常, 对刺激反应活跃. 实验6 wk后, 与Control组比较, DMH组和DMH+NaBt组大鼠毛发枯黄粗糙, 饮水、进食、排便明显减少, 经常表现为困倦呆滞状, 蜷缩少动, 对刺激反应缓慢. NaBt组饮水、进食、精神等正常, 排稀便且量增多, 体质量增长比其他组缓慢.
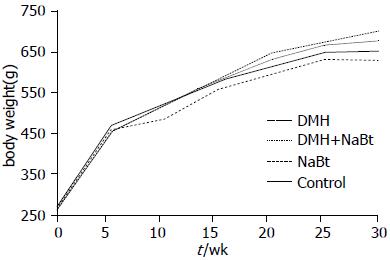
前6 wk大鼠体质量增长较快, 6 wk以后体质量增长减缓, 26 wk后各组体质量增长进入平台期(图1). 前6 wk各组大鼠之间的体质量无显著性差异, 实验6-16 wk, DMH组、DMH+NaBt组、Control组体质量变化与NaBt组体质量变化比较有显著性差异(P<0.05), 后者体质量增加缓慢, DMH组、DMH+NaBt组和Control组之间大鼠体质量无显著性差异; 16 wk以后各组之间体质量比较无显著性差异, 实验结束时各组大鼠平均体质量分别为: DMH组699.33 g±86.82 g, DMH+NaBt组676.15 g±93.79 g, NaBt组631.73 g±62.06 g, Control组653.70 g±74.15 g, 各组间比较均无显著性差异.
2.3.1 肿瘤数目: DMH组肠道肿瘤发生率66. 67%(8/12), 4只大鼠单发, 4只多发, 其中1只大鼠小肠和大肠共有肿瘤4个; DMH+NaBt组肠道肿瘤发生率84.62%(11/13), 6只单发, 5只多发, 其中2只大鼠小肠和大肠共有肿瘤6个. DMH组1只大鼠出现大肠多发肿瘤并周围淋巴结转移; DMH+NaBt组1只出现小肠、大肠多发肿瘤及腹腔广泛转移. DMH组共发现肿瘤16个, 荷瘤率1.33(16/12), 其中小肠肿瘤4个, 大肠肿瘤12个; DMH+NaBt组共发现肿瘤19个, 荷瘤率1.46(19/13), 其中小肠肿瘤3个, 大肠肿瘤16个, 两组比较无统计学差异. 无论是DMH组还是DMH+NaBt组, 结肠肿瘤发生率都明显高于小肠肿瘤, 有统计学差异(DMH组75.00% vs 25.00%, P<0.05; DMH+NaBt组84.21% vs 15.79%, P<0.01). 两组之间大肠肿瘤发生率无显著性差异, 荷瘤率无显著性差异. NaBt组和Control组未见肿瘤(表1).
| DMH组(n = 12) | DMH+NaBt组(n = 13) | NaBt组(n = 14) | Control组(n = 9) | |
| 小肠肿瘤(个/只) | 4/2 | 3/2 | 0/0 | 0/0 |
| 小肠肿瘤发生率(%) | 16.67 | 15.38 | 0 | 0 |
| 小肠荷瘤率(%) | 0.33 | 0.23 | 0 | 0 |
| 结肠肿瘤(个/只) | 12/7 | 16/11 | 0/0 | 0/0 |
| 大肠肿瘤发生率(%) | 58.33 | 84.62 | 0 | 0 |
| 大肠荷瘤率(%) | 1.00 | 1.23 | 0 | 0 |
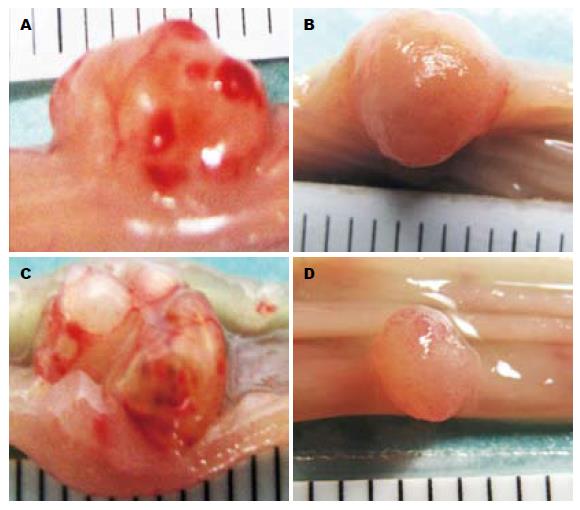
2.3.2 肿瘤的部位和大小: DMH组小肠肿瘤1个位于十二指肠, 3个位于空肠, 最大径0.2-0.8 cm; DMH+NaBt组小肠肿瘤3个均位于空肠, 最大径0.4-3.2 cm, 小肠肿瘤体积略大于DMH组. DMH组位于大肠近、中、远端1/3处的肿瘤个数分别为4、1、7(其中2个在直肠); DMH+NaBt组位于大肠近、中、远端1/3处的肿瘤个数分别为7、2、7(其中2个在直肠). DMH组结肠肿瘤最大径<0.5 cm, 0.5 cm<最大径<1 cm以及>1 cm的肿瘤个数分别为6、4、2; DMH+NaBt组对应依次为4、9、2个. DMH组肿瘤平均体积<0.05 cm3有10个, >0.05 cm3有6个; DMH+NaBt组肿瘤平均体积<0.05 cm3有5个, >0.05 cm3有14个, DMH组和DMH+NaBt组肠道肿瘤平均体积有统计学差异(P<0.05).
2.3.3 肿瘤生长方式: DMH组小肠肿瘤2个向腔外生长, 2个向腔内生长, 大肠肿瘤1个向腔外生长, 11个向腔内生长; DMH+NaBt组小肠肿瘤2个向腔外生长, 1个向腔内生长, 大肠肿瘤2个向腔外生长, 14个向腔内生长. 向腔外生长的肿瘤最大径均>0.5 cm. 两组大鼠小肠肿瘤均以腔外生长方式为主, 大肠肿瘤均以腔内生长方式为主(图2).
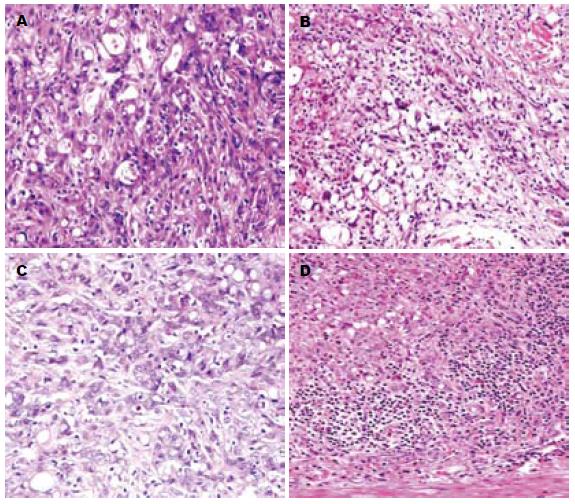
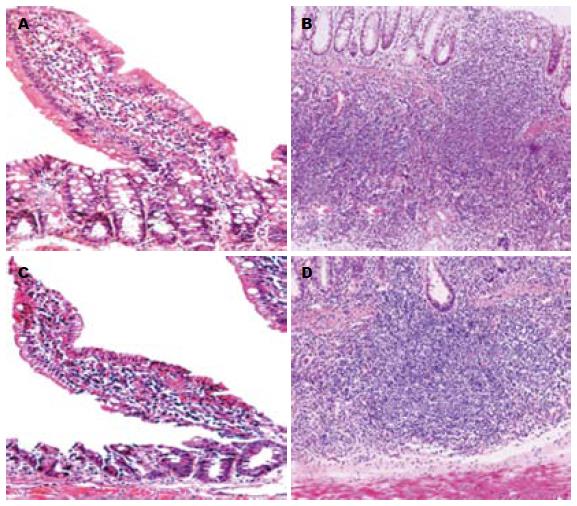
2.3.4 肿瘤及瘤旁组织学改变和浸润深度: DMH组和DMH+NaBt组小肠肿瘤分化均较差, 病理类型为低分化管状腺癌(图3A, C)、印戒细胞癌和黏液腺癌. DMH组和DMH+NaBt组大肠肿瘤均以管状腺癌为主, 前者管状腺瘤1个, 高中分化管状腺癌5个, 中低分化管状腺癌5个, 印戒细胞癌1个(图3B); 后者高中分化管状腺癌6个, 中低分化管状腺癌7个, 低分化腺癌2个(图3D), 印戒细胞癌1个. 两组小肠肿瘤瘤旁组织学改变为黏膜层有少量淋巴细胞浸润; 大肠肿瘤瘤旁组织学改变除了黏膜层大量淋巴细胞浸润外, 11个瘤旁有淋巴滤泡形成, 并可见增生的淋巴滤泡浸润黏膜层和黏膜下层(图4). DMH组肿瘤浸润深度以黏膜层为主, 7个在黏膜内生长, 2个浸润至黏膜下层, 7个侵犯固有肌层或浆膜层; DMH+NaBt组2个在黏膜内生长, 9个浸润至黏膜下层, 8个侵犯至肌层或浆膜层. 与DMH+NaBt组相比, DMH组浸润深度多局限于黏膜层内, 有统计学差异(P<0.05). NaBt组3只大鼠组织学改变有大肠黏膜腺体萎缩, 其余和Control组一样, 肠壁组织无明显炎性细胞浸润.
有关肠道肿瘤的研究主要集中于结直肠部位, 自1970年Druckrey首次报道用DMH成功诱导出大鼠结肠肿瘤模型以来, 该模型已经广泛应用于结直肠肿瘤的研究. 但是DMH诱导大鼠小肠肿瘤的研究罕有报道. Thurnherr等[2]用DMH诱导大鼠结直肠肿瘤约35 wk后, 从直肠到升结肠均见肿瘤生长, 尤其集中在距肛门2-4 cm处, 但小肠并未见肿瘤形成, 小肠黏膜炎性反应与对照组相比也没有明显差异. Rogers等[3]用DMH诱导大鼠38 wk后, 发现除了结直肠有肿瘤形成外, 十二指肠和空肠也有肿瘤生成, 但并没有对小肠肿瘤进行详细描述, 也没有和大肠进行对比. 本研究以DMH诱导Wistar大鼠肠道肿瘤为实验模型, 观察DMH诱发小肠和大肠肿瘤的情况. 实验结果显示DMH不仅可诱导出大鼠大肠肿瘤, 也可成功诱导出小肠肿瘤, 但小肠肿瘤发生率明显低于大肠肿瘤(P<0.05), 与临床发病非常类似.
DMH组和DMH+NaBt组中有4只大鼠形成7个小肠肿瘤, 其中3只同时伴有大肠肿瘤形成, 这可能与大鼠个体差异、药物敏感性以及肿瘤易感性有关. 与大肠肿瘤相比, 两组小肠肿瘤体积均较大, 以腔外生长方式为主, 组织学恶性度较高, 病理类型以低分化管状腺癌, 印戒细胞癌和黏液腺癌为主, 除1个为黏膜内癌, 其他均浸润到肌层和浆膜层. 两组大鼠中有18只共有28个大肠肿瘤, 肿瘤大小不一, 以腔内生长方式为主, 仅DMH组大肠有1个管状腺瘤, 半数以上病理类型为中低分化管状腺癌, 部分伴印戒细胞癌和黏液腺癌. DMH组和DMH+NaBt组大肠肿瘤以黏膜层和黏膜下层浸润为主(15/28). 小肠和大肠瘤旁的组织学改变也有不同, 小肠瘤旁组织黏膜内仅可见少量淋巴细胞浸润, 而在大肠瘤旁黏膜和黏膜下层却可见大量淋巴细胞浸润及淋巴滤泡形成. 这可能是大肠黏膜在DMH刺激下, 使反应性淋巴细胞增生更明显. 无论是DMH组还是DMH+NaBt组, 小肠肿瘤发生率明显低于大肠肿瘤, 差异有显著性(P<0.05, P<0.01).
肿瘤的形成和细胞的增殖、凋亡失衡有关, 小肠自身的凋亡保护机制可能是小肠肿瘤低发的原因之一. Potten等[4]通过对人类肠道细胞的研究发现, DMH引起肠道细胞凋亡的主要部位并不相同, 小肠细胞凋亡更多出现在小肠隐窝干细胞处, 大肠细胞凋亡主要在隐窝顶部上皮. 说明在致癌因素作用下, 小肠出现异常的干细胞自动凋亡, 防止突变的干细胞进展成为肿瘤细胞, 而结肠干细胞凋亡能力远不如前者, 突变在干细胞分化和生长过程中逐渐累积, 最终可能导致肿瘤的发生. 近年, 研究结果显示正常人类小肠组织细胞凋亡水平远高于结肠组织, 机制可能与Bax、Bid蛋白的高表达和Bcl-xl低表达有关[5,6]. 也有研究表明DMH诱导大肠肿瘤可能与Wnt/β-catenin、PI3K/PTEN/Akt信号转导通路有关[7,8], 并与线粒体改变有关[9]. 本研究结果中小肠肿瘤的发生率低于大肠肿瘤可能与小肠和大肠的凋亡部位、凋亡水平、凋亡途径及凋亡相关蛋白表达水平不同有关.
NaBt是一种纤维膳食类四碳短链脂肪酸, 促进肠道蠕动, 这可能与本实验NaBt组大鼠排便增多, 6-16 wk体质量增长缓慢的现象有关(P<0.05). NaBt可以促进肠道营养, 改善肠黏膜损害和减少炎性浸润, 口服NaBt可以治疗溃疡性结肠炎并且降低患结肠癌的风险[10,11]. NaBt的肠道营养作用可能解释本实验16 wk后NaBt组体质量与其他组无差异的原因. NaBt作为一种重要的组蛋白去乙酰化酶抑制剂, 通过抑制核小体组蛋白去乙酰化, 减少组蛋白去乙酰化酶对转录的抑制, 使转录因子激活特异性调控基因, 使细胞周期受到阻滞从而抑制肿瘤生长. 文献报道, NaBt可以诱导结直肠癌[12]、胰腺癌[13]、前列腺癌[14]、膀胱癌[15]、子宫内膜癌[16]、白血病[17]、 嗜铬细胞瘤[18]等肿瘤细胞凋亡, 抑制肿瘤的生长. 但对NaBt用于消化系统肿瘤的治疗研究出现2种不同观点.
一方面, 很多研究者认为NaBt可以减少由DMH诱发的大鼠结直肠肿瘤数目和降低肿瘤恶性程度[19], 并且可以显著减少DMH诱发的Wistar大鼠结直肠异型隐窝灶(ACF)的发生[20]. 有研究表明NaBt抑制肿瘤生长除了与抑制组蛋白去乙酰化酶活性有关外, 还可能参与其促进肿瘤细胞凋亡的机制: (1)NaBt以一种SOCE依赖方式引起结肠肿瘤细胞凋亡, 即NaBt可促进内质网Ca2+释放入胞浆中, 引起细胞外Ca2+大量内流进而引发细胞凋亡[21]; (2)NaBt使人结肠腺瘤COLO205细胞系对内源性线粒体凋亡途径和TNF-α依赖的外源性细胞凋亡途径更敏感[12,22]; (3)也有报道NaBt促进肿瘤细胞凋亡是通过线粒体途径而并非TNF-α途径[23], NaBt通过促使caspase-10的表达引起细胞凋亡[24]; (4)NaBt促凋亡与细胞膜上死亡受体(DR4/5)的高表达有关, 后者可激活TGF-β依赖的凋亡通路上Smad3蛋白; NaBt促使细胞凋亡也与下调抗凋亡蛋白(cFLIP, XIAP)和活化促凋亡蛋白tBid的表达密切相关[25]. 有研究显示在大鼠肠道形成肿瘤过程中, NaBt使黏膜上皮凋亡指数上调, 但是对肿瘤增殖及ACF的形成并无作用[26].
但是另一方面, Silva等[27]报道NaBt并不能有效预防结直肠肿瘤的进展, Caderni等[28]也发现NaBt不能有效减少大鼠患肠道肿瘤的概率. 本研究以DMH诱导Wistar大鼠肠道肿瘤为研究模型, 观察NaBt对肠道肿瘤的作用. 结果显示用NaBt后, 虽然DMH+NaBt组死亡率低于DMH组, DMH组大肠肿瘤发生率(58.33%)低于DMH+NaBt组(84.62%), 但两组之间肠道肿瘤发生率、荷瘤率、肿瘤生长方式和组织学类型均无统计学差异. 但是NaBt对肠道肿瘤大小和浸润深度有统计学差异(P<0.05, P<0.05), 表现为DMH+NaBt组肿瘤平均体积≥0.5 cm3的个数多于DMH组, 且肿瘤浸润较DMH组深, 仅2个为黏膜内浸润. 提示NaBt可能促进肠道肿瘤的生长和浸润. 在肿瘤早期, NaBt可以抑制肿瘤的发生[29], 这可能与NaBt的免疫调节作用[30-32]有关, 但在肿瘤生长晚期, 由于NaBt的肠道营养作用, 在长期营养肠道细胞的同时可能也促使了肿瘤细胞的生长. 因此关于NaBt可否用于肠道肿瘤的预防及治疗仍需做进一步的深入研究.
感谢北京大学第三医院消化科病理室及中心实验室为本论文工作提供的帮助和指导.
关于DMH诱导大鼠大肠肿瘤模型已经成熟, 但对于DMH诱导小肠肿瘤的研究甚少.丁酸钠(NaBt)作为一种组蛋白去乙酰化酶抑制剂, 对肿瘤的抑制作用成为众多学者研究的热点, 观点也不统一.
黄培林, 教授, 东南大学肿瘤学
目前DMH诱导大鼠大肠肿瘤的模型, 主要用于一些肿瘤抑制剂的观察和研究. NaBt对肿瘤的抑制作用也是近年来研究的热点和重点, 其对肿瘤作用的机制仍需进一步深入研究.
在NaBt对肿瘤生长的研究中发现, NaBt可以诱导前列腺癌、膀胱癌、子宫内膜癌等肿瘤细胞凋亡, 抑制肿瘤的生长. 对大肠癌的作用观点不一, 对小肠癌的作用罕见文献报道.
由于DMH不仅可成功诱导出大鼠大肠肿瘤, 也可诱导出小肠肿瘤, 可作为小肠肿瘤发生、发展及肿瘤抑制剂进一步研究的实验基础; 并与大肠进行对照, 找出两者肿瘤发生的异同点.
本研究重点观察和比较DMH诱导大鼠小肠肿瘤和/或大肠肿瘤的作用, 同时观察NaBt对DMH诱导肠道肿瘤的作用. 文稿具有一定的科学性、实用性和可读性.
编辑: 张姗姗 电编:闫晋利
| 1. | Naito S, von Eschenbach AC, Giavazzi R, Fidler IJ. Growth and metastasis of tumor cells isolated from a human renal cell carcinoma implanted into different organs of nude mice. Cancer Research. 1986;46:4109-4115. [PubMed] |
| 2. | Thurnherr N, Deschner EE, Stonehill EH, Lipkin M. Induction of adenocarcinomas of the colon in mice by weekly injections of 1,2-dimethylhydrazine. Cancer Res. 1973;33:940-945. [PubMed] |
| 3. | Rogers AE, Herndon BJ, Newberne PM. Induction by dimethylhydrazine of intestinal carcinoma in normal rats and rats fed high or low levels of vitamin A. Cancer Res. 1973;33:1003-1009. [PubMed] |
| 4. | Potten CS, Li YQ, O'Connor PJ, Winton DJ. A possible explanation for the differential cancer incidence in the intestine, based on distribution of the cytotoxic effects of carcinogens in the murine large bowel. Carcinogenesis. 1992;13:2305-2312. [PubMed] [DOI] |
| 5. | Gao C, Wang AY. Significance of increased apoptosis and Bax expression in human small intestinal adenocarcinoma. J Histochem Cytochem. 2009;57:1139-1148. [PubMed] [DOI] |
| 7. | Allameh A, Dadkhah A, Rahbarizadeh F, Ashrafi-Helan J, Fatemi F. Effect of dietary caraway essential oils on expression of β-catenin during 1,2-dimethylhydrazine-induced colonic carcinogenesis. J Nat Med. 2012; Mar 15. [Epub ahead of print]. [PubMed] [DOI] |
| 8. | Vaish V, Sanyal SN. Role of Sulindac and Celecoxib in the regulation of angiogenesis during the early neoplasm of colon: Exploring PI3-K/PTEN/Akt pathway to the canonical Wnt/β-catenin signaling. Biomed Pharmacother. 2012; Feb 17. [Epub ahead of print]. [PubMed] |
| 9. | Saini MK, Sanyal SN, Vaiphei K. Piroxicam and C-phycocyanin mediated apoptosis in 1,2-dimethylhydrazine dihydrochloride induced colon carcinogenesis: exploring the mitochondrial pathway. Nutr Cancer. 2012;64:409-418. [PubMed] [DOI] |
| 10. | Vieira EL, Leonel AJ, Sad AP, Beltrão NR, Costa TF, Ferreira TM, Gomes-Santos AC, Faria AM, Peluzio MC, Cara DC. Oral administration of sodium butyrate attenuates inflammation and mucosal lesion in experimental acute ulcerative colitis. J Nutr Biochem. 2012;23:430-436. [PubMed] [DOI] |
| 11. | D'Argenio G, Cosenza V, Delle Cave M, Iovino P, Delle Valle N, Lombardi G, Mazzacca G. Butyrate enemas in experimental colitis and protection against large bowel cancer in a rat model. Gastroenterology. 1996;110:1727-1734. [PubMed] [DOI] |
| 12. | Pajak B, Gajkowska B, Orzechowski A. Sodium butyrate sensitizes human colon adenocarcinoma COLO 205 cells to both intrinsic and TNF-alpha-dependent extrinsic apoptosis. Apoptosis. 2009;14:203-217. [PubMed] [DOI] |
| 13. | Masaki K, Hiroyuki S, Sumiya I, Shinichi U, Shoji N. Effects of a histone deacetylase inhibitor, sodium butyrate, on 53-kDa protein expression and sensitivity to anticancer drugs of pancreatic cancer cells. Curr Ther Res. 2010;71:162-172. [DOI] |
| 14. | Kim J, Park H, Im JY, Choi WS, Kim HS. Sodium butyrate regulates androgen receptor expression and cell cycle arrest in human prostate cancer cells. Anticancer Res. 2007;27:3285-3292. [PubMed] |
| 15. | Wang D, Wang Z, Tian B, Li X, Li S, Tian Y. Two hour exposure to sodium butyrate sensitizes bladder cancer to anticancer drugs. Int J Urol. 2008;15:435-441. [PubMed] [DOI] |
| 16. | Kato K, Kuhara A, Yoneda T, Inoue T, Takao T, Ohgami T, Dan L, Kuboyama A, Kusunoki S, Takeda S. Sodium butyrate inhibits the self-renewal capacity of endometrial tumor side-population cells by inducing a DNA damage response. Mol Cancer Ther. 2011;10:1430-1439. [PubMed] [DOI] |
| 17. | dos Santos MP, Schwartsmann G, Roesler R, Brunetto AL, Abujamra AL. Sodium butyrate enhances the cytotoxic effect of antineoplastic drugs in human lymphoblastic T-cells. Leuk Res. 2009;33:218-221. [PubMed] [DOI] |
| 18. | Cayo MA, Cayo AK, Jarjour SM, Chen H. Sodium butyrate activates Notch1 signaling, reduces tumor markers, and induces cell cycle arrest and apoptosis in pheochromocytoma. Am J Transl Res. 2009;1:178-183. [PubMed] |
| 19. | Medina V, Afonso JJ, Alvarez-Arguelles H, Hernández C, González F. Sodium butyrate inhibits carcinoma development in a 1,2-dimethylhydrazine-induced rat colon cancer. JPEN J Parenter Enteral Nutr. 1998;22:14-17. [PubMed] [DOI] |
| 20. | Peluzio M, Moreira A, Queiroz I, Dias C, Franceschini S, Alvarez-leite J, Natali A, Sabarense C. Oral administration of sodium butyrate reduces chemically induced preneoplastic lesions in experimental. Revista de Nutrição. 2009;22:717-725. [DOI] |
| 21. | Sun S, Li W, Zhang H, Zha L, Xue Y, Wu X, Zou F. Requirement for store-operated calcium entry in sodium butyrate-induced apoptosis in human colon cancer cells. Biosci Rep. 2012;32:83-90. [PubMed] [DOI] |
| 22. | Pajak B, Orzechowski A. Sodium butyrate-dependent sensitization of human colon adenocarcinoma COLO 205 cells to TNF-alpha-induced apoptosis. J Physiol Pharmacol. 2007;58 Suppl 3:163-176. [PubMed] |
| 23. | Wang L, Luo HS, Xia H. Sodium butyrate induces human colon carcinoma HT-29 cell apoptosis through a mitochondrial pathway. J Int Med Res. 2009;37:803-811. [PubMed] |
| 24. | Nohara K, Yokoyama Y, Kano K. The important role of caspase-10 in sodium butyrate-induced apoptosis. Kobe J Med Sci. 2007;53:265-273. [PubMed] |
| 25. | Pajak B, Orzechowski A, Gajkowska B. Molecular basis of sodium butyrate-dependent proapoptotic activity in cancer cells. Adv Med Sci. 2007;52:83-88. [PubMed] |
| 26. | Caderni G, Luceri C, Lancioni L, Tessitore L, Dolara P. Slow-release pellets of sodium butyrate increase apoptosis in the colon of rats treated with azoxymethane, without affecting aberrant crypt foci and colonic proliferation. Nutr Cancer. 1998;30:175-181. [PubMed] [DOI] |
| 27. | Silva FG, Penido LC, Valente FX, Mendes MC, Rosa DD, Glória MB, Peluzio Mdo C. Sodium butyrate does not decrease the evolution of precancerous lesions in rats. Acta Cir Bras. 2010;25:507-512. [PubMed] [DOI] |
| 28. | Caderni G, Luceri C, De Filippo C, Salvadori M, Giannini A, Tessitore L, Dolara P. Slow-release pellets of sodium butyrate do not modify azoxymethane (AOM)-induced intestinal carcinogenesis in F344 rats. Carcinogenesis. 2001;22:525-527. [PubMed] [DOI] |
| 29. | Wong CS, Sengupta S, Tjandra JJ, Gibson PR. The influence of specific luminal factors on the colonic epithelium: high-dose butyrate and physical changes suppress early carcinogenic events in rats. Dis Colon Rectum. 2005;48:549-559. [PubMed] [DOI] |
| 30. | Segain JP, Raingeard de la Blétière D, Bourreille A, Leray V, Gervois N, Rosales C, Ferrier L, Bonnet C, Blottière HM, Galmiche JP. Butyrate inhibits inflammatory responses through NFkappaB inhibition: implications for Crohn's disease. Gut. 2000;47:397-403. [PubMed] [DOI] |
| 31. | Lührs H, Gerke T, Müller JG, Melcher R, Schauber J, Boxberge F, Scheppach W, Menzel T. Butyrate inhibits NF-kappaB activation in lamina propria macrophages of patients with ulcerative colitis. Scand J Gastroenterol. 2002;37:458-466. [PubMed] [DOI] |
| 32. | Inan MS, Rasoulpour RJ, Yin L, Hubbard AK, Rosenberg DW, Giardina C. The luminal short-chain fatty acid butyrate modulates NF-kappaB activity in a human colonic epithelial cell line. Gastroenterology. 2000;118:724-734. [PubMed] [DOI] |