修回日期: 2012-03-13
接受日期: 2012-03-25
在线出版日期: 2012-05-08
目的: 研究nesfatin-1对离体培养的大鼠胃黏膜酸分泌的影响, 探讨nesfatin-1对H+/K+-ATP酶mRNA及蛋白表达的影响.
方法: 酶解法分离大鼠胃黏膜细胞, 细胞免疫荧光检测法鉴定细胞. 用不同浓度的nesfatin-1(10-4-10-1 μmol/L)对胃黏膜细胞进行处理0、1、2、3、4 h, 设立空白对照组, 以14C-氨基比林摄取为酸分泌指标, 检测nesfatin-1对大鼠离体的胃黏膜细胞酸分泌的影响. 用RT-PCR法及Western印迹法检测nesfatin-1对胃黏膜细胞H+/K+-ATP酶alpha(α)亚基和beta(β)亚基mRNA及蛋白表达的影响.
结果: Nesfatin-1在10-1 μmol/L浓度下, 在1、2 h能够抑制离体培养的大鼠胃黏膜细胞的酸分泌. Nesfatin-1(10-1 μmol/L)在1、2、3 h均能够抑制H+/K+-ATP酶α亚基mRNA表达水平; 在1、2 h能够抑制H+/K+-ATP酶β亚基mRNA表达水平, 分别与对照组相比, 差异有统计学意义(均P<0.01). Nesfatin-1(10-4-10-1 μmol/L)作用胃黏膜细胞2 h时, 呈剂量依赖性抑制α亚基和β亚基mRNA表达水平, 分别与对照组相比, 差异有统计学意义(均P<0.01). Nesfatin-1(10-1 μmol/L)在1、2、3 h能够抑制α亚基蛋白表达水平; 在2、3 h能够抑制β亚基蛋白表达水平, 分别与对照组相比, 差异有统计学意义(均P<0.01). Nesfatin-1(10-3-10-1 μmol/L)作用胃黏膜细胞2 h时, 呈剂量依赖性抑制α亚基和β亚基蛋白表达水平, 与对照组相比, 差异有统计学意义(均P<0.01).
结论: Nesfatin-1能抑制离体培养的大鼠胃黏膜细胞的酸分泌, 有可能是通过下调H+/K+-ATP酶α亚基和β亚基的mRNA及蛋白表达的水平影响酸分泌.
引文著录: 李静慧, 李学良, 吴静, 贾方圆, 林琳. Nesfatin-1对离体胃黏膜细胞胃酸分泌的影响. 世界华人消化杂志 2012; 20(13): 1123-1130
Revised: March 13, 2012
Accepted: March 25, 2012
Published online: May 8, 2012
AIM: To clarify the effect of nesfatin-1 on gastric acid secretion and the expression of the H+/K+-ATPase mRNA and protein in rat gastric mucosa cells in vitro.
METHODS: Gastric mucosa cells were isolated from SD rats by enzymolysis and identified by immunofluorescence staining. Cultured rat gastric mucosa cells were divided into control group and nesfatin-1 group, and the nesfatin-1 group was pretreated with different concentrations (0, 10-4, 10-3, 10-2, 10-1 μmol/L) of nesfatin-1 for different durations (0, 1, 2, 3, 4 h). The effect of nesfatin-1 on gastric acid secretion was investigated by monitoring 14C-aminopyrine (14C-AP) accumulation, and the expression of H+/K+-ATPase α and β subunit mRNA and protein was examined by real-time PCR and Western blot.
RESULTS: Pretreatment with nesfatin-1 at a dose of 10-1 or 10-2 μmol/L for 2 or 3 h inhibited gastric acid secretion, but nesfatin-1 at a dose of 10-3 or 10-4 μmol/L had no such effect. Nesfatin-1 at a dose of 10-1 μmol/L inhibited the expression of H+/K+-ATPase α subunit mRNA after pretreatment for 1, 2, or 3 h and inhibited the expression of H+/K+-ATPase β subunit mRNAs after pretreatment for 1 or 2 h. In the dose range between 10-4 to 10-1 μmol/L, nesfatin-1 dose-dependently inhibited the expression of H+/K+-ATPase α subunit and β subunit mRNA after pretreatment for 2 h. Nesfatin-1 at a dose of 10-1 μmmol/L inhibited H+/K+-ATPase α subunit protein expression after pretreatment for 1, 2 or 3 h and inhibited H+/K+-ATPase β subunit protein expression after pretreatment for 2 or 3 h. In the dose range between 10-3 to 10-1 μmol/L, nesfatin-1 dose-dependently inhibited H+/K+-ATPase α and β subunit protein expression after pretreatment for 2 h.
CONCLUSION: Our data suggest that nesfatin-1 inhibits gastric acid secretion by rat gastric mucosa cells in vitro possibly by down-regulating the expression of H+/K+-ATPase mRNA and protein..
- Citation: Li JH, Li XL, Wu J, Jia FY, Lin L. Nesfatin-1 inhibits gastric acid secretion by cultured rat gastric mucosa cells. Shijie Huaren Xiaohua Zazhi 2012; 20(13): 1123-1130
- URL: https://www.wjgnet.com/1009-3079/full/v20/i13/1123.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i13.1123
Nesfatin-1是由日本学者发现的一种新的厌食肽[1], 包含82个氨基酸, 起源于前体蛋白, 核组蛋白-2(nucleobindin2, NUCB2). NUCB2是由包含24个氨基酸的信号肽和396个氨基端的蛋白结构组成, 在人类、大鼠和小鼠间保持高度同源性[2]. NUCB2在激素原转化酶的作用下水解为N-端片段nesfatin-1和2个C-端肽nesfatin-2和nesfatin-3. 但只有nesfatin-1能够抑制大鼠的夜间摄食量和体质量的增加. NUCB2/nesfatin-1最初发现表达于调节摄食的下丘脑和脑干核中[1], 也表达于外周组织, 尤其是胃肠道中[3]. 中枢注射NUCB2/nesfatin-1不仅可以抑制大小鼠的夜间摄食量[4,5], 还可以抑制小鼠的胃肠动力[6]; 外周注射也可以抑制小鼠的夜间摄食量[7], nesfatin-1以非饱和的方式双向通过血脑屏障[8,9], 提示nesfatin-1在外周也发挥重要的生理作用.
有研究表明, nesfatin-1的免疫阳性细胞高度表达于胃泌酸腺[3]中, 我们的前期研究表明中枢注射nesfatin-1可以抑制大鼠的胃酸分泌, 那么nesfatin-1是否在外周也发挥同样的作用, 因此本实验研究了nesfatin-1对大鼠离体培养的胃黏膜细胞的胃酸分泌的影响. H+/K+-ATP酶是胃酸分泌的最终环节, H+/K+-ATP酶分为α和β两个亚单位[10,11], α亚单位含有ATP结合位点和酰基磷酸化作用位点, 起着催化和转运H+和K+的功能[12], β亚单位主要是稳定α亚单位及辅助泌酸[13]. 若nesfatin-1能够影响大鼠离体培养的胃黏膜细胞的胃酸分泌, 那么nesfatin-1是否通过对H+/K+-ATP酶的α和β两个亚单位的调节而影响胃酸分泌, 本研究进一步探讨了nesfatin-1对H+/K+-ATP酶α和β两个亚单位mRNA和蛋白表达水平的影响.
♂SD大鼠, 体质量200-250 g, 由南京医科大学动物中心提供, 有实验动物合格证. 胎牛血清购自Sigma公司; nesfatin-1购自ENZO公司; 14C-氨基比林购自Amersham公司; Ham's F12/DMEM培养基购自Gibco公司; H+/K+-ATPase α亚基、H+/K+-ATPase β亚基引物由上海英俊公司合成; 链霉蛋白酶、抗H+/K+-ATPase α亚基抗体购自Merk公司; 抗H+/K+-ATPase β亚基单克隆抗体、抗组胺单克隆抗体、抗胃泌素单克隆抗体和抗生长抑素单克隆抗体购自Abcam公司; TRIzol试剂、BCA蛋白测定试剂盒、电化学发光(ECL)试剂盒购自Invitrogen公司; 逆转录试剂盒PrimscriptTM RT reagent Kit及Real-Time PCR试剂盒SYBR Premix Ex TaqTM Ⅱ均购自日本TaKaRa公司; RIPA裂解液、PMSF购自碧云天生物技术研究所.
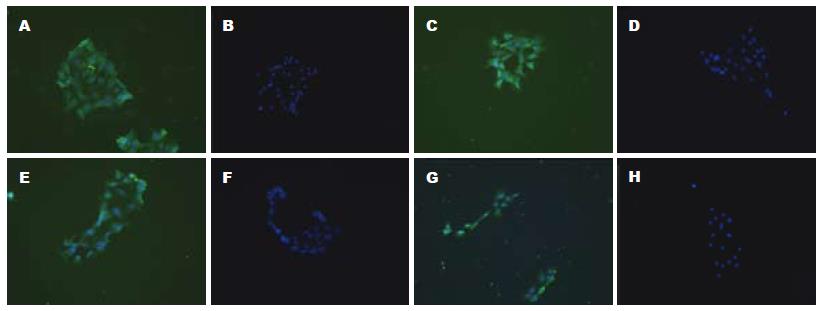
1.2.1 离体大鼠胃黏膜细胞培养和鉴定: (1)培养所需液体Medium A: 50 mmol/L HEPES, 350 μmol/L EDTA, 0.5 mmol/L NaH2PO4, 1 mmol/L Na2HPO4, 20 mmol/L NaHCO3, 70 mmol/L NaCl, 20 mmol/L KCl, 11 mmol/L D(+)-glucose, pH 7.8; Medium B: A液中去除EDTA, 加10 mmol/L Ca2+ and 15 mmol/L Mg2+, pH 7.4; Medium C: 140 mmol/L NaCl, 1.2 mmol/L MgSO4, 1 mmol/L CaCl2, 10 mmol/L HEPES, 11 mmol/L glucose, 100 mg/L DTT, 0.5 g/L BSA, pH 7.4; 消化液: 用Medium A配制, 链霉蛋白酶浓度为10 g/L; (2)胃黏膜细胞培养: 取非禁食SD大鼠, 脱颈处死, 结扎贲门、幽门, 取胃, 立即放入冰冷的PBS液中, 在胃底作一长约1 cm的切口, 用玻璃棒翻转胃, PBS清洗, 注入消化酶并结扎. 将翻转胃囊放入Medium A中, 消化30 min, 结束后放入Medium B中孵育10 min; 再将胃囊重新放入Medium A中消化30 min, 结束后放入Medium B中孵育10 min. 整个过程均给予震荡, 皆充以950 mL/L O2和50 mL/L CO2[14]. 收集最后一步的细胞, 过细胞筛网、离心, Medium C洗涤2次, 制成细胞悬液, 计数, 接种细胞至用鼠尾胶原包被的盖玻片上; (3)细胞免疫法鉴定胃黏膜细胞: 取出细胞爬片, 4%多聚甲醛固定20 min, 0.2%Triton X-100通透10 min, 与二抗相同宿主的血清封闭30 min, 分别加入抗H+/K+-ATPase b亚基的单抗(1:2 000)、抗组胺的单抗(1:4 000)、抗胃泌素的单抗(1:1 000)和抗生长抑素(1 mg/L)的单抗, 4 ℃湿盒内过夜; 异硫氰酸荧光素(FITC)标记的二抗(1:500)室温2 h(避光); 用DAPI染核, 甘油封片, 激光共聚焦显微镜观察并拍照. 用PBS代替一抗, 作为阴性对照.
1.2.2 Nesfatin-1对离体培养的胃黏膜细胞分泌胃酸的影响: 胃黏膜细胞培养48 h后, 设立实验组、空白对照组和二硝基苯酚(DNP)组, 实验组分别加入浓度为10-4-10-1 μmol/L的nesfatin-1, 分别作用0、1、2、3、4 h. 加入14C-AP(终浓度为0.1 μCi/mL)[15], 37 ℃平衡15 min; 充分混匀细胞, DNP组加入0.1 mmol/L二硝基苯酚用于校正非特异吸附的14C-AP, PBS洗涤后, 1% Triton X-100裂解细胞, 加入闪烁液中液闪记数. 实验组及对照组分别减除非特异吸附数值, 以对照组为100%, 计算实验组改变的百分数.
1.2.3 qRT-PCR检测H+/K+-ATP酶mRNA的表达: (1)实验分组: 根据预实验结果, 设立空白对照组, 实验组分别为nesfatin-1(10-1 μmol/L)作用于胃黏膜细胞1、2、3、4 h和10-4-10-1 μmol/L的nesfatin-1作用于胃黏膜细胞2 h; (2)RT-PCR: 按TRIzol试剂说明提取各组细胞总RNA, 依照逆转录试剂盒说明逆转录为cDNA. 按SYBR Premix Ex TaqTM Ⅱ试剂盒说明进行RT-PCR, 反应体系为20 μL, 循环条件为: 95 ℃ 90 s; 95 ℃ 30 s, 60 ℃ 30 s, 40个循环; 95 ℃ 1 min, 55 ℃ 1 min, 55 ℃ 10 s, 80个循环. 根据溶解曲线确保其产物纯度, 采用制作标准曲线的方法得到数据. 引物序列为: α亚基, 上游5'-GTGCCACATTCTTTGTGGTG, 下游5'-GAGCAGATGACTGACGTGCA; β亚基, 上游5'-GTFFTCATGACTGGGCTCTT, 下游5'-CCCAGGAGCTGTTTCAGAG; GAPDH, 上游5'-GAGTCAACGGATTTGGTCGT, 下游5'-TTGATTTTGGAGGGATCTCG.
1.2.4 Western印迹法检测H+/K+-ATP酶蛋白表达变化: 裂解液裂解细胞, 提取细胞蛋白, 用BCA法蛋白定量. 每孔40 μg蛋白上样, 12%聚丙烯酰胺凝胶电泳, 转膜至聚偏氟乙烯膜(PVDF膜)上; 5%脱脂牛奶封闭2 h, 加一抗, 分别为抗H+/K+-ATPase α亚基抗体(1:2 000)、抗H+/K+-ATPase β亚基抗体(1:4 000)、抗Actin抗体(1:2 000), 4 ℃孵育过夜, 置37 ℃孵育二抗1 h. 用ECL化学发光试剂显影、定影; 采用Bio-Rad公司数码成像系统扫描图片, Quantity One软件灰度分析, 以Actin作为内参照, 进行定量分析.
统计学处理 用SPSS13.0统计软件进行分析, 结果用mean±SD表示, 多组均数比较采用单因素方差分析, 两两比较采用LSD法, P<0.05为差异有统计学意义.
锥虫蓝排斥反应显示活细胞数>90%, 胃黏膜细胞培养24 h后, 可见细胞贴壁生长. 细胞免疫荧光染色, 激光共聚焦显微镜检测结果显示, 壁细胞与抗H+/K+-ATPase β亚基单抗结合, ECL细胞与抗组胺单抗结合, G细胞与抗胃泌素单抗结合, D细胞与抗生长抑素单抗结合; 经FITC染色后, 细胞质显绿色荧光, 细胞核经DAPI染色发出蓝色荧光; 阴性对照仅见细胞核为蓝色荧光(图1).
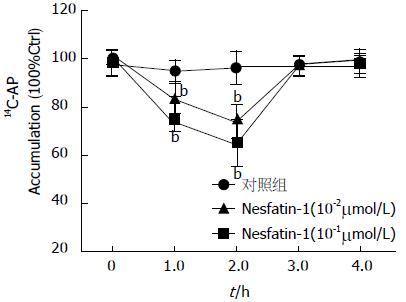
Nesfatin-1在10-4及10-3 μmol/L时对胃黏膜细胞的基础酸分泌未见明显抑制作用, 但10-2及10-1 μmol/L的nesfatin-1在1 h(0.82±0.06, 0.74±0.03), 2 h(0.73±0.07, 0.65±0.09)均能抑制胃黏膜细胞的基础酸分泌, 与对照组(1.00)比较差异有统计学意义(P<0.01, 图2). 但在3 h及4 h, nesfatin-1抑制大鼠胃黏膜分泌胃酸的作用消失.
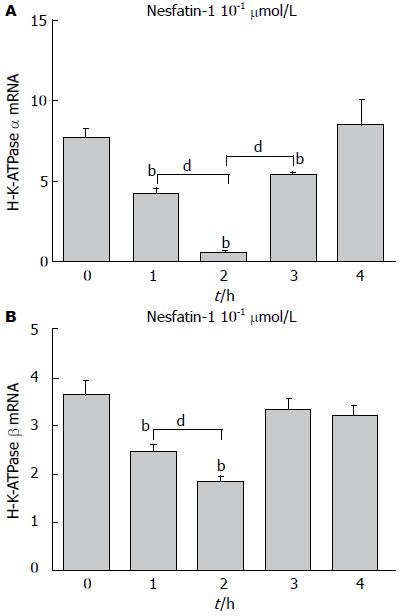
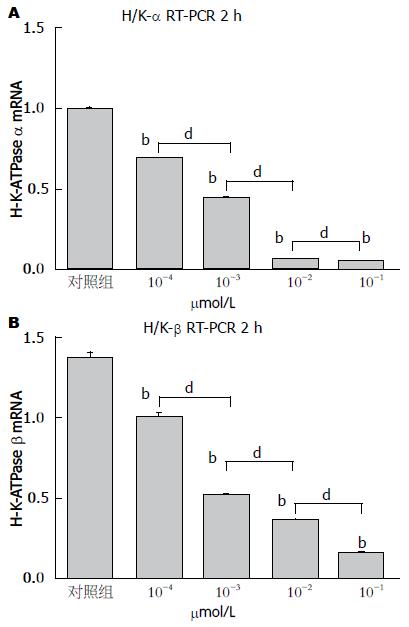
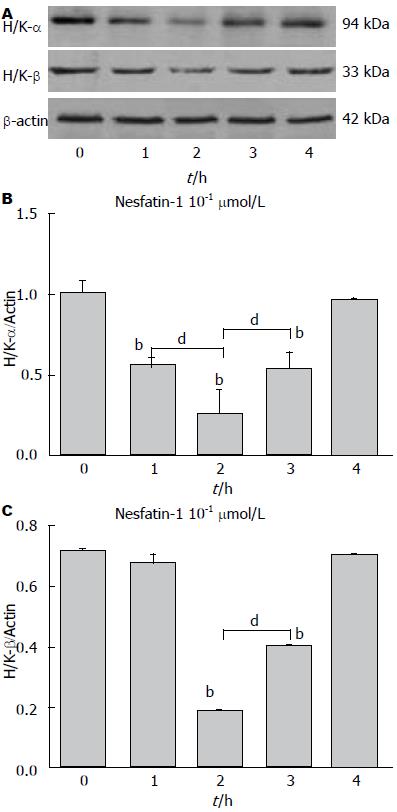
2.3.1 Nesfatin-1对H+/K+-ATP酶α亚基mRNA表达的影响: nesfatin-1在浓度为10-1 μmol/L时, 在1 h(4.10±0.32), 2 h(4.69±0.06), 3 h(5.31±0.23)能够抑制H+/K+-ATP酶α亚基mRNA表达水平, 与对照组(7.60±0.53)比较, 差异有统计学意义(P<0.01), 其中2 h的抑制作用最强. 而4 h(8.46±1.49)时抑制作用消失(P>0.05, 图3A). Nesfatin-1作用胃黏膜细胞2 h, 在浓度为10-4、10-3、10-2和10-1 μmol/L时, 呈剂量依赖性地抑制H+/K+-ATP酶α亚基mRNA表达水平(0.69±0.02, 0.44±0.01, 0.07±0.00, 0.05±0.00), 分别与对照组(1.22±0.03)相比, 差异均有统计学意义(均P<0.01, 图4A), 实验组各组之间相比, 差异均有统计学意义(均P<0.01).
2.3.2 Nesfatin-1对H+/K+-ATP酶β亚基mRNA表达的影响: nesfatin-1(10-1 μmol/L)在1 h(2.47±0.17), 2 h(1.83±0.22)抑制胃黏膜细胞H+/K+-ATP酶β亚基mRNA表达水平, 2 h时抑制作用最强, 分别与对照组(3.61±0.34)比较, 差异均有统计学意义(P<0.01, 图3B). 至3 h(3.35±0.24), 4 h(3.18±0.25)时该抑制作用消失. 进一步研究发现, nesfatin-1作用胃黏膜细胞2 h时, 其对H+/K+-ATP酶 β亚基mRNA表达的抑制作用呈剂量依赖性. 在nesfatin-1的浓度为10-4、10-3、10-2及10-1 μmol/L时, H+/K+-ATPase β亚基mRNA的表达值分别为1.00±0.03、0.52±0.01、0.35±0.01、0.16±0.005, 与对照组(1.37±0.04)相比, 差异均有统计学意义(均P<0.01, 图4B). 实验组各组之间相比, 差异均有统计学意义(均P<0.01).
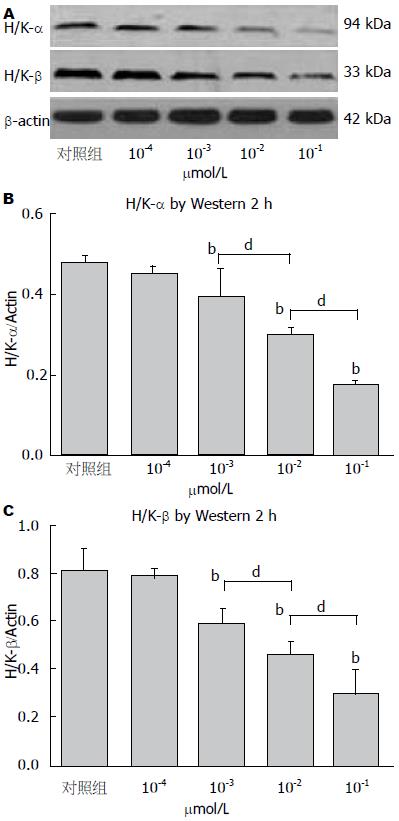
2.4.1 Nesfatin-1对H+/K+-ATP酶α亚基蛋白表达的影响: nesfatin-1(10-1 μmol/L)在1 h(0.56±0.03), 2 h(0.26±0.15)及3 h(0.54±0.09)抑制了胃黏膜细胞H+/K+-ATP酶α亚基蛋白表达水平, 其中2 h的抑制作用最强, 各时间点与对照组(1.02±0.07)比较, 差异均有统计学意义(均P<0.01, 图5A, B). 4 h(0.98±0.02)时这种抑制作用消失(P>0.05). Nesfatin-1作用胃黏膜细胞2 h时, 在浓度为10-3, 10-2, 10-1 μmol/L状态下, 其对H+/K+-ATP酶α亚基蛋白表达水平的抑制作用呈剂量依赖性, 其表达值分别为0.39±0.07、0.29±0.02、0.17±0.01, 与对照组(0.48±0.02)相比, 差异均有统计学意义(均P<0.01, 图6A, B). 这3组之间相比, 差异均有统计学意义(均P<0.01). 10-4 μmol/L nesfatin-1(0.45±0.02)对H+/K+-ATP酶α亚基蛋白表达无影响.
2.4.2 Nesfatin-1对H+/K+-ATP酶β亚基蛋白表达的影响: nesfatin-1(10-1 μmol/L)在2 h(0.18±0.01), 3 h(0.40±0.01)均能够抑制H+/K+-ATP酶β亚基蛋白表达水平, 与对照组(0.72±0.004)比较, 差异均有统计学意义(均P<0.01). 而其中2 h的抑制作用强于3 h(P<0.01, 图5C). 但nesfatin-1在1 h(0.67±0.04)和4 h(0.71±0.01)时未表现出对H+/K+-ATP酶β亚基蛋白表达的抑制作用. 在nesfatin-1作用2 h时, 在浓度分别为10-3、10-2、10-1 μmol/L状态下, 均能抑制H+/K+-ATP酶β亚基蛋白表达, 其表达值分别为0.59±0.06、0.47±0.05、0.31±0.09, 与对照组(0.82±0.09)相比, 差异均有统计学意义(P<0.01, 图6C). 这3组之间相比, 差异均有统计学意义(均P<0.01). 10-4 μmol/L nesfatin-1对H+/K+-ATP酶β亚基蛋白表达无影响(P>0.05).
研NUCB2/nesfatin-1除广泛分布于中枢神经系统, 包括室旁核、弓状核、孤束核和动眼神经副核[16-18]等, 也表达于外周, 如脂肪组织、胃、胰腺、十二指肠和睾丸[3,19-22]等. Nesfatin-1可以调节多种重要生理活动, 包括葡萄糖的代谢、免疫调节、胃肠运动和胃黏膜的保护作用[4,6,23-25]等. 有研究显示, NUCB2 mRNA在大鼠胃黏膜层的表达量是其大脑组织的10倍, 且nesfatin-1主要与胃泌酸腺中间部分的X/A样细胞分泌的葛瑞林(ghrelin)共存, nesfatin-1还在泌酸腺基底部的少数细胞中与生长抑素和组氨酸脱羧酶共存[3]. Ghrelin、生长抑素、组氨酸脱羧酶均可影响胃酸的分泌[26,27], 提示nesfatin-1在胃黏膜的分泌功能中起着重要作用.
胃酸分泌涉及了神经、内分泌、旁分泌、自分泌和神经-内分泌等复杂因素及其相互作用. 本实验排除了影响胃酸分泌的神经、神经-内分泌等复杂因素, 研究nesfatin-1对大鼠离体培养的胃黏膜酸分泌的影响. 我们的研究结果表明, nesfatin-1能够抑制胃黏膜细胞的基础胃酸分泌, 且nesfatin-1随着处理时间延长而抑酸作用减弱, 其可能原因为nesfatin-1的活性随着孵育时间延长而减弱, 或是离体胃黏膜细胞随着分离时间延长使胃酸分泌功能减弱, 表现对外来刺激反应性减弱. Nesfatin-1与ghrelin、生长抑素、组氨酸脱羧酶共同表达于胃黏膜的泌酸腺, nesfatin-1是否通过影响这些因子的分泌而影响胃酸分泌, 需要进一步研究.
壁细胞包含大量的管泡结构, H+/K+-ATP酶位于这些管泡结构上. 当壁细胞未受刺激时, 胞浆内管泡极多, 与线粒体相伴分布于整个胞质中, 分泌小管很少, 管腔狭窄, 表面微绒毛少而短; 当壁细胞受到刺激时, 胞浆内管泡减少, 分泌小管增多, 微绒毛也加长、变多, 使壁细胞分泌面积大大增加. H+/K+-ATP酶集中分布在壁细胞顶部分泌小管, 管状结构不断向顶部分泌小管融合, 使H+/K+-ATP酶不断向顶部质膜补充, 从而使壁细胞分泌胃酸[28-30]. 因此nesfatin-1可能通过下调H+/K+-ATP酶2个亚基的表达引起酸分泌功能的降低.
实验中观察到nesfatin-1不仅能够下调H+/K+-ATP酶α, β两个亚基mRNA的表达, 还可以抑制H+/K+-ATP酶α, β两个亚基蛋白的表达, 与nesfatin-1抑制胃黏膜细胞酸分泌的结果一致. 表明nesfatin-1抑制大鼠离体培养的胃黏膜细胞胃酸的分泌, 可能与其抑制H+/K+-ATP酶的合成有关. H+/K+-ATP酶的活性亦可以影响酸分泌, nesfatin-1是否也通过降低H+/K+-ATP酶的活性抑制胃黏膜细胞的酸分泌, 需要进一步研究. 壁细胞内的分泌小管和管泡等形态、数量与壁细胞的分泌状态有关, 因此nesfatin-1是否通过影响壁细胞的形态而影响胃酸分泌, 需要电镜进一步观察壁细胞超微结构的变化情况.
H+/K+-ATP酶的2个亚单位的生物合成场所是壁细胞的内质网, 在高尔基体装配成二聚体后, α亚单位才稳定, 随后向高尔基体膜及管泡膜移动. 本实验中观察到nesfatin-1抑制H+/K+-ATP酶α亚基和β亚基mRNA和蛋白表达的时间点与其抑制胃酸的时间稍有不一致, 认为可能是其2个亚基在高尔基体装配成二聚体后才能发挥作用, 故只有当这2个亚基在同一时间被抑制时, 才可观察到nesfatin-1对胃酸分泌的影响.
胃酸的分泌还有赖于H+/K+-ATP酶从壁细胞胞质的管状结构不断向顶部分泌小管融合, nesfatin-1是否影响这个融合的过程, 需免疫荧光进一步证实nesfatin-1作用于胃黏膜细胞时H+/K+-ATP酶2个亚基的具体分布位置. 另一方面, 因为有一系列的靶信号和蛋白-蛋白相互作用参与并调控这个过程[31-34], 可通过检测这些蛋白的表达进一步证实nesfatin-1影响胃酸分泌的机制.
总之, nesfatin-1能够抑制离体培养的大鼠胃黏膜细胞的胃酸分泌, 并能下调H+/K+-ATP酶mRNA和蛋白的表达水平, 但这个过程具体是通过直接作用于壁细胞还是间接作用于胃黏膜其他细胞来完成, 又是作用于何受体, 这些问题均有待于进一步研究.
Nesfatin-1是最近发现的一种新的厌食肽, 最初发现表达于调节摄食的下丘脑和脑干核中, 也表达于外周组织, 尤其是胃肠道中; 研究显示, nesfatin-1在胃黏膜的胃酸分泌功能中可能起着重要作用.
任建林, 教授, 厦门大学附属中山医院消化内科
Nesfatin-1可以调节多种重要生理活动, 包括葡萄糖的代谢、免疫调节、胃肠运动和胃黏膜的保护作用, 关于他对胃酸分泌的影响尚未见报道.
研究表明, nesfatin-1的免疫阳性细胞高度表达于胃泌酸腺中, 且中枢注射nesfatin-1可以抑制大鼠的胃酸分泌.
本文初次探讨了nesfatin-1对离体胃黏膜细胞的胃酸分泌的影响, 并观察他对H+/K+-ATP酶的影响, 为其将来的临床应用提供一定基础.
本实验研究了nesfatin-1对离体培养的大鼠胃黏膜细胞胃酸分泌的影响, 并探讨了nesfatin-1对H+/K+-ATP酶α和β表达水平的作用, 有助于揭示该分子作用的具体机制,并为临床治疗相关疾病提供一定的理论依据.
本研究先进性、科学性均较好, 结果可靠, 结论正确.
编辑: 张珊珊 电编:鲁亚静
| 1. | Oh-I S, Shimizu H, Satoh T, Okada S, Adachi S, Inoue K, Eguchi H, Yamamoto M, Imaki T, Hashimoto K. Identification of nesfatin-1 as a satiety molecule in the hypothalamus. Nature. 2006;443:709-712. [PubMed] [DOI] |
| 2. | Miura K, Titani K, Kurosawa Y, Kanai Y. Molecular cloning of nucleobindin, a novel DNA-binding protein that contains both a signal peptide and a leucine zipper structure. Biochem Biophys Res Commun. 1992;187:375-380. [PubMed] [DOI] |
| 3. | Stengel A, Goebel M, Yakubov I, Wang L, Witcher D, Coskun T, Taché Y, Sachs G, Lambrecht NW. Identification and characterization of nesfatin-1 immunoreactivity in endocrine cell types of the rat gastric oxyntic mucosa. Endocrinology. 2009;150:232-238. [PubMed] [DOI] |
| 4. | Stengel A, Goebel M, Wang L, Rivier J, Kobelt P, Mönnikes H, Lambrecht NW, Taché Y. Central nesfatin-1 reduces dark-phase food intake and gastric emptying in rats: differential role of corticotropin-releasing factor2 receptor. Endocrinology. 2009;150:4911-4919. [PubMed] [DOI] |
| 5. | Goebel M, Stengel A, Wang L, Taché Y. Central nesfatin-1 reduces the nocturnal food intake in mice by reducing meal size and increasing inter-meal intervals. Peptides. 2011;32:36-43. [PubMed] [DOI] |
| 6. | Atsuchi K, Asakawa A, Ushikai M, Ataka K, Tsai M, Koyama K, Sato Y, Kato I, Fujimiya M, Inui A. Centrally administered nesfatin-1 inhibits feeding behaviour and gastroduodenal motility in mice. Neuroreport. 2010;21:1008-1011. [PubMed] |
| 7. | Shimizu H, Oh-I S, Hashimoto K, Nakata M, Yamamoto S, Yoshida N, Eguchi H, Kato I, Inoue K, Satoh T. Peripheral administration of nesfatin-1 reduces food intake in mice: the leptin-independent mechanism. Endocrinology. 2009;150:662-671. [PubMed] [DOI] |
| 8. | Pan W, Hsuchou H, Kastin AJ. Nesfatin-1 crosses the blood-brain barrier without saturation. Peptides. 2007;28:2223-2228. [PubMed] [DOI] |
| 9. | Price TO, Samson WK, Niehoff ML, Banks WA. Permeability of the blood-brain barrier to a novel satiety molecule nesfatin-1. Peptides. 2007;28:2372-2381. [PubMed] [DOI] |
| 10. | Agnew BJ, Duman JG, Watson CL, Coling DE, Forte JG. Cytological transformations associated with parietal cell stimulation: critical steps in the activation cascade. J Cell Sci. 1999;112:2639-2646. [PubMed] |
| 11. | Zalewsky CA, Moody FG. Stereological analysis of the parietal cell during acid secretion and inhibition. Gastroenterology. 1977;73:66-74. [PubMed] |
| 12. | Spicer Z, Miller ML, Andringa A, Riddle TM, Duffy JJ, Doetschman T, Shull GE. Stomachs of mice lacking the gastric H,K-ATPase alpha -subunit have achlorhydria, abnormal parietal cells, and ciliated metaplasia. J Biol Chem. 2000;275:21555-21565. [PubMed] [DOI] |
| 13. | Scarff KL, Judd LM, Toh BH, Gleeson PA, Van Driel IR. Gastric H(+),K(+)-adenosine triphosphatase beta subunit is required for normal function, development, and membrane structure of mouse parietal cells. Gastroenterology. 1999;117:605-618. [PubMed] [DOI] |
| 14. | Lambrecht NW, Yakubov I, Scott D, Sachs G. Identification of the K efflux channel coupled to the gastric H-K-ATPase during acid secretion. Physiol Genomics. 2005;21:81-91. [PubMed] [DOI] |
| 15. | Soll AH. Secretagogue stimulation of [14C]aminopyrine accumulation by isolated canine parietal cells. Am J Physiol. 1980;238:G366-G375. [PubMed] |
| 16. | Kohno D, Nakata M, Maejima Y, Shimizu H, Sedbazar U, Yoshida N, Dezaki K, Onaka T, Mori M, Yada T. Nesfatin-1 neurons in paraventricular and supraoptic nuclei of the rat hypothalamus coexpress oxytocin and vasopressin and are activated by refeeding. Endocrinology. 2008;149:1295-1301. [PubMed] [DOI] |
| 17. | Brailoiu GC, Dun SL, Brailoiu E, Inan S, Yang J, Chang JK, Dun NJ. Nesfatin-1: distribution and interaction with a G protein-coupled receptor in the rat brain. Endocrinology. 2007;148:5088-5094. [PubMed] [DOI] |
| 18. | Fort P, Salvert D, Hanriot L, Jego S, Shimizu H, Hashimoto K, Mori M, Luppi PH. The satiety molecule nesfatin-1 is co-expressed with melanin concentrating hormone in tuberal hypothalamic neurons of the rat. Neuroscience. 2008;155:174-181. [PubMed] [DOI] |
| 19. | Ramanjaneya M, Chen J, Brown JE, Tripathi G, Hallschmid M, Patel S, Kern W, Hillhouse EW, Lehnert H, Tan BK. Identification of nesfatin-1 in human and murine adipose tissue: a novel depot-specific adipokine with increased levels in obesity. Endocrinology. 2010;151:3169-3180. [PubMed] [DOI] |
| 20. | Zhang AQ, Li XL, Jiang CY, Lin L, Shi RH, Chen JD, Oomura Y. Expression of nesfatin-1/NUCB2 in rodent digestive system. World J Gastroenterol. 2010;16:1735-1741. [PubMed] [DOI] |
| 21. | Gonzalez R, Tiwari A, Unniappan S. Pancreatic beta cells colocalize insulin and pronesfatin immunoreactivity in rodents. Biochem Biophys Res Commun. 2009;381:643-648. [PubMed] [DOI] |
| 22. | Foo KS, Brauner H, Ostenson CG, Broberger C. Nucleobindin-2/nesfatin in the endocrine pancreas: distribution and relationship to glycaemic state. J Endocrinol. 2010;204:255-263. [PubMed] [DOI] |
| 23. | Yosten GL, Samson WK. Nesfatin-1 exerts cardiovascular actions in brain: possible interaction with the central melanocortin system. Am J Physiol Regul Integr Comp Physiol. 2009;297:R330-R336. [PubMed] [DOI] |
| 24. | Özsavcí D, Erşahin M, Şener A, Özakpinar ÖB, Toklu HZ, Akakín D, Şener G, Yeğen BÇ. The novel function of nesfatin-1 as an anti-inflammatory and antiapoptotic peptide in subarachnoid hemorrhage-induced oxidative brain damage in rats. Neurosurgery. 2011;68:1699-1708; discussion 1708. [PubMed] |
| 25. | Su Y, Zhang J, Tang Y, Bi F, Liu JN. The novel function of nesfatin-1: anti-hyperglycemia. Biochem Biophys Res Commun. 2010;391:1039-1042. [PubMed] [DOI] |
| 26. | Komasaka M, Horie S, Watanabe K, Murayama T. Antisecretory effect of somatostatin on gastric acid via inhibition of histamine release in isolated mouse stomach. Eur J Pharmacol. 2002;452:235-243. [PubMed] [DOI] |
| 27. | Yakabi K, Ro S, Onouhi T, Tanaka T, Ohno S, Miura S, Johno Y, Takayama K. Histamine mediates the stimulatory action of ghrelin on acid secretion in rat stomach. Dig Dis Sci. 2006;51:1313-1321. [PubMed] [DOI] |
| 28. | Black JA, Forte TM, Forte JG. Inhibition of HCl secretion and the effects on ultrastructure and electrical resistance in isolated piglet gastric mucosa. Gastroenterology. 1981;81:509-519. [PubMed] |
| 29. | Forte TM, Machen TE, Forte JG. Ultrastructural changes in oxyntic cells associated with secretory function: a membrane-recycling hypothesis. Gastroenterology. 1977;73:941-955. [PubMed] |
| 30. | Duman JG, Pathak NJ, Ladinsky MS, McDonald KL, Forte JG. Three-dimensional reconstruction of cytoplasmic membrane networks in parietal cells. J Cell Sci. 2002;115:1251-1258. [PubMed] |
| 31. | Mizukawa Y, Nishizawa T, Nagao T, Kitamura K, Urushidani T. Cellular distribution of parchorin, a chloride intracellular channel-related protein, in various tissues. Am J Physiol Cell Physiol. 2002;282:C786-C795. [PubMed] |
| 32. | Chew CS, Chen X, Bollag RJ, Isales C, Ding KH, Zhang H. Targeted disruption of the Lasp-1 gene is linked to increases in histamine-stimulated gastric HCl secretion. Am J Physiol Gastrointest Liver Physiol. 2008;295:G37-G44. [PubMed] [DOI] |
| 33. | Pagliocca A, Hegyi P, Venglovecz V, Rackstraw SA, Khan Z, Burdyga G, Wang TC, Dimaline R, Varro A, Dockray GJ. Identification of ezrin as a target of gastrin in immature mouse gastric parietal cells. Exp Physiol. 2008;93:1174-1189. [PubMed] [DOI] |
| 34. | Ding X, Deng H, Wang D, Zhou J, Huang Y, Zhao X, Yu X, Wang M, Wang F, Ward T. Phospho-regulated ACAP4-Ezrin interaction is essential for histamine-stimulated parietal cell secretion. J Biol Chem. 2010;285:18769-18780. [PubMed] [DOI] |