修回日期: 2012-03-05
接受日期: 2012-03-25
在线出版日期: 2012-05-08
目的: 获得一株适合用于生物人工肝支持系统的细胞材料.
方法: 用已构建好的重组质粒pBudCE4.1-CYP 3A4-GST A1转染肝脏肿瘤细胞系C3A, 用Zeocin筛选, 所得细胞系命名为C3A-未优势化; 通过qRT-PCR方法检测目的基因表达情况; 对转染重组质粒的肝脏肿瘤细胞系C3A的合成、代谢、解毒等功能及性状进行综合评价.
结果: 成功构建了转染重组质粒pBudCE4.1-CYP 3A4-GST A1的细胞系; 构建好的C3A-未优势化细胞系通过qRT-PCR方法检测其目的基因CYP 3A4和GST A1的表达量较正常C3A细胞系高; 通过色谱法证明CYP 3A4活性较正常C3A细胞系高; 用免疫组织化学实验证实目的基因GST A1的表达较正常C3A细胞系多; 另外, 对利多卡因的代谢能力亦高于正常C3A细胞.
结论: 构建的C3A-未优势化细胞系功能有所改善, 有望成为生物人工肝系统的细胞材料.
引文著录: 常彬霞, 貌盼勇, 游绍莉, 李保森, 辛绍杰. 转染重组质粒pBudCE4.1-CYP 3A4-GST A1的肝细胞系的建立及功能评价. 世界华人消化杂志 2012; 20(13): 1081-1087
Revised: March 5, 2012
Accepted: March 25, 2012
Published online: May 8, 2012
AIM: To generate a new cell strain that could be used in the bioartificial liver support system.
METHODS: The C3A cell line was transfected with the recombinant plasmid pBudCE4.1-CYP 3A4-GST A1, which expresses both cytochrome P450 3A4 (CYP 3A4) and glutathione-S-transferase A1 (GSTA1), and cultured in MEM containing 400 mg/L Zeocin for 2 wk. The obtained cell line was named C3A-Unoptimized. The expression of CYP 3A4 and GSTA1 in C3A-Unoptimized cells was detected by qRT-PCR, and the function of the C3A-Unoptimized cell line was evaluated.
RESULTS: The C3A-Unoptimized cell line stably expressed both CYP 3A4 and GST A1. The expression levels of CYP 3A4 and GSTA1 were higher in C3A-Unoptimized cells than in non-transfected C3A cells. Chromatogram assay showed that the activity of CYP 3A4 could be detected in C3A-Unoptimized cells but was undetectable in non-transfected C3A cells. Immunohistochemical staining indicated higher expression of GSTA1 in C3A-Unoptimized cells than in non-transfected C3A cells. The ability to metabolize lidocaine for C3A-Unoptimized cells was enhanced compared to non-transfected C3A cells (62.5% vs 30%).
CONCLUSION: The function of the C3A-Unoptimized cell line has been improved, and this cell line might be used in the bioartificial liver support system.
- Citation: Chang BX, Mao PY, You SL, Li BS, Xin SJ. Construction and functional evaluation of a liver cell line tranfected with a vector expressing cytochrome P450 3A4 and glutathione-S-transferase A1. Shijie Huaren Xiaohua Zazhi 2012; 20(13): 1081-1087
- URL: https://www.wjgnet.com/1009-3079/full/v20/i13/1081.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i13.1081
肝脏疾病时肝功能受损的患者, 药物代谢功能会受到不同程度的影响, 从而使得药物的不良反应增加, 疗效下降. 大多数药物是先经Ⅰ相反应再经Ⅱ相反应后消除, 少数药物只经过Ⅰ相反应或Ⅱ相反应后消除, 最终由非极性化合物转变为极性化合物排出体外. 肝脏中含量最丰富和最重要的Ⅰ相药物代谢酶和Ⅱ相药物代谢酶分别是细胞色素P450 3A4(cytochrome P450 3A4, CYP 3A4)和谷胱甘肽硫转移酶A1(glutathione-S-transferase A1, GST A1). 本试验旨在用已构建好的重组质粒pBudCE4.1-CYP 3A4-GST A1转染肝脏肿瘤细胞系C3A, 并对其合成、代谢、解毒等功能及性状进行综合评价, 以期获得一株适合用于生物人工肝支持系统的细胞材料.
C3A细胞(中国人民解放军第302医院病毒研究室惠赠); pBudCE4.1-CYP 3A4-GST A1重组质粒(已构建完成); Zeocin(母液浓度100 g/L)、lipofectamine 2000、HQ高纯度质粒抽提试剂盒、TRIzol、逆转录试剂盒、RNase H(Invitrogen公司); MTT试剂盒(碧云天C0009); PV-9000二步法免疫组织化学检测试剂(中杉金桥); 鼠抗人GST A1单抗(美国Santa Cruz). 荧光定量PCR仪(BIO-RAD); 荧光显微镜、相差倒置显微镜伴摄像装置(日本Nikon); 全自动生化仪器AU5400(日本OLYMPUS公司); 液-质联用仪(Agilent LC-MSD VL, 配有Agilent 1100泵, 分析软件为Agilent Chemical Rev. B. 01. 03 [204]); Micro CL 21R高速冷冻离心机(Thermo Electron Corporation).
1.2.1 肝脏肿瘤细胞系C3A对Zeocin敏感度试验(Kill Curves): 将生长状态良好, 处于对数生长期的C3A细胞, 按照密度比1:10接种到24孔板中. 细胞铺板24 h后, 可以加入抗生素Zeocin进行筛选, Zeocin的筛选浓度为150-600 mg/L. 根据抗生素的剂量范围和相关靶细胞的筛选信息设定合适的筛选剂量梯度, 每个梯度设置2个复孔. 持续观察并记录细胞的生长情况, 每3 d换1次培养基, 加入抗生素继续筛选. 靶细胞抗生素最佳筛选剂量为可在3 d内导致大量的细胞死亡, 并在2 wk内杀死所有细胞的浓度.
1.2.2 质粒瞬时共转染靶细胞: 用HQ高纯度质粒抽提试剂盒制备重组质粒pBudCE4.1-CYP 3A4-GST A1. 将状态良好、处于对数生长期的C3A细胞用0.25%胰酶消化, 用MEM培养液悬浮成单细胞悬液, 细胞计数后, 按照每孔5×105个细胞接种于6孔板的每个孔中. 在细胞覆盖率80%左右时, 用lipofectamine 2000进行转染实验. 在37 ℃, 50 mL/L的CO2的培养箱中培养4-6 h后, 换上MEM培养液(不含抗生素), 放置在37 ℃, 50 mL/L的CO2的培养箱中继续培养过夜; 24 h后, 消化细胞, 待稳转株筛选; 48 h后, 收集样品用于qRT-PCR. 转染重组质粒pBudCE4.1-CYP 3A4-GST A1的细胞系命名为C3A-未优势化, 未转染重组质粒的细胞系(空白对照)命名为C3A-空白.
1.2.3 稳转株的筛选: 细胞转染24 h后, 消化细胞, 按照1:30将细胞接种到5个10 cm的细胞培养皿中(空白对照细胞留1个皿即可). 待细胞贴壁后, 加入Kill curve实验中筛选出的抗生素剂量400 mg/L. 持续观察细胞的筛选情况, 每3 d换1次含有抗生素Zeocin 400 mg/L的MEM培养液. 待空白对照皿中的C3A细胞已经全部死亡, C3A-未优势化各皿中细胞克隆已经形成, 将所有细胞消化合并在1个6孔板中培养. 扩增并冻存细胞, 并准备细胞进行基因和蛋白水平的检测.
1.2.4 qRT-PCR检测目的基因表达: 分别提取C3A-未优势化和C3A-空白细胞系的总RNA, 并反转录cDNA, 保存在-20 ℃备用. 通过qRT-PCR检测细胞样品中目的基因和内参基因GAPDH的表达量, 根据qRT-PCR反应曲线得到各样品目的基因和内参基因的Ct值, 采用∆∆Ct的方法进行相对定量. 使用空白的C3A样品作为对照样品, 检测各组样品目的基因的表达情况.
∆∆Ct = (待测样品的目的基因的Ct平均值-待测样品的内参基因的Ct平均值)-(对照样品的目的基因的Ct平均值-对照样品的内参基因的Ct平均值), 基因的表达量F = 2-∆∆Ct. 目的基因的检测用引物序列(5'-3'): homo未优势化GSTA1-F: CTGAGCCGGGCTGACATTC, homo未优势化GSTA1-R: GGGCTGCCAGGCTGTAGAA; homo未优势化CYP3A4-F: CACCCACCTATGATACTGTGCTAC, homo未优势化CYP3A4-R: TCTATGTTGTCCTTGTTCTTCTTGC; 内参GAPDH-F(bp114): GAAGGTCGGAGTCAACGGATT, 内参GAPDH-R(bp341C): CGCTCCTGGAAGATGGTGAT.
PCR反应体系为: 10×PCR Buffer 2.5 µL, 25 mmol/L Mg2+ 2 µL, 25 mmol/L dNTPs 0.2 µL, 上下游引物各0.5 µL, 50×SYBR Mix 0.5 µL, Taq酶0.3 µL, 模板1.2 µL, ddH2O补齐至25 µL; PCR反应程序: 95 ℃预变性2 min; 95 ℃变性10 s, 60 ℃退火30 s, 70 ℃延伸45 s, 40个循环; 熔解温度70 ℃-95 ℃.
1.2.5 MTT法检测重组质粒pBudCE4.1-CYP 3A4-GST A1转染前后肝细胞系的增殖: 将生长状态良好, 处于对数生长期的细胞, 按照每100 μL 6 000个细胞接种至96孔板中, 每个检测时间点的C3A-空白和C3A-未优势化细胞分别接种3个孔, 空白孔各加入100 μL PBS. 分别于细胞贴壁24、48、72、96 h后进行MTT实验. 在570 nm测定吸光度(A)值, 根据数值绘制细胞增殖曲线.
1.2.6 生化指标的检测: 细胞培养上清液中前白蛋白、胆碱酯酶、甲胎蛋白、葡萄糖、肌酐的测定: 用5 mL培养瓶, 每瓶各加入不同株细胞约5×105个, 加入含100 mL/L FBS的MEM培养液5 mL, 每日更换培养液, 约72 h待细胞长成单层后, 取培养液在OLYMPUS AU5400全自动生化仪器上检测细胞培养上清液中前白蛋白、胆碱酯酶、葡萄糖及肌酐; 用免疫比浊法检测甲胎蛋白.
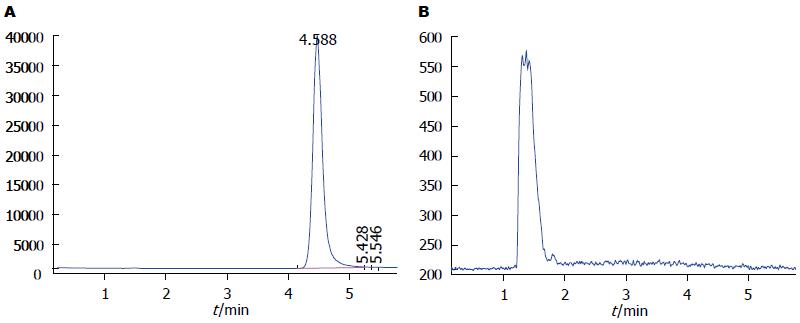
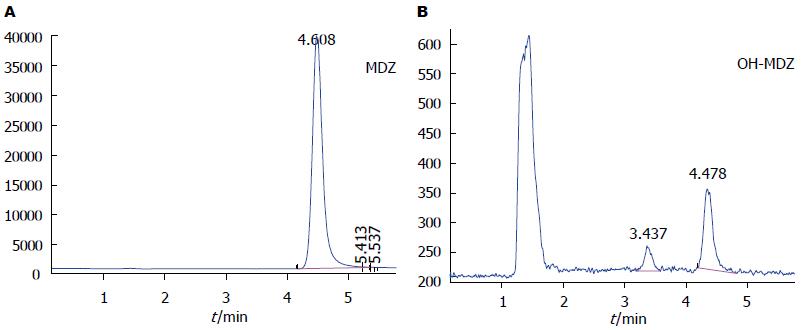
1.2.7 细胞色素P450 3A4活性的测定: (1)液相条件: 色谱柱为Capcell PAK C18 90303 column (2.0×100 mm ID, 5 µm, Shiseido, Japan); 流动相为70:30的水(含0.1%甲酸、5 mmol/L甲酸铵), 乙腈(含0.1%甲酸), 流速为0.2 mL/min; (2)质谱条件: 以ESI源正离子检测方式: 毛细管温度350 ℃, 碰撞能量150, 毛细管电压+4 000 V; 咪达唑仑(MDZ)m/z 326(M+1)、羟-咪达唑仑(OH-MDZ) m/z 342(M+1)、内标普萘洛尔(PRO)m/z 260(M+1); (3)按照每孔约5×105个细胞将C3A-空白和C3A-未优势化细胞接种于6孔板中, 每种细胞3个孔, 每孔加入含100 mL/L FBS的MEM培养液2 mL, 置37 ℃, 50 mL/L CO2, 饱和湿度的培养箱中过夜培养. 取出6孔板, 用无血清的MEM培养液清洗细胞2次; 用无血清的MEM培养液配置咪达唑仑(药物初始浓度1 g/L), 终浓度为1 mg/L, 室温孵育数分钟. 将配置好的含有咪达唑仑的培养液加入6孔板中, 每孔2 mL, 置37 ℃、50 mL/L CO2, 饱和湿度的培养箱中培养1 h. 取出6孔板, 从每孔中取出100 μL培养液于干净的微离心管中, 加入300 μL含PRO 100 μg/L的终止液终止反应; (4)随行标准曲线及质控样品制备: 取1 g/L MDZ母液用细胞培养液缓冲液稀释成10、20、50、200、500、1 000 μg/L标准曲线工作液. 加入3倍标准溶液体积的含PRO 100 μg/L的终止液混合, 涡旋涡旋2 min, 混匀后14 000 r/min离心10 min, 取上清10 μL进样至LC-MS检测.
1.2.8 C3A-空白及C3A-未优化细胞系代谢功能的检测(利多卡因转化试验): 按照每孔约5×104个细胞将C3A-空白和C3A-未优势化细胞接种于24孔板中, 每组细胞12个孔, 每孔中加入含100 mL/L FBS的MEM培养液和含浓度为400 μg/L Zeocin, 100 mL/L FBS的MEM培养液1 mL, 置37 ℃、50 mL/L CO2, 饱和湿度的培养箱中过夜培养. 将浓度为20 g/L的盐酸利多卡因溶液分别用含100 mL/L FBS的MEM培养液和含浓度为400 μg/L Zeocin, 100 mL/L FBS的MEM培养液稀释至浓度为80 mg/L. 弃去24孔板中培养液, 将配置好的浓度为80 mg/L利多卡因溶液分别加入24孔板中的相应细胞中, 每孔约1 mL, 按照2、8、12、24 h留取培养液标本, 每次留取约500 μL, 4 ℃保存. 留取的培养液标本送公安部物证鉴定中心用微流控毒物快速检测仪测定利多卡因浓度.
用浓度为150-600 mg/L的Zeocin对C3A细胞进行敏感度试验, 结果确定最佳筛选剂量为400 mg/L, 加入该浓度抗生素筛选2 wk后, 细胞几乎全部死亡, 存活的个别细胞形态也发生了极大的变异, 符合Zeocin说明书中描述(图1).
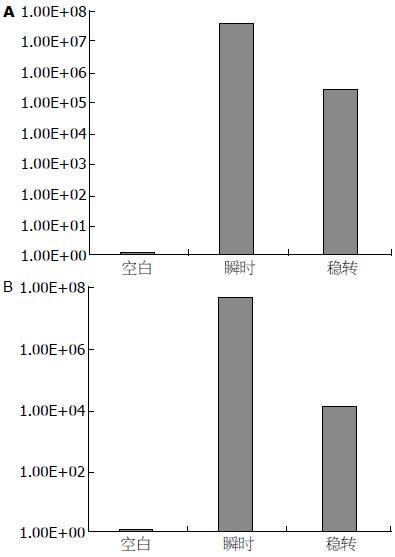
2.2.1 CYP 3A4的表达: CYP 3A4在C3A-未优势化瞬时转染细胞中的表达量是在C3A-空白细胞中的45467531.15倍, 在C3A-未优势化稳转细胞中的表达量是在C3A-空白细胞中的256452.7175倍(图2A).
2.2.2 GST A1的表达: GST A1在C3A-未优势化瞬时转染细胞中的表达量是在C3A-空白细胞中的47893725.72倍, 在C3A-未优势化稳转细胞中的表达量是在C3A-空白细胞中的13493.71523倍(图2B).
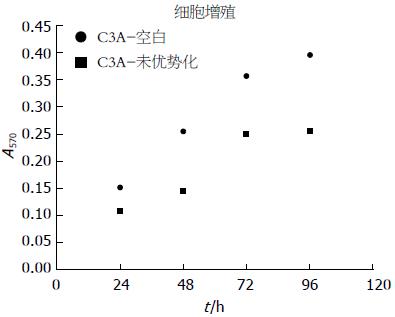
转染重组质粒pBudCE4.1-CYP 3A4-GST A1的细胞系C3A-未优势化生长速率低于未转染质粒的C3A-空白细胞系, 提示CYP 3A4和/或GST A1的表达量增加可能会导致细胞生长受到抑制(图3).
2.4.1 前白蛋白、胆碱酯酶、甲胎蛋白、葡萄糖、肌酐的检测: 在C3A细胞转染重组质粒前后前白蛋白、胆碱酯酶、葡萄糖的检测结果比较无统计学差异, 而甲胎蛋白的检测结果比较存在统计学差异, C3A-未优势化细胞培养液中的AFP明显高于C3A-空白细胞(表1).
| 检测指标 | C3A-空白 | C3A-未优势化 |
| 白蛋白(g/L) | 1.67±0.58 | 1.33±0.58 |
| 前白蛋白(mg/L) | 3.33±0.58 | 3 |
| 胆碱酯酶(U/L) | 20.67±18.77 | 21.67±31.5 |
| 甲胎蛋白(μg/L) | 114.33±2.08 | 398.67±10.69b |
| 葡萄糖(mmol/L) | 2.1±0.1 | 1.52±0.39 |
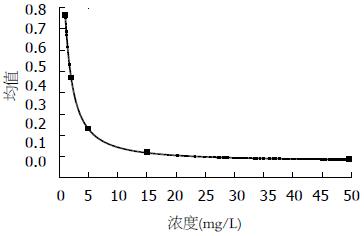
2.4.2 细胞培养上清液中人白蛋白的ELISA检测: 根据标准曲线测得待测标本的ALB含量(mg/L, 图4); ELISA法检测C3A细胞在转染重组质粒前后细胞培养上清液中人白蛋白的含量变化, 分别为1.166±0.123、1.119±0.086, 二者无统计学差异.
3A4活性的测定 色谱法测定结果提示, C3A-空白细胞株加入MDZ孵育1 h后无羟化MDZ的形成, 而C3A-未优势化细胞株加入MDZ孵育1 h后有2种羟化MDZ的形成, 说明C3A-未优势化细胞系的细胞色素P450 3A4存在活性, 而C3A-空白细胞系的细胞色素P450 3A4活性较低, 检测不出(图5, 6).
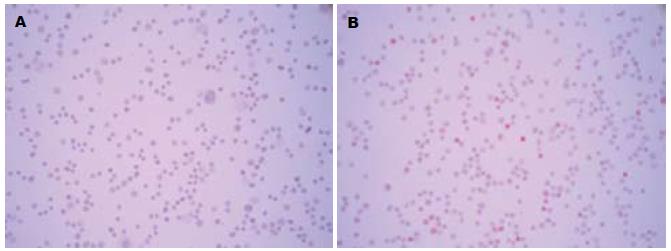
GST A1在C3A-未优势化细胞系中表达较好, 而在C3A-空白肝细胞系表达量较低, 检测不到(图7).
肝脏是人体重要的合成、解毒和代谢器官. 在严重肝脏疾病时, 由于在肝脏表达的药物代谢酶含量及活性均受到影响, 因此肝脏的药物代谢能力下降, 从而使得药效降低, 而不良反应增加, 影响药物疗效, 并且会进一步损伤肝脏. 对于此类患者, 在内科治疗效果不佳的情况下, 人工肝不失为一种良好的治疗方法. 人工肝中的生物型和混合型生物人工肝由于引入肝细胞, 在一定程度上能够替代肝脏的合成、解毒和代谢功能因而受到广泛关注. 最理想的生物人工肝反应器中的细胞材料应该具备成熟肝细胞的所有生物合成、代谢解毒功能[1,2], 但迄今为止尚未出现一种肝细胞能够完全满足生物人工肝的需要. 现用于临床研究的从HepG2细胞系中获得的C3A细胞系, 被证实有一定的疗效[3,4]. 严重肝脏疾病患者体内有大量毒性产物蓄积, 这些毒性产物在被生物人工肝解除的同时, 亦会对反应器中的肝细胞产生毒性作用. 本研究构建了表达Ⅰ相药物代谢酶CYP 3A4和Ⅱ相药物代谢酶GST-A1的C3A细胞系, 以期提高其对药物的代谢能力, 并减轻毒性产物对肝细胞的毒性损伤作用.
细胞色素P450酶(CYP450)是药物代谢涉及的主要酶, 因其CO结合物在450 nm处的光谱吸收峰而命名, 存在于许多组织和器官中, 但是含量在肝脏中最为丰富, 因此与肝脏疾病关系密切[5]. CYP450能够催化大量内源性和外源性复合物的代谢, 包括: 异生物质、药物、环境毒物、类固醇和脂肪酸等, 其能够减轻药物毒性, 使得通常的用药剂量能够被多数人以合理的速率清除[6]. 真核细胞CYP450通常由480-560个氨基酸组成, 绝大多数嵌入内质网或线粒体膜中, 分别被称为微粒体型CYP450和线粒体型CYP450[5]. 在57个人类CYP450中, 5个参与了95%的药物代谢反应[7], 即: CYP 3A4、2C9、2C19、2D6和1A2. 其中, CYP3A4是人类最重要、在肝脏中含量最丰富的药物代谢CYP450, 占总肝脏CYP450的60%, 能够代谢120多种不同种类的药物, 不同程度地参与60%的临床用药代谢[5,8]. 肝脏疾病患者CYP 3A4蛋白的活性和表达均有不同程度的减少[9-14].
GST由200-240个氨基酸组成, 其3级结构为一种球状的二聚体蛋白, 以同源或异源二聚体状态存在的GST具有催化活性[15], 被分为Alpha(GSTA)、Kappa(GSTK)、Mu(GSTM)、Pi(GSTP)、Sigma(GSTS)、Theta(GSTT)、Zeta(GSTZ)和Omega(GSTO)等8个家族[16,17]. GST是细胞防御多种内源性和环境产生的毒性化合物的一部分, 保护大分子免受活性亲电子物质的攻击[18]. GST的通常反应是将谷胱甘肽(GSH)加至具有各种化学结构的亲电子物质上, 促进其在细胞内降解清除和/或分泌至细胞外. 重要的底物包括由Ⅰ相CYP450催化衍生出的多环芳香族碳氢环氧化物, 多种氧化反应的副产物、工业污染物和化学药品、化疗药物、卤代溶剂等[19]. 此外, GST亦可作为转运蛋白转运亲脂化合物, 如: 胆红素、胆酸、类固醇激素和不同的外源性化合物, 并参与类固醇激素的合成[20]. 通过酶促和非酶促反应, 解除化学诱变剂、促癌剂以及脂质和DNA氢过氧化物的毒性, 保护正常细胞免受致癌和促癌因素的影响, 在抗诱变和抗肿瘤中起重要作用[21,22]. 其中GSTA的活性和含量在人肝脏中占优势, 在肝细胞损伤时被快速大量释放入血, 包括2个由单独基因编码的免疫学不同的亚单位, GSTA1和GSTA2, 从人类肝脏中纯化出同源二聚体GSTA1-1、GSTA2-2和异源二聚体GSTA1-2. 某些GST同功酶含有非硒依赖性谷胱甘肽过氧化酶(GPx)的活性, 能清除脂类自由基, 有抗脂质过氧化的作用, GPx活性主要由GST-α展现, GSTA1-1是GST-α家族中的主要成员, 对于脂质过氧化物有较高的GPx活性.
本研究用构建好的重组质粒pBudCE4.1-CYP 3A4-GST A1转染C3A细胞系. 用MTT法检测构建成功的转染未经优势化的重组质粒pBudCE4.1-CYP 3A4-GST A1的C3A-未优势化细胞系与作为对照的未转染质粒的C3A-空白的肝细胞增殖情况, 发现C3A-未优势化细胞系生长较C3A-空白缓慢, 从而得出结论CYP 3A4和GST A1的表达量增加会导致细胞生长受到抑制. 其原因可能为: 加入的筛选抗生素Zeocin细胞毒性较大, GST在对抗其细胞毒性的过程中, 需消耗GSH, 而GSH合成中的重要原料为谷氨酰胺, 是细胞培养液中的重要营养物质, 由于谷氨酰胺的含量明显减少, 从而使得细胞的生长受到抑制. 虽然C3A-未优势化细胞系的生长速度较C3A-空白缓慢, 但通过qRT-PCR、CYP 3A4的活性测定, GST A1的免疫组织化学以及利多卡因转化试验等研究结果表明, C3A-未优势化细胞系的CYP 3A4和GST A1的含量和活性均有所增加, 功能亦有所改善, 有望成为生物人工肝系统的细胞材料.
生物型和混合型生物人工肝由于引入肝细胞, 在一定程度上能够替代肝脏的合成、解毒和代谢功能, 而受到广泛关注. 但迄今为止尚未出现一种肝细胞能够完全满足生物人工肝的需要.
唐世刚, 教授, 湖南省人民医院
最理想的生物人工肝反应器中的细胞材料应该具备成熟肝细胞的所有生物合成、代谢解毒功能, 但迄今为止尚未出现一种肝细胞能够完全满足生物人工肝的需要.
构建好的C3A-未优势化细胞系表达CYP 3A4和GST A1的含量和活性均有所增加, 功能亦有所改善, 有望成为生物人工肝系统的细胞材料.
该研究设计合理, 实验技术成熟, 实验结果可信, 对生物人工肝系统的临床应用提供了较好的参考价值.
编辑: 张姗姗 电编:闫晋利
| 1. | Chamuleau RA, Deurholt T, Hoekstra R. Which are the right cells to be used in a bioartificial liver? Metab Brain Dis. 2005;20:327-335. [PubMed] [DOI] |
| 2. | Hoque ME, Mao HQ, Ramakrishna S. Hybrid braided 3-D scaffold for bioartificial liver assist devices. J Biomater Sci Polym Ed. 2007;18:45-58. [PubMed] [DOI] |
| 3. | Shi Q, Gaylor JD, Cousins R, Plevris J, Hayes PC, Grant MH. The effects of serum from patients with acute liver failure on the growth and metabolism of Hep G2 cells. Artif Organs. 1998;22:1023-1030. [PubMed] [DOI] |
| 4. | 刘 鸿凌, 辛 绍杰, 貌 盼勇. 生物人工肝支持系统中细胞材料的选择. 中国组织工程研究与临床康复. 2007;11:9561-9564. |
| 5. | Nelson DR, Koymans L, Kamataki T, Stegeman JJ, Feyereisen R, Waxman DJ, Waterman MR, Gotoh O, Coon MJ, Estabrook RW. P450 superfamily: update on new sequences, gene mapping, accession numbers and nomenclature. Pharmacogenetics. 1996;6:1-42. [PubMed] [DOI] |
| 6. | Lee HS, Yang M. Applications of CYP-450 expression for biomonitoring in environmental health. Environ Health Prev Med. 2008;13:84-93. [PubMed] [DOI] |
| 7. | Bertz RJ, Granneman GR. Use of in vitro and in vivo data to estimate the likelihood of metabolic pharmacokinetic interactions. Clin Pharmacokinet. 1997;32:210-258. [PubMed] [DOI] |
| 8. | McKinnon RA, Burgess WM, Hall PM, Roberts-Thomson SJ, Gonzalez FJ, McManus ME. Characterisation of CYP3A gene subfamily expression in human gastrointestinal tissues. Gut. 1995;36:259-267. [PubMed] [DOI] |
| 9. | Yang LQ, Li SJ, Cao YF, Man XB, Yu WF, Wang HY, Wu MC. Different alterations of cytochrome P450 3A4 isoform and its gene expression in livers of patients with chronic liver diseases. World J Gastroenterol. 2003;9:359-363. [PubMed] |
| 10. | Lown K, Kolars J, Turgeon K, Merion R, Wrighton SA, Watkins PB. The erythromycin breath test selectively measures P450IIIA in patients with severe liver disease. Clin Pharmacol Ther. 1992;51:229-238. [PubMed] [DOI] |
| 11. | Huet PM, Villeneuve JP. Determinants of drug disposition in patients with cirrhosis. Hepatology. 1983;3:913-918. [PubMed] [DOI] |
| 12. | Kleinbloesem CH, van Harten J, Wilson JP, Danhof M, van Brummelen P, Breimer DD. Nifedipine: kinetics and hemodynamic effects in patients with liver cirrhosis after intravenous and oral administration. Clin Pharmacol Ther. 1986;40:21-28. [PubMed] [DOI] |
| 13. | Chalasani N, Gorski JC, Patel NH, Hall SD, Galinsky RE. Hepatic and intestinal cytochrome P450 3A activity in cirrhosis: effects of transjugular intrahepatic portosystemic shunts. Hepatology. 2001;34:1103-1108. [PubMed] [DOI] |
| 14. | Horiike N, Abe M, Kumagi T, Hiasa Y, Akbar SM, Michitaka K, Onji M. The quantification of cytochrome P-450 (CYP 3A4) mRNA in the blood of patients with viral liver diseases. Clin Biochem. 2005;38:531-534. [PubMed] [DOI] |
| 15. | Mannervik B, Danielson UH. Glutathione transferases--structure and catalytic activity. CRC Crit Rev Biochem. 1988;23:283-337. [PubMed] [DOI] |
| 16. | Hayes JD, McLellan LI. Glutathione and glutathione-dependent enzymes represent a co-ordinately regulated defence against oxidative stress. Free Radic Res. 1999;31:273-300. [PubMed] [DOI] |
| 17. | Blackburn AC, Tzeng HF, Anders MW, Board PG. Discovery of a functional polymorphism in human glutathione transferase zeta by expressed sequence tag database analysis. Pharmacogenetics. 2000;10:49-57. [PubMed] [DOI] |
| 18. | Strange RC, Spiteri MA, Ramachandran S, Fryer AA. Glutathione-S-transferase family of enzymes. Mutat Res. 2001;482:21-26. [PubMed] [DOI] |
| 19. | Hayes JD, Pulford DJ. The glutathione S-transferase supergene family: regulation of GST and the contribution of the isoenzymes to cancer chemoprotection and drug resistance. Crit Rev Biochem Mol Biol. 1995;30:445-600. [PubMed] [DOI] |
| 20. | Johansson AS, Mannervik B. Human glutathione transferase A3-3, a highly efficient catalyst of double-bond isomerization in the biosynthetic pathway of steroid hormones. J Biol Chem. 2001;276:33061-33065. [PubMed] [DOI] |