修回日期: 2012-01-10
接受日期: 2012-03-15
在线出版日期: 2012-04-08
目的: 探讨炎症反应在扑热息痛(acetaminophen, AAP)肝损害中的作用.
方法: 应用AAP建立SD大鼠肝损害模型; 分别于给药后3、6、12、24 h处死大鼠, AAP组和对照组分别测定ALT水平, HE染色观察肝脏病理变化, 放射免役分析法测定血清TNF-α水平, 免疫组织化学和Western blot方法检测肝组织中TNF-α、iNOS蛋白的表达.
结果: AAP组和对照组相比: 血清ALT(nKat/L)进行性升高(3、6、12、24 h的值分别为: 1166.90±151.03 vs 586.78±89.35, 2153.84±254.55 vs 573.45±75.18, 4220.84±928.52 vs 750.15±81.68, 13202.64±1392.78 vs 780.16±161.37, 均P<0.01); 肝脏病理损伤进行性加剧, 24 h达高峰; 给药后24 h血清TNF-α(µg/L)水平显著升高(5.69±0.46 vs 2.64±0.27, P<0.01), 且与血清ALT水平呈显著的正相关(r = 0.773, P<0.01); 免疫组织化学方法测定肝组织TNF-α、iNOS表达明显增强, 分别于6、12 h达高峰; Western blot方法检测肝组织TNF-α、iNOS蛋白的表达显著高于对照组(P<0.01), 分别于3、6 h达高峰, 24 h时仍高于正常水平.
结论: 炎症反应在AAP肝损伤发生、发展的过程中发挥着关键的作用.
引文著录: 田丰, 解莹, 张亚杰. 肿瘤坏死因子-α、诱导性一氧化氮合酶在扑热息痛肝损害中的表达. 世界华人消化杂志 2012; 20(10): 818-823
Revised: January 10, 2012
Accepted: March 15, 2012
Published online: April 8, 2012
AIM: To investigate the role of inflammation in the pathogenesis of acetaminophen-induced liver injury.
METHODS: A model of acetaminophen-induced liver injury was developed in SD rats. The rats were killed at 3, 6, 12, and 24 h after acetaminophen injection to take blood samples for measuring serum ALT and tumor necrosis factor-α (TNF-α) levels and hepatic tissue samples for evaluating pathological changes by HE staining and detecting the expression of TNF-α and inducible nitric oxide synthase (iNOS) by immunohistochemistry and Western blot.
RESULTS: Compared to control rats, serum ALT (nKat/L) progressively increased (3 h: 1166.90 ± 151.03 vs 586.78 ± 89.35; 6 h: 2153.84 ± 254.55 vs 573.45 ± 75.18; 12 h: 4220.84 ± 928.52 vs 750.15 ± 81.68; 24 h: 13202.64 ± 1392.78 vs 780.16 ± 161.37; all P < 0.01); liver pathological damage was progressively exacerbated and peaked at 24 h; serum TNF-α (µg/L) significantly increased at 24 h after administration (5.69 ± 0.46 vs 2.64 ± 0.27, P < 0.01) and showed a significant positive correlation with serum ALT levels (r = 0.773, P < 0.01); the expression of TNF-α and iNOS in the liver was significantly increased in rats treated with acetaminophen.
CONCLUSION: Inflammation plays a key role in the development of acetaminophen-induced liver injury.
- Citation: Tian F, Xie Y, Zhang YJ. Expression of tumor necrosis factor-α and inducible nitric oxide synthase in acetaminophen-induced liver injury. Shijie Huaren Xiaohua Zazhi 2012; 20(10): 818-823
- URL: https://www.wjgnet.com/1009-3079/full/v20/i10/818.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i10.818
扑热息痛(acetaminophen, AAP)是应用最广泛的解热镇痛药物. 他引起的肝损害是非常普遍的. 在美国, 因为药物引起爆发性肝衰竭而需要肝移植的患者中, AAP是首位原因[1]. 因此, 对于AAP肝损害发病机制的研究有着极为重要的意义. 近年来, 炎症反应在AAP肝损害中的作用引起人们的重视. 本实验应用AAP建立SD大鼠肝损害模型, 用免疫组织化学和Western blot方法检测大鼠肝组织中肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、诱导性一氧化氮合酶(inducible nitric oxide synthase, iNOS)蛋白的表达, 以探讨炎症反应在AAP肝损害中的作用.
5-6周龄的♀SD大鼠, 体质量180-240 g, 购自中国医科大学动物实验中心, 大鼠实验前于本院动物实验中心饲养1 wk, 昼夜交替12 h, 在室温及稳定湿度条件下, 用平衡饲料喂养. AAP购自Sigma公司; TNF-α放射免疫分析试剂盒购自北京福瑞生物工程公司; SABC免疫组织化学试剂盒、兔抗大鼠TNF-α单克隆抗体、兔抗大鼠iNOS单克隆抗体、山羊抗兔IgG均购自武汉博士德生物工程有限公司; 考马斯亮蓝蛋白定量试剂盒购自南京建成生物工程公司; 自动生物化学分析仪(日本岛津公司); 普通光学显微镜(日本Olympus公司); FT-613自动放免测量仪(北京核仪器厂); 低温高速离心机(HERMLE Z-383K, 德国); 电泳仪(Bio-RAD, 美国); 凝胶成像分析系统(Kodak 1D, 美国).
1.2.1 分组和处理: 40只♀SD大鼠随机分为正常对照组和AAP组, 每组20只. 试验前1夜禁食水, 2 d上午给药. AAP溶于37 ℃ PBS液(pH 7.4)中(100 g/L), AAP组给予AAP(1 g/kg)腹腔注射[2], 正常对照组给予等量PBS液腹腔注射, 给药后自由进食水. 于给药后3、6、12、24 h(每时点各组分别有5只大鼠)用10%水合氯醛(5 mL/kg)腹腔注射麻醉, 心脏穿刺取血, 分离血清, -20 ℃保存; 后用锋利的手术刀于肝脏中叶取1块肝组织, 置于40 g/L甲醛中固定, 后立即取下余下肝组织, 置于液氮中, -80 ℃保存.
1.2.2 ALT测定: 用自动生物化学分析仪进行.
1.2.3 病理检测: 取肝中叶组织一块, 用40 g/L甲醛溶液固定, 石蜡包埋, 5 μm厚切片, 常规HE染色, 光镜下观察其病理改变.
1.2.4 血清TNF-α水平测定: 采用放射免疫分析法进行.
1.2.5 免疫组织化学检测: 肝组织切片常规脱腊入水; 3%H2O2溶液浸泡20 min以灭活内源性过氧化物酶; 蒸馏水洗3次; 40%火力微波修复抗原10 min; 冷却后PBS液冲洗; 滴加一抗(兔抗大鼠iNOS、TNF-α 1:160稀释), 37 ℃ 2 h; PBS液冲洗; 滴加生物素化山羊抗兔IgG, 37 ℃ 20 min; PBS液冲洗; 加配制的DAB溶液, 显色后封片; PBS代替一抗作阴性对照. 以细胞浆中有棕黄色颗粒的细胞为阳性细胞. 每张切片随机选择10个高倍镜视野(400×)进行观察. 应用显微(荧光)图像分析系统对选取视野内免疫组织化学阳性信号进行光强度及面积分析, 计算灰度积分值. (灰度积分值与染色面积和强度成反比, 表达越强灰度积分值越低).
1.2.6 Western blot检测: 取-80 ℃肝组织约200 mg, 加入4 ℃预冷的细胞质蛋白提取液1.0 mL, 匀浆机匀浆. 13 000 r/min离心30 min, 收集上清; 考马斯亮蓝法进行蛋白定量; 配制聚丙烯酰胺凝胶, 样本置于沸水浴中5 min使蛋白变性, 每孔加样20 μL, 聚丙烯酰胺凝胶电泳, 积层胶电压80 V, 分离胶电压120 V, 持续3 h; 采用湿式转膜仪, 条件为4 ℃ 100 V电压转膜2 h, 将蛋白转至硝酸纤维素膜上; 脱脂奶粉封闭2 h; TTBS冲洗3次, 加一抗(兔抗大鼠iNOS、TNF-α, 1:200稀释)4 ℃孵育过夜; TTBS冲洗3次, 每次5 min, 加入稀释的辣根过氧化酶标记的山羊抗兔IgG孵育1 h; TTBS冲洗3次, 每次10 min, 显色2-5 min, 待蛋白条带显示清晰时, 中止反应; 凝胶成像分析系统分析胶片上的Western blot信号条带的吸光度(A)值.
统计学处理 数据用mean±SD表示, 各组间均数比较用t检验, 用SPSS11.0统计软件进行分析.
各时间点AAP组血清ALT(nKat/L)水平较对照组均显著升高(给药后3、6、12、24 h分别为: 1166.90±151.03 vs 586.78±89.35, 2153.84±254.55 vs 573.45±75.18, 4220.84±928.52 vs 750.15±81.68, 13202.64±1392.78 vs 780.16±161.37, P<0.01), 且随时间进行性升高, 24 h达高峰.
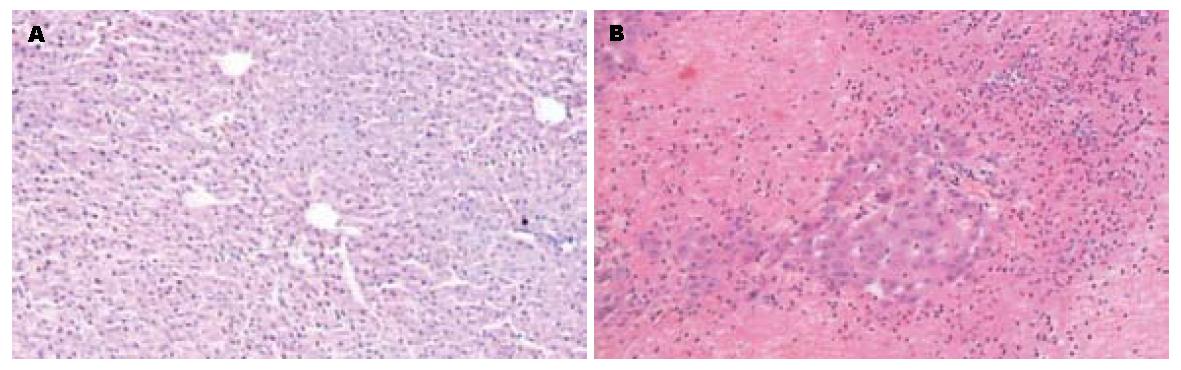
AAP组肝脏明显肿大、充血, 镜下: 轻者表现为肝细胞点状坏死、重者表现为小叶中心肝细胞广泛的炎性细胞浸润、出血、带状坏死, 且随时间进行性加重, 24 h达高峰, 对照组未见异常(图1).
给药后24 h, AAP组血清TNF-α(μg/L)水平显著高于对照组(5.69±0.46 vs 2.64±0.27, P<0.01)且与血清ALT水平呈显著的正相关(r = 0.773, P<0.01), 余时间点2组间无显著性差异.
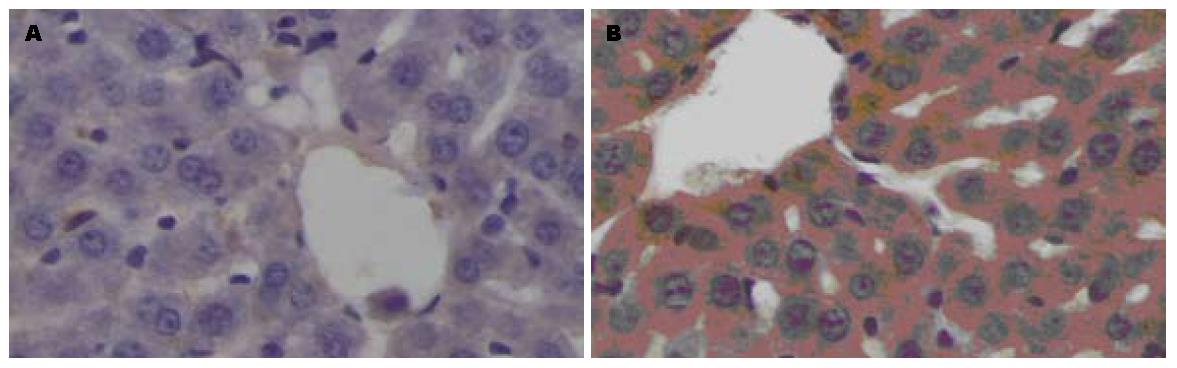
2.4.1 TNF-α表达: 对照组仅有中央静脉周围少量肝细胞表达, 且着色较浅、范围小; AAP组表达部位主要在中央静脉周围和汇管区周围的大量肝细胞和少量肝窦内皮细胞、库普弗细胞, 着色深, 范围广, 给药后6 h达高峰(表1, 图2).
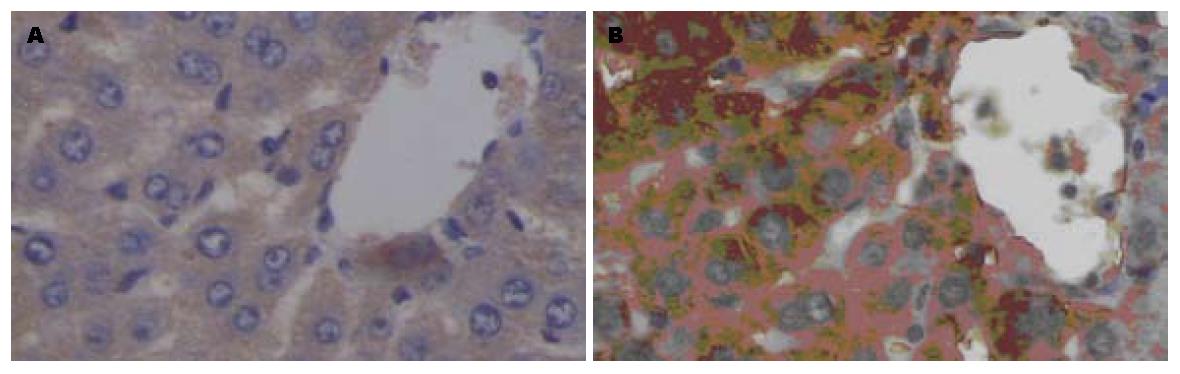
2.4.2 iNOS表达: 对照组仅有中央静脉周围少量肝细胞表达, 且着色较浅、范围小; AAP组表达部位主要在中央静脉周围的大量肝细胞和少量肝窦内皮细胞、库普弗细胞, 着色深, 范围广, 给药后12 h达高峰(表2, 图3).
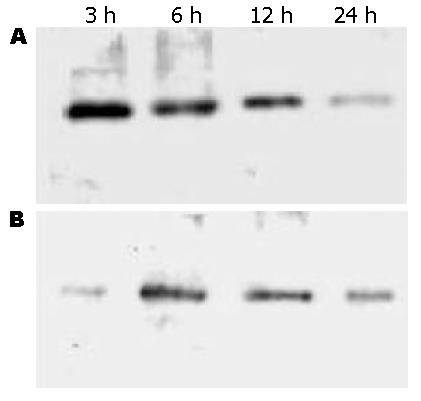
AAP组肝组织TNF-α、iNOS蛋白表达均显著高于对照组(P<0.01), 分别于3 h和6 h达高峰, 24 h时仍高于正常水平(图4).
近来, 炎症反应在AAP肝损害中的作用引起人们的重视. AAP引起的损伤可以激活肝库普弗细胞和内皮细胞, 使促炎因子级联样释放, 进一步激活上述细胞, 使炎症反应持续和放大, 最终导致氧化应激和过氧化亚硝酸盐形成, 对肝损伤起了重要的放大和促进作用[3-5].
TNF-α是主要由激活的肝库普弗细胞释放的重要促炎因子[6-8], 他的产生被认为是肝脏炎症反应中最早出现的表现之一. TNF-α导致其他促炎因子级联样的释放, 引起各种炎症细胞的浸润和激活[9,10]. 他还可以直接引起细胞毒性, 而导致细胞的坏死和凋亡[11,12]. 国外文献报道: 在AAP肝损害动物模型中, 肝组织TNF-α表达明显增加, 给予TNF-α中和抗体可以明显减轻AAP肝损害[13]; 在敲除TNF-α基因的小鼠, 四氯化碳、乙醇、二甲基亚硝基胺等引起的肝损害明显减轻[14]; 应用硫酸葡聚糖或氯化钆抑制肝库普弗细胞功能也可以减轻AAP肝损害[15]. 以上说明TNF-α是导致肝损害的一个主要促炎因子. 但TNF-α在AAP肝损害中的作用也存在争议. Simpson等[16]报道: 应用TNF-α抗体并不能减轻AAP肝损害; Boess等[17]报道: TNF-α和淋巴细胞毒素双基因敲除鼠和野生型鼠相比, AAP引起的肝损害无差别; Gardner等[18]报道: 敲除TNF-α基因的小鼠, AAP肝损害反而加重, 表现为ALT升高更明显, 小叶中心坏死出现更早, 范围更广, 促炎因子表达更快, 抑炎因子和促进创伤修复因子表达延迟, 这似乎提示TNF-α有保肝作用.
由肝脏中的各种细胞产生的NO起着细胞保护和细胞毒性的双重作用[19,20]. 在正常情况下, 由内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)合成的少量NO起着维持细胞内环境稳定的细胞保护作用[21], 而在各种肝损害因素作用下, 由促炎因子诱导产生的iNOS使肝细胞、内皮细胞、库普弗细胞、巨噬细胞等产生大量的NO, 起着细胞毒性作用[22-24]. AAP引起肝脏损伤, 诱导肝细胞、内皮细胞、库普弗细胞、巨噬细胞等大量表达iNOS, 进而导致NO过量合成, NO与超氧自由基反应, 产生活性更强的氧化剂: 过氧化亚硝酸盐, 通过脂质过氧化、抑制P450蛋白活性、抑制DNA合成、诱导细胞凋亡、改变酶的活性、抑制细胞增生、直接的细胞毒性作用等造成肝损害. Gardner等[25]证实: 过量的AAP可使小鼠和大鼠肝组织iNOS表达明显增加, 同时伴随着肝损害的进行性加重; 应用选择性iNOS抑制剂可使小鼠AAP肝损害明显减轻; 敲除iNOS基因的小鼠和野生型小鼠相比AAP肝损害明显减轻. 以上说明iNOS和NO在AAP肝损害中发挥着关键的作用. 同时我们也看到无论是应用iNOS抑制剂还是敲除iNOS基因都不能完全消除AAP引起的肝损害, 甚至产生完全相反的结果[26,27]. 原因考虑如下: (1)各组实验所用的实验动物种群不同; (2)除了iNOS以外还有其他因素促进NO的合成; (3)炎症反应是一个复杂的网络系统, 当iNOS表达减少时, 其他促炎因子如TNF-α等可能代偿性表达增多.
我们的实验结果显示: AAP组TNF-α、iNOS表达显著高于对照组, 主要表达在肝细胞, 其次为内皮细胞和库普弗细胞; 给药后24 h, AAP组血清TNF-α水平显著高于对照组, 且与血清ALT水平呈显著的正相关. 上述结果说明TNF-α、iNOS过量表达在AAP肝损害中发挥着关键作用, 是导致肝损害的关键促炎因子. 同时我们发现: 无论是免疫组织化学还是Western blot方法都提示TNF-α表达早于iNOS(免疫组织化学方法TNF-α、iNOS的表达分别于6、12 h达高峰, Western blot方法二者分别于3、6 h达高峰), 从而推测TNF-α可有力的诱导iNOS表达, 与国外报道相近[28].
既往我们已经报道[29,30]: 在AAP引起的肝损害中, 中性粒细胞趋化因子-1(cytokine-induced neutrophil chemoattractant-1, CINC-1)和细胞间黏附分子-1(intercellular adhesion molecular-1, ICAM-1)mRNA表达显著增加, 结合本实验结果, 说明TNF-α、iNOS、CINC-1、ICAM-1等促炎因子级联样释放, 在AAP肝损伤发生、发展的过程中发挥着关键的作用.
药物性肝病是引起爆发性肝衰竭的主要原因. 扑热息痛(AAP)是目前世界上广泛使用的解热镇痛药, 过量使用将导致严重的肝损害. 氧化应激和过氧化亚硝酸盐形成等对肝损伤起了重要的放大和促进作用.
朴云峰, 教授, 吉林大学第一临床医院消化科
近年来, 炎症反应在扑热息痛肝损害中的作用引起人们重视. TNF-α的产生是肝脏炎症反应最早出现的表现之一, 其可导致iNOS的释放, 引起各种炎症细胞的浸润和激活. 因此研究TNF-α、iNOS的表达将对探讨AAP肝损害的相关机制有重要意义.
Bradham等报道TNF-α导致其他促炎因子如: iNOS的级联样释放, 引起各种炎症细胞的浸润和激活.
本实验建立大鼠AAP肝损害模型, 用血清、病理、免疫组织化学、Western blot方法衡量炎症反应及测定肝组织TNF-α、iNOS表达, 以探讨炎症反应以及TNF-α、iNOS表达在AAP肝损伤发生、发展过程中的作用.
本实验通过多种检测手段证明TNF-α、iNOS介导的炎症反应在AAP肝损害的发生、发展中起到重要促进作用, 丰富了AAP肝损害的机制研究.
该文通过检测TNF-α, iNOS的表达, 进一步阐明扑热息痛致肝损伤的机制与促炎因子级联释放相关. 实验设计合理, 论证充分, 结果可靠.
编辑: 曹丽鸥 电编: 闫晋利
| 1. | Ostapowicz G, Fontana RJ, Schiødt FV, Larson A, Davern TJ, Han SH, McCashland TM, Shakil AO, Hay JE, Hynan L. Results of a prospective study of acute liver failure at 17 tertiary care centers in the United States. Ann Intern Med. 2002;137:947-954. [PubMed] [DOI] |
| 2. | Bauer I, Vollmar B, Jaeschke H, Rensing H, Kraemer T, Larsen R, Bauer M. Transcriptional activation of heme oxygenase-1 and its functional significance in acetaminophen-induced hepatitis and hepatocellular injury in the rat. J Hepatol. 2000;33:395-406. [PubMed] [DOI] |
| 3. | Laskin DL, Pilaro AM. Potential role of activated macrophages in acetaminophen hepatotoxicity. I. Isolation and characterization of activated macrophages from rat liver. Toxicol Appl Pharmacol. 1986;86:204-215. [PubMed] [DOI] |
| 4. | Jaeschke H, Farhood A, Smith CW. Neutrophils contribute to ischemia/reperfusion injury in rat liver in vivo. FASEB J. 1990;4:3355-3359. [PubMed] |
| 5. | Stordeur P, Goldman M. Interleukin-10 as a regulatory cytokine induced by cellular stress: molecular aspects. Int Rev Immunol. 1998;16:501-522. [PubMed] [DOI] |
| 6. | Douni E, Akassoglou K, Alexopoulou L, Georgopoulos S, Haralambous S, Hill S, Kassiotis G, Kontoyiannis D, Pasparakis M, Plows D. Transgenic and knockout analyses of the role of TNF in immune regulation and disease pathogenesis. J Inflamm. 1995;47:27-38. [PubMed] |
| 7. | Faubion WA, Gores GJ. Death receptors in liver biology and pathobiology. Hepatology. 1999;29:1-4. [PubMed] [DOI] |
| 8. | Decker K. Biologically active products of stimulated liver macrophages (Kupffer cells). Eur J Biochem. 1990;192:245-261. [PubMed] [DOI] |
| 9. | Bradham CA, Plümpe J, Manns MP, Brenner DA, Trautwein C. Mechanisms of hepatic toxicity. I. TNF-induced liver injury. Am J Physiol. 1998;275:G387-G392. [PubMed] |
| 10. | Luster MI, Simeonova PP, Gallucci RM, Bruccoleri A, Blazka ME, Yucesoy B. Role of inflammation in chemical-induced hepatotoxicity. Toxicol Lett. 2001;120:317-321. [PubMed] [DOI] |
| 11. | Bohlinger I, Leist M, Gantner F, Angermüller S, Tiegs G, Wendel A. DNA fragmentation in mouse organs during endotoxic shock. Am J Pathol. 1996;149:1381-1393. [PubMed] |
| 12. | Wang JH, Redmond HP, Watson RW, Bouchier-Hayes D. Role of lipopolysaccharide and tumor necrosis factor-alpha in induction of hepatocyte necrosis. Am J Physiol. 1995;269:G297-G304. [PubMed] |
| 13. | Blazka ME, Wilmer JL, Holladay SD, Wilson RE, Luster MI. Role of proinflammatory cytokines in acetaminophen hepatotoxicity. Toxicol Appl Pharmacol. 1995;133:43-52. [PubMed] [DOI] |
| 14. | Kitamura K, Nakamoto Y, Akiyama M, Fujii C, Kondo T, Kobayashi K, Kaneko S, Mukaida N. Pathogenic roles of tumor necrosis factor receptor p55-mediated signals in dimethylnitrosamine-induced murine liver fibrosis. Lab Invest. 2002;82:571-583. [PubMed] [DOI] |
| 15. | Laskin DL, Gardner CR, Price VF, Jollow DJ. Modulation of macrophage functioning abrogates the acute hepatotoxicity of acetaminophen. Hepatology. 1995;21:1045-1050. [PubMed] [DOI] |
| 16. | Simpson KJ, Lukacs NW, McGregor AH, Harrison DJ, Strieter RM, Kunkel SL. Inhibition of tumour necrosis factor alpha does not prevent experimental paracetamol-induced hepatic necrosis. J Pathol. 2000;190:489-494. [PubMed] [DOI] |
| 17. | Boess F, Bopst M, Althaus R, Polsky S, Cohen SD, Eugster HP, Boelsterli UA. Acetaminophen hepatotoxicity in tumor necrosis factor/lymphotoxin-alpha gene knockout mice. Hepatology. 1998;27:1021-1029. [PubMed] [DOI] |
| 18. | Gardner CR, Laskin JD, Dambach DM, Chiu H, Durham SK, Zhou P, Bruno M, Gerecke DR, Gordon MK, Laskin DL. Exaggerated hepatotoxicity of acetaminophen in mice lacking tumor necrosis factor receptor-1. Potential role of inflammatory mediators. Toxicol Appl Pharmacol. 2003;192:119-130. [PubMed] [DOI] |
| 19. | Li J, Billiar TR. Nitric Oxide. IV. Determinants of nitric oxide protection and toxicity in liver. Am J Physiol. 1999;276:G1069-G1073. [PubMed] |
| 20. | Laskin JD, Heck DE, Gardner CR, Laskin DL. Prooxidant and antioxidant functions of nitric oxide in liver toxicity. Antioxid Redox Signal. 2001;3:261-271. [PubMed] [DOI] |
| 21. | Albrecht EW, Stegeman CA, Heeringa P, Henning RH, van Goor H. Protective role of endothelial nitric oxide synthase. J Pathol. 2003;199:8-17. [PubMed] [DOI] |
| 22. | Shibuki H, Katai N, Yodoi J, Uchida K, Yoshimura N. Lipid peroxidation and peroxynitrite in retinal ischemia-reperfusion injury. Invest Ophthalmol Vis Sci. 2000;41:3607-3614. [PubMed] |
| 23. | Lin KT, Xue JY, Wong PY. Mechanisms of peroxynitrite-induced apoptosis in HL-60 cells. Adv Exp Med Biol. 1999;469:569-575. [PubMed] [DOI] |
| 24. | Zhuang S, Simon G. Peroxynitrite-induced apoptosis involves activation of multiple caspases in HL-60 cells. Am J Physiol Cell Physiol. 2000;279:C341-C351. [PubMed] |
| 25. | Gardner CR, Heck DE, Yang CS, Thomas PE, Zhang XJ, DeGeorge GL, Laskin JD, Laskin DL. Role of nitric oxide in acetaminophen-induced hepatotoxicity in the rat. Hepatology. 1998;27:748-754. [PubMed] [DOI] |
| 26. | Michael SL, Mayeux PR, Bucci TJ, Warbritton AR, Irwin LK, Pumford NR, Hinson JA. Acetaminophen-induced hepatotoxicity in mice lacking inducible nitric oxide synthase activity. Nitric Oxide. 2001;5:432-441. [PubMed] [DOI] |
| 27. | Hinson JA, Bucci TJ, Irwin LK, Michael SL, Mayeux PR. Effect of inhibitors of nitric oxide synthase on acetaminophen-induced hepatotoxicity in mice. Nitric Oxide. 2002;6:160-167. [PubMed] [DOI] |
| 28. | Geller DA, Nussler AK, Di Silvio M, Lowenstein CJ, Shapiro RA, Wang SC, Simmons RL, Billiar TR. Cytokines, endotoxin, and glucocorticoids regulate the expression of inducible nitric oxide synthase in hepatocytes. Proc Natl Acad Sci U S A. 1993;90:522-526. [PubMed] [DOI] |