修回日期: 2011-11-12
接受日期: 2011-12-23
在线出版日期: 2012-01-08
目的: 研究补中益气丸对STZ糖尿病大鼠肝脏NO3-、ONOO-、MDA、糖原及肝损害的影响及机制.
方法: 通过2次腹腔注射链脲佐菌素(STZ)制作大鼠糖尿病模型, 第1次腹腔注射STZ 55 mg/kg, 第8天行第2次腹腔注射同等剂量STZ. 每周大鼠尾尖采血测空腹血糖值, 造模成功的SD大鼠随机分为糖尿病组, 常规喂养4 wk; 补中益气丸组给予补中益气丸水溶液, 每只大鼠用量为8 g/kg, 每天1次, 连续28 d. 采用分光光度法测定鼠肝脏ONOO-、MDA、糖原, 通过HE染色病理检查和积分系统估计肝损害程度.
结果: 糖尿病大鼠出现明显的糖尿病症状, 肝病理检测发现肝细胞变小, 肝窦变窄, 肝细胞核变小浅染, 肝小叶结构不清, 肝索结构紊乱, 存在充血和少量炎性细胞浸润, 尤其在肝1区, 肝组织MDA、ONOO-水平显著升高, 肝糖原显著降低. 补中益气丸组大鼠肝细胞、肝细胞核、肝窦、肝索、肝小叶异常及充血和炎症明显改善, 糖尿病症状亦明显改善; 肝组织MDA、ONOO-水平显著降低, 肝糖原显著升高. 相关分析发现, 肝糖原与MDA、ONOO-、肝细胞索结构紊乱、充血、炎症呈显著负相关, 与肝细胞大小、肝细胞核大小、肝血窦大小呈显著正相关; 肝组织MDA、ONOO-水平与肝细胞大小、肝细胞核大小、肝血窦大小呈显著负相关, 与肝细胞索结构紊乱、充血、炎症呈显著正相关.
结论: 补中益气丸可能通过改善STZ糖尿病大鼠肝脏氧化应激, 改善胰岛素信号通路、激活磷酸酶脱磷酸化活性, 进而升高糖原合成酶活性和肝糖原含量, 改善肝氧化代谢和肝的氧化损伤.
引文著录: 刘晓秋, 李元滨, 吴凌. 补中益气丸对早期糖尿病大鼠肝氧化损害及肝糖原作用的机制. 世界华人消化杂志 2012; 20(1): 60-65
Revised: November 12, 2011
Accepted: December 23, 2011
Published online: January 8, 2012
AIM: To evaluate the effect of Buzhong Yiqi Pill on the levels of ONOO-, malondialdehyde (MDA), and glycogen, and oxidative damage in the liver of early diabetic rats.
METHODS: Diabetes was induced by two intraperitoneal injections of streptozocin (STZ, 55 mg/kg): one on day 1 and the other on day 8. Diabetic rats were randomly divided into diabetes group (untreated) and Buzhong Yiqi Pill group (given Buzhong Yiqi Pill 8 g /kg, i.g. for 28 consecutive days). The concentrations of ONOO-, MDA, and glycogen in the liver were determined by colorimetric methods, and hepatic pathology was evaluated by hematoxylin and eosin (HE) staining using a scoring system.
RESULTS: Diabetic rats developed significant diabetes symptoms, and had obviously decreased level of glycogen and increased levels of MDA and ONOO- in hepatic tissue. Treatment with Buzhong Yiqi Pill significantly increased the level of glycogen, decreased the levels of MDA and ONOO-, and improved diabetes symptoms and histological changes in the liver. A negative correlation was found between the level of glycogen and those of MDA/ONOO- and between the level of glycogen and the severity of diabetes symptoms.
CONCLUSION: Buzhong Yiqi Pill decreased the synthesis of free radicals in hepatic tissue possibly by promoting the insulin signaling pathway to activate glycogen synthase, increase hepatic glycogen production and improve liver oxidative metabolism and damage.
- Citation: Liu XQ, Li YB, Wu L. Effect of Buzhong Yiqi Pill on oxidative damage and glycogen synthesis in the liver of early diabetic rats. Shijie Huaren Xiaohua Zazhi 2012; 20(1): 60-65
- URL: https://www.wjgnet.com/1009-3079/full/v20/i1/60.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i1.60
肝病常见于1型糖尿病, 并增加1型糖尿病其他并发症如肾病、眼病、心血管病的发病率[1-6], 非酒精性脂肪肝病与1型糖尿病胰岛素抵抗显著相关[7]. 从急性肝炎到肝癌的所有肝损害, 均涉及肝细胞、枯否氏细胞、星状细胞和内皮细胞的凋亡、坏死、炎症免疫反应、纤化、缺血、基因表达改变和再生, 其中氧化应激和硝化应激是独立于病因的、参与以上过程的关键因素, 他们在肝病的诱导和进展中起关键作用, 参与大量的细胞因子和生长因子激活和转录, 后者又进一步促进氧化应激和硝化应激, 形成恶性循环[8]. 同时氧化应激和硝化应激也与糖尿病的发生发展密切相关[9-12]. 补中益气汤是健脾益气的代表方, 现代药理研究亦显示, 该方剂有抗氧化和保肝作用[13-17]. 因此, 本实验研究补中益气丸对STZ糖尿病大鼠肝脏ONOO-、MDA、糖原及肝损害的影响, 探讨相关的机制.
补中益气丸处方组成: 黄芪、党参、炙甘草、炒白术、当归、升麻、柴胡、陈皮. 由北京同仁堂科技发展股份有限公司制药厂出品, 国药准字: Z11020244, 购于广州中医药大学第一附属医院先烈东路门诊部. 将药丸打成细粉末, 加蒸馏水, 按给药剂量8 g/kg调制成1.6 g/2 mL水溶液. 37℃恒温箱, 数码相机(C170 D425, Olympus imaging corp), 高速冷冻离心机(型号: 3K-302), UV-754紫外可见分光光度计, 722分光光度计.
1.2.1 造模及分组: 参照郭学军等实验模型的方法[18], 选取体质量为170-200 g的SD大鼠30只, 随机抽取10只为正常对照组, 剩余20只用于制作糖尿病病理模型. 造模前先更换笼具, 禁食(不禁水)12 h; 造模组动物腹腔注射新鲜配制1% STZ液, 注射剂量为55 mg/kg, 第8天再行第2次腹腔注射同等剂量1%STZ液, 正常组大鼠相应腹腔注射0.1 mol/L柠檬酸缓冲液, 注射剂量为1 mL/只. 各组大鼠尾尖采血测空腹血糖(FBG), 筛选出FBG<16.7 mmol/L的大鼠行口服葡萄糖耐量实验(OGTT), OGTT异常者与FBG≥16.7 mmol/L一并确定为糖尿病动物模型. 将造模成功的糖尿病大鼠再分为两组: 糖尿病组及补中益气丸组. 糖尿病组常规喂养4 wk, 补中益气丸组给予补中益气丸水溶液, 每只大鼠用量为8 g/kg, 每天1次, 连续4 wk.
1.2.2 动物处理: 造模满4 wk后, 处死正常组、DM组大鼠, 剖腹取肝组织, 用0.9% NaCl溶液洗去附着的血液并用滤纸吸干, 准确称取大鼠肝组织用于指标测定. 补中益气丸治疗组灌服中药结束后, 依前法处置剩余大鼠.
1.2.3 肝脏的病理检查: 造模满4 wk后, 处死各组大鼠, 剖腹取肝组织, 观察肝脏是否有病变, 并用40 g/L甲醛将其固定、脱水、石蜡包埋, HE染色. 肝脏划分为3个区域. 肝1区: 位于汇管区周围, 含氧量较高, 肝3区:位于中央静脉周围, 含氧量低, 肝2区: 位于两者之间, 含氧量一般. 肝脏病理损害的积分: 分别显微镜下观察肝1区、肝2区、肝3区肝细胞大小(由小到大积分0-4)、肝细胞核大小(由小到大积分0-4)、肝血窦大小(由小到大积分0-4)、肝细胞索结构紊乱(由轻到重积分0-4)、充血(由轻到重积分0-4)、炎症(由轻到重积分0-4).
1.2.4 检测指标: 每日观察大鼠饮食、饮水、粪便, 记录饮水量, 每周称体质量及尾尖采血测空腹血糖(FBG). (1)肝组织匀浆和蛋白定量. 准确称取大鼠肝组织0.4 g, 用5 mL匀浆液(5%三氯乙酸)在玻璃匀浆器中制肝匀浆, 将匀浆液置低温高速冷冻离心机, 离心15000 g, 10 min, 上清液用于蛋白定量. 采用考马斯亮蓝G250显色法, 牛血清白蛋白溶液为标准. 其余上清液用于以下指标测定. (2)ONOO-分析. 按参考文献[19]方法进行. 标本上清液中, 加入2.0 mL 55 mmol/L NaOH及2.0 mL 75 mmol/L ZnSO4去蛋白, 离心后, 上清液ONOO-浓度通过紫外分光光度法测定, 测302 nm波长的吸光度, 以摩尔消光系数e302 = 1 670 mol/(L•cm)计算ONOO-浓度. (3)MDA测定. 按硫代巴比妥酸比色[20]方法进行, 取带塞试管2支, 分别为测定、空白管, 依次加入标本上清液、蒸馏水各0.3 mL, 分别加入3 mL 0.05 mol/L的盐酸, 涡旋混匀后, 再加入1 mL硫代巴比妥酸试剂, 充分混匀, 加盖置100 ℃沸水浴中反应40 min, 取出后流水冷却, 吸取上层液体, 于波长为535 nm处, 以空白管调零点, 比色测定吸光度值(A值), 查标准曲线得结果. (4)肝糖原测定. 准确称取大鼠肝组织0.4 g, 用5 mL匀浆液(5%三氯乙酸)在玻璃匀浆器中制肝匀浆, 将匀浆液置低温高速冷冻离心机, 离心15 000 g, 10 min, 上清夜用于糖原分析; 碘盐显色法测糖原, 按参考文献[21]方法进行.
统计学处理 所有数据用mean±SD表示, 统计学显著性通过非配对学生t检验进行计算, 相关系数被计算, P<0.05考虑为具有显著性差异, 所有数据分析用Excel 2003统计软件.
正常组大鼠饮食、体质量、精神状态均正常、毛色光滑亮泽. 糖尿病组大鼠毛色枯黄无光泽, 毛态竖立, 精神倦怠, 体型消瘦, 饮水排尿增多, 抵抗减弱, 懒动, 以及尾尖采血测空腹血糖异常; 补中益气丸组大鼠精神状态、活动力、抵抗力及空腹血糖较糖尿病组显著改善.
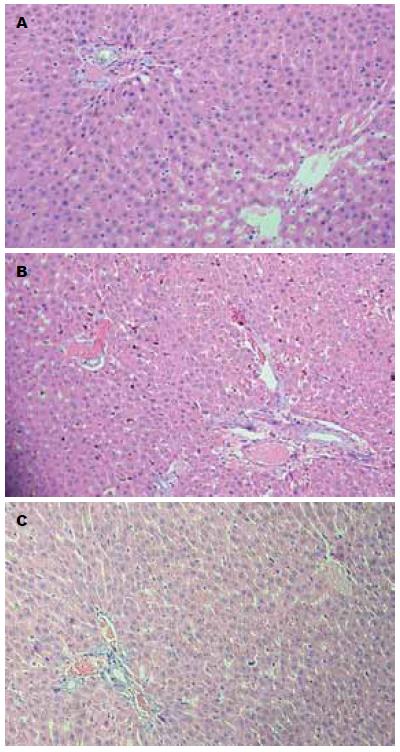
正常组SD大鼠肝细胞大小均一, 可见双核肝细胞; 肝小叶结构完整, 肝索排列整齐, 肝窦无扩张和变窄. 糖尿病组SD大鼠肝细胞变小, 肝窦变窄, 肝细胞核变小浅染, 肝小叶结构不清, 肝索结构紊乱, 存在充血和少量炎性细胞浸润, 尤其在肝1区. 补中益气丸组SD大鼠肝细胞、肝细胞核、肝窦、肝索、肝小叶异常及充血和炎症明显改善(图1, 表1).
| 分组 | 肝细胞大小 | 肝细胞核大小 | 肝血窦大小 | 肝索紊乱 | 充血 | 炎症 |
| 肝1区 | ||||||
| 正常组 | 3.5±0.53 | 3.3±0.67 | 3.4±0.97 | 0.5±0.53 | 0.5±0.53 | 0.6±0.52 |
| 糖尿病组 | 1.8±0.79b | 1.6±0.70b | 1.6±0.52b | 3.3±0.82b | 3.3±0.68b | 1.9±0.88b |
| 补中益气丸组 | 2.9±0.74d | 2.8±0.79d | 2.9±0.88d | 1.6±0.70d | 1.4±0.70d | 0.8±0.63d |
| 肝2区 | ||||||
| 正常组 | 3.4±0.52 | 3.2±0.63 | 3.3±0.95 | 0.6±0.52 | 0.4±0.52 | 0.5±0.53 |
| 糖尿病组 | 2.3±0.68b | 2.2±0.79b | 1.7±0.48b | 3.1±0.88b | 3.1±0.74b | 1.7±0.82b |
| 补中益气丸组 | 3.1±0.74c | 3.0±0.94c | 2.9±0.88d | 1.7±0.68d | 1.5±0.53d | 0.8±0.63d |
| 肝3区 | ||||||
| 正常组 | 3.2±0.48 | 3.4±0.52 | 3.5±0.85 | 0.5±0.53 | 0.6±0.52 | 0.4±0.52 |
| 糖尿病组 | 2.4±0.52b | 2.3±0.68b | 1.8±0.42b | 3.2±0.79b | 3.2±0.63b | 1.6±0.70b |
| 补中益气丸组 | 3.0±0.67c | 2.9±0.57c | 3.0±0.82d | 1.8±0.63d | 1.6±0.52d | 0.9±0.57c |
糖尿病组肝组织MDA、ONOO-水平显著升高, 肝糖原显著降低. 补中益气丸治疗组, 肝组织MDA、ONOO-水平显著降低, 肝糖原显著升高(表2).
通过对肝糖原与肝组织MDA、ONOO-水平相关系数的计算及统计学分析显示: 肝糖原与肝组织MDA、ONOO-水平呈显著负相关(r1 = -0.371, r2 = -0.377).
通过对肝细胞大小、肝细胞核大小、肝血窦大小、肝细胞索结构紊乱、充血、炎症与肝糖原、肝组织MDA、ONOO-水平相关系数的计算及统计学分析, 显示: 肝细胞大小、肝细胞核大小、肝血窦大小与肝糖原呈显著正相关, 与肝组织MDA、ONOO-水平呈显著负相关; 肝细胞索结构紊乱、充血、炎症与肝糖原呈显著负相关, 与肝组织MDA、ONOO-水平呈显著正相关(表3).
本实验发现糖尿病大鼠出现明显的糖尿病症状, 肝病理检测发现肝细胞变小, 肝窦变窄, 肝细胞核变小浅染, 肝小叶结构不清, 肝索结构紊乱, 存在充血和少量炎性细胞浸润, 尤其在肝1区, 肝组织MDA、ONOO-水平显著升高, 肝糖原显著降低. 补中益气丸组大鼠肝细胞、肝细胞核、肝窦、肝索、肝小叶异常及充血和炎症明显改善, 糖尿病症状亦明显改善; 肝组织MDA、ONOO-水平显著降低, 肝糖原显著升高. 相关分析发现, 肝糖原与MDA、ONOO-、肝细胞索结构紊乱、充血、炎症呈显著负相关, 与肝细胞大小、肝细胞核大小、肝血窦大小呈显著正相关; 肝组织MDA、ONOO-水平与肝细胞大小、肝细胞核大小、肝血窦大小呈显著负相关, 与肝细胞索结构紊乱、充血、炎症呈显著正相关.
肝1区细胞负责糖原的合成和分解, 蛋白代谢和血浆蛋白的合成, 肝3区与糖原储存及脂类和色素形成有关, 肝2区共享肝1区和肝3区的功能[22], Herrman等[23]已报道糖尿病存在较小的肝细胞; 细胞核负责RNA的产生和随后的蛋白质合成, 细胞核大小与DNA含量和代谢活动密切相关[24-27], 肝细胞核变小表明肝细胞代谢活动的降低.
胰岛素信号通路介导脱磷酸化反应, 激活糖原合成酶, 合成糖原. Højlund等[28]已发现, 人类糖尿病肌肉的糖原合成酶超磷酸化, 不能被传统的胰岛素信号调节, 因而导致糖原合成受阻. Bulum等[7]发现, 非酒精性脂肪肝病与1型糖尿病胰岛素抵抗显著相关, 非酒精性脂肪肝病指标ALT、AST、ALK、AST/ALT、铁与胰岛素敏感性指标eGDR呈显著负相关[7]. Ohta等[29]发现, 急性心肌梗死后心衰小鼠的骨骼肌胰岛素抵抗是由于氧化应激损害引起. Zhai等[30]发现, 在损伤诱导的胰岛素抵抗中, 氧化应激起重要作用. Deb等[31]发现, 氧化应激诱导的寡聚化, 能抑制非受体酪氨酸磷酸酶的活性. Kuban-Jankowska等[32]发现, 蛋白酪氨酸磷酸酶对氧化高度敏感, 氧化应激产生的自由基能失活蛋白酪氨酸磷酸酶.
以上表明补中益气丸可能通过改善STZ糖尿病大鼠肝脏氧化应激, 改善胰岛素信号通路、激活磷酸酶脱磷酸化活性, 进而升高糖原合成酶活性和肝糖原含量, 改善肝氧化代谢和肝的氧化损伤.
肝病常见于1型糖尿病, 并增加1型糖尿病其他并发症如肾病、眼病、心血管病的发病率, 亦与1型糖尿病胰岛素抵抗显著相关. 氧化应激和硝化应激是独立于病因的、参与从急性肝炎到肝癌的所有肝损害过程的关键因素, 同时氧化应激和硝化应激也与糖尿病的发生发展密切相关.
黄昆, 教授, 华中科技大学同济药学院
中草药的疗效与其抗氧化作用密切相关. 中药的抗氧化作用是重要的研究方向. 补中益气汤是健脾益气的代表方, 现代药理研究亦显示, 该方剂有抗氧化和保肝作用. 然而补中益气丸对糖尿病大鼠肝氧化损害的作用及机制尚未见报道.
研究显示, 肝病与1型糖尿病胰岛素抵抗显著相关, 在损伤诱导的胰岛素抵抗中, 氧化应激起重要作用, 急性心肌梗死后心衰小鼠的骨骼肌胰岛素抵抗是由于氧化应激损害引起.
本实验研究补中益气丸对STZ糖尿病大鼠肝脏ONOO-、MDA、糖原及肝损害的影响, 探讨补中益气丸通过改善肝脏氧化应激, 改善胰岛素信号通路、糖原合成、肝氧化代谢及肝的氧化损伤的可能机制.
氧化应激和硝化应激在许多疾病的诱导和进展中起关键作用, 参与大量的细胞因子和生长因子激活和转录, 后者又进一步促进氧化应激和硝化应激, 形成恶性循环. 在这一领域进行中药作用机制的研究, 对于中药的开发, 有着重要实际应用价值.
本文实验数据较完整, 逻辑清晰, 有一定的创新性和理论价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Targher G, Bertolini L, Padovani R, Rodella S, Zoppini G, Pichiri I, Sorgato C, Zenari L, Bonora E. Prevalence of non-alcoholic fatty liver disease and its association with cardiovascular disease in patients with type 1 diabetes. J Hepatol. 2010;53:713-718. [PubMed] [DOI] |
| 2. | Targher G, Pichiri I, Zoppini G, Trombetta M, Bonora E. Increased Prevalence of Cardiovascular Disease in Type 1 Diabetic Patients with Non-Alcoholic Fatty Liver Disease. J Endocrinol Invest. 2011; Jul 27. [Epub ahead of print]. [PubMed] |
| 3. | Targher G, Bertolini L, Chonchol M, Rodella S, Zoppini G, Lippi G, Zenari L, Bonora E. Non-alcoholic fatty liver disease is independently associated with an increased prevalence of chronic kidney disease and retinopathy in type 1 diabetic patients. Diabetologia. 2010;53:1341-1348. [PubMed] [DOI] |
| 4. | Manna P, Das J, Ghosh J, Sil PC. Contribution of type 1 diabetes to rat liver dysfunction and cellular damage via activation of NOS, PARP, IkappaBalpha/NF-kappaB, MAPKs, and mitochondria-dependent pathways: Prophylactic role of arjunolic acid. Free Radic Biol Med. 2010;48:1465-1484. [PubMed] [DOI] |
| 5. | El-Karaksy HM, Anwar G, Esmat G, Mansour S, Sabry M, Helmy H, El-Hennawy A, Fouad H. Prevalence of hepatic abnormalities in a cohort of Egyptian children with type 1 diabetes mellitus. Pediatr Diabetes. 2010;11:462-470. [PubMed] [DOI] |
| 6. | Leeds JS, Forman EM, Morley S, Scott AR, Tesfaye S, Sanders DS. Abnormal liver function tests in patients with Type 1 diabetes mellitus: prevalence, clinical correlations and underlying pathologies. Diabet Med. 2009;26:1235-1241. [PubMed] [DOI] |
| 7. | Bulum T, Kolarić B, Duvnjak L, Duvnjak M. Nonalcoholic Fatty liver disease markers are associated with insulin resistance in type 1 diabetes. Dig Dis Sci. 2011;56:3655-3663. [PubMed] [DOI] |
| 8. | Clichici S, Catoi C, Mocan T, Filip A, Login C, Nagy A, Daicoviciu D, Decea N, Gherman C, Moldovan R. Non-invasive oxidative stress markers for liver fibrosis development in the evolution of toxic hepatitis. Acta Physiol Hung. 2011;98:195-204. [PubMed] [DOI] |
| 9. | Rains JL, Jain SK. Oxidative stress, insulin signaling, and diabetes. Free Radic Biol Med. 2011;50:567-575. [PubMed] [DOI] |
| 10. | Stadler K. Peroxynitrite-driven mechanisms in diabetes and insulin resistance - the latest advances. Curr Med Chem. 2011;18:280-290. [PubMed] [DOI] |
| 11. | Giacco F, Brownlee M. Oxidative stress and diabetic complications. Circ Res. 2010;107:1058-1070. [PubMed] [DOI] |
| 12. | Pitocco D, Zaccardi F, Di Stasio E, Romitelli F, Santini SA, Zuppi C, Ghirlanda G. Oxidative stress, nitric oxide, and diabetes. Rev Diabet Stud. 2010;7:15-25. [PubMed] [DOI] |
| 13. | 上 野幸三. 补中益气汤对食物过敏模型小鼠肝脏的抗过敏作用. 国外医学•中医中药分册. 2002;24:352-353. |
| 16. | 季 宇彬, 刘 建军, 张 翠, 战 凤军, 关 雪刃. 补中益气汤对EAC小鼠癌细胞膜LPO含量的影响. 黑龙江商学院学报(自然科学版). 1992;8:57-59, 77. |
| 19. | Uppu RM, Pryor WA. Synthesis of Peroxynitrite in a Two-Phase System Using Isoamyl Nitrite and Hydrogen Peroxide Anal Biochem. Anal Biochem. 1996;236:242-249. [PubMed] [DOI] |
| 22. | Katz NR. Metabolic heterogeneity of hepatocytes across the liver acinus. J Nutr. 1992;122:843-849. [PubMed] |
| 23. | Herrman CE, Sanders RA, Klaunig JE, Schwarz LR, Watkins JB. Decreased apoptosis as a mechanism for hepatomegaly in streptozotocin-induced diabetic rats. Toxicol Sci. 1999;50:146-151. [PubMed] [DOI] |
| 24. | Sørensen FB, Kristensen IB, Grymer F, Jakobsen A. DNA-index and stereological estimation of nuclear volume in primary and metastatic malignant melanomas: a comparative study with analysis of heterogeneity. APMIS. 1990;98:61-70. [PubMed] [DOI] |
| 25. | Zimmerman HJ, MacMurray FG, Rapparport H, Alpert LK. Studies of the liver in diabetes mellitus. I. Structural and functional abnormalities. J Lab Clin Med. 1950;36:912-921. [PubMed] |
| 26. | Christie GS, Le page RN. Enlargement of liver cell nuclei: effect of dimethylnitrosamine on size and desoxyribosenucleic acid content. Lab Invest. 1961;10:729-743. [PubMed] |
| 27. | Henrique RM, Monteiro RA, Rocha E, Marini-Abreu MM. A stereological study on the nuclear volume of cerebellar granule cells in aging rats. Neurobiol Aging. 1997;18:199-203. [PubMed] [DOI] |
| 28. | Højlund K, Birk JB, Klein DK, Levin K, Rose AJ, Hansen BF, Nielsen JN, Beck-Nielsen H, Wojtaszewski JF. Dysregulation of glycogen synthase COOH- and NH2-terminal phosphorylation by insulin in obesity and type 2 diabetes mellitus. J Clin Endocrinol Metab. 2009;94:4547-4556. [PubMed] [DOI] |
| 29. | Ohta Y, Kinugawa S, Matsushima S, Ono T, Sobirin MA, Inoue N, Yokota T, Hirabayashi K, Tsutsui H. Oxidative stress impairs insulin signal in skeletal muscle and causes insulin resistance in postinfarct heart failure. Am J Physiol Heart Circ Physiol. 2011;300:H1637-H1644. [PubMed] [DOI] |
| 30. | Zhai L, Ballinger SW, Messina JL. Role of reactive oxygen species in injury-induced insulin resistance. Mol Endocrinol. 2011;25:492-502. [PubMed] [DOI] |
| 31. | Deb I, Poddar R, Paul S. Oxidative stress-induced oligomerization inhibits the activity of the non-receptor tyrosine phosphatase STEP61. J Neurochem. 2011;116:1097-1111. [PubMed] [DOI] |
| 32. | Kuban-Jankowska A, Górska M, Debicki A, Popowska U, Knap N, Woźniak M. [Protein tyrosine phosphatases--endogenous markers of oxidative stress]. Postepy Biochem. 2010;56:269-273. [PubMed] |