修回日期: 2011-11-20
接受日期: 2011-12-01
在线出版日期: 2012-01-08
目的: 研究敲除多聚磷酸激酶(polyphosphate kinase, PPK)基因后对幽门螺旋杆菌(Helicobacter pylori, H. pylori)逃避巨噬细胞免疫清除的影响.
方法: 通过同源重组的原理构建H. pylori PPK敲除菌株. 提取PPK敲除菌株体内多聚磷酸盐, 转化为ATP进行定量, 并与野生型菌株内多聚磷酸盐水平进行比较. 将PPK敲除菌株及野生型菌株分别与小鼠巨噬细胞系RAW264.7共同培养, 比较存活的H. pylori数量.
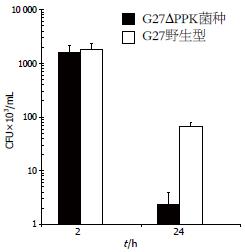
结果: 成功构建敲除PPK的H. pylori菌种. Western blot显示该菌无PPK蛋白表达. 对敲除PPK的H. pylori菌株中的多聚磷酸盐定量结果显示, 其内PP含量为0.46±0.25 nmol Pi/mg Protein, 显著低于G27野生菌种(175.33±21.22 nmol Pi/mg Protein, P<0.01). 将该菌株与小鼠巨噬细胞系RAW264.7共同培养, 2 h时间点, G27及G27DPPK菌种在巨噬细胞内的存活无显著差异; 而在24 h时间点, G27DPPK菌种在巨噬细胞内的存活率显著低于野生型G27菌种, 巨噬细胞内的BacLight kit染色结果显示, G27DPPK菌种在巨噬细胞内获得染色的活菌显著低于野生型G27菌种.
结论: PPK是H. pylori合成多聚磷酸盐的关键酶. 敲除该基因后, H. pylori合成多聚磷酸盐的能力显著下降, 其逃避巨噬细胞清除的能力明显减弱.
引文著录: 杨诏旭, 路程伊, 杨宾, 夏宁, 窦科峰. 敲除PPK基因对幽门螺杆菌逃避巨噬细胞免疫清除的影响. 世界华人消化杂志 2012; 20(1): 22-26
Revised: November 20, 2011
Accepted: December 1, 2011
Published online: January 8, 2012
AIM: To evaluate the impact of knockout of the polyphosphate kinase gene in Helicobacter pylori (H. pylori) on bacterial evasion of immune elimination by macrophages.
METHODS: A PPK null mutant of H. pylori was constructed by gene homologous recombination. The polyphosphate was extracted from the PPK null mutant and wild type bacteria to compare the amount of polyphosphate by conversion into ATP. PPK null mutant H. pylori or wild type bacteria were co-cultured with murine macrophage cell line Raw 264.1 to compare the bacterial survival in macrophages at 24 h.
RESULTS: A PPK null mutant H. pylori strain was successfully constructed. The amount of polyphosphate in PPK null mutant bacteria was significantly lower than that in wild type bacteria (0.46 nmol Pi/mg Protein ± 0.25 nmol Pi/mg Protein vs 175.33 nmol Pi/mg Protein ± 21.22 nmol Pi/mg Protein, P < 0.01). Compared to wild type H. pylori, the survival rate of PPK null mutant bacteria in macrophages was similar at 2 h but was significantly reduced at 24 h.
CONCLUSION: PPK plays a critical role in synthesizing polyphosphate in H. pylori. PPK knockout in H. pylori significantly impaired their ability to synthesize polyphosphate and to evade immune elimination by macrophages.
- Citation: Yang ZX, Lu CY, Yang B, Xia N, Dou KF. PPK knockout attenuates evasion of immune elimination of Helicobacter pylori by macrophages. Shijie Huaren Xiaohua Zazhi 2012; 20(1): 22-26
- URL: https://www.wjgnet.com/1009-3079/full/v20/i1/22.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i1.22
幽门螺旋杆菌(Helicobacter pylori, H. pylori)是一种微需氧的、螺旋形、革兰氏阴性杆菌. 世界上大约一半以上的人口存在H. pylori感染[1,2], 其可终生在宿主体内存活, 并可引起慢性胃炎. 其中约10%的患者可发展为消化性溃疡, 而H. pylori感染者的胃癌发生率也明显高于无H. pylori者[3-5]. H. pylori逃避宿主免疫清除的机制是关系其致病性的重要因素. 一般来说, H. pylori感染会引起胃黏膜的慢性炎症, 并刺激胃黏膜上皮细胞释放炎症因子, 这些因子可以促使大量中性粒细胞及巨噬细胞聚集在感染部位[6,7], 以清除H. pylori的感染. 然而, 巨噬细胞虽然可以吞噬H. pylori, 却常常不能将其有效清除, 使得H. pylori可在巨噬细胞内存活[8,9], 从而诱导免疫适应. 目前, 关于H. pylori逃避巨噬细胞清除的机制尚不清楚. 有研究发现, 敲除多聚磷酸激酶(polyphosphate kinase, PPK)的H. pylori, 其对宿主感染能力显著下降[10,11], 据此我们推测其可能更易于被宿主免疫系统清除. 本研究旨在探索H. pylori合成多聚磷酸(polyphosphate, PP)的能力是否与其逃避巨噬细胞清除有关, 从而为进一步研究PP与H. pylori致胃癌的关系提供实验基础.
H. pyloriG27菌种为本室保存. 小鼠巨噬细胞系RAW264.7购自ATCC. BacLight细菌存活鉴定试剂盒购自Promega; BLBB培养基[12](1%胰蛋白酶、1%多肽胺、0.1%葡萄糖、0.2%酵母提取物、0.5%氯化钠)所有配料均购自Sigma; DMEM(低糖)细胞培养基及胎牛血清购自Invitrogen; 荧光显微镜为Olympus公司产品; PPK多克隆抗体是通过免疫新西兰白兔获得; PPK蛋白为本室纯化保存. GITC裂解液:4M guanidine isothiocyanate(GITC)-50 mmol/L Tris-HCl, pH 7.0; ATP bioluminescence assay kit(Roche); Saponin购自Sigma.
1.2.1 H. pylori培养:H. pylori培养条件如下: 液体培养基为BLBB加100 mL/L的胎牛血清, 气体环境为(50 mL/L O2, 100 mL/L CO2, 850 mL/L N2), 置于37 ℃培养箱内, 并以60 r/min温和振摇. 固体培养基另含1.5%凝胶.
1.2.2 H. pyloriG27 PPK基因的敲除: 按Ayraud等[10]的方法进行敲除. 具体如下: 提取G27的基因组DNA为模板, PCR扩增PPK基因的全长序列, 大小约2 kb. 将该序列连接入大小约3.6 kb的pILL570载体中[13]. 分别在PPK基因的N端下游300 bp处及C端上游300 bp处设计引物, 引物分别为5'-CGGGGTACCCATTATAGGGGGTG ATACAAAGCCC-3', 5'-CGCGGATCCGAAATCATTG AATGGCTCTATCAGCC-3'. 引物分别包含KpnⅠ和BamHⅠ酶切位点, 以PCR扩增质粒中的4.2 kb片段(片断包括PPK N端300 bp的序列, pILL570载体及PPK C端300 bp的序列). PCR扩增0.9 kb的无启动子的卡那霉素抗性基因[14], 同样在引物两端放置KpnⅠ和BamHⅠ酶切位点. 将上述2个片断分别以KpnⅠ和BamHⅠ双酶切后进行连接, 连接后质粒置入DH-5a感受态细菌中, 筛选含质粒的单克隆细菌. 扩增质粒, 利用H. pylori可进行自然转染的特性, 将该重组质粒转染入H. pyloriG27野生菌. 以卡那霉素筛选单克隆菌落, 存活的菌株应由卡那霉素抗性基因替代了PPK基因(即G27DPPK). 提取基因组DNA, PCR扩增PPK基因区域, 测序挑选PPK基因获得敲除的菌株, 并作进一步分析.
1.2.3 H. pylori菌体内PPK的表达及PP的定量: 按上述条件将H. pyloriG27菌种及G27DPPK菌种接种于液体培养基, 起始A600为0.05. 培养20 h待A600约为1时, 离心收集细菌. 菌体裂解后经SDS-PAGE电泳, 转PVDF膜, 经PPK的多克隆抗体进行Western blot检验PPK的表达情况; 并以纯化的PPK蛋白作为对照, 指示PPK蛋白的电泳位置. 同时裂解菌体, 提取菌体内PP[15], 具体步骤如下: 离心收集A600为1的细菌1.5 mL, 加入0.5 mL 95 ℃的GITC裂解液, 振摇悬浮细菌. 在95 ℃孵育2 min, 超声裂菌1 min. 测定蛋白浓度后, 加入30 mL 10% SDS, 振摇后12 000 g离心10 min去除沉淀. 加入0.5 mL 95%乙醇, 混匀后加5 mL Glassmilk孵育20 min以吸附PP. 洗涤后加入DNA酶及RNA酶各20 mg, 降解DNA及RNA, 再次洗涤后离心收集Glassmilk, 以50 mL 50 mmol/L Tris-HCl(pH 8.0)洗脱PP. 取9 mL上述PP溶液, 跑Urea-PAGE胶, 以toluidine blue染色, 比较2种细菌产生PP的能力. 为进一步定量PP, 将PP转化为ATP, 以ATP bioluminescence assay kit(Roche)定量ATP, 以此计算PP的Pi值(磷酸根), 上述实验重复3次, 最终数值为3次平均值.
1.2.4 H. pylori与小鼠巨噬细胞系RAW264.7的共培养及存活率测定: 收集生长良好的小鼠巨噬细胞RAW264.7, 随后按每孔2×104个细胞接种于96孔板. 细胞培养基为含10% FBS的DMEM, 并置于37 ℃, 50 mL/L CO2的细胞培养箱内培养24 h. 而后显微镜下观察确认细胞已良好贴壁生长, 将细胞以0.1 mL PBS洗涤3遍后备用. 分别离心收集H. pyloriG27菌种及G27DPPK菌种, 在4 ℃条件下, 以含100 mL/LFBS的DMEM悬浮, 制成A600约0.025(1.5×107/mL) 的细菌悬液. 将100 µL上述悬液分别加入96孔板中, 于4 ℃ 600 g离心5 min, 以帮助H. pylori贴附于巨噬细胞上. 以100 mL DMEM洗涤3遍后, 加入100 mL 37 ℃ DMEM(含100 mL/L FBS), 置于细胞培养箱内培养1 h后, 以100 mL DMEM洗涤1遍, 加入100 mL含100 mg/L Gentamicin的DMEM(含100 mL/L FBS), 继续培养1 h, 以杀灭未被巨噬细胞吞噬的H. pylori. 此时, 将其培养的巨噬细胞再分为2组: 一组(2 h组)经DMEM洗涤3遍后, 直接裂解, 测定其中存活的H. pylori; 另一组(24 h组)洗涤后继续加入100 mL DMEM培养基(含100 mL/L FBS), 培养至24 h, 再进行裂解及测定. 细胞裂解及测定存活的H. pylori的方法如下: 将细胞洗涤后, 加入0.1 mL的无菌蒸馏水, 5 min后, 以Pipette轻柔吹打, 获得悬液, 将该悬液作一系列的稀释, 分别涂于LB固体平板上, 计数所形成的细菌单克隆, 计算获得存活的H. pylori数目. 上述实验每个实验点均设3次重复, 最终结果取平均值.
1.2.5 巨噬细胞RAW264.7内存活的H. pylori的染色: 巨噬细胞与G27菌种及G27DPPK菌种的共培养大致同前, 部分步骤改变如下: 将24孔板内置12 mm清洁玻片, 巨噬细胞按每孔1×105个细胞接种. H. pyloriG27菌种及G27DPPK菌种, 同样制成1.5×107/mL的细菌悬液, 将500 mL上述悬液分别加入24孔板中, 培养过程同前. 同样在1 h时加入100 mg/L Gentamicin, 继续培养1 h, 以杀灭未被巨噬细胞吞噬的H. pylori. 而在培养至24 h时, 以BacLight细菌存活鉴定试剂盒染色存活的H. pylori, 直接观察在巨噬细胞内存活的H. pylori. 具体步骤如下: PBS洗涤后, 加入0.5 mL 1 g/L saponin(溶于PBS), 室温下孵育10 min, 然后小心移除saponin溶液(巨噬细胞已非常脆弱, 操作须非常轻柔), 加入0.25 mL稀释的BacLight溶液(步骤见Promega产品说明书), 室温下孵育15 min, 取出玻片, 快速置于载玻片上, 于荧光显微镜下观察存活的H. pylori(染为绿色荧光).
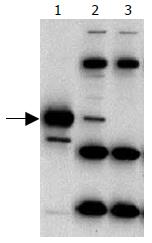
裂解后的G27及G27DPPK菌种, 以PPK的多克隆抗体进行Western blot, 结果证实, G27DPPK菌种内无PPK表达, PPK酶已获得良好敲除(图1). 而将两菌种按前述常规条件培养后, 裂解细菌提取PP, 跑Urea-PAGE, 并以toluidine blue染色后显示: G27DPPK菌种内PP无明显显示, 而野生型G27菌种内PP获得良好染色(图2). 将两菌种内PP分别转化为ATP进行定量, 证实G27DPPK内PP含量为0.46±0.25 nmol Pi/mg Protein(以每mg细菌总蛋白对应的nmol磷酸根为单位), 显著低于G27野生菌种(175.33 nmol Pi/mg Protein±21.22 nmol Pi/mg Protein, P<0.01).
野生型G27及G27DPPK菌种与巨噬细胞共培养后, 裂解细胞, 涂LB平板, 测定存活H. pylori. 结果显示, 2 h时间点, G27及G27DPPK菌种在巨噬细胞内的存活无显著差异; 而在24 h时间点, G27DPPK菌种在巨噬细胞内的存活率显著低于野生型G27菌种(图3).
H. pylori与巨噬细胞共培养的24 h时间点, 用BacLight kit染色巨噬细胞内存活的H. pylori, 结果显示: G27DPPK菌种在巨噬细胞内获得染色的活菌显著低于野生型G27菌种(图4).
H. pylori是引起胃溃疡乃至胃癌的重要病源体. 1994年, 世界卫生组织将H. pylori定义为一类致癌病原体[16], 这也是目前发现的第1个可以致癌的细菌. 在我国, H. pylori感染非常常见, 而治疗与预防H. pylori感染是公共医疗卫生的迫切需要.
H. pylori的自然感染能诱导机体免疫系统强烈的应答, 但这种应答却无法有效清除H. pylori. 反而由于长期的慢性感染, 引起机体产生反复的炎症反应, 造成胃黏膜细胞的损伤. 这主要是由于H. pylori可以通过一系列机制来逃避机体的免疫清除[17-19], 其中包括抑制T细胞的活化[20,21], 通过基因重组逃避抗体识别[22], 诱导巨噬细胞凋亡[23,24], 抑制巨噬细胞的内吞作用[25,26], 阻断巨噬细胞吞噬体的成熟等[27,28]. 尤其是H. pylori被巨噬细胞内吞后, 可通过多种途径抑制吞噬体与溶酶体的结合, 从而使其可以在巨噬细胞内存活, 而不被杀伤, 但究竟H. pylori内的哪些基因与物质参与了这一调节过程, 目前尚不完全清楚.
之前的研究发现, H. pylori在特定条件下可出现PP的积聚[29,30]. 而PPK是合成PP的关键酶, 如果敲除该酶, 则这种DPPK菌种对小鼠的感染力明显下降[10,11], 难以在小鼠胃内定植, 但其机制并不清楚. 由于我们之前的研究发现, PP的积聚可以修饰H. pylori主要转录因子Sigma80, 进而调节基因的转录[30]. 但这种转录调节与H. pylori致病性的关系, 目前尚不完全清楚. 通过本实验, 我们希望验证缺失PPK的菌种, 是否因不能有效积聚PP, 从而影响其所调控基因的表达, 而减弱了逃避巨噬细胞清除的能力, 以致其难以有效感染宿主.
本实验中, G27DPPK菌种经Western blot证实无PPK的表达, 同时我们分别通过Urea-PAGE及转化PP为ATP进行定量的2种方法, 均证实G27DPPK菌种内PP生成量显著低于野生型G27菌种, 即丧失了积聚PP的能力.
随后, 我们用这种缺失积聚PP能力的菌种, 与巨噬细胞共培养. 结果发现在培养的2 h时间点, 也即刚刚用gentamicin清除掉未被巨噬细胞吞噬的H. pylori时, G27DPPK菌种与野生型G27菌种在巨噬细胞内的存活数无显著差异, 提示巨噬细胞吞噬2种细菌的能力无明显差别. 而在24 h时间点, G27DPPK菌种在巨噬细胞内的存活率显著低于野生型G27菌种, 说明缺失合成PP能力的菌种, 其逃避巨噬细胞清除的能力显著下降. 为更直观地观察H. pylori在巨噬细胞内存活情况, 我们使用了BacLight kit染色活菌, 从而可以直接在荧光显微镜下观察活菌数. 值得注意的是, 以此种方法显示的存活细菌不仅可获得良好荧光染色, 且仍具有一定的游动性. 通过这一染色活菌的方法, 进一步证实了前面的结论.
总之, 本实验证实PPK是H. pylori合成PP的关键酶, H. pylori合成PP的能力, 可帮助其逃避巨噬细胞的清除. 我们推测, PP可能通过调节Sigma80, 进而调控H. pylori内相关基因的表达, 从而抑制巨噬细胞的清除作用. 未来我们将进一步验证这一假设, 并探索PP调节的靶点基因.
逃避巨噬细胞清除是幽门螺旋杆菌(H. pylori)逃避宿主免疫清除的机制之一, 但关于H. pylori如何逃避巨噬细胞清除是亟待解决的关键问题.
白爱平, 副教授, 江西省南昌大学第一附属医院消化病研究所
本研究首次发现多聚磷酸的积聚与H. pylori逃避巨噬细胞清除密切相关, 敲除多聚磷酸激酶(PPK)基因, H. pylori合成多聚磷酸的能力大大降低, 且更易被巨噬细胞清除.
明确PPK基因是H. pylori逃避巨噬细胞清除的重要基因, 可以将其作为治疗靶点.
作者通过检测PPK基因缺失的H. pylori被巨噬细胞免疫清除试验, 探讨了细菌PPK基因在H. pylori逃避巨噬细胞免疫清除中的功能和作用. 研究选题恰当、结论可靠.
编辑: 张姗姗 电编:何基才
| 1. | Shi R, Xu S, Zhang H, Ding Y, Sun G, Huang X, Chen X, Li X, Yan Z, Zhang G. Prevalence and risk factors for Helicobacter pylori infection in Chinese populations. Helicobacter. 2008;13:157-165. [PubMed] [DOI] |
| 2. | Malaty HM. Epidemiology of Helicobacter pylori infection. Best Pract Res Clin Gastroenterol. 2007;21:205-214. [PubMed] [DOI] |
| 3. | Dorer MS, Talarico S, Salama NR. Helicobacter pylori's unconventional role in health and disease. PLoS Pathog. 2009;5:e1000544. [PubMed] [DOI] |
| 4. | Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, Sasaki N, Schlemper RJ. Helicobacter pylori infection and the development of gastric cancer. N Engl J Med. 2001;345:784-789. [PubMed] [DOI] |
| 5. | Axon AT. Relationship between Helicobacter pylori gastritis, gastric cancer and gastric acid secretion. Adv Med Sci. 2007;52:55-60. [PubMed] |
| 6. | Agnihotri N, Bhasin DK, Vohra H, Ray P, Singh K, Ganguly NK. Characterization of lymphocytic subsets and cytokine production in gastric biopsy samples from Helicobacter pylori patients. Scand J Gastroenterol. 1998;33:704-709. [PubMed] [DOI] |
| 7. | Suzuki T, Kato K, Ohara S, Noguchi K, Sekine H, Nagura H, Shimosegawa T. Localization of antigen-presenting cells in Helicobacter pylori-infected gastric mucosa. Pathol Int. 2002;52:265-271. [PubMed] [DOI] |
| 8. | Algood HM, Cover TL. Helicobacter pylori persistence: an overview of interactions between H. pylori and host immune defenses. Clin Microbiol Rev. 2006;19:597-613. [PubMed] [DOI] |
| 9. | Allen LA. Phagocytosis and persistence of Helicobacter pylori. Cell Microbiol. 2007;9:817-828. [PubMed] [DOI] |
| 10. | Ayraud S, Janvier B, Labigne A, Ecobichon C, Burucoa C, Fauchère JL. Polyphosphate kinase: a new colonization factor of Helicobacter pylori. FEMS Microbiol Lett. 2005;243:45-50. [PubMed] [DOI] |
| 11. | Ayraud S, Janvier B, Salaun L, Fauchère JL. Modification in the ppk gene of Helicobacter pylori during single and multiple experimental murine infections. Infect Immun. 2003;71:1733-1739. [PubMed] [DOI] |
| 12. | Hawrylik SJ, Wasilko DJ, Haskell SL, Gootz TD, Lee SE. Bisulfite or sulfite inhibits growth of Helicobacter pylori. J Clin Microbiol. 1994;32:790-792. [PubMed] |
| 13. | Contreras M, Thiberge JM, Mandrand-Berthelot MA, Labigne A. Characterization of the roles of NikR, a nickel-responsive pleiotropic autoregulator of Helicobacter pylori. Mol Microbiol. 2003;49:947-963. [PubMed] [DOI] |
| 14. | Skouloubris S, Thiberge JM, Labigne A, De Reuse H. The Helicobacter pylori UreI protein is not involved in urease activity but is essential for bacterial survival in vivo. Infect Immun. 1998;66:4517-4521. [PubMed] |
| 15. | Ault-Riché D, Fraley CD, Tzeng CM, Kornberg A. Novel assay reveals multiple pathways regulating stress-induced accumulations of inorganic polyphosphate in Escherichia coli. J Bacteriol. 1998;180:1841-1847. [PubMed] |
| 16. | Suzuki H, Iwasaki E, Hibi T. Helicobacter pylori and gastric cancer. Gastric Cancer. 2009;12:79-87. [PubMed] [DOI] |
| 17. | Wilson KT, Crabtree JE. Immunology of Helicobacter pylori: insights into the failure of the immune response and perspectives on vaccine studies. Gastroenterology. 2007;133:288-308. [PubMed] [DOI] |
| 18. | D'Elios MM, Andersen LP. Helicobacter pylori inflammation, immunity, and vaccines. Helicobacter. 2007;12 Suppl 1:15-19. [PubMed] [DOI] |
| 20. | Bergman MP, D'Elios MM. Cytotoxic T cells in H. pylori-related gastric autoimmunity and gastric lymphoma. J Biomed Biotechnol. 2010;2010:104918. [PubMed] |
| 22. | Aras RA, Fischer W, Perez-Perez GI, Crosatti M, Ando T, Haas R, Blaser MJ. Plasticity of repetitive DNA sequences within a bacterial (Type IV) secretion system component. J Exp Med. 2003;198:1349-1360. [PubMed] [DOI] |
| 23. | Lewis ND, Asim M, Barry DP, de Sablet T, Singh K, Piazuelo MB, Gobert AP, Chaturvedi R, Wilson KT. Immune evasion by Helicobacter pylori is mediated by induction of macrophage arginase II. J Immunol. 2011;186:3632-3641. [PubMed] [DOI] |
| 24. | 黎 村艳, 张 艳, 余 敏君, 刘 志杰, 于 文. 幽门螺杆菌VacA通过激活NF-kB诱导巨噬细胞分泌及凋亡. 中华微生物学和免疫学杂. 2009;5:454-459. |
| 25. | Allen LA, Allgood JA, Han X, Wittine LM. Phosphoinositide3-kinase regulates actin polymerization during delayed phagocytosis of Helicobacter pylori. J Leukoc Biol. 2005;78:220-230. [PubMed] [DOI] |
| 26. | Allen LA, Allgood JA. Atypical protein kinase C-zeta is essential for delayed phagocytosis of Helicobacter pylori. Curr Biol. 2002;12:1762-1766. [PubMed] [DOI] |
| 27. | Borlace GN, Jones HF, Keep SJ, Butler RN, Brooks DA. Helicobacter pylori phagosome maturation in primary human macrophages. Gut Pathog. 2011;3:3. [PubMed] [DOI] |
| 28. | Keep S, Borlace G, Butler R, Brooks D. Role of immune serum in the killing of Helicobacter pylori by macrophages. Helicobacter. 2010;15:177-183. [PubMed] [DOI] |
| 29. | Segal ED, Falkow S, Tompkins LS. Helicobacter pylori attachment to gastric cells induces cytoskeletal rearrangements and tyrosine phosphorylation of host cell proteins. Proc Natl Acad Sci U S A. 1996;93:1259-1264. [PubMed] [DOI] |
| 30. | Yang ZX, Zhou YN, Yang Y, Jin DJ. Polyphosphate binds to the principal sigma factor of RNA polymerase during starvation response in Helicobacter pylori. Mol Microbiol. 2010;77:618-627. [PubMed] [DOI] |