修回日期: 2011-02-28
接受日期: 2011-03-08
在线出版日期: 2011-03-28
目的: 探讨胰腺血管周上皮样细胞肿瘤(perivascular epithelioid cell tumors, PEComas)的临床病理学特征、诊断、鉴别诊断、治疗方法和预后.
方法: 对1例罕见的胰腺PEComas进行光镜观察、免疫组织化学染色, 并结合文献探讨该病的临床病理学特点.
结果: 肿瘤位于胰头部, 光镜下可见肿瘤内含有丰富的厚壁和薄壁血管, 血管周围及血管间为成巢、成片或器官样排列的上皮样细胞. 肿瘤细胞体积较大, 呈多边形, 胞质丰富, 透亮或颗粒状、淡嗜酸性. 细胞核小, 圆形、卵圆形或不规则形, 核分裂象罕见. 免疫组织化学显示肿瘤细胞HMB45、Melan-A、SMA、HHF35、Vimentin弥漫强阳性, D2-40和S-100呈弱阳性表达, Syn、CK(Pan)、CD117、CD34、Insuin、Somatostatin、Gastrin、Calcitonin、α-hCG、ACTH、Serotonin、PP、VIP、Glucagon均阴性.
结论: 胰腺PEComas是一种生物学行为未定的间叶源性肿瘤, 有其独特的组织形态及免疫组织化学表型. 目前尚无明确的良、恶性诊断标准. 以手术完整切除为主要治疗方法, 术后密切随访.
引文著录: 谢飞来, 宋屿娜, 曲利娟, 余英豪, 郑智勇. 胰腺血管周上皮样细胞肿瘤的临床病理特点. 世界华人消化杂志 2011; 19(9): 964-968
Revised: February 28, 2011
Accepted: March 8, 2011
Published online: March 28, 2011
AIM: To investigate the clinicopathologic features, diagnosis, treatment and prognosis of perivascular epithelioid cell tumor (PEComa) of the pancreas.
METHODS: One case of PEComa of the pancreas was investigated by light microscopy and immunohistochemistry. A literature review was performed to summarize the characteristics of the disease.
RESULTS: The tumor was located in the head of the pancreas. Microscopically, the lesion was composed of thick or thin blood vessels and nest- or slice-shaped cells around the blood vessels. The tumor cells were huge, showed different polygons and had abundant clear to eosinophilic, granular cytoplasm. The nuclei were polymorphic and no mitoses were observed. Immunohistochemistrically, the tumor cells were strongly positive for HMB45, Melan-A, SMA, HHF35 and vimentin, weakly positive for D2-40 and S-100, and negative for Syn, CK (Pan), CD117, CD34, insuin, somatostatin, gastrin, calcitonin, α-hCG, ACTH, serotonin, PP, VIP and glucagon.
CONCLUSION: Pancreatic PEComa is a mesenchymal tumor with undetermined biological behavior and has unique histological, immunohistochemical and ultrastructural features. There are no definitely diagnostic criteria currently available to differentiate malignant and benign pancreatic PEComa. Current management has relied on surgery, and postoperative long-term close follow-up is needed.
- Citation: Xie FL, Song YN, Qu LJ, Yu YH, Zheng ZY. Clinicopathologic features of perivascular epithelioid cell tumor of the pancreas. Shijie Huaren Xiaohua Zazhi 2011; 19(9): 964-968
- URL: https://www.wjgnet.com/1009-3079/full/v19/i9/964.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i9.964
血管周上皮样细胞肿瘤(perivascular epithelioid cell tumors, PEComas)是2002年WHO软组织新分类的间叶性肿瘤, 又称具有血管周上皮样细胞分化的肿瘤, 因上皮样细胞围绕血管呈器官样、放射状排列并特异性表达黑色素细胞和肌细胞标志物而得名. 目前PEComas家族成员包括: 血管平滑肌脂肪(angiomyolipoma, AML)[上皮样血管平滑肌脂肪瘤(epithelioid angiomyolipoma, EAML)]、肺及肺外透明细胞'糖'瘤(clear cell 'sugar' tumor, CCST)、淋巴管平滑肌瘤病(lymphangioleio-myomatosis, LAM)、肝镰状韧带/圆韧带透明细胞肌黑色素细胞性肿瘤(clear cell myomelanocytic tumor of the falciform ligament/ligamentum teres, CCMMT)[1]. 发生在胰腺的PEComas很少见, 国内未见相关文献报道. 现报道中国人民解放军南京军区福州总医院病理科近期诊断的1例胰腺PEComas, 并复习文献探讨该病的临床病理学特征、诊断、鉴别诊断、治疗方法和预后, 旨在提高对该病的认识.
患者, 女, 58岁, 因反复上腹部疼痛6 mo余, 于2010-05-27入院. 腹痛为持续性胀痛, 无他处放射痛, 平卧时疼痛减轻, 伴食欲减退、乏力等症状. 曾就诊当地医院, 考虑胃炎, 予胃药口服及补液(具体不详)等治疗, 上诉症状无明显缓解, 并出现全身皮肤黄染、大便陶土色, 无进行性加重, 无腹泻、腹胀、便秘、里急后重感、黑便. 腹部B超示: 胰头区低回声团块, 考虑肿瘤. 查血生化氯化物升高110 mmol/L, 余均在正常范围. 血清肿瘤标志物: AFP 5.8 μg/L、CEA 1.99 μg/L、CA-125 9.1 kU/L、CA19-9 13.69 kU/L, 均在正常范围. 腹部MRI示: 胰头部见一类圆形结节, T2WI、脂肪抑制及DWI呈稍高信号, T1WI呈低信号, 大小约2.2 cm×2.1 cm, 边界尚清, 增强扫描病灶动脉期呈明显强化, 延迟后强化有所退出, 胰管无明显扩张. 诊断: 胰腺恶性肿瘤, 行胰头肿物切除术+胰肠R-Y吻合术, 术后切除标本送病理检查.
手术标本经40 g/L甲醛溶液固定, 常规石蜡包埋, 4 μm厚切片, HE染色; 采用EliVision法分别进行HMB45、Melan-A、SMA、HHF35、D2-40、S-100、Syn、CK(Pan)、CD117、CD34、Ki-67、Vimentin、Insuin、Somatostatin、Gastrin、Calcitonin、α-hCG、ACTH、Serotonin、PP、VIP、Glucagon等免疫组织化学染色. 光镜观察. 所用一抗和EliVision试剂盒均购自福州迈新生物技术开发有限公司.
部分胰腺切除标本, 大小3.0 cm×2.5 cm×2.0 cm, 切面见一类圆形肿物, 大小2.2 cm×2.1 cm×1.5 cm, 边界尚清, 无明显包膜, 切面灰红灰白色, 质地较软.
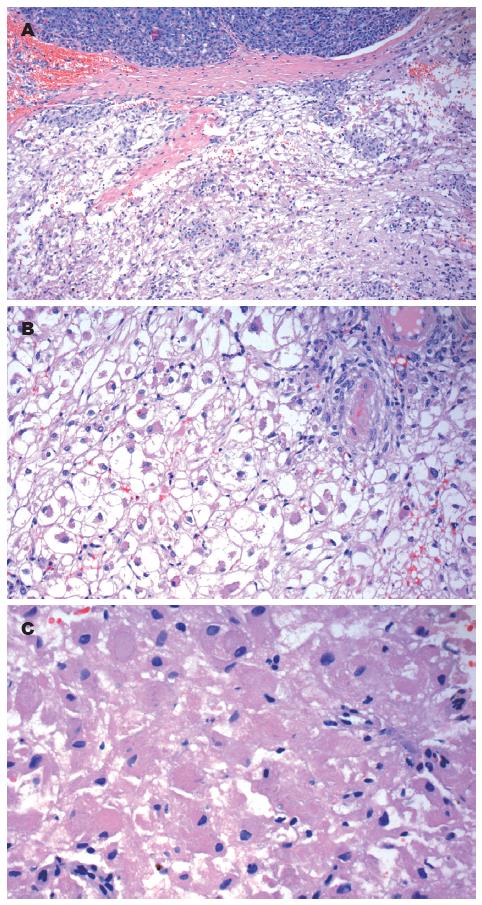
肿瘤细胞呈巢状和片状排列, 与周围胰腺组织界限清楚(图1A). 肿瘤内含丰富的厚壁和薄壁血管, 上皮样细胞围绕血管或血管间呈成巢、成片或器官样排列. 肿瘤细胞体积大, 呈圆形或多边形, 胞质丰富, 透亮或颗粒状、淡嗜酸性(图1B). 肿瘤细胞核小, 轻度异型, 居中或偏位, 呈圆形、卵圆形或不规则形, 染色质细腻, 核仁不明显, 无核分裂象(图1C).
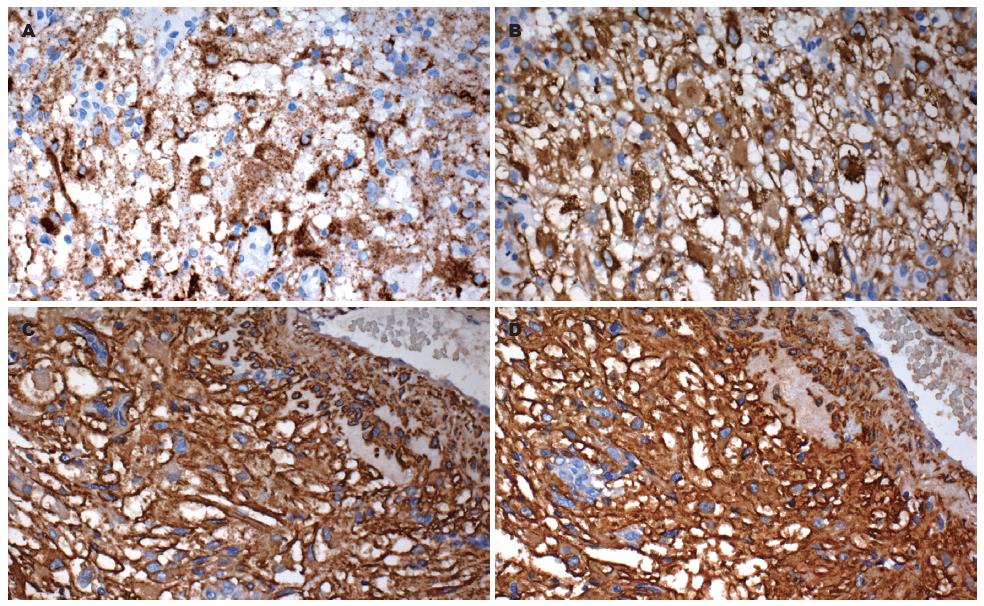
肿瘤细胞HMB45(图2A)、Melan-A(图2B)、SMA(图2C)、HHF35(图2D)、Vimentin弥漫强阳性, D2-40和S-100呈弱阳性表达, Syn、CK(Pan)、CD117、CD34、Insuin、Somatostatin、Gastrin、Calcitonin、α-hCG、ACTH、Serotonin、PP、VIP、Glucagon均阴性.
胰腺PEComas, 单向型上皮样血管平滑肌脂肪瘤. 术后随访5 mo无瘤生存.
根据Martignoni等[2]2008年的报道, 血管周上皮样细胞(perivascular epithelioid cell, PEC)作为组成肾脏AML的异常肌母细胞, 是1943年由Apitz最先提出的, 直到1992年, Bonetti等[3]才赋予了PEC新的含义. 他们将PEC定义为分布于血管周围, 常围绕血管呈放射状排列, 免疫组织化学特异性表达黑色素细胞及肌细胞标志物的PEC. 随后, 陆续发现多种发生在不同部位、貌似互不相关的肿瘤如AML、CCST、LAM、CCMMT等均由PEC组成, 相互之间存在密切关系, 属同一家族. 因此, 1996年Zamboni等[4]根据其基本的结构及其特殊的免疫表型特点将上述肿瘤定义为PEComas, 并很快获得病理工作者的认可.
PEComas好发于实质脏器和腹腔, 包括肝脏、肾脏、肺脏、子宫、胃肠道、阔韧带、乳腺、大网膜、前列腺、膀胱、胰腺、胆总管、软组织等. 多见于女性, 各年龄段均可发病, 中位年龄46岁. 临床症状取决于肿瘤发生部位, 多数表现为无痛性肿块. 影像学检查: 除了AML富含脂肪外, 家族其他成员常因肿瘤无脂肪成分而难以与癌或肉瘤鉴别[2]. 发生在胰腺的PEComas很罕见, 自1996年Zamboni等[4]报道首例以来, 迄今仅国外报道6例[4,6-9], 均为女性, 中位年龄54岁, 临床常表现为腹痛、腹胀、食欲减退和体质量下降, 实验室检查常无特殊. 本文报道的胰腺PEComas, 系女性患者, 临床表现反复上腹痛6 mo余, 对症治疗无明显缓解, 并出现全身皮肤黄染、大便陶土色, 体质量下降7 kg, 腹部MRI示胰头占位, 拟胰腺恶性肿瘤而收治入院.
关于PEComas的组织起源及发病机制迄今尚不十分清楚. 有研究发现, 1/3-1/2的AML和LAM患者临床伴有结节性硬化综合征(the tuberous sclerosis complex, TSC), 准确地说与TSC1和TSC2基因突变有关[10]. TSC为常染色体显性遗传性疾病, 系由TSC1(9q34)和TSC2(16p13.3)基因突变、缺失等引起的一系列临床症状. TSC基因通过调节Rheb/mTOR/p70S6K途径上发挥重要作用. Kenerson等[11]证实在AML中磷酸化的p70S6K(mTOR活性的标志物)高表达, 磷酸化的蛋白激酶B的低表达与TSC1或TSC2功能破坏是一致的.
尽管PEComas家族成员的肿瘤细胞均为PEC, 但不同成员的组织形态学表现不尽相同. AML主要由比例不等的脂肪组织、梭形或上皮样的平滑肌细胞和异常的厚壁血管3种成分混合组成. CCST由纤细的血管网和围绕血管周围成片、成巢或器官样排列的上皮样或梭形透明细胞组成, 一般无厚壁血管. CCMMT与CCST相似, 由大量纤细的血管网将梭形或上皮样细胞分隔成巢状、片状和腺泡状. LAM由淋巴管及其周围增生的淋巴管肌细胞所组成. 有学者提出AML、CCST、CCMMT和LAM可能是PEComas的不同阶段, 建议诊断时除了用PEComas外, 还需注明具体名称, 以便临床医生更好的理解[2].
PEComas免疫表型具有特征性, 所有家族成员均特异性表达黑色素细胞和平滑肌细胞标志物, 而上皮细胞标记(CK、EMA)阴性. 黑色素细胞标志物中HMB45表达最敏感, 其次是Melan-A和MitF; 平滑肌标记主要表达SMA和Actin. 此外, 肿瘤细胞还可以表达desmin、Vimentin、S-100等. 超微结构特征: 肿瘤细胞外可见断续的基膜样物质, 胞质内细胞器较丰富, 可见成束的微丝、糖原颗粒、发育好的粗面内质网、大量线粒体和类似黑色素小体的结构及致密颗粒.
PEComas生物学行为未定, 原因在于该病是WHO新近分类的肿瘤, 迄今无大宗病例报道, 人们对其预后认识不足. 已有报道显示PEComas有良性、交界性和恶性[12,13]. Folpe等[14]总结了26例软组织和女性生殖系统PEComas并提出以下诊断暂行标准. (1)良性: 肿瘤直径≤5 cm、非浸润性生长、无高的核分级和细胞高密度、核分裂象≤1个/50个HPF、无坏死、无血管侵犯; (2)恶性潜能未定: 仅有核的多形性/多核巨细胞、或肿瘤直径仅>5 cm; (3)恶性: 具有两个或更多下列相关指标: 肿瘤直径>5 cm、浸润性生长、高的核分级和细胞高密度、核分裂象>1个/50 HPF、坏死、血管侵犯.
本例形态学特征表现如下: (1)形态多样的上皮样细胞呈弥漫、不规则片状、结节状, 或围绕扩张的厚壁/薄壁血管呈放射状排列; (2)肿瘤细胞呈圆形、多边形或短梭形, 胞质丰富、透明至淡嗜伊红色; 细胞核圆形或不规则形、居中或偏位, 染色质细腻, 核仁不明显, 核分裂象罕见; (3)免疫表型: HMB45、Melan-A、SMA、HHF35、Vimentin弥漫强阳性, D2-40和S-100弱阳性, Syn、CK(Pan)、CD117、CD34、Insuin、Somatostatin、Gastrin、Calcitonin、α-hCG、ACTH、Serotonin、PP、VIP、Glucagon均阴性. 本例肿瘤中虽无脂肪成分, 但富含厚壁、扭曲的血管, 最后诊断: 胰腺PEComas, 单向型EAML.
胰腺PEComas需要与以下原发性及继发性胰腺肿瘤进行鉴别诊断: (1)恶性黑色素瘤[15]: 二者肿瘤细胞均表达HMB-45、Melan-A, 但后者还表达S-100, 而不表达肌源性标志物; (2)原发性或继发性透明细胞癌[16]: 透明细胞癌亦富于糖原及纤细的血管网, 细胞异型性也不明显, 很难与CCST鉴别, 但后者表达上皮性, 而不表达HMB-45和肌源性标志物, 易与CCST鉴别; (3)神经内分泌肿瘤[17]: 好发于胰腺, 肿瘤也富于血管, 但后者表达神经内分泌的标记, 而不表达HMB-45和肌源性标志物, 很容易鉴别; (4)恶性纤维组织细胞瘤[18]: 肿瘤由纤维组织细胞组成, 常呈梭形、车辐状排列, 另见大量瘤巨细胞、病理核分裂象及间质炎症细胞浸润. 仅从形态学特点很容易与前者鉴别; (5)实性-假乳头状瘤[19]: 组织学可见瘤细胞围绕血管排列成片块状、巢状的实性区及有纤维血管轴心的分支状假乳头两种排列方式, 肿瘤细胞不表达HMB-45、Melan-A, 但表达CD10、CD56、 NSE等; (6)嗜酸细胞癌[20]: 由成片或成巢富含颗粒状、嗜酸性胞质的瘤细胞构成, 不易与前者区别, 但后者细胞核大, 核仁明显, 且表达上皮性标标志物, 而不表达HMB-45和肌源性标志物, 可以鉴别.
PEComas以手术完整切除为主要治疗方法, 针对该病的特效性药物治疗目前无相关文献报道. Kenerson等[11]通过免疫组织化学和免疫印记证实, 临床不伴有TSC的肾及肾外AML中有1/2病例TSC失活及mTOR高表达. Rapamycin是特效的mTOR抑制剂[21], 目前动物TSC模型及临床肾AML的治疗研究已取得满意效果, 但是否适用于其他部位的PEComas, 有待进一步研究. PEComas的预后与肿瘤大小、浸润性生长模式、高级别核、肿瘤坏死、核分裂象、是否转移等生物学行为密切相关. 多数恶性PEComas与高度恶性肉瘤一样, 具有高度侵袭性, 容易发生早期转移而死亡. 少数恶性PEComas可在若干年(7-9年)后发生转移[2].
总之, 胰腺PEComas是一种生物学行为未定的间叶源性肿瘤, 有其独特的组织学形态、免疫组织化学表型以及超微结构特征. 目前尚无明确的良、恶性诊断标准, 治疗主要以手术为主, 并在术后长期密切随访.
PEComas主要发生于肾脏和肝脏, 发生于胰腺的极为罕见, 目前国外仅报道6例, 国内尚未见报道. 临床医生和病理医生对胰腺PEComas的临床病理特征认识不足, 容易误诊.
于颖彦, 教授, 上海交通大学医学院附属瑞金医院器官移植中心病理室
PEComas是1996年Zamboni等在报道1例发生在胰腺的透明细胞糖瘤时提出的, 用以描述一类具有相似形态学和免疫表型特征的肿瘤, 包括: AML、CCST、LAM、CCMMT.
本文主要对1例胰腺PEComas的临床诊疗经过、病理形态学特征及免疫表型进行总结, 并复习相关文献, 探讨胰腺PEComas的临床及病理形态学特征.
胰腺PEComas的组织形态学表现多样化, 容易误诊. 在胰腺肿瘤的鉴别诊断中应想到此肿瘤的可能, 免疫组织化学同时表达黑色素细胞和平滑肌细胞标志物有助鉴别.
本文选题新颖, 对从事肿瘤病理诊断工作者有较好的借鉴作用.
编辑: 曹丽鸥 电编:何基才
| 1. | Fletcher CDM, Unni KK, Mertens F. Pathology and Genetics of Tumors of Soft Tissue and Bone. World Health Organization Classification of Tumors, Lyon, France: IARC Press 2002; 221-222. |
| 2. | Martignoni G, Pea M, Reghellin D, Zamboni G, Bonetti F. PEComas: the past, the present and the future. Virchows Arch. 2008;452:119-132. [PubMed] [DOI] |
| 3. | Bonetti F, Pea M, Martignoni G, Zamboni G. PEC and sugar. Am J Surg Pathol. 1992;16:307-308. [PubMed] [DOI] |
| 4. | Zamboni G, Pea M, Martignoni G, Zancanaro C, Faccioli G, Gilioli E, Pederzoli P, Bonetti F. Clear cell "sugar" tumor of the pancreas. A novel member of the family of lesions characterized by the presence of perivascular epithelioid cells. Am J Surg Pathol. 1996;20:722-730. [PubMed] [DOI] |
| 5. | Heywood G, Smyrk TC, Donohue JH. Primary angiomyolipoma of the pancreas. Pancreas. 2004;28:443-445. [PubMed] [DOI] |
| 6. | Ramuz O, Lelong B, Giovannini M, Delpero JR, Rochaix P, Xerri L, Hassoun J, Flejou JF, Monges G. "Sugar" tumor of the pancreas: a rare entity that is diagnosable on preoperative fine-needle biopsies. Virchows Arch. 2005;446:555-559. [PubMed] [DOI] |
| 7. | Périgny M, Larochelle O, Hammel P, Sauvanet A, Dokmak S, Belghiti J, Ruszniewski P, Vilgrain V, Bedossa P, Couvelard A. [Pancreatic perivascular epithelioid cell tumor (PEComa)]. Ann Pathol. 2008;28:138-142. [PubMed] [DOI] |
| 8. | Hirabayashi K, Nakamura N, Kajiwara H, Hori S, Kawaguchi Y, Yamashita T, Dowaki S, Imaizumi T, Osamura RY. Perivascular epithelioid cell tumor (PEComa) of the pancreas: immunoelectron microscopy and review of the literature. Pathol Int. 2009;59:650-655. [PubMed] [DOI] |
| 9. | Baez JC, Landry JM, Saltzman JR, Qian X, Zinner MJ, Mortelé KJ. Pancreatic PEComa (sugar tumor): MDCT and EUS features. JOP. 2009;10:679-682. [PubMed] |
| 10. | van Slegtenhorst M, de Hoogt R, Hermans C, Nellist M, Janssen B, Verhoef S, Lindhout D, van den Ouweland A, Halley D, Young J. Identification of the tuberous sclerosis gene TSC1 on chromosome 9q34. Science. 1997;277:805-808. [PubMed] [DOI] |
| 11. | Kenerson H, Folpe AL, Takayama TK, Yeung RS. Activation of the mTOR pathway in sporadic angiomyolipomas and other perivascular epithelioid cell neoplasms. Hum Pathol. 2007;38:1361-1371. [PubMed] [DOI] |
| 12. | Yamamoto H, Oda Y, Yao T, Oiwa T, Kobayashi C, Tamiya S, Kawaguchi K, Hino O, Tsuneyoshi M. Malignant perivascular epithelioid cell tumor of the colon: report of a case with molecular analysis. Pathol Int. 2006;56:46-50. [PubMed] [DOI] |
| 13. | Gleeson FC, de la Mora Levy JG, Zhang L, Levy MJ. The differential broadens. EUS FNA appearance and cytological findings of pancreatic angiomyolipoma. JOP. 2008;9:67-70. [PubMed] |
| 14. | Folpe AL, Mentzel T, Lehr HA, Fisher C, Balzer BL, Weiss SW. Perivascular epithelioid cell neoplasms of soft tissue and gynecologic origin: a clinicopathologic study of 26 cases and review of the literature. Am J Surg Pathol. 2005;29:1558-1575. [PubMed] [DOI] |
| 15. | He MX, Song B, Jiang H, Hu XG, Zhang YJ, Zheng JM. Complete resection of isolated pancreatic metastatic melanoma: a case report and review of the literature. World J Gastroenterol. 2010;16:4621-4624. [PubMed] [DOI] |
| 16. | Lee HY, Lee DG, Chun K, Lee S, Song SY. Clear cell carcinoma of the pancreas -a case report and review of the literature-. Cancer Res Treat. 2009;41:175-181. [PubMed] [DOI] |
| 18. | Yu RS, Wang JW, Chen Y, Ding WH, Xu XF, Chen LR. A case of primary malignant fibrous histiocytoma of the pancreas: CT and MRI findings. World J Gastroenterol. 2008;14:2942-2945. [PubMed] [DOI] |
| 19. | Liu X, Rauch TM, Siegal GP, Jhala N. Solid-pseudopapillary neoplasm of the pancreas: Three cases with a literature review. Appl Immunohistochem Mol Morphol. 2006;14:445-453. [PubMed] [DOI] |
| 20. | Zerbi A, De Nardi P, Braga M, Radice F, Sironi M, Di Carlo V. An oncocytic carcinoma of the pancreas with pulmonary and subcutaneous metastases. Pancreas. 1993;8:116-119. [PubMed] [DOI] |
| 21. | Cohen E. mTOR inhibitors. Clin Adv Hematol Oncol. 2006;4:38-39. [PubMed] |