修回日期: 2011-01-26
接受日期: 2011-02-15
在线出版日期: 2011-03-18
目的: 探讨猪背驮式肝移植手术的改进方式, 提高猪肝移植的生存率.
方法: 对照组用方法1行猪背驮式肝移植: 用彭式解剖分离器"刮吸法"保留下腔静脉, 切除受体肝. 实验组用方法2, 暂时性门腔分流猪背驮式肝移植. 在方法1的"刮吸法"保留下腔静脉, 切除受体肝的基础上加暂时性门腔分流. 冷缺血时间、无肝期、手术时间、失血量、生存期等观察指标用SPSS13.0的t检验和生存分析作统计处理.
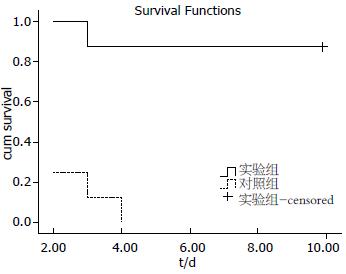
结果: 对照组和实验组分别实施猪肝移植8对. 手术成功率分别87.5%、100%. 冷缺血时间分别为: 142.8 min±7.4 min, 155.6 min±8.3 min(P = 0.006). 无肝期分别为: 25.8 min±1.3 min, 36.3 min±1.0 min(P = 0.000). 手术时间分别为: 264.1 min±9.5 min, 277.3 min±8.6 min(P = 0.012). 失血量分别为: 892.5 mL±113.9 mL, 888.8 mL±93.7 mL(P = 0.94), 1 d生存率分别为87.5%、100%, 2 d生存率分别为25%、100%, 3 d生存率分别为12.5%、87.5%, 4 d生存率分别为0.0%、87.5%. 实验组87.5%肝移植猪术后生存超过10 d(P = 0.000).
结论: 猪暂时性门腔分流背驮式肝移植的方法, 维持手术期间血流动力学稳定, 减轻门静脉系统淤血. 减少胃肠道淤血是猪肝移植成功和提高生存率的关键.
引文著录: 刘静, 陈达丰, 杨爱国, 周松, 邹耀祥, 聂凯, 李冉冉, 刘广欣. 猪暂时性门腔分流背驮式肝移植模型的建立. 世界华人消化杂志 2011; 19(8): 832-835
Revised: January 26, 2011
Accepted: February 15, 2011
Published online: March 18, 2011
AIM: To improve the piggy-back orthotopic liver transplantation (PBOLT) technique in pigs and to enhance the survival rate of pigs after liver transplantation.
METHODS: Pigs were divided into control group and experimental group. The inferior caval vein was separated from the liver of recipients by curettage and aspiration using Peng's multifunctional operative dissector in the control group. Temporary portacaval shunting was added in the experimental group to reduce congestion in the portal system during anhepatic phase.
RESULTS: The PBOLT procedures were performed in eight pairs of pigs in both the control group and experimental group, with a success rate of 87.5% and 100%, respectively. There were significant differences in cold ischemia time (142.8 min ± 7.4 min vs 155.6 min ± 8.3 min, P = 0.006), anhepatic phase duration (25.8 min ± 1.3 min vs 36.3 min ± 1.0 min, P = 0.000), and operation time (264.1 min ± 9.5 min vs 277.3 min ± 8.6 min, P = 0.012) between the two groups though no significant difference was noted in mean bleeding volume (892.5 mL ± 113.9 mL vs 888.8 mL ± 93.7 mL, P = 0.94). The 1-, 2-, 3- and 4-day survival rates were 87.5% and 100%, 25% and 100%, 12.5% and 87.5%, and 0% and 87.5% in the control group and experimental group, respectively. On day 10 after PBOLT, 87.5% of pigs of the experimental group were still alive (P = 0.000).
CONCLUSION: PBOLT with temporary portacaval shunting can maintain hemodynamic stability and relieve congestion of the portal system in pigs during liver transplantation. Control of gastrointestinal congestion is key to the success of liver transplantation and can raise the survival rate of pigs after liver transplantation.
- Citation: Liu J, Chen DF, Yang AG, Zhou S, Zou YX, Nie K, Li RR, Liu GX. Development of an improved pig model of piggyback liver transplantation with temporary portacaval shunting. Shijie Huaren Xiaohua Zazhi 2011; 19(8): 832-835
- URL: https://www.wjgnet.com/1009-3079/full/v19/i8/832.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i8.832
由于猪肝在诸多方面是与人肝相似, 猪肝移植模型在研究肝移植排斥反应发生机制、免疫抑制使用、免疫耐受、器官保存、缺血再灌注损伤等方面具有许多优越性, 所以猪肝移植是用得较多的大动物肝移植模型[1]. 由于静脉转流经典肝移植和非转流肝移植手术方式的不足, 苗雄鹰等[2]改善了肝移植的方法, 创建了猪背驮式原位肝移植(piggy-back orthotopic liver transplantation, PBOLT)的动物模型, 提高了成功率. 由于猪解剖特点, 猪胃肠道体积大, 所占血流比例大, 因此维持无肝期门静脉(portal vein, PV)血流通畅, 减少胃肠道淤血是PBOLT成功的关键[3]. 我们进行肝移植免疫耐受的诱导研究[4,5], 从2003-01开始经历转流下猪原位肝移植, 非转流猪原位肝移植, 非转流猪PBOLT. 在非转流猪PBOLT手术技巧成熟后, 于2008-02/2008-10,对猪PBOLT的动物模型手术方式进一步改进, 建立了暂时性门腔分流猪PBOLT的动物模型, 使手术成功率, 术后生存率明显提高, 生存时间明显延长, 取得了满意的结果.
从福建省漳州市郊收购上海白色猪32头, 平均体质量44 kg±3 kg, 供体体质量略轻于受体, 雌雄不限, 供、受体间无明确的血缘关系. 供、受体分别为16头. 且供体作为输血源. 受体术前24 h禁食, 6 h禁水.
1.2.1 麻醉与监测: 麻醉术前5-18 min常规0.6 mg 阿托品肌注, 以防止术中呕吐及误吸. 供、受体均采用先用氯胺酮15 mg/kg肌注行麻醉诱导, 再气管插管, 复合麻醉, 直视下右颈内动脉插管以监测动脉压, 右颈内静脉插双腔管监测中心静脉压、心电图、体温、呼吸等.
1.2.2 分组: 对照组和实验组供受体各8头, 分别按手术方法1, 方法2交替进行手术.
1.2.3 观察指标: 冷缺血时间、无肝期、手术时间、失血量、生存时间. 术后死亡当天作解剖观察大体病理.
1.2.4 手术: 方法1: 供体肝素化后在经颈内静脉输平衡液同时, 十字切口入腹, 迅速经腹主动脉末端插管外接血袋, 收集全血1 000 mL待用后,即灌注4 ℃生理盐水1 500 mL, 同时经肠系膜上静脉插管灌注4 ℃盐水1 500 mL, 在肾静脉平面以下剪开下腔静脉(inferiorvena cava, IVC), 用红细胞回收仪收集红细胞待用. 待肝脏颜色变为黄白色后, 常规方法取肝, 在4 ℃生理盐水中修肝. 方法2: 仅在受体肝脏及周围管道结构分离好后先行PV与IVC的端侧吻合后, 再按方法1的方法吻合肝上IVC后, 再阻断PV, 行PV端端吻合, 其他手术步骤同方法1, 肝动脉吻合后, 以5-0 prolene连续缝合肝下IVC暂时性切口.
统计学处理 两种手术方法冷缺血时间、无肝期、手术时间、失血量统计分析处理用两个独立样本t检验, 生存时间比较用生存分析中乘积极限法(Kaplan-Meier法)作生存曲线, 用Log-rank等进行显著性检验.
用方法1, 方法2实施猪肝移植各8次, 手术成功率87.5%、100%. 冷缺血时间分别为: 142.8 min±7.4 min、155.6 min±8.3 min[t = -3.3, 95%CI: (-21.3)~(-4.4), P = 0.006]. 无肝期分别为: 25.8 min±1.3 min, 36.3 min±1.0 min[t = -18.0, 95%CI: (-11.7)~(-9.3), P = 0.000]. 手术时间分别为: 264.1 min±9.5 min, 277.3 min±8.6 min[t = -2.9, 95%CI: (-22.8)~(-3.4), P = 0.012]. 失血量分别为: 892.5 mL±113.9 mL, 888.8 mL±93.7 mL[t = 0.072, 95%CI: (-108.1)~115.6, P = 0.94]. 术后1 d生存率分别为: 87.5%、100%, 2 d生存率分别为: 25%、100%, 3 d生存率分别为12.5%、87.5%, 4 d生存率分别为: 0.0%、87.5%. 实验组87.5%生存超过10 d(χ2 = 14.4, 95%CI: 0.4-5.6, P = 0.000, 图1). 死亡解剖所见: 对照组中1例术中血压不稳定术后3 h死亡, 肠道淤斑, 水肿严重. 5例见800 mL以内的血性腹水, 各1例见500 mL淡红色腹水, 黄色腹水. 实验组1例术后49 h因肝动脉血栓死亡, 其余7例术后生存时间均超过10 d, 于术后第10天宰杀, 见肝脏与周围组织粘连, 肝脏组织稍红.
经典式肝移植由于同时阻断了PV和IVC, 术中易出现低血容量性休克, 术中需大量输血、输液, 无肝期造成的酸中毒、高血钾、液体负荷、肺水肿、胃肠道淤血、细菌酵解产生大量内毒素进入体循环, 是导致恢复受体PV血流后和围手术期死亡的主要原因[6]. 而转流下的猪肝移植术虽然解决了同时阻断PV和IVC的不足, 但是除了转流泵的昂贵价格外, 转流术操作费时、易导致血栓形成和栓塞、血细胞机械性破坏、转流切口的淋巴水肿、内环境的不稳定性等缺点, 这明显限制了其在猪肝移植中的应用[7]. PBOLT虽然明显缩短了无肝期, 无下肢及肾淤血危险, 保证血流动力学的稳定[8]. 但因猪的胃肠道体积大, 血液丰富, 胃肠道淤血对机体内环境严重地干扰, 复流后胃肠道缺血再灌注损伤严重. 要建立稳定的猪肝移植模型, 必须降低胃肠淤血所导致术中血流动力学的不稳定程度, 减轻PV系统淤血是猪PBOLT成功的关键[3]. 无肝期保留PV系统腔静脉系统血流通畅的PBOLT是一较理想的肝移模型[9]. 而肠系膜下静脉与右肾平面以下的IVC行侧侧吻合的方法在行背驮式肝移植无肝期较好地保持PV、腔静脉血流通畅, 但由于猪肠道所占体积大, 血流所占全身百分比大, 肠系膜下静脉与IVC间由于有一段距离, 受肠系膜上静脉口径大小影响的原因, 引流PV系统的血液不彻底, 术后PV的部分血液不经过肝脏而直接进入血液体循环, 可能对移植肝的营养产生不利影响, 或由于肠系膜下静脉口径小, 流速慢, 在无肝期后关闭肠系膜下静脉与IVC的侧吻合口后, 所以容易导致肠系膜血栓形成, 影响肝移植术后猪的生存期. Belghiti等[10]曾临床上应用暂时性门腔分流术PBOLT的方法. 暂时性门腔分流术猪PBOLT方法能减少移植肝的体积、减轻PV的压力、较少出血、维持良好的肾功能、预防内脏的淤血, 有利于血流动力学的稳定, 减轻再灌注损伤[7,11-14]. 未见文献报道用这种方法建立猪肝移植模型.
本研究的方法1基本按苗雄鹰等[2]报道的方法行猪PBOLT, 主要有几点不同: (1)分离受体肝后IVC时开始用彭式解剖分离器"刮吸法"自下方开始, 结合向左右翻转肝脏, 处理第二, 第三肝门, 小血管(<3 mm)电凝, 稍大血管钳夹后切断结扎, 切除肝脏; (2)手术放大镜下前后壁分别用7-0 prolene端端连续缝合肝动脉、以6-0 PDS端端连续缝合胆总管; (3)不放置腹腔引流; (4)在进行血管、胆管吻合时用"三缝一拉"的方法[15]. 但, 方法1和方法2中失血量统计分析无差异, 虽然在冷缺血时间、无肝期、手术时间方面比较, 方法2较方法1时间长, 差异具有统计学意义, 用方法1行PBOLT的手术成功率为87.5%,与文献[3]报道相近. 用方法2行暂时性门腔分流术PBOLT术后猪生存期较方法1术后猪生存期长, 差异有显著统计学意义. 分析其原因可能有: (1)因为胃肠道所占体积较大, 猪PV流量占全身血流比例大, 且受体猪术前不存在因肝硬化引起的门腔分流侧支循环, 所以在猪PV完全阻断后, 胃肠道瘀血水肿较有肝硬化的临床肝移植患者胃肠道瘀血水肿重. 方法2保证了肝上IVC吻合时保留了PV和IVC血流, 无肝期有潜在危险性血流动力学的不稳定、胃肠淤血、内毒素产生、酸中毒和高血钾等均被解除[8], 减少了PV复流后内环境的干扰; (2)方法2中尽管无肝期较长, 但是无肝期间有PV足够血液流入体循环, 在门腔分流前阻断PV对于肝上IVC吻合后, PV吻合前的再次阻断PV可能起到了预处理的保护作用, 因此短暂阻断PV使猪胃肠道、心血管对随后阻断PV的耐受性增强; (3)可以在无肝期期间无肝脏遮挡的情况下进行从容地彻底止血, 降低了肝移植术后创面出血的风险.
因猪的肝后IVC几乎都被肝右叶包绕, 因此分离第二, 第三肝门是猪PBOLT较难的操作,也是容易出现大出血、空气栓塞易引起猪术中死亡的关键步骤之一. 本实验用彭式解剖分离器,"刮吸法"分离第二, 第三肝门, 降低了猪PBOLT的难度, 术者将彭式解剖分离器作为优化电刀和吸引器功能器械在临床工作中常规应用, 熟练地使用此器械, 降低了分离第二, 第三肝门的难度. 仔细分离, 提前准备阻断钳, 一旦大出血, 及时部分阻断IVC, 缝合破口是保证手术成功的重要步骤之一.
应用手术放大镜可以使肝动脉及胆总管的吻合更为精准, 减少肝动脉吻合口出血, 狭窄, 血栓形成机会和胆总管狭窄和胆漏的机会. 在吻合血管和胆管时应用"三缝一拉"的方法[15], 有助于做到适合的针距、边距, 加快吻合速度,缩短吻合时间. 本实验对照组肝移植猪生存率较文献报道低[16], 具体原因不清, 有待进一步研究.
对厦门大学附属东南医院麻醉科卢承志教授等多名医师、手术室谢玮娜主管护师及普外科等多名护师在手术中地配合表示感谢.
由于猪肝在诸多方面与人肝相似, 猪肝移植模型在研究肝移植排斥反应发生机制、免疫抑制使用、免疫耐受、器官保存、缺血再灌注损伤等方面具有许多优越性, 猪肝移植模型是常用大动物肝移植模型.
戴朝六, 教授, 中国医科大学第二临床学院(盛京医院)肝胆外科; 徐泱, 副教授, 上海复旦大学附属中山医院肝肿瘤外科
苗雄鹰等改善了肝移植的方法, 创建了猪背驮式原位肝移植的动物模型, 提高了成功率.
本文进一步改进猪背驮式原位肝移植的手术方式, 建立了猪暂时性门腔分流背驮式原位肝移植的模型, 使手术成功率、术后生存率明显提高, 生存时间明显延长, 取得了满意的结果.
本文用彭式解剖分离器,"刮吸法"分离第二, 第三肝门, 降低了猪背驮式原位肝移植的难度, 暂时性门腔分流背驮式原位肝移植, 无肝期间猪门静脉足够血液流入体循环, 减轻了猪门静脉系统淤血, 术后猪生存期长, 此猪肝移植模型有利于建立稳定的猪肝移植模型, 便于进行实验研究和临床肝移植队伍的训练.
本文创新性较好, 对临床进一步正确认识门静脉淤血及其再灌注对机体与移植肝的影响有一定的参考意义, 对进一步做好、做精肝脏移植手术有一定的理论价值.
编辑: 李薇 电编:李薇
| 1. | Oike F, Uryuhara K, Otsuka M, Dehoux JP, Otte JB, Lerut J, Gianello P. Simplified technique of orthotopic liver transplantation in pigs. Transplantation. 2001;71:328-331. [PubMed] [DOI] |
| 5. | Liu J, Gao Y, Wang S, Sun EW, Wang Y, Zhang Z, Shan YQ, Zhong SZ. Effect of operation-synchronizing transfusion of apoptotic spleen cells from donor rats on acute rejection of recipient rats after liver transplantation. World J Gastroenterol. 2005;11:1161-1166. [PubMed] |
| 7. | Torres OJ, Pantoja PB, Barbosa ES, Barros Cde A, Servin ET, Servin SC. Hemodynamic alterations during orthotopic liver experimental transplantation in pigs. Acta Cir Bras. 2008;23:135-139. [PubMed] [DOI] |
| 8. | Fonouni H, Mehrabi A, Soleimani M, Müller SA, Büchler MW, Schmidt J. The need for venovenous bypass in liver transplantation. HPB (Oxford). 2008;10:196-203. [PubMed] |
| 9. | Doria C, Bodzin AS, Frank AM, Maley WR, Ramirez CB. An alternative surgical technique for caval preservation in liver transplantation. J Gastrointest Surg. 2010;14:1040-1044. [PubMed] [DOI] |
| 11. | Belghiti J, Noun R, Sauvanet A. Temporary portocaval anastomosis with preservation of caval flow during orthotopic liver transplantation. Am J Surg. 1995;169:277-279. [PubMed] [DOI] |
| 12. | Navarro F, Le Moine MC, Fabre JM, Belghiti J, Cherqui D, Adam R, Pruvot FR, Letoublon C, Domergue J. Specific vascular complications of orthotopic liver transplantation with preservation of the retrohepatic vena cava: review of 1361 cases. Transplantation. 1999;68:646-650. [PubMed] [DOI] |
| 13. | Belghiti J, Ettorre GM, Durand F, Sommacale D, Sauvanet A, Jerius JT, Farges O. Feasibility and limits of caval-flow preservation during liver transplantation. Liver Transpl. 2001;7:983-987. [PubMed] [DOI] |
| 14. | de Cenarruzabeitia IL, Lázaro JL, Bilbao I, Balsells J. Portocaval shunt throughout anhepatic phase in orthotopic liver transplantation for cirrhotic patients. Transplant Proc. 2007;39:2280-2284. [PubMed] [DOI] |
| 15. | Farantos C, Arkadopoulos N, Theodoraki K, Kostopanagiotou G, Katis K, Tzavara K, Andreadou I, Dimopoulou K, Hatzoudi E, Sidiropoulou T. Effect of the portacaval shunt on reperfusion injury after 65% hepatectomy in pigs. Eur Surg Res. 2008;40:347-353. [PubMed] [DOI] |
| 16. | 谢 金敏, 潘 明新, 张 会迎, 孔 凡东, 姚 坤厚, 王 琼, 高 毅. 非转流小型猪原位肝移植模型的建立及评价. 中国组织工程研究与临床康复. 2007;11:613-616. |