修回日期: 2011-01-13
接受日期: 2011-01-21
在线出版日期: 2011-03-18
目的: 明确5-FU处理胃癌MGC803细胞后自噬的存在, 并探讨自噬在5-FU诱导凋亡中的作用.
方法: 5-FU处理胃癌MGC803细胞. MTT检测细胞增殖能力. 流式细胞术检测细胞凋亡. Western blot检测蛋白表达. 荧光显微镜观察自噬的发生.
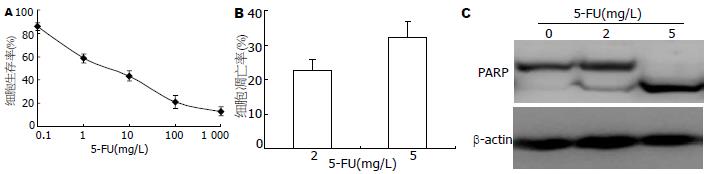
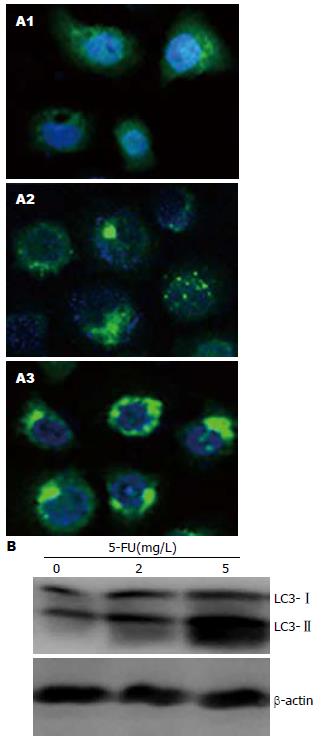
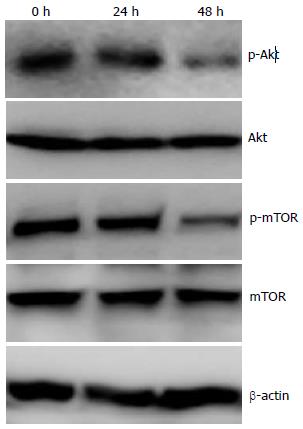
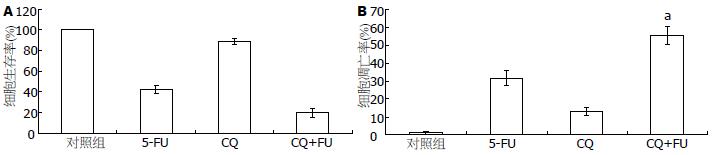
结果: 0.1-1 000 mg/L的5-FU作用MGC803细胞48 h, 抑制细胞增殖50%的药物浓度(IC50)为2.07 mg/L±1.14 mg/L. 2 mg/L和5 mg/L的5-FU作用细胞48 h, 细胞凋亡率分别为22.46%±3.21%和32.27%±4.52%. 同时, 5-FU诱导细胞自噬的发生, 观察到LC3的点状聚集和LC3-II蛋白的提高. 并且, 5-FU抑制了PI3K/Akt/mTOR通路的活性. 用氯喹抑制自噬明显提高了5-FU诱导的细胞凋亡(P<0.05).
结论: 5-FU诱导保护性自噬并阻止了胃癌MGC803细胞的凋亡. 5-FU和自噬抑制剂的联合应用可能是很有希望的胃癌治疗策略.
引文著录: 徐玲, 曲秀娟, 刘云鹏, 刘静, 丁小娣, 侯科佐, 张晔. 保护性自噬对5-FU诱导的胃癌细胞凋亡的抑制作用. 世界华人消化杂志 2011; 19(8): 777-781
Revised: January 13, 2011
Accepted: January 21, 2011
Published online: March 18, 2011
AIM: To investigate whether 5-fluorouracil (5-FU) induces autophagy in human gastric cancer cell line MGC803 and to identify the role of autophagy in 5-FU -induced cell apoptosis.
METHODS: After cultured MGC803 cells were treated with 5-FU, cell proliferation was measured using MTT assay; cell apoptosis was determined by flow cytometry; protein expression was detected by Western blot; and autophagy was observed by fluorescent microscopy.
RESULTS: The concentration of 5-FU inducing a 50% inhibition of cell proliferation (IC50) was 2.07 mg/L ± 1.14 mg/L in MGC803 cells. After treatment with 2 and 5 mg/L 5-FU for 48 h, the rates of cell apoptosis were 22.46% ± 3.21% and 32.27% ± 4.52%, respectively. Autophagy, characterized by an increase in the number of punctate LC3 dots and the level of LC3-II protein, was observed in cells treated with 5-FU. The activity of the PI3K/Akt/mTOR pathway was inhibited by 5-FU treatment. Inhibition of autophagy with chlorochine significantly enhanced 5-FU -induced apoptosis (P < 0.05).
CONCLUSION: 5-FU-induced protective autophagy prevents MGC803 cells from apoptosis. Combination therapy with 5-FU and autophagy inhibitors may be a promising therapeutic strategy for gastric cancer.
- Citation: Xu L, Qu XJ, Liu YP, Liu J, Ding XD, Hou KZ, Zhang Y. Protective autophagy inhibits 5-FU-induced apoptosis in human gastric cancer cell line MGC803. Shijie Huaren Xiaohua Zazhi 2011; 19(8): 777-781
- URL: https://www.wjgnet.com/1009-3079/full/v19/i8/777.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i8.777
5-FU作为传统化疗药在胃癌治疗中取得了很好的疗效, 以5-FU为基础的ECF方案成为胃癌的标准治疗方案[1,2]. 目前认为, 化疗药通过诱导肿瘤细胞的凋亡而实现对肿瘤的杀伤作用. 自噬是细胞内的降解系统, 通过传递细胞组分到溶酶体中进行降解而维持细胞代谢平衡[3]. 近年来的研究显示, 自噬在肿瘤的治疗中有不可忽视的作用, 而且自噬与凋亡有着密不可分的关系[4,5]. 最新的研究表明, 5-FU能诱导结肠癌细胞发生自噬, 这种保护性自噬使肿瘤细胞逃离了5-FU诱导的凋亡[6]. 但是, 5-FU是否可诱导胃癌细胞发生自噬尚无报道. 本研究观察了5-FU作用胃癌MGC803细胞前后自噬的变化, 初步探讨了自噬的发生机制及其与凋亡的关系.
RPMI1640培养基购于Gibco公司. 胎牛血清购于天津血液病研究所. RNase A购于AMRESCO公司. 碘化丙啶(PI)、甲基偶氮唑蓝(MTT)和氯喹(CQ)购于Sigma公司. Hoechst33342来自于Invitrogen公司. actin和Akt抗体购于Santa Cruz公司. LC3, PARP, 磷酸化Akt(phospho-Akt, p-Akt)(Ser-473), 磷酸化哺乳动物雷帕霉素靶蛋白(phospho mammalian target of rapamycin, p-mTOR)和mTOR抗体购自Cell Signaling公司.
1.2.1 细胞培养: 胃癌MGC803细胞为本实验室常规传代培养, 生长于含有100 mL/L灭活胎牛血清、12 kU/L庆大霉素的RPMI1640培养液中, 于37 ℃、50 mL/L CO2、饱和湿度的培养箱内培养, 0.25%胰酶消化液消化传代, 2-3 d传代1次.
1.2.2 细胞活力检测: 取对数生长期细胞接种于96孔板, 培养12 h后分别加入既定浓度的5-FU和氯喹, 每组设3个复孔, 每孔终体积为200 μL. 培养44 h后每孔加入MTT溶液(5 g/L)25 μL, 继续孵育4 h后吸去上清, 每孔加入200 μL DMSO, 振荡摇匀. 用酶标仪于570 nm波长条件下测定吸光度值.
1.2.3 细胞凋亡检测: 取对数生长期细胞接种于6孔板, 培养12 h后分别加入既定浓度的5-FU和氯喹. 48 h后分别收集对照组及处理组细胞, 700 mL/L乙醇固定4 h后, 加入10 μL的PI(20 mg/L), 避光孵育30 min, 用FACScan流式细胞仪进行检测, WinMDI软件进行分析.
1.2.4 Akt、mTOR、LC3、PARP的蛋白检测: 分别收集对照组及处理组细胞, 将其裂解于200 μL含有蛋白酶抑制剂(100 μg/mL PMSF, 2 μg/mL Aprotitin)的RIPA裂解液中[0.1% SDS, 1% Triton-100, 150 mmol/L NaCl, 1 mmol/L EDTA(pH8.0), 10 mmol/L Tris-HCl(pH7.5)], 4 ℃裂解40 min, 15 000 r/min离心20 min, 取上清, Lowry法进行蛋白定量. 与3×样品缓冲液混合后, 煮沸5 min. 将样品(50 μg/lane)在12%的SDS-聚丙烯凝胶中进行电泳3 h, 然后转印至硝酸纤维素膜上(电压: 2 mV/cm2; 时间: 40 min). 用5%脱脂牛奶封闭2 h后, 按预染Marker标记的分子量剪裁转印膜, 分别加入actin, LC3, PARP, p-Akt和Akt, p-mTOR和mTOR抗体, 4 ℃过夜. TTBS洗4次后加入辣根过氧化物酶标记的二抗室温作用30 min, ECL法显色, GIS凝胶图像分析系统照相并分析处理.
1.2.5 荧光显微技术检测自噬: 分析绿荧光蛋白融合的LC3(GFP-LC3)的定位, 用Lipofectamine 2000将编码GFP-LC3的质粒转染MGC803细胞中, 200 mg/L的G418筛选稳定转染细胞系. 用既定浓度的5-FU处理稳定转染细胞系48 h, Hoechst33342染细胞核后, 荧光显微镜下观察胃癌细胞中绿色荧光的分布.
统计学处理 所有数据均为3次独立实验结果, 以mean±SD表示. 采用SPSS13.0统计软件进行统计学分析. 两组之间比较采用t检验, P<0.05有统计学意义.
0.1-1 000 mg/L的5-FU作用MGC803细胞48 h, 抑制细胞增殖50%的药物浓度(IC50)为2.07 mg/L±1.14 mg/L(图1A). 选取2 mg/L和5 mg/L的5-FU作用细胞48 h, 细胞凋亡率分别为22.46%±3.21%和32.27%±4.52%(图1B). 2 mg/L的5-FU作用MGC803细胞48 h, 我们检测到PARP的裂解. 5-FU浓度提高5 mg/L, PARP的裂解更为明显(图1C). 这些结果表明, 5-FU能诱导胃癌MGC803细胞发生凋亡.
2 mg/L的5-FU处理GFP-LC3稳定转染的MGC803细胞48 h, 荧光显微镜观察到LC3的点状聚集, 而5 mg/L的5-FU诱导了更明显的LC3聚集(图2A). Western blot的结果显示, 2 mg/L的5-FU作用MGC803细胞48 h, 有LC3-Ⅱ蛋白的提高. 当5-FU浓度提高到5 mg/L, LC3-Ⅱ蛋白进一步提高(图2B). 上述结果表明, 5-FU能诱导胃癌MGC803细胞发生自噬.
与对照组相比, 5 mg/L的5-FU作用MGC803细胞24 h和48 h, p-Akt的活性逐渐下降. 与此同时, 下游p-mTOR的活性也有下调. 这些数据提示, 5-FU很可能通过抑制PI3K/Akt/mTOR通路诱导胃癌MGC803细胞的凋亡和自噬(图3).
5 mg/L的5-FU和20 μmol/L的氯喹(chloroquine, CQ)联合作用MGC803细胞48 h, 联合组与单药5-FU相比, 细胞增殖抑制率明显提高 (79.71%±4.28% vs 57.40%±3.45%, P<0.05, 图4A). 流式细胞仪结果显示, 5-FU和CQ的联合同样使细胞凋亡率明显增高(55.65%±4.89% vs 31.64%±3.98%, P<0.05, 图4B). 我们的结果证实, 抑制自噬增强了5-FU诱导的胃癌MGC803细胞凋亡.
早在1962年Ashford等就提出细胞自噬这一概念, 自噬是广泛存在于真核细胞中的生命现象, 他作为一种细胞生存的机制, 参与了细胞器的代谢和再利用. 虽然近年来对细胞自噬的研究取得了巨大的进展, 但是自噬与肿瘤发生发展的相互关系以及在肿瘤治疗中的调节机制尚未完全明确. 越来越多的报道显示, 某些肿瘤细胞在化疗药作用后发生自噬, 从而使肿瘤细胞逃离药物诱导的凋亡[7-9]. 5-FU作为传统化疗药, 在胃癌的治疗中一直有着举足轻重的地位. 最近的研究显示, 5-FU在诱导结肠癌细胞凋亡的同时, 也引起了自噬的发生[10]. 但5-FU是否能诱导胃癌细胞发生自噬尚无报道. 我们的研究显示, 随着5-FU浓度的提高, 对MGC803细胞的增殖抑制和诱导凋亡作用明显增强. 与此同时, 我们观察到了LC3绿色荧光的点状聚集和LC3-II蛋白的提高. LC3的特殊变化提示细胞自噬的发生. 这些结果证明, 5-FU诱导胃癌MGC803细胞凋亡的同时, 也诱导了自噬的发生.
在许多肿瘤中, PI3K/Akt信号通路存在活化, 这是克服肿瘤对药物耐药的关键靶点[11]. PI3K/Akt的主要作用是促进细胞增殖和阻止细胞凋亡[12-14]. mTOR是哺乳动物PI3K/Akt通路的下游效应物, 是一种丝氨酸/苏氨酸蛋白激酶. 一旦Akt活化, 下游分子mTOR接着被活化, 从而抑制凋亡的发生. 同时, mTOR也是自噬调节的关键靶点, 其活性是自噬体形成和成熟的关键, 抑制mTOR的活性能促进自噬的发生[15,16]. 我们的研究显示, 5-FU作用MGC803细胞24 h, Akt和mTOR的活性轻度被抑制. 而5-FU作用48 h后, Akt和mTOR的活性明显被抑制. 我们的结果提示, 5-FU很可能通过抑制PI3K/Akt/mTOR通路的活性来诱导胃癌MGC803细胞发生凋亡和自噬.
肿瘤细胞发生自噬后会出现两种不同的结果, 一种是稳定细胞内环境, 保护细胞逃离损害, 维持细胞存活; 另一种是启动细胞主动性的Ⅱ型细胞死亡程序, 发生自噬性细胞死亡. 最新的研究显示, 化疗药顺铂作用肿瘤细胞后引起的自噬反应使肿瘤细胞存活, 因此自噬的发生与化疗耐药密切相关[17]. Bijnsdorp等[18]报道, 由于三氟胸苷没有引起保护性自噬, 因此比5-FU诱导了更多的结肠癌细胞凋亡. 另有学者报道, 5-FU诱导的自噬是保护性自噬, 用自噬抑制剂能够增强结肠癌细胞对5-FU的敏感性[19]. CQ是一种自噬抑制剂, 他能增强不同化疗药物对肿瘤细胞的杀伤作用[20]. 在我们的研究中, 用CQ和5-FU联合作用胃癌MGC803细胞48 h, 诱导了更明显的增殖抑制和细胞凋亡. 这说明5-FU引起的自噬是保护性自噬, 他部分拮抗了5-FU诱导的胃癌细胞凋亡.
总之, 5-FU在诱导胃癌MGC803细胞凋亡时, 也诱导了保护性自噬. 抑制自噬的发生能增强5-FU对胃癌的杀伤作用. 5-FU和自噬抑制剂的联合应用很可能成为胃癌治疗的新策略, 为今后胃癌的临床治疗提供重要的理论依据.
感谢中国医科大学实验技术中心高建技师提供的荧光显微技术支持.
5-FU作为传统化疗药在胃癌治疗中取得了很好的疗效. 近年来的研究显示, 自噬在肿瘤的治疗中有不可忽视的作用, 而且自噬与凋亡有着密不可分的关系.
杜雅菊, 主任医师, 哈尔滨医科大学附属第二医院消化内科; 刘正稳, 教授, 西安交通大学医学院第一附属医院传染科
Li等于2010年报道, 5-FU能诱导结肠癌细胞发生自噬, 这种保护性自噬使肿瘤细胞逃离了5-FU诱导的凋亡.
本文证实了5-FU诱导胃癌细胞自噬, 从而逃避5-FU诱导的凋亡. 5-FU很可能通过抑制PI3K/Akt/mTOR通路诱导胃癌细胞的凋亡和自噬. 用自噬抑制剂明显提高了5-FU诱导的细胞凋亡.
如何提高胃癌的敏感性是肿瘤治疗领域的重要问题. 本研究明确了自噬在5-FU诱导胃癌细胞凋亡中的重要作用, 对提高胃癌的敏感性具有重要的科学意义和潜在的临床价值.
本文条理清晰, 结构严谨, 5-FU与自噬的抑制剂联合可能为胃癌治疗设计新的策略, 对进一步提高胃癌患者的治疗效果及改善预后具有潜在意义.
编辑: 李薇 电编:李薇
| 1. | Sumpter K, Harper-Wynne C, Cunningham D, Rao S, Tebbutt N, Norman AR, Ward C, Iveson T, Nicolson M, Hickish T. Report of two protocol planned interim analyses in a randomised multicentre phase III study comparing capecitabine with fluorouracil and oxaliplatin with cisplatin in patients with advanced oesophagogastric cancer receiving ECF. Br J Cancer. 2005;92:1976-1983. [PubMed] [DOI] |
| 2. | Cunningham D, Starling N, Rao S, Iveson T, Nicolson M, Coxon F, Middleton G, Daniel F, Oates J, Norman AR. Capecitabine and oxaliplatin for advanced esophagogastric cancer. N Engl J Med. 2008;358:36-46. [PubMed] [DOI] |
| 4. | Edinger AL, Thompson CB. Death by design: apoptosis, necrosis and autophagy. Curr Opin Cell Biol. 2004;16:663-669. [PubMed] [DOI] |
| 5. | Li DD, Wang LL, Deng R, Tang J, Shen Y, Guo JF, Wang Y, Xia LP, Feng GK, Liu QQ. The pivotal role of c-Jun NH2-terminal kinase-mediated Beclin 1 expression during anticancer agents-induced autophagy in cancer cells. Oncogene. 2009;28:886-898. [PubMed] [DOI] |
| 6. | Li J, Hou N, Faried A, Tsutsumi S, Kuwano H. Inhibition of autophagy augments 5-fluorouracil chemotherapy in human colon cancer in vitro and in vivo model. Eur J Cancer. 2010;46:1900-1909. [PubMed] [DOI] |
| 8. | Levine B, Yuan J. Autophagy in cell death: an innocent convict? J Clin Invest. 2005;115:2679-2688. [PubMed] [DOI] |
| 9. | Oehadian A, Koide N, Hassan F, Islam S, Mori I, Yoshida T, Yokochi T. Differential expression of autophagy in Hodgkin lymphoma cells treated with various anti-cancer drugs. Acta Med Indones. 2007;39:153-156. [PubMed] |
| 10. | Li J, Hou N, Faried A, Tsutsumi S, Takeuchi T, Kuwano H. Inhibition of autophagy by 3-MA enhances the effect of 5- FU-induced apoptosis in colon cancer cells. Ann Surg Oncol. 2009;16:761-771. [PubMed] [DOI] |
| 11. | Kim D, Dan HC, Park S, Yang L, Liu Q, Kaneko S, Ning J, He L, Yang H, Sun M. AKT/PKB signaling mechanisms in cancer and chemoresistance. Front Biosci. 2005;10:975-987. [PubMed] [DOI] |
| 12. | Hanada M, Feng J, Hemmings BA. Structure, regulation and function of PKB/AKT--a major therapeutic target. Biochim Biophys Acta. 2004;1697:3-16. [PubMed] |
| 13. | Qu X, Zhang Y, Li Y, Hu X, Xu Y, Xu L, Hou K, Sada K, Liu Y. Ubiquitin ligase Cbl-b sensitizes leukemia and gastric cancer cells to anthracyclines by activating the mitochondrial pathway and modulating Akt and ERK survival signals. FEBS Lett. 2009;583:2255-2262. [PubMed] [DOI] |
| 14. | Qu X, Li Y, Liu J, Xu L, Zhang Y, Hu X, Hou K, Liu Y. Cbl-b promotes chemotherapy-induced apoptosis in rat basophilic leukemia cells by suppressing PI3K/Akt activation and enhancing MEK/ERK activation. Mol Cell Biochem. 2010;340:107-114. [PubMed] [DOI] |
| 15. | Fu L, Kim YA, Wang X, Wu X, Yue P, Lonial S, Khuri FR, Sun SY. Perifosine inhibits mammalian target of rapamycin signaling through facilitating degradation of major components in the mTOR axis and induces autophagy. Cancer Res. 2009;69:8967-8976. [PubMed] [DOI] |
| 16. | Amaravadi RK, Yu D, Lum JJ, Bui T, Christophorou MA, Evan GI, Thomas-Tikhonenko A, Thompson CB. Autophagy inhibition enhances therapy-induced apoptosis in a Myc-induced model of lymphoma. J Clin Invest. 2007;117:326-336. [PubMed] [DOI] |
| 17. | Ren JH, He WS, Nong L, Zhu QY, Hu K, Zhang RG, Huang LL, Zhu F, Wu G. Acquired cisplatin resistance in human lung adenocarcinoma cells is associated with enhanced autophagy. Cancer Biother Radiopharm. 2010;25:75-80. [PubMed] [DOI] |
| 18. | Bijnsdorp IV, Peters GJ, Temmink OH, Fukushima M, Kruyt FA. Differential activation of cell death and autophagy results in an increased cytotoxic potential for trifluorothymidine compared to 5-fluorouracil in colon cancer cells. Int J Cancer. 2010;126:2457-2468. [PubMed] |
| 19. | Sasaki K, Tsuno NH, Sunami E, Tsurita G, Kawai K, Okaji Y, Nishikawa T, Shuno Y, Hongo K, Hiyoshi M. Chloroquine potentiates the anti-cancer effect of 5-fluorouracil on colon cancer cells. BMC Cancer. 2010;10:370. [PubMed] [DOI] |