修回日期: 2011-01-25
接受日期: 2011-02-15
在线出版日期: 2011-03-08
目的: 探讨磷脂酰肌醇蛋白聚糖3(GPC3)在肝细胞癌(HCC)等不同肝病组织中的表达情况及其对肝癌早期诊断的意义.
方法: 采用免疫组织化学方法检测126例肝穿刺活检标本(包括13例极早期HCC、44例早期HCC、16例不典型增生、29例肝硬化和24例肝炎)及57例中晚期HCC手术标本中GPC3和甲胎蛋白(AFP)的表达, 28例正常肝组织作对照.
结果: GPC3在HCC与其他组织中的表达差异具有统计学意义(P<0.01). GPC3和AFP对HCC诊断的敏感性分别为80.7%和37.7%, 特异性分别为99.4%和93.6%. 在极早期和早期肝癌中, GPC3的阳性表达率, 显著高于AFP(92.3% vs 38.5%; 72.7% vs 34.1%, 均P<0.05). GPC3在极早期和早期肝癌中的表达均高于高级别不典型增生组(P<0.01). 在肝硬化、肝炎、正常肝组织中均未见GPC3和AFP蛋白表达. GPC3在小肝癌中的阳性率为78.6%, 联合AFP可将诊断敏感性提高为85.7%. 在血清AFP阴性的小肝癌中GPC3的阳性率高达70%. GPC3阳性表达患者肝癌根治术后1年、2年、3年的复发率明显高于GPC3阴性患者(P<0.05).
结论: GPC3在极早期和早期HCC中具有良好的敏感性和特异性, 有望成为新的肝癌早期诊断标志物, 肝穿刺活检行GPC3染色是一个有效的肝癌早期鉴别诊断的辅助工具, 同时也有助于预测HCC患者的预后.
引文著录: 王涛, 王凤梅, 高英堂, 朱争艳, 郭洪生, 杨斌, 张传山, 张勤, 杜智. 磷脂酰肌醇蛋白聚糖3在肝穿刺活检标本中鉴别诊断的意义. 世界华人消化杂志 2011; 19(7): 693-699
Revised: January 25, 2011
Accepted: February 15, 2011
Published online: March 8, 2011
AIM: To analyze the expression of glypican 3 (GPC3) in different liver diseases and to explore its significance in early diagnosis of hepatocellular carcinoma (HCC).
METHODS: The expression of GPC3 and α-fetoprotein (AFP) was detected by immunohistochemistry in 126 liver needle biopsy specimens from 13 patients with very early stage HCC, 44 patients with early stage HCC, 16 patients with dysplastic nodules, 29 patients with liver cirrhosis, and 24 patients with hepatitis, and in 57 resected HCC specimens from patients with intermediate and advanced HCC. Twenty-eight resected normal liver tissue specimens were used as controls.
RESULTS: The expression of GPC3 in HCC differed significantly from those in other liver diseases (all P < 0.01). Detection of GPC3 expression showed a higher diagnostic sensitivity (80.7%) and specificity (99.4%) than that of AFP (37.7% and 93.6%, respectively). GPC3 was expressed in 92.3% of very early stage HCC and in 72.7% of early stage of HCC. In contrast, AFP only appeared in 38.5% of very early stage HCC and in 34.1% of early stage HCC. The positive rates of GPC3 expression in very early and early stage HCC were significantly higher than those in dysplastic nodules (both P < 0.01). GPC3 and AFP expression was not detected in liver cirrhosis, hepatitis or normal liver tissue. In patients with small HCC, the positive rate of GPC3 expression was 78.6%, and combined detection of GPC3 and AFP had a sensitivity of 85.7%. In patients with small HCC who had an AFP of ≤20 μg/L, the positive rate of GPC3 expression was 70%. The recurrence rate after radical surgery in GPC3-positive patients was higher than that of GPC3-negative ones (P < 0.05).
CONCLUSION: GPC3 is highly expressed in HCC. Detection of GPC3 expression has a high sensitivity and specificity for diagnosis of very early and early stage HCC and therefore represents a potential diagnostic parameter for early HCC. Immunohistochemistry detection of GPC3 in liver needle biopsy specimens is an effective ancillary tool for early diagnosis of HCC. GPC3 expression is an independent prognostic factor for HCC recurrence after surgery.
- Citation: Wang T, Wang FM, Gao YT, Zhu ZY, Guo HS, Yang B, Zhang CS, Zhang Q, Du Z. Significance of GPC3 expression in liver biopsy specimens for differential diagnosis of liver diseases. Shijie Huaren Xiaohua Zazhi 2011; 19(7): 693-699
- URL: https://www.wjgnet.com/1009-3079/full/v19/i7/693.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i7.693
肝细胞癌(hepatocellular carcinoma, HCC)是世界上最常见的恶性肿瘤之一, 其发病率排第6位, 死亡率排第3位, 全球每年新发肝癌的病例是62万左右, 其中中国占55%[1]. 肝癌起病隐匿, 恶性度高, 容易复发和转移, 出现典型临床症状时多已处于中晚期, 丧失诸多治疗机会. 因此早期诊断对改善HCC的预后至关重要[2]. 磷脂酰肌醇蛋白聚糖3(glypican 3, GPC3)是硫酸类肝素蛋白聚糖家族中的一员, 通过糖基磷脂酰肌醇锚定在细胞表面, 对细胞生长、分化和增殖具有重要作用[3]. GPC3在生物体内的分布具有明显的组织特异性和组织分化的时相特异性. 在胎肝、胎盘等胚胎组织中GPC3高表达, 但是在成人正常肝组织中未见表达, 且他与多种肿瘤关系密切, 在间皮瘤[4]、乳腺癌[5]、卵巢癌[6]、及肺癌[7]中GPC3表达下调, 但在肝癌组织中表达水平明显上调. 所以近年来GPC3作为一种新的HCC标志物成为国外研究的热点. 但多局限于小样本的横断面研究, 且国内外肝癌的病因学存在一定差异, 我国的肝癌多发生在乙型肝炎病毒感染的基础之上. 本研究从疾病的进展角度出发, 应用IHC方法检测良性肝病、癌前病变及肝癌穿刺活检组织中GPC3表达情况, 从而探讨GPC3染色在肝穿刺活检标本中鉴别诊断的意义及其在HCC早期诊断中的价值, 同时了解GPC3蛋白的表达和HCC患者预后的相关性.
收集天津市第三中心医院2003-12/2008-10住院的肝病患者肝组织标本共268例, 参照美国肝病学会-巴塞罗那(AASLD-BCLC)分期标准和治疗策略[8]及WHO(2000)消化系统肿瘤分类进行临床和病理诊断. 114例肝癌, 按照BCLC分期分为极早期13例、早期44例(两者均为穿刺标本, 其中直径≤3 cm的小肝癌42例)、中晚期57例(手术标本); 癌旁组织57例, 为距癌组织2 cm处无癌细胞浸润的肝组织; 不典型增生16例、肝硬化29例、肝炎24例(三者均为穿刺标本); 正常肝组织28例(取自肝血管瘤手术标本)作为对照. 肝穿刺活检标本均为超声引导下穿刺所得. 肝癌组织学类型: 高分化55例, 中分化45例, 低分化14例. 肝癌患者男94例, 女20例, 年龄22-82(平均55.9±10.9)岁. 肝癌根治术前均未行放、化疗或其他抗肿瘤治疗. 所有标本均经4%甲醛溶液固定, 石蜡包埋, 4 μm连续切片. 该研究经本院医学伦理委员会批准.
1.2.1 实验: 鼠抗人Glypican-3单克隆抗体(1G-12)购自美国Santa Cruz Biotechnology. 鼠抗人α-1-AFP单克隆抗体(ZA-0008)、即用型二步法检测试剂盒PV-9000及DAB试剂盒均购自北京中杉金桥生物技术有限公司, 行免疫组织化学SP两步法染色, GPC3工作浓度为1:100, AFP工作浓度为1:50. 每批染色均设已知阳性切片作阳性对照, 用磷酸盐缓冲液代替一抗作阴性对照, 具体操作步骤按试剂盒说明书进行.
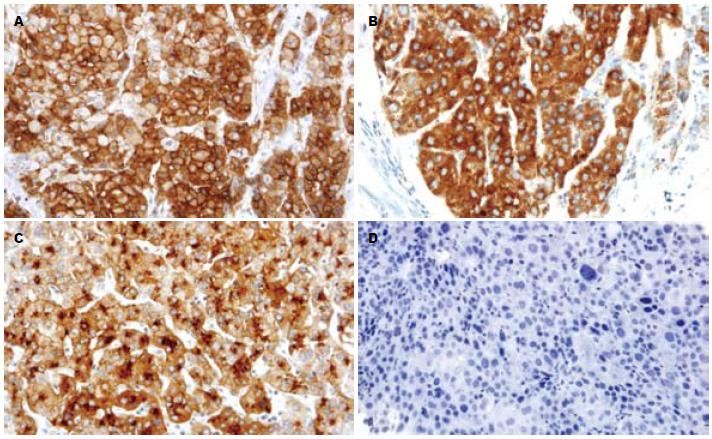
1.2.2 结果判定: 由两位资深病理医生分别评定各种肝脏组织标本的病理特征. 以细胞质和(或)细胞膜出现棕黄色颗粒为阳性. 综合染色强度和阳性细胞数所占比例进行半定量判定[9]. 染色强度评定: 不着色0分; 淡黄色为1分; 棕黄色为2分; 深棕色为3分. 阳性细胞数所占比例评定: 阳性细胞数<5%为0分; 5%-25%为1分; 25%-50%为2分; >50%为3分. 两种评分相加, 将结果分为4个等级, 0-1分为阴性(-); 2分为弱阳性(+); 3-4分为中阳性(++); 5-6分为强阳性(+++). 根据着色部位不同可分为胞膜型、胞质型和毛细胆管型.
统计学处理 所有统计学分析均使用SPSS 13.0统计软件处理. 服从正态分布的计量资料以 表示. 采用Frequencies、χ2检验、Fisher确切概率法、二分类多因素Logistic回归分析. P<0.05为差异有统计学意义.
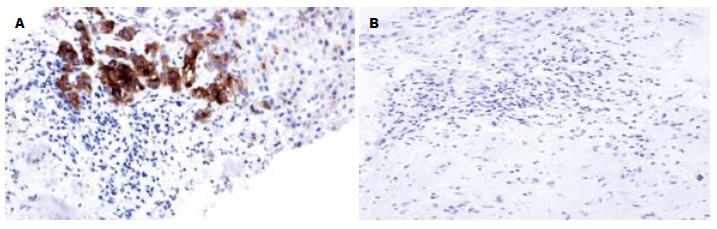
GPC3主要表达在肝癌细胞的细胞质和细胞膜中, 其次为毛细胆管腔缘(图1). GPC3在HCC与其他组织中的表达差异具有统计学意义(P<0.01). GPC3在肝癌组织中高表达, 敏感性和特异性分别为80.7%和99.4%, 其中强阳性47例, 占51.1%, 中阳性28例, 弱阳性17例. GPC3在肝癌穿刺标本和大体标本中的阳性率分别为77.2%和84.2%, 两者之间的差异无统计学意义(P>0.05). 而在正常肝组织、肝炎、肝硬化及癌旁中均未见GPC3蛋白的表达, 不典型增生组中仅1例高级别不典型增生表达, 为中阳性, 其余均为阴性(图2).
AFP主要表达在细胞质, 在肝癌和癌旁中的阳性表达率分别为37.7%和13.6%, 与GPC3表达之间的差异均有统计学意义(P<0.05), 而在正常肝、肝炎、及肝硬化组织中均未见表达. 在不典型增生组中, 有2例高级别不典型增生表达AFP, 与GPC3表达之间的差异无统计学意义.
(1)GPC3蛋白在极早期、早期、中期和进展期肝癌中的阳性率分别为92.3%、72.7%、84.2%, 均明显高于AFP蛋白的表达, 差异具有统计学意义(P<0.05, 表1). GPC3在极早期肝癌和早期肝癌中的阳性率显著高于高级别不典型增生9.1%(1/11), 差异有统计学意义(P<0.01). 在13例极早期肝癌中GPC3强阳性4例, 中阳性6例, 弱阳性仅有2例, 而AFP则无1例为强阳性表达; (2)在42例直径≤3 cm的小肝癌中, 血清AFP(>20 μg/L)、组织GPC3蛋白、AFP蛋白的阳性率分别为52.4%、78.6%、40.5%, 后两者联合诊断小肝癌的敏感性为85.7%, 显著优于单独AFP(40.5%), 差异有统计学意义(P<0.01). GPC3与血清AFP及组织中AFP蛋白表达之间的差异均具有统计学意义(P<0.01); (3)在20例血清AFP≤20 μg/L且直径≤3 cm的小肝癌中, 有14例表达GPC3蛋白, 占70%.
统计分析表明, GPC3蛋白的表达与患者性别、年龄、肝功能分级、是否合并肝硬化、肿瘤直径、肿瘤个数、肿瘤分化程度、TNM分期、血清AFP、r-GT水平和HBsAg阳性等方面的差异无统计学意义(P>0.05, 表2). 与AFP蛋白相比较, GPC3在高分化和中分化HCC中的阳性表达率明显较高(P<0.01, 表3).
| 项目 | n | 阳性n(%) | χ2值 | P值 |
| 性别 | ||||
| 男 | 94 | 76(80.85) | ||
| 女 | 20 | 16(80.00) | 0.000 | >0.05 |
| 年龄(岁) | ||||
| ≥55 | 63 | 47(74.60) | ||
| <55 | 51 | 45(88.24) | 3.363 | >0.05 |
| 合并肝硬化 | ||||
| 有 | 99 | 83(83.84) | ||
| 无 | 15 | 9(60.00) | 3.346 | >0.05 |
| 肝功能 | ||||
| A | 85 | 66(77.65) | ||
| B | 29 | 26(89.66) | 2.002 | >0.05 |
| 血清AFP(μg/L) | ||||
| ≤20 | 49 | 38(77.55) | ||
| 20-200 | 27 | 20(74.07) | ||
| >200 | 38 | 34(89.47) | 2.951 | >0.05 |
| 血清r-GT | ||||
| 有 | 44 | 32(72.73) | ||
| 无 | 67 | 57(85.07) | 2.548 | >0.05 |
| 缺失 | 3 | |||
| 血清HBsAg | ||||
| 阳性 | 80 | 68(85.00) | ||
| 阴性 | 34 | 24(70.59) | 3.182 | >0.05 |
| 血管侵犯 | ||||
| 有 | 22 | 18(81.82) | ||
| 无 | 92 | 74(80.43) | 0.000 | >0.05 |
| 肿瘤直径(cm) | ||||
| ≥5 | 46 | 36(78.26) | ||
| <5 | 68 | 56(82.35) | 0.295 | >0.05 |
| 肿瘤数目 | ||||
| 单发 | 75 | 59(78.67) | ||
| 多发 | 39 | 33(84.62) | 0.583 | >0.05 |
| TNM分期 | ||||
| Ⅰ/Ⅱ | 72 | 58(80.56) | ||
| Ⅲ/Ⅳ | 42 | 34(80.95) | 0.003 | >0.05 |
肝癌根治术后密切随访91例, 中位随访时间13(1-61) mo, 58例患者肝癌复发, 12例患者远处转移, 其中5例为肺转移. 死亡35例, 其中26例患者死于肝癌, 9例患者死于其他疾病. GPC3蛋白阳性表达患者肝癌根治术后1年、2年、3年的复发率分别为52.1%(37/71)、60.6%(43/71)和67.6%(48/71), 明显高于GPC3蛋白阴性表达患者的复发率20.0%(4/20)、35.0%(7/20)和40.0%(8/20), 差异均有统计学意义. 选取GPC3表达、肿瘤直径、肿瘤个数、年龄、性别、分化程度、TNM分期、血管侵犯8个因素, 应用多因素Logistic回归模型分析其对于HCC复发的影响, 结果显示HCC复发与2种因素有关: GPC3表达(OR = 3.422, 95%CI: 1.186-9.879, P = 0.023)和肿瘤直径(OR = 1.126, 95%CI: 1.016-1.249, P = 0.024), 所以GPC3蛋白表达是影响患者术后复发的一个独立因素.
HCC是一种常见的恶性肿瘤, 早期诊断有助于选择治疗和改善预后. 病毒性肝炎、肝硬化是HCC发生的主要病理基础, 对多数病理医生来说, 肝炎、肝硬化以及进展期肝癌因病理形态学特征相对明显比较容易诊断, 而形态介于腺瘤样增生、不典型腺瘤样增生与早期肝癌之间的鉴别则非常的困难[10]. 目前被广泛应用于肝癌诊断的AFP、Hep1、CD10、CD34等免疫组织化学标志物均存在明显局限性[11,12], 所以寻找理想的生物标志物成为肝癌研究领域的难点和热点. 近年来诸多研究将GPC3单独作为联合其他标志物[13-15]或者免疫组织化学指标[16-22], 能够将HCC和肝脏良性肿瘤、胆管细胞癌、转移性肝癌区别开来[13,16-19,23]. 而本研究着重于从"肝炎-肝硬化-肝癌"三部曲进展的角度出发, 检测GPC3在正常肝组织、肝炎、肝硬化、不典型增生、极早期肝癌、早期肝癌、中晚期肝癌、癌旁肝组织中的表达, 从而尝试探讨其在肝癌尤其在早期肝癌发生发展中的作用.
研究报道GPC3在HCC中特异性高表达, 敏感性为72%-90%, 特异性为96%-100%[13-22]. 本实验证实GPC3对HCC诊断的敏感性和特异性分别为80.7%和99.4%. 在正常肝、肝炎、肝硬化、癌旁组织中均未见GPC3的表达, 与前人的研究结果一致[15,16,27]. 本研究还发现在13例极早期HCC中, GPC3阳性率为92.3%(12/13), 而AFP仅有5例为阳性表达, 无1例为强阳性表达. GPC3在极早期和早期肝癌AFP蛋白阴性中的阳性率分别为87.5%(7/8)和72.4%(21/29), 意味着在肝癌早期诊断上GPC3显著优于AFP. 同时GPC3在极早期和早期肝癌中的表达均明显高于高级别不典型增生组, 差异有统计学意义(P<0.01). 结果表明肝穿刺活检的GPC3染色有利于将影像学难以分辨的、直径较小的早期肝癌和癌前病变及良性结节区分开来. Hsu等[25]早在1997年报道肝癌中GPC3 mRNA的表达优于AFP mRNA, 在小肝癌中差异则更为明显. 同时Tangkijvanich等[26]、Capurro等[23]在血清学方面也证实了在小肝癌诊断中, GPC3优于AFP. 与Libbrecht等[18]的研究相一致的是, 本研究发现在小肝癌中GPC3阳性表达率为78.6%, 联合AFP可将诊断敏感性提高到85.7%. GPC3蛋白在血清AFP阴性的小肝癌中的阳性率同样高达70%, 提示GPC3蛋白的检测有助于肝癌的早期诊断.
Yamauchi等[15]报道, GPC3在不典型增生中局灶性弱着色, 低级别和高级别中的阳性率分别为25%(2/8)和75%(6/8). 与之不同的是本实验结果显示在低级别不典型增生中未见GPC3表达, 在高级别不典型增生中的阳性率仅为9.1%(1/11), 与Libbrecht等[18]研究报道一致. 迄今, 文献报道[15,17,18,23]通过免疫组织化学的方法检测GPC3在146例不典型增生中的表达, 其中GPC3在69例低级别中阳性率为5.8%, 在77例高级别中为16.9%, 两者之间的差异有统计学差异(P = 0.037). 众多研究结果之间存在差异, 可能与不典型增生诊断的困难性及诊断能力的差异[24], 及标本的取材、试剂的来源以及免疫组织化学过程有关. 但不可否认的是, GPC3在早期肝癌和癌前病变中有着重要的鉴别诊断价值.
GPC3表达与肝癌合并肝硬化是否有关目前尚无定论, Wang等[17]和Anatelli等[27]研究证实在肝硬化基础上的肝癌GPC3表达率显著提高, 存在统计学差异, 但另有研究显示HCC组织中GPC3表达与合并肝硬化无关[16,27,31]. 本研究显示, 在肝硬化组和非肝硬化组HCC组织中GPC3表达率分别为83.84%和60%, 但差异无统计学意义. 上述结果的不同可能与标本的大小、取材方法和肝癌的病因学有关. 同时, 实验还发现GPC3在HCC中的表达与患者肝功能分级、肿瘤直径、肿瘤个数、TNM分期、血清AFP定性、血管侵犯等无关, 与先前研究结果一致[16,27].
本研究表明, GPC3阳性组患者肝癌根治术后1、2、3年的复发率明显高于GPC3阴性组患者, 多因素Logistic回归分析表明GPC3表达是影响患者肝癌根治术后复发的一个独立因素, 同时我们还发现强阳性组患者的术后平均复发时间为8.3 mo, 与Shirakawa等[28]研究报道相符. 方芳等[29]报道在肝癌组检测到的血清GPC3阳性率为41.4%, 而在肝癌复发组中阳性率高达61.1%, 与其组织中91.3%的高表达相平行. Lai等[30]研究表明肝癌组织中高表达SULF2 mRNA的HCC患者, 术后复发率较高, 预后较差, 且通过裸鼠种植瘤证实SULF2能够上调GPC3的表达, 促进肿瘤生长. 以上研究均提示GPC3与肝癌复发存在某种联系, 但GPC3与肝癌复发的具体机制还待进一步研究.
我们和其他多项研究表明GPC3在5%-30% HCC中不表达[13-22,31,32], 所以GPC3阴性表达不能简单的排除HCC. 阴性结果的出现可能有以下原因: 一方面在肝癌形成过程中可能存在着不同的分子路径; 另一方面GPC3在HCC中可能呈局灶性表达. 总之, 本实验证明GPC3在HCC中高表达, 在肝脏良性病变及癌前病变中不表达或低表达, 有利于将微小肝癌与高级别不典型增生鉴别开来, 具有较高的敏感性和特异性, 肝穿刺活检的GPC3染色有望用于肝癌病理的辅助诊断. 且GPC3作为影响患者术后复发的一个独立因素, 对判断治疗效果及预测复发有一定意义, 但对于患者预后的影响尚需大样本进一步研究.
寻找理想的生物标志物一直是肝癌研究领域的难点和热点, GPC3因其高敏感性、高特异性近年来备受关注.
石毓君, 副研究员, 四川大学华西医院外科
目前被广泛应用于肝癌诊断的AFP、Hep1、CD10、CD34等免疫组织化学标志物均存在明显局限性, 所以寻找理想的生物标志物成为肝癌研究领域的难点和热点. 近年来GPC3作为一种新的HCC标志物成为国外研究的热点.
Liu等用免疫组织化学方法检测58例HCC和12例肝硬化组织中GPC3的表达, 发现GPC3在HCC中的阳性率为94.8% (55/58). 28例血清AFP≥400 μg/L的肝癌组织中GPC3全为阳性, 30例血清AFP<400 μg/L的肝癌组织中的阳性率也高达90%(27/30), 而在癌旁及肝硬化组织中未见表达.
本研究从疾病的进展角度出发, 应用IHC方法检测良性肝病、癌前病变及肝癌穿刺活检组织中GPC3表达情况, 从而探讨GPC3染色在肝穿刺活检标本中鉴别诊断的意义及其在HCC早期诊断中的价值, 同时了解GPC3蛋白的表达和HCC患者预后的相关性.
本文能丰富读者对HCC中GPC3表达情况的认识, 具有一定的参考价值, 但创新性一般.
编辑: 李军亮 电编:何基才
| 1. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 3. | Filmus J, Selleck SB. Glypicans: proteoglycans with a surprise. J Clin Invest. 2001;108:497-501. [PubMed] |
| 4. | Murthy SS, Shen T, De Rienzo A, Lee WC, Ferriola PC, Jhanwar SC, Mossman BT, Filmus J, Testa JR. Expression of GPC3, an X-linked recessive overgrowth gene, is silenced in malignant mesothelioma. Oncogene. 2000;19:410-416. [PubMed] [DOI] |
| 5. | Xiang YY, Ladeda V, Filmus J. Glypican-3 expression is silenced in human breast cancer. Oncogene. 2001;20:7408-7412. [PubMed] [DOI] |
| 6. | Lin H, Huber R, Schlessinger D, Morin PJ. Frequent silencing of the GPC3 gene in ovarian cancer cell lines. Cancer Res. 1999;59:807-810. [PubMed] |
| 7. | Kim H, Xu GL, Borczuk AC, Busch S, Filmus J, Capurro M, Brody JS, Lange J, D'Armiento JM, Rothman PB. The heparan sulfate proteoglycan GPC3 is a potential lung tumor suppressor. Am J Respir Cell Mol Biol. 2003;29:694-701. [PubMed] [DOI] |
| 8. | Forner A, Reig ME, de Lope CR, Bruix J. Current strategy for staging and treatment: the BCLC update and future prospects. Semin Liver Dis. 2010;30:61-74. [PubMed] [DOI] |
| 9. | Mattern J, Koomägi R, Volm M. Association of vascular endothelial growth factor expression with intratumoral microvessel density and tumour cell proliferation in human epidermoid lung carcinoma. Br J Cancer. 1996;73:931-934. [PubMed] [DOI] |
| 11. | Wee A. Diagnostic utility of immunohistochemistry in hepatocellular carcinoma, its variants and their mimics. Appl Immunohistochem Mol Morphol. 2006;14:266-272. [PubMed] [DOI] |
| 12. | Kakar S, Gown AM, Goodman ZD, Ferrell LD. Best practices in diagnostic immunohistochemistry: hepatocellular carcinoma versus metastatic neoplasms. Arch Pathol Lab Med. 2007;131:1648-1654. [PubMed] |
| 13. | Coston WM, Loera S, Lau SK, Ishizawa S, Jiang Z, Wu CL, Yen Y, Weiss LM, Chu PG. Distinction of hepatocellular carcinoma from benign hepatic mimickers using Glypican-3 and CD34 immunohistochemistry. Am J Surg Pathol. 2008;32:433-444. [PubMed] [DOI] |
| 14. | Di Tommaso L, Franchi G, Park YN, Fiamengo B, Destro A, Morenghi E, Montorsi M, Torzilli G, Tommasini M, Terracciano L. Diagnostic value of HSP70, glypican 3, and glutamine synthetase in hepatocellular nodules in cirrhosis. Hepatology. 2007;45:725-734. [PubMed] [DOI] |
| 15. | Yamauchi N, Watanabe A, Hishinuma M, Ohashi K, Midorikawa Y, Morishita Y, Niki T, Shibahara J, Mori M, Makuuchi M. The glypican 3 oncofetal protein is a promising diagnostic marker for hepatocellular carcinoma. Mod Pathol. 2005;18:1591-1598. [PubMed] |
| 16. | Wang HL, Anatelli F, Zhai QJ, Adley B, Chuang ST, Yang XJ. Glypican-3 as a useful diagnostic marker that distinguishes hepatocellular carcinoma from benign hepatocellular mass lesions. Arch Pathol Lab Med. 2008;132:1723-1728. [PubMed] |
| 17. | Wang XY, Degos F, Dubois S, Tessiore S, Allegretta M, Guttmann RD, Jothy S, Belghiti J, Bedossa P, Paradis V. Glypican-3 expression in hepatocellular tumors: diagnostic value for preneoplastic lesions and hepatocellular carcinomas. Hum Pathol. 2006;37:1435-1441. [PubMed] [DOI] |
| 18. | Libbrecht L, Severi T, Cassiman D, Vander Borght S, Pirenne J, Nevens F, Verslype C, van Pelt J, Roskams T. Glypican-3 expression distinguishes small hepatocellular carcinomas from cirrhosis, dysplastic nodules, and focal nodular hyperplasia-like nodules. Am J Surg Pathol. 2006;30:1405-1411. [PubMed] [DOI] |
| 19. | Shirakawa H, Kuronuma T, Nishimura Y, Hasebe T, Nakano M, Gotohda N, Takahashi S, Nakagohri T, Konishi M, Kobayashi N. Glypican-3 is a useful diagnostic marker for a component of hepatocellular carcinoma in human liver cancer. Int J Oncol. 2009;34:649-656. [PubMed] |
| 20. | Nakatsura T, Yoshitake Y, Senju S, Monji M, Komori H, Motomura Y, Hosaka S, Beppu T, Ishiko T, Kamohara H. Glypican-3, overexpressed specifically in human hepatocellular carcinoma, is a novel tumor marker. Biochem Biophys Res Commun. 2003;306:16-25. [PubMed] [DOI] |
| 21. | Ligato S, Mandich D, Cartun RW. Utility of glypican-3 in differentiating hepatocellular carcinoma from other primary and metastatic lesions in FNA of the liver: an immunocytochemical study. Mod Pathol. 2008;21:626-631. [PubMed] [DOI] |
| 22. | Shafizadeh N, Ferrell LD, Kakar S. Utility and limitations of glypican-3 expression for the diagnosis of hepatocellular carcinoma at both ends of the differentiation spectrum. Mod Pathol. 2008;21:1011-1018. [PubMed] [DOI] |
| 23. | Capurro M, Wanless IR, Sherman M, Deboer G, Shi W, Miyoshi E, Filmus J. Glypican-3: a novel serum and histochemical marker for hepatocellular carcinoma. Gastroenterology. 2003;125:89-97. [PubMed] [DOI] |
| 24. | Llovet JM, Chen Y, Wurmbach E, Roayaie S, Fiel MI, Schwartz M, Thung SN, Khitrov G, Zhang W, Villanueva A. A molecular signature to discriminate dysplastic nodules from early hepatocellular carcinoma in HCV cirrhosis. Gastroenterology. 2006;131:1758-1767. [PubMed] [DOI] |
| 25. | Hsu HC, Cheng W, Lai PL. Cloning and expression of a developmentally regulated transcript MXR7 in hepatocellular carcinoma: biological significance and temporospatial distribution. Cancer Res. 1997;57:5179-5184. [PubMed] |
| 26. | Tangkijvanich P, Chanmee T, Komtong S, Mahachai V, Wisedopas N, Pothacharoen P, Kongtawelert P. Diagnostic role of serum glypican-3 in differentiating hepatocellular carcinoma from non-malignant chronic liver disease and other liver cancers. J Gastroenterol Hepatol. 2010;25:129-137. [PubMed] [DOI] |
| 27. | Anatelli F, Chuang ST, Yang XJ, Wang HL. Value of glypican 3 immunostaining in the diagnosis of hepatocellular carcinoma on needle biopsy. Am J Clin Pathol. 2008;130:219-223. [PubMed] [DOI] |
| 28. | Shirakawa H, Suzuki H, Shimomura M, Kojima M, Gotohda N, Takahashi S, Nakagohri T, Konishi M, Kobayashi N, Kinoshita T. Glypican-3 expression is correlated with poor prognosis in hepatocellular carcinoma. Cancer Sci. 2009;100:1403-1407. [PubMed] [DOI] |
| 30. | Lai JP, Sandhu DS, Yu C, Han T, Moser CD, Jackson KK, Guerrero RB, Aderca I, Isomoto H, Garrity-Park MM. Sulfatase 2 up-regulates glypican 3, promotes fibroblast growth factor signaling, and decreases survival in hepatocellular carcinoma. Hepatology. 2008;47:1211-1222. [PubMed] [DOI] |
| 31. | Kandil D, Leiman G, Allegretta M, Trotman W, Pantanowitz L, Goulart R, Evans M. Glypican-3 immunocytochemistry in liver fine-needle aspirates : a novel stain to assist in the differentiation of benign and malignant liver lesions. Cancer. 2007;111:316-322. [PubMed] [DOI] |
| 32. | Liu H, Li P, Zhai Y, Qu CF, Zhang LJ, Tan YF, Li N, Ding HG. Diagnostic value of glypican-3 in serum and liver for primary hepatocellular carcinoma. World J Gastroenterol. 2010;16:4410-4415. [PubMed] [DOI] |